试验二药用氯化钠的制备
- 格式:doc
- 大小:217.00 KB
- 文档页数:2

药用氯化钠的制备实验报告药用氯化钠的制备实验报告引言:药用氯化钠是一种常见的药品,广泛应用于医疗领域。
本实验旨在通过制备药用氯化钠的过程,探究其制备方法和相关实验步骤。
一、实验目的:通过实验制备药用氯化钠,了解其制备方法和相关实验步骤。
二、实验原理:药用氯化钠是由氯化钠晶体制备而成。
氯化钠晶体是一种离子晶体,由钠离子(Na+)和氯离子(Cl-)组成。
在实验中,我们将利用溶液的蒸发结晶方法制备氯化钠晶体。
三、实验材料:1. 氯化钠(NaCl)2. 蒸发皿3. 蒸馏水4. 火炉或加热板5. 滤纸6. 称量器具四、实验步骤:1. 准备工作:a. 将蒸发皿清洗干净并晾干。
b. 使用称量器具准确称取一定质量的氯化钠。
c. 准备足够的蒸馏水。
2. 溶解氯化钠:a. 将称取好的氯化钠溶解在适量的蒸馏水中,搅拌均匀,直至溶解完全。
3. 蒸发结晶:a. 将溶解好的氯化钠溶液倒入蒸发皿中。
b. 将蒸发皿放置在火炉或加热板上,用中小火加热。
c. 随着溶液的蒸发,逐渐形成氯化钠晶体。
d. 当溶液完全蒸发,留下的是白色的氯化钠晶体。
4. 晶体收集:a. 使用滤纸将蒸发皿中的氯化钠晶体过滤出来。
b. 将收集到的氯化钠晶体晾干。
五、实验注意事项:1. 实验操作过程中要注意安全,避免溶液溅出或烧伤。
2. 火炉或加热板操作时要小心,避免烧伤。
3. 溶解氯化钠时要充分搅拌,确保溶解彻底。
4. 晶体收集时要注意过滤纸的使用,避免晶体损失。
六、实验结果与讨论:经过实验,我们成功制备了药用氯化钠晶体。
实验中,通过溶解氯化钠并蒸发结晶,我们得到了白色的氯化钠晶体。
这些晶体可用于药物制剂中,具有调节体液平衡、补充电解质等作用。
在实验过程中,我们注意到溶液的蒸发速度会影响晶体的形成。
如果蒸发速度过快,晶体可能会形成不完整或较小的晶体。
而蒸发速度过慢,则可能导致晶体形成时间过长。
因此,在实际制备药用氯化钠时,需要控制好蒸发速度,以获得理想的晶体形态和质量。
![药用氯化钠的制备[7篇]](https://uimg.taocdn.com/4f15e85af6ec4afe04a1b0717fd5360cba1a8db9.webp)
药用氯化钠的制备[7篇]以下是网友分享的关于药用氯化钠的制备的资料7篇,希望对您有所帮助,就爱阅读感谢您的支持。
药用氯化钠的制备第一篇医用氯化钠的制备一、实验目的1、掌握医用氯化钠的制备原理和方法。
2、掌握称量,溶解,过滤,沉淀,抽滤,蒸发等基本操作。
3、练习pH试纸的使用方法。
二、实验原理医用氯化钠是以粗盐为原料提纯而得的。
粗盐中含有多种杂质,既有不溶性的杂质,如泥沙;还有可溶性杂质,如SO42-, Ca2+, Mg2+, K+等相应盐类。
不溶性杂质,可用过滤的方法除去,而对于可溶性杂质,如SO4, Ca, Mg, K等,则必须用化学方法处理才能除去。
常用的化学方法是先加入稍过量的BaCl2溶液将SO42- 转化为难溶的BaSO4沉淀通过过滤而除去:Ba2+ + SO42- = BaSO4再向该溶液中加入NaOH-Na2CO3混合溶液,Ca2+, Mg2+以及过量的Ba2+也可分别生成相应的沉淀而除去:Ca+ CO3 = CaCO32+ -2-2Mg+ 2OH + CO3 = Mg2(OH)2CO3Ba2+ + CO32- = BaCO3-过滤后的溶液中,加HCl中和过量的混合碱并使之呈弱酸性,可除去上步引入的OH 、CO32- :H + OH = H2O2H+ + CO32- = H2O + CO2对于其中少量的Br-、I-、K+,由于其含量少,溶解度大,在最后的浓缩、结晶中仍留在母液中而与NaCl分离。
+-2+ 2-2-2+2++三、仪器设备试管、烧杯、量筒、蒸发皿、漏斗、布氏漏斗、抽滤瓶、酒精灯、电炉(或煤气灯)、石棉网、托盘天平PH试纸四.实验试剂HCl ( 2molL)、H2SO4 (0.5molL)、HAc (3molL)、NaOH (2molL)、Na2CO3(饱和溶液)、BaCl2 (25%, 0.1molL)、粗食盐10克-1-1-1-1-1五、实验流程附图1 医用氯化钠的制备实验操作流程图:六、注意事项1.产品炒干时要用小火,以免食盐飞溅伤人。

《药用氯化钠的制备》实验综述报告
氯化钠是一种常见的无机盐,被广泛应用于医药、食品工业等领域。
药用氯化钠是指
用于医疗用途的氯化钠制剂,可以用于注射、口服、局部应用等多种途径。
本实验旨在探
究药用氯化钠的制备方法及其纯度检测。
一、实验方法
1.制备氯化钠溶液
取适量的氯化钠,加入适量的去离子水,搅拌至完全溶解。
将氯化钠溶液倒入锥形瓶中,加入饱和氯化钠溶液,搅拌均匀,静置1小时,过滤。
取得的氯化钠晶体晾干后,置于加热板上,用中火进行干燥。
反复几次,直至完全干燥。
将得到的干燥氯化钠晶体加入无菌水中,搅拌均匀,滤去未溶解的部分。
将滤液进行
无菌操作,最终得到药用氯化钠制剂。
4.纯度检测
使用化学滴定法进行纯度检测,以氯化银溶液为滴定液,药用氯化钠溶液为被滴定液,直至溶液呈乳白色。
二、实验结果与分析
本实验制备的药用氯化钠制剂纯度较高,并且无菌作业过程严谨,符合药品生产流程
的要求。
使用化学滴定法作为质量检测手段,可以较准确地判断药用氯化钠的纯度。
三、实验优化与改进
1.考虑添加药用氯化钠制剂的pH调节剂,保证其适合人体使用。
2.在制备过程中,可以添加一定的抗氧化剂,以延长药物的保质期。
3.在控制药物质量的同时,要注意药用氯化钠的生产成本。
四、实验总结
本实验通过制备药用氯化钠制剂,深入了解了药物生产的质量控制细节和操作技巧。
同时也对药用氯化钠制剂的应用领域和质量标准有了更为深入的理解。

《药用氯化钠的制备》实验综述报告实验目的:本实验旨在探究药用氯化钠的制备方法,通过实验操作了解和掌握药用氯化钠的制备及其相关知识。
实验原理:氯化钠,化学式NaCl,是一种常用的药用化学品,也是一种重要的生产原料。
在实验中,常用的制备氯化钠的方法有两种:一种是氯化氢酸钠法,另一种是硝酸钠与氯化铵反应生成氯化铵,再由氯化铵与氢氧化钠反应生成氯化钠。
实验仪器与试剂:氢氧化钠固体、氯化铵固体、硝酸钠固体、蒸馏水实验步骤:1. 首先准备好氢氧化钠固体和硝酸钠固体,按照一定的比例混合在一起。
2. 将混合好的固体含量平均撒在玻璃器皿中,待用。
3. 准备好氯化铵固体,与蒸馏水混合搅拌,直至完全溶解。
4. 将氯化铵固体与蒸馏水混合液缓缓滴入玻璃器皿中,同时产生的气体挡住,直至完全反应后,放置一段时间让产生的气体完全挥发。
5. 将玻璃器皿中的溶液过滤,然后进行冷却结晶。
6. 分离析出的固体,称重,放入干燥器中。
实验结果与分析:通过上述步骤,我们成功制备出了药用氯化钠。
实验结果表明,制备出的氯化钠具有较高的纯度,符合药用氯化钠的制备标准。
实验中需要注意加入硝酸钠的过程,需要缓慢搅拌,避免溶液里的气体逸出。
冷却结晶的过程中需要注意温度控制,以免结晶物质出现不纯情况。
实验结论:通过本次实验,我们成功制备了药用氯化钠,并掌握了制备药用氯化钠的方法。
实验中所用的玻璃器皿、试剂都需求达到一定纯度,以保证实验的准确性和有效性。
实验过程中,需要严格控制反应条件,确保反应过程顺利进行。
希望本次实验能够帮助大家更好地了解和掌握药用氯化钠的制备方法。

《药用氯化钠的制备》实验综述报告
药用氯化钠是一种常用的药物,具有抗炎、抗菌、退热等功能。
其制备方法有多种,本实验综述报告将对其中的一种制备方法进行介绍。
制备药用氯化钠的原料是氯化钠固体。
可以选择优质的食盐,经过蒸发结晶等方法得到氯化钠固体。
由于氯化钠易溶于水,因此可以使用水作为溶剂。
将所得的氯化钠固体加入适量的水溶解,过滤掉杂质。
此过程中可以加热溶剂,提高溶解度。
过滤后得到纯净的氯化钠溶液。
然后,将氯化钠溶液进行浓缩。
通过加热溶液,使水分蒸发,溶液中的氯化钠浓度增加。
浓缩可以采用蒸发结晶的方法,将溶液进行煮沸,使水分蒸发,得到浓缩的氯化钠溶液。
将浓缩的氯化钠溶液进行冷却结晶,得到药用氯化钠固体。
冷却结晶可以采用自然冷却或者冰浴的方法,通过使溶液降温,使溶液中的氯化钠结晶析出。
所得的药用氯化钠固体可以通过过滤、干燥等方法进行处理,使得其颗粒均匀、质量稳定。
需要注意的是,制备药用氯化钠过程中要保证操作的环境卫生和操作的严密性,避免杂质的进入。
要注意浓缩和结晶过程的温度控制,避免溶液过热或过冷,影响制备效果。
药用氯化钠的制备是一个较为简单的过程,通过溶解、浓缩和结晶等步骤,可以得到纯净且质量稳定的药用氯化钠固体。
这种制备方法具有操作简便、成本低廉等优点,适合大规模生产。

《药用氯化钠的制备》实验综述报告8篇第1篇示例:实验名称:药用氯化钠的制备实验目的:本实验旨在通过不同的制备方法,制备出具有药用价值的氯化钠,并对不同制备方法的优缺点进行综合评价。
一、实验原理及背景氯化钠是一种重要的药用化学品,广泛应用于医药、食品等领域。
其制备方法主要包括离子交换法、真空蒸发法、晶体生长法等。
离子交换法是通过树脂的交换作用将无机物质转化成固体。
真空蒸发法是将溶液加热到高温后,使其中的溶剂蒸发。
晶体生长法是将溶液中的溶质在溶液中逐渐沉淀析出,形成晶体。
这些方法各有优缺点,本实验将对比这些方法的优劣。
二、实验步骤1. 离子交换法制备氯化钠准备一个离子交换树脂柱,将氯化钠溶液通过柱体,经过离子交换树脂,得到经净化的氯化钠溶液,再通过真空蒸发法获得固体氯化钠。
2. 真空蒸发法制备氯化钠将氯化钠溶液置于真空蒸发器中,加热使其溶剂蒸发,最终得到固态氯化钠。
3. 晶体生长法制备氯化钠将氯化钠溶液中的氯化钠结晶,过滤后得到氯化钠固体。
三、实验结果及分析经过对比实验,在制备过程中分别记录了制备时间、成品产量、纯度等数据。
离子交换法能够获得高纯度的氯化钠,但制备时间较长;真空蒸发法制备快速,但纯度较低;晶体生长法既能获得相对高纯度的氯化钠,又能在较短时间内完成制备。
四、结论及展望通过本实验的对比,可以得出不同制备方法的优缺点。
在实际应用中,可根据具体需求选择不同方法进行制备。
未来可以进一步优化实验条件,提高不同方法的效率和纯度,并探索新的氯化钠制备方法。
以上就是《药用氯化钠的制备》实验综述报告的内容,希望对大家有所帮助。
第2篇示例:药用氯化钠(NaCl)是一种常见的药品原料,广泛用于制备注射液、口服溶液、洗眼液等药物。
对药用氯化钠的制备及其质量控制一直是制药工作者关注的话题。
本实验综述报告将简要介绍药用氯化钠的制备方法,并对制备过程中的关键步骤和质量控制进行讨论,旨在为相关研究人员提供参考。
一、药用氯化钠的制备方法目前,常用的药用氯化钠制备方法主要包括晶格法、液相法和盐湖法。

《药用氯化钠的制备》实验综述报告7篇第1篇示例:药用氯化钠,即医用盐,是一种常用的药品和生活用品,在医疗和食品加工行业有着广泛的应用。
药用氯化钠的制备是一项重要的实验工作,本文将对药用氯化钠的制备实验进行综述报告。
一、实验目的本实验的主要目的是通过反应制备药用氯化钠晶体,并学习实验中所涉及的化学原理和操作技巧。
二、实验原理药用氯化钠的主要原料是氯化钠和纯净水。
实验中,将氯化钠溶解于纯净水中,经过加热溶解、过滤、结晶等步骤,最终得到药用氯化钠晶体。
三、实验步骤与操作1. 准备实验器材和药品:氯化钠、纯净水、玻璃烧杯、玻璃棒、热板等。
2. 将适量氯化钠溶解于纯净水中,搅拌至完全溶解。
3. 将溶液通过滤纸进行过滤,去除杂质。
4. 将过滤后的溶液置于热板上加热,待水分蒸发后开始结晶。
5. 等待结晶完全形成后,将药用氯化钠晶体取出并晾干。
四、实验结果与分析通过本实验,成功制备了药用氯化钠晶体。
根据实验数据和观察结果,药用氯化钠晶体质地均匀、晶莹剔透,符合药用标准要求。
五、实验总结与心得体会本实验通过简单的化学反应制备了药用氯化钠晶体,增进了对化学原理和实验操作的理解和掌握。
也提高了操作技能和实验操作的熟练程度。
药用氯化钠的制备实验对于化学实验室的教学和科研有着重要的意义。
通过实验,学生们可以深入了解药用氯化钠的制备过程和原理,提高实验操作技能,为今后的科研工作和生活实践打下坚实的基础。
希望通过这份实验综述报告,能够对读者对药用氯化钠的制备有更深入的了解和认识。
第2篇示例:一、实验目的本实验旨在掌握药用氯化钠的制备方法,了解其制备过程和注意事项,培养学生的实验操作能力和分析能力。
二、实验原理药用氯化钠的主要制备方法有重晶石法、氯化镁法、蒸发结晶法等。
重晶石法是应用最广泛的方法。
其原理是将氯化铵和氯化钠按一定的比例混合,加热至一定温度使其反应生成氯化钠,然后通过结晶和过滤得到药用氯化钠的产品。
三、实验步骤1.称取适量的氯化铵和氯化钠按照一定的比例混合。

《药用氯化钠的制备》实验综述报告
药用氯化钠是一种重要的药物原料,用于制备注射用生理盐水、洗眼液等药物。
本实验旨在通过简单的化学实验制备药用氯化钠,并对制备过程进行综述。
1. 实验材料准备:氯化钠固体、蒸馏水、容器、滤纸、酒精灯等。
2. 称取适量的氯化钠固体,放入容器中。
3. 加入适量的蒸馏水,搅拌溶解。
4. 对溶液进行过滤,去除杂质。
5. 将过滤后的溶液进行蒸发,使溶液中的水分蒸发掉。
6. 得到固体氯化钠,待干燥后即可使用。
制备过程中需要注意以下几点:
1. 实验室应保持清洁卫生,使用干净的容器和滤纸,以避免杂质对氯化钠制备的影响。
2. 溶解氯化钠时,应充分搅拌以加速溶解速度。
3. 溶液过滤时,滤纸要紧贴漏斗壁,以避免溶液泄漏。
4. 蒸发溶液时要注意控制温度和加热时间,以避免溶液溢出和固体氯化钠的烧焦。
药用氯化钠制备的综述报告主要包括对实验原理、实验步骤和注意事项的介绍,同时还要对实验结果进行分析和总结。
实验原理部分可以对氯化钠的化学性质和溶解过程进行介绍,实验步骤部分可以结合具体实验条件和操作方法进行详细说明,注意事项部分可以列举一些制备过程中需要注意的重要事项。
还可以对实验结果进行分析,比如对制备出的药用氯化钠的纯度进行检测,以确保其符合药品生产的相关要求。
还可以对制备过程中可能遇到的问题和改进方向进行讨论,并提出实验改进的建议。
《药用氯化钠的制备》实验综述报告主要包括实验的介绍、步骤、注意事项、结果分析和改进建议等内容。
通过实验综述报告的编写,可以加深对药用氯化钠制备的理解,提高实验操作和分析能力。

《药用氯化钠的制备》实验综述报告
药用氯化钠是一种常用的药物,具有抗感染、抗炎、抗衰老等多种功效。
本文对药用氯化钠的制备方法进行了综述。
药用氯化钠可以通过氯化钠溶液的蒸发结晶得到。
将氯化钠溶解在适量的蒸馏水中,搅拌均匀并加热至溶液沸腾,然后停止加热,让溶液自然冷却。
随着溶液温度的降低,氯化钠会结晶出来。
用过滤器过滤得到的晶体并将其晾干,即可得到纯净的药用氯化钠。
药用氯化钠还可以通过电解法制备。
将氯化钠溶解在适量的蒸馏水中,得到氯化钠溶液。
然后将两块铂电极分别插入溶液中,进行电解。
通电时,氯化钠分子会分解成氯离子和钠离子,分别在两个电极上析出。
在阳极上析出的氯离子会与电解质中的氢离子结合生成氯气,而在阴极上析出的钠离子则与水分子结合生成氢氧化钠。
通过收集氢氧化钠并将其与盐酸反应,可以得到纯净的药用氯化钠。
药用氯化钠的制备方法包括溶液结晶法、电解法和化学反应法。
通过这些方法,可以制备纯净的药用氯化钠,为生产高质量的药物提供基础材料。
但需要注意的是,在制备过程中应当严格控制反应条件和操作步骤,确保药用氯化钠的纯度和质量。
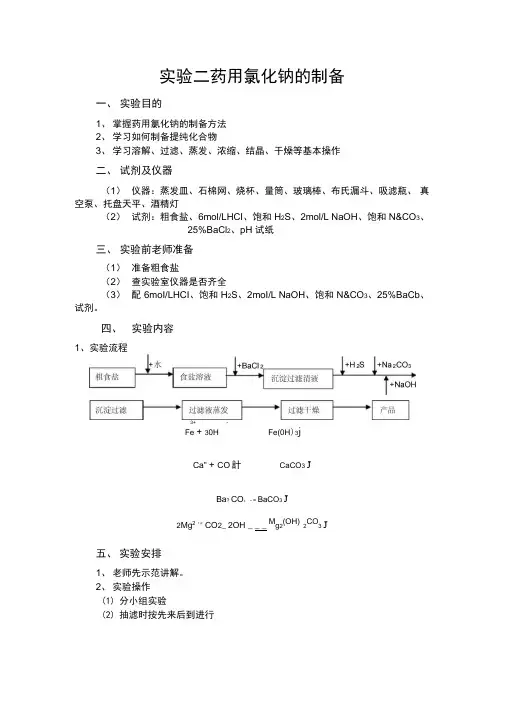
实验二药用氯化钠的制备一、实验目的1、掌握药用氯化钠的制备方法2、学习如何制备提纯化合物3、学习溶解、过滤、蒸发、浓缩、结晶、干燥等基本操作二、试剂及仪器(1)仪器:蒸发皿、石棉网、烧杯、量筒、玻璃棒、布氏漏斗、吸滤瓶、真空泵、托盘天平、酒精灯(2)试剂:粗食盐、6mol/LHCI、饱和H2S、2mol/L NaOH、饱和N&CO3、25%BaCl2、pH 试纸三、实验前老师准备(1)准备粗食盐(2)查实验室仪器是否齐全(3)配6moI/LHCI、饱和H2S、2moI/L NaOH、饱和N&CO3、25%BaCb、试剂。
四、实验内容1、实验流程3+ -Fe + 30H Fe(0H)3jCa" + CO計CaCO3 JBa? CO;- = BaCO3 J2Mg2'* CO2_ 2OH _ _ _ Mg2(OH)2CO3 J五、实验安排1、老师先示范讲解。
2、实验操作(1)分小组实验(2)抽滤时按先来后到进行(3)干燥按先来后到进行六、思考题1、在加入沉淀剂SO42-、Ca2+、Mg2+等离子转入沉淀以除去它们时,加热与加热对分离操作有何影响?如何检查这些离子是否沉淀完全2、在调pH过程中,若加入的盐酸过量怎么办?为何要调成弱酸性?3、在浓缩过程中,能否把溶液蒸干?为什么?七、结果2、实验步骤(1)粗盐溶解。
(2)加氯化钡除去SO4-杂质离子。
步骤包括沉淀、检测、过滤步骤。
(3)滤液加H2S除去重金属离子、饱和Na z CO3除去Ca2+和Ba2+,用NaOH 调节pH为10—11充分沉淀Fe3^^其他金属离子。
步骤包括加试剂、检测、加热、过滤。
(4)滤液用盐酸调节pH为3—4放置沉淀产生,步骤包括蒸发浓缩,抽滤。
(5)晶体烘干,称重,计算产率。
3、涉及反应Ba2 SO2「BaSO4 J金属离子+ S2---------------------------- 沉淀。

《药用氯化钠的制备》实验综述报告
一、引言
二、实验目的
1. 了解药用氯化钠的制备方法;
2. 掌握药用氯化钠的实验操作技巧;
3. 了解药用氯化钠在医药领域的应用。
三、实验原理
药用氯化钠的制备主要有两种方法:一种是通过海水或岩盐提炼,另一种是通过化学
合成。
通过海水或岩盐提炼药用氯化钠的方法是将海水或岩盐溶解在水中,然后经过蒸发结
晶或电解制备氯化钠。
这种方法的优点是原料容易获得,但是提取氯化钠的纯度相对较
低。
通过化学合成制备药用氯化钠的方法是将氯气和氢氧化钠反应生成氯化钠溶液,然后
经过蒸发结晶得到固体氯化钠。
这种方法的优点是制备出的药用氯化钠纯度较高。
四、实验步骤
五、实验应用
药用氯化钠在医药领域有广泛的应用,主要包括以下几个方面:
1. 输液制剂:氯化钠溶液是一种用于输液的解毒剂,在临床上被广泛应用;
2. 治疗疾病:氯化钠可以用于治疗低钠血症、水中毒等疾病;
3. 化验药品:氯化钠可以用于生化分析和实验室研究中;
4. 护理用品:氯化钠还可以用于口腔护理、伤口清洁等。
六、结论
通过实验综述报告的介绍,我们了解了药用氯化钠的制备方法、实验步骤及其在医药
领域的应用。
我们也了解到了药用氯化钠在医药领域的重要作用。
希望通过本实验的学习,能够加深对药用氯化钠的了解,提高实验操作技能,为今后的科研和应用工作打下坚实的
基础。
《药用氯化钠的制备》实验综述报告
药用氯化钠是药物中常见的一种制剂,它常用于口服药物的配制,也可以用于各种注射剂的制备。
本文将对药用氯化钠的制备方法进行综述。
药用氯化钠的制备方法比较简单,常见的有以下几种:
一、盐酸与氢氧化钠的中和反应法:
将一定质量的盐酸溶液与氢氧化钠溶液按一定的量比加入反应容器中,加热搅拌,使其完全反应生成氯化钠和水,并同时发生副反应生成氯气和氢氧化钠。
待反应完全后,过滤除去沉淀,然后进行煮干浓缩,最后得到药用氯化钠。
二、氯化钠加热干燥法:
将一定质量的氯化钠加入烘箱中进行加热干燥,温度一般控制在100-150℃之间,时间根据氯化钠的含水量和干燥速度来定。
待氯化钠完全干燥后,取出即得药用氯化钠。
三、浓缩法:
将一定质量的氯化钠溶液倒入蒸发器中,采用低温浓缩或高温浓缩的方法进行浓缩,直至得到所需浓度的氯化钠溶液。
然后将溶液进行过滤、过滤液进行干燥,最后得到药用氯化钠。
以上三种方法在实际应用中都比较常见,根据需要选择合适的方法进行制备即可。
药用氯化钠的制备过程中需要注意以下几个方面:
一、控制反应条件:不同的制备方法对反应条件有一定的要求,例如温度、时间等,需要根据具体情况进行调整,以保证反应能够进行完全。
二、提高纯度:药用氯化钠作为药物原料,其纯度要求比较高,制备过程中要注意选择优质的原料,避免污染。
同时在制备过程中要进行多次的过滤和洗涤,以提高纯度。
三、干燥过程:药用氯化钠在干燥过程中需注意控制温度和时间,避免过度干燥导致结晶结构破坏。
《药用氯化钠的制备》实验综述报告1. 引言1.1 背景介绍药用氯化钠是一种常见的药物原料,在医疗、制药和实验室中都有广泛的应用。
氯化钠是一种无机化合物,由氯离子和钠离子组成,具有很强的溶解性和稳定性。
在临床上,氯化钠可以用于静脉注射、皮下注射、双肌注射等多种途径,用于补充体液、维持电解质平衡、调节酸碱平衡等。
氯化钠还可以作为生理盐水、洗液等药物配方的重要成分。
在制备药用氯化钠的过程中,需要确保其纯度和质量符合医药标准,以确保药物的安全性和有效性。
对药用氯化钠的制备方法进行研究和探讨具有重要的意义。
通过实验对药用氯化钠的制备过程进行深入了解,可以为提高药品质量、优化生产工艺提供有益的参考和指导。
本文将介绍药用氯化钠的制备实验过程,旨在探讨最优的制备方法,为药物生产和研究提供有益的参考。
1.2 研究目的本实验旨在探究药用氯化钠的制备方法,验证合成氯化钠的操作流程,并通过实验结果分析不同实验条件下的产率及纯度,为未来进一步研究及应用提供参考。
通过本实验的实施,我们希望能够找到一种简便、高效、安全的制备氯化钠的方法,为其在医学领域的应用提供更加可靠的工艺支持。
通过对实验结果的讨论分析,探讨实验中可能存在的问题,并提出改进措施,为将来的研究工作提供指导和参考,推动医学领域氯化钠制备工艺的进步和发展。
1.3 意义药用氯化钠是一种常见的药品,具有广泛的应用价值。
其主要作用是用于维持体内正常的水电解质平衡,调节血容量和血压。
药用氯化钠在临床上常用于生理盐水、葡萄糖氯化钠注射液等药物的配制中,广泛应用于各种治疗、营养和生产过程中。
研究药用氯化钠的制备方法具有重要的实际意义。
通过实验制备药用氯化钠,不仅可以了解制备方法和原理,还可以培养学生的实践操作能力和分析能力。
在医药工业和临床医学中,准确制备药物是至关重要的,保证药品的质量和安全性。
深入研究药用氯化钠的制备方法对于提高医药工作者的专业素养和技能水平具有积极的推动作用。
《药用氯化钠的制备》实验综述报告实验名称:药用氯化钠的制备实验目的:1. 了解氯化钠的制备方法和原理2. 掌握药用氯化钠的制备技术3. 熟悉实验操作流程和注意事项4. 增强化学实验操作技能实验原理:氯化钠是一种常见的药用化合物,它主要用于调节体内水分和电解质平衡,维持细胞的正常功能。
氯化钠可通过化学方法制备,最常用的方法是将氢氧化钠和盐酸混合反应生成氯化钠和水,化学方程式为NaOH + HCl → NaCl + H2O。
制备的氯化钠需要符合药用级别的纯度要求,因此在实验中需要控制好反应条件和操作技术,保证制备出的氯化钠符合药用标准。
实验仪器和试剂:1. 实验仪器:量筒、玻璃烧杯、试管、搅拌棒、热水浴2. 实验试剂:氢氧化钠、盐酸、蒸馏水实验步骤:1. 准备氢氧化钠溶液:取一定量的氢氧化钠固体,加入适量的蒸馏水中,充分溶解后得到氢氧化钠溶液。
2. 准备盐酸溶液:取一定量的盐酸,加入适量的蒸馏水中,充分稀释后得到盐酸溶液。
3. 反应制备氯化钠:将氢氧化钠溶液缓慢滴加到盐酸溶液中,同时用玻璃棒快速搅拌,直至反应结束。
4. 过滤固体产物:将产生的氯化钠固体沉淀物用过滤纸过滤,将过滤得到的氯化钠固体用蒸馏水洗涤。
5. 干燥氯化钠:将洗涤得到的氯化钠固体产物置于烘箱或热水浴中干燥,得到最终的药用氯化钠产物。
实验结果与讨论:根据实验步骤操作,制备出的药用氯化钠应该是白色结晶固体,无杂质,符合药用级别的纯度标准。
在实验过程中需要注意溶液滴加速度和搅拌速度,控制好反应温度和时间,以保证制备的氯化钠的质量稳定。
实验中使用的盐酸和氢氧化钠也要求纯度较高,以确保产物的纯度。
结论:通过本实验,学习了药用氯化钠的制备方法和原理,掌握了操作技术和注意事项,提高了化学实验操作技能。
同时也了解了药用氯化钠的重要性和用途,在日常生活和医疗中有着重要的应用价值。
在今后的学习和工作中,将继续努力,提高实验操作技术,为将来的科学研究和实践工作做好充分的准备。
《药用氯化钠的制备》实验综述报告一、实验目的:1.学会化学方法提纯粗盐,同时进一步精制成试剂级纯度的氯化钠提供原料.2.练天平的采用,以及冷却、熔化、过滤器、冷却和结晶、潮湿的基本操作.3.体会过滤的原理在生活生产等社会实际中的应用.二、实验原理:粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:ca2+,mg2+,so42- 等.不溶性杂质可以用过滤的方法除去,ca2+,mg2+,so42-可以通过化学方法----加试剂使之沉淀,在过滤,然后蒸发水分得到较纯净的精盐.三、实验仪器和药品:药品:粗盐,水,盐酸(2n),氢氧化钠(2n),氯化钡(1n),碳酸钠(1n)器材:天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片四、实验操作方式:五、实验总结1.在除去ca2+,mg2+,so42-时,为什么必须先加bacl2溶液,然后提na2co3溶液?2.蒸发前为什么要将粗盐溶液的ph调到4—5?一、实验题目:粗盐制取分析氢铵氯化钠二、实验目的:1.稳固预热过滤器,冷却、铀等基本操作;2.了解沉淀溶解平衡原理的应用;3.自学在拆分纯化物质过程中,定性检验ca、mg、so4等离子与否召用。
三、实验原理:粗盐中,除含一些不溶性杂志,还含有ca、mg、so4和fe等可溶性法除去,然后冷却水分获得较清澈的精盐。
1.bacl2—naoh,na2co3法(1)除so4,重新加入bacl2溶液ba+so4=baso4(2)除ca2+、mg2+、和fe3+和过量的ba2+,重新加入naoh—na2co3ca2++co32-=caco3 ba2++co32-=baco3 4mg2++4co32-+h2o=mg(oh)2·3mgco3(3)除co32-,重新加入hcl溶液co3+2h=h2o+co2↑四、实验仪器与药品仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、三脚架、酒精灯、石棉网、火柴、滤纸、漏斗、蒸发皿、坩埚钳、表面皿、ph试纸、抽滤机、铁架台(带铁圈)、小试管、胶头滴管。
实验二 药用氯化钠的制备
一、实验目的
1、掌握药用氯化钠的制备方法
2、学习如何制备提纯化合物
3、学习溶解、过滤、蒸发、浓缩、结晶、干燥等基本操作
二、试剂及仪器
(1)仪器:蒸发皿、石棉网、烧杯、量筒、玻璃棒、布氏漏斗、吸滤瓶、真空泵、托盘天平、酒精灯
(2)试剂:粗食盐、6mol/LHCl 、饱和H 2S 、2mol/L NaOH 、饱和Na 2CO 3、
25%BaCl 2、pH 试纸
三、实验前老师准备
(1)准备粗食盐
(2)查实验室仪器是否齐全
(3)配6mol/LHCl 、饱和H 2S 、2mol/L NaOH 、饱和Na 2CO 3、25%BaCl 2、试剂。
四、实验内容
2、实验步骤
(1)粗盐溶解。
(2)加氯化钡除去-2
4SO 杂质离子。
步骤包括沉淀、检测、过滤步骤。
(3)滤液加H 2S 除去重金属离子、饱和Na 2CO 3除去Ca 2+和Ba 2+,用NaOH 调节pH 为10—11充分沉淀Fe 3+和其他金属离子。
步骤包括加试剂、检测、加热、过滤。
(4)滤液用盐酸调节pH 为3—4放置沉淀产生,步骤包括蒸发浓缩,抽滤。
(5)晶体烘干,称重,计算产率。
3、涉及反应
BaSO 4-2
42SO Ba ++↓
金属离子+ S 2- 沉淀
Fe +OH Fe(OH)3↓ 3+-3
↓
CaCO 3+2Ca + -2
3CO ↓ BaCO 3-++23
2CO Ba ↓ Mg 2(OH)2CO 3--+++2OH CO Mg 2322
五、实验安排
1、老师先示范讲解。
2、实验操作
(1)分小组实验
(2)抽滤时按先来后到进行
(3)干燥按先来后到进行
六、思考题
1、在加入沉淀剂SO 42-、Ca 2+、Mg 2+等离子转入沉淀以除去它们时,加热与 加热对分离操作有何影响?如何检查这些离子是否沉淀完全
2、在调pH 过程中,若加入的盐酸过量怎么办?为何要调成弱酸性?
3、在浓缩过程中,能否把溶液蒸干?为什么?
七、结果。