铝、镁、铁、锌与酸 反应
- 格式:ppt
- 大小:320.00 KB
- 文档页数:39

金属与稀盐酸和稀硫酸的反应规律一、引言金属与稀盐酸和稀硫酸的反应一直是化学实验中常见的实验内容。
通过观察金属与稀盐酸和稀硫酸的反应,可以深入了解金属与酸反应的规律,为进一步学习金属与酸的化学性质奠定基础。
本文将系统介绍金属与稀盐酸和稀硫酸的反应规律,以便读者对此类反应有更深入的了解。
二、金属与稀盐酸的反应规律1. 钠与稀盐酸的反应规律钠是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化钠,并伴有剧烈的放热现象。
化学方程式为:2Na + 2HCl → 2NaCl + H2↑。
2. 镁与稀盐酸的反应规律镁是一种较活泼的金属,与稀盐酸反应会产生氢气和氯化镁。
镁与盐酸的反应速度较快,但放热不如钠。
化学方程式为:Mg + 2HCl → MgCl2 + H2↑。
3. 铝与稀盐酸的反应规律铝是一种较活泼的金属,但铝表面的氧化膜会限制其与酸反应速度。
在稀盐酸中,铝表面的氧化膜会溶解,继而与盐酸发生反应,产生氢气和氯化铝。
化学方程式为:2Al + 6HCl → 2AlCl3 + 3H2↑。
4. 锌与稀盐酸的反应规律锌是一种活泼的金属,与稀盐酸会产生氢气和氯化锌。
锌与盐酸的反应速率较快,但放热不及钠。
化学方程式为:Zn + 2HCl → ZnCl2 +H2↑。
5. 铁与稀盐酸的反应规律铁是一种较活泼的金属,与稀盐酸会产生氢气和氯化铁。
铁与盐酸的反应速率较慢,但放热较大。
化学方程式为:Fe + 2HCl → FeCl2 +H2↑。
三、金属与稀硫酸的反应规律1. 钠与稀硫酸的反应规律钠与稀硫酸反应会产生硫化氢气和亚硫酸钠,并伴有放热现象。
化学方程式为:2Na + H2SO4 → Na2SO3 + H2S↑。
2. 镁与稀硫酸的反应规律镁与稀硫酸反应会产生硫化氢气、硫酸镁和水。
镁与硫酸反应速率较慢,但放热较大。
化学方程式为:Mg + H2SO4 → MgSO4 + H2S↑。
3. 铝与稀硫酸的反应规律铝与稀硫酸反应会产生硫化氢气、亚硫酸铝和水。

一、中考初中化学金属与酸反应的图像 1.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
故选B。
2.下列所示的四个图像,能正确反映对应变化关系的是A.向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉B.等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应C.向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸D.向一定量的含有盐酸的氯化铜溶液中滴加氢氧化钠溶液【答案】B【解析】【分析】【详解】A、铁的金属活动性比铜强,比镁弱,向一定量的硝酸铜和硝酸镁的混合溶液中加入铁粉,铁不能与硝酸镁溶液反应,铁能与硝酸铜溶液反应生成硝酸亚铁溶液和铜,参加反应的铁的质量小于生成铜的质量,则溶液的质量应减少,故错误;B、等质量的镁和铁分别与等质量、等浓度足量的稀硫酸反应,横坐标是硫酸的量,故等量的硫酸产生氢气的质量相等,当金属全部参加反应,生成氢气的质量与金属的相对原子质量成反比(+2价的金属),则镁产生的氢气的质量大于铁,故正确;C、向一定量氢氧化钠溶液中滴加pH=3的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,随着反应进行,溶液碱性减弱,pH减小,恰好完全反应时pH=7,继续加入稀盐酸时,溶液pH小于7,但是不能减小到3,更不能小于3,故错误;D、向含有盐酸的氯化铜溶液中滴加烧碱溶液时,氢氧化钠先和稀盐酸反应,后和氯化铜反应,因此开始不能产生沉淀,故错误。
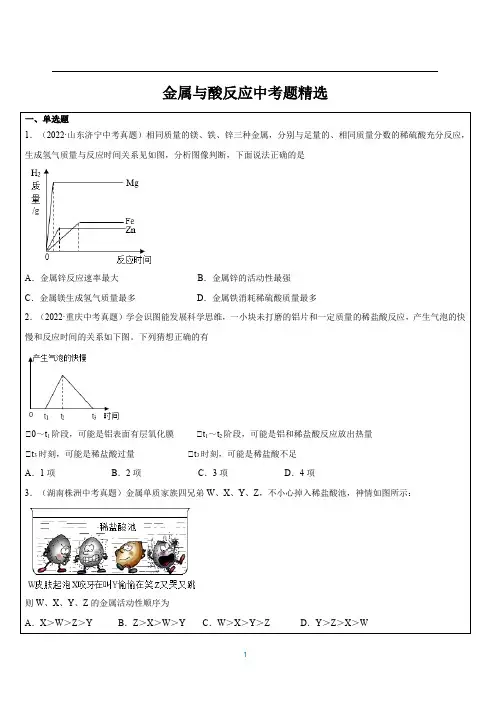
金属与酸反应中考题精选一、单选题1.(2022·山东济宁中考真题)相同质量的镁、铁、锌三种金属,分别与足量的、相同质量分数的稀硫酸充分反应,生成氢气质量与反应时间关系见如图,分析图像判断,下面说法正确的是A.金属锌反应速率最大B.金属锌的活动性最强C.金属镁生成氢气质量最多D.金属铁消耗稀硫酸质量最多2.(2022·重庆中考真题)学会识图能发展科学思维,一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如下图。
下列猜想正确的有①0~t1阶段,可能是铝表面有层氧化膜①t1~t2阶段,可能是铝和稀盐酸反应放出热量①t3时刻,可能是稀盐酸过量①t3时刻,可能是稀盐酸不足A.1项B.2项C.3项D.4项3.(湖南株洲中考真题)金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:则W、X、Y、Z的金属活动性顺序为A.X>W>Z>Y B.Z>X>W>Y C.W>X>Y>Z D.Y>Z>X>W4.(2021·甘肃甘南中考真题)用稀盐酸与大小相同的镁、锌、铜片反应探究金属活动性。
实验如下图所示。
下列说法正确的是A.铜片表面可以观察到气泡B.锌片比镁片反应更剧烈C.金属活动性由强到弱顺序为:镁>锌>铜D.三支试管中盐酸的溶质质量分数可以不同5.(湖北孝感中考真题)现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。
向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。
则下列结论正确的个数是①恰好完全反应时,一定没有固体剩余①x的值为0.2①铁样品中可能含有镁①M点对应的溶液中含有2种或3种溶质A.1个B.2个C.3个D.4个6.(2021·广西玉林中考真题)如图所示,倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压,瓶内气压与时间关系如曲线所示。
有关说法正确的是A.反应结束后,稀盐酸可能有剩余B.曲线①表示锌粒与稀盐酸的反应C.比较b、c两点,说明影响反应速率的因素之一是反应物的接触面积D.a、b、c、d四点处的溶质成分相同7.(2022·河南中考真题)某种金属混合物样品由Mg、Al、Fe、Cu四种金属中的两种组成。

镁铁锌铝与稀盐酸反应生成氢气质量一、简介镁铁锌铝是常见的金属元素,它们与稀盐酸反应能够生成氢气,这一反应在工业生产和实验室中具有重要的应用价值。
本文将对镁铁锌铝与稀盐酸反应生成氢气的质量进行探究和分析。
二、镁与稀盐酸的反应1. 反应方程式镁+ 2HCl → MgCl2 + H2↑2. 反应规律在常温下,镁与稀盐酸反应生成氢气,生成氢气的质量与反应中镁的质量、反应时间、反应温度等因素有关。
可以通过实验得到生成氢气的质量与反应条件的关系。
三、铁与稀盐酸的反应1. 反应方程式Fe + 2HCl → FeCl2 + H2↑2. 反应规律铁与稀盐酸反应同样能够生成氢气,生成氢气的质量与反应中铁的质量、反应时间、反应温度等因素也有关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
四、锌与稀盐酸的反应1. 反应方程式Zn + 2HCl → ZnCl2 + H2↑2. 反应规律锌与稀盐酸反应同样产生氢气,生成氢气的质量与反应中锌的质量、反应时间、反应温度等因素也成正比关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
五、铝与稀盐酸的反应1. 反应方程式2Al + 6HCl → 2AlCl3 + 3H2↑2. 反应规律铝与稀盐酸反应同样会产生氢气,生成氢气的质量与反应中铝的质量、反应时间、反应温度等因素也有关系。
实验可以进一步验证生成氢气的质量与反应条件的相关性。
六、结论通过对镁铁锌铝与稀盐酸反应生成氢气的质量进行分析和研究,可以得出以下结论:1. 反应中金属的质量越多,生成氢气的质量越大。
2. 反应时间和反应温度的增加会促进生成氢气的速度和质量。
3. 不同的金属和反应条件下,生成氢气的质量存在一定的差异,需要具体实验进行验证和分析。
七、展望进一步研究和探索镁铁锌铝与稀盐酸反应生成氢气的质量,可以深入了解金属与酸类物质的化学反应规律,为工业生产和实验室应用提供依据和参考。
同时可以通过改变反应条件和金属材料,探索新的反应路径和应用领域。



铝镁铁锌四中金属,分别和稀盐酸、稀硫酸反应的化学方程式
答:
镁和稀盐酸反应生成氯化镁和氢气,和稀硫酸反应生成硫酸镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑,Mg+H2SO4═MgSO4+H2↑;
铝和稀盐酸反应生成氯化铝和氢气,和稀硫酸反应生成硫酸铝和氢气,反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,2Al+3H2SO4═Al2(SO4)3+3H2↑;
锌和稀盐酸反应生成氯化锌和氢气,和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,Zn+H2SO4═ZnSO4+H2↑;
铁和稀盐酸反应生成氯化亚铁和氢气,和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑,Fe+H2SO4═FeSO4+H2↑;
镁和稀盐酸反应生成氯化镁和氢气,和稀硫酸反应生成硫酸镁和氢气;
铝和稀盐酸反应生成氯化铝和氢气,和稀硫酸反应生成硫酸铝和氢气;
锌和稀盐酸反应生成氯化锌和氢气,和稀硫酸反应生成硫酸锌和氢气;
铁和稀盐酸反应生成氯化亚铁和氢气,和稀硫酸反应生成硫酸亚铁和氢气.。

一、中考初中化学金属与酸反应的图像1.在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。
综合以上信息得到以下结论,合理的是A .从图象可以看出,金属镁比金属锌的活动性强B .若两种金属都有剩余,二者得到的氢气质量相同C .若硫酸有剩余,二者得到氢气的质量相同D .若两种金属完全溶解,二者消耗硫酸的质量相同【答案】B【解析】【分析】【详解】A 、图像体现的是产生氢气质量与消耗硫酸质量之间的关系,没有体现时间关系,无法比较镁、锌反应的速率,无法得出镁和锌的活动性强弱,说法错误;B 、若两种金属都有剩余,则消耗的硫酸质量相等,根据氢元素质量守恒,产生的氢气均来自硫酸中的氢元素,故二者得到的氢气质量相同,说法正确;C 、若硫酸有剩余,根据2442Mg H SO MgSO H 242+=+↑,2442Zn H SO ZnSO H 652+=+↑可知,相同质量的镁、锌产生氢气的质量为:镁>锌,说法错误;D 、若两种金属完全溶解,根据2442Mg H SO MgSO H 2498+=+↑,2442Zn H SO ZnSO H 6598+=+↑可知,相同质量的镁、锌与硫酸反应,消耗硫酸的质量为:镁>锌,说法错误。
故选:B 。
2.下列图像能正确反映其对应关系的是()A.向等质量、等浓度的稀硫酸中分别加入过量的Zn和FeB.向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸C.用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气D.向盛有稀硫酸的烧杯中不断加水稀释【答案】B【解析】【分析】【详解】A、酸质量相等,金属过量,最终产生氢气质量相等,产生相同质量的氢气时,消耗的锌的质量应大于铁的质量,与图像不符;B、向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸,稀盐酸会先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成二氧化碳氯化钠和水,与图像相符,故选B;C、催化剂只能改变反应速率,不能改变生成物的多少,用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气,生成氧气质量应该相等,与图像不符;D、加水稀释只会使稀硫酸酸性减弱,不可能pH大于7,变为碱性,与图像不符。

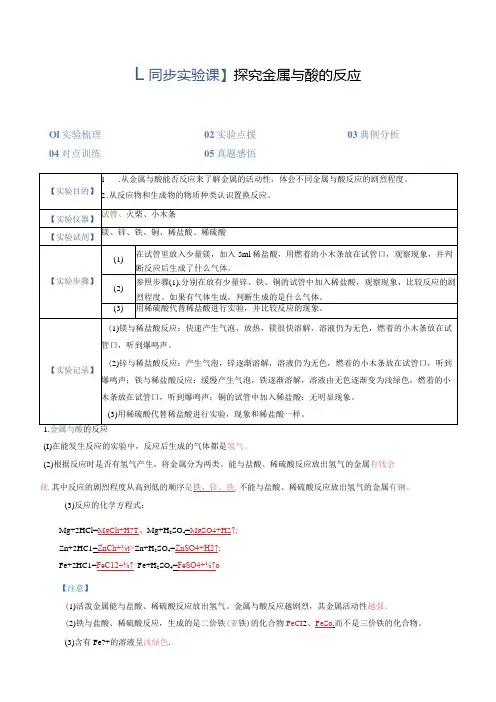
L同步实验课】探究金属与酸的反应Ol实验梳理02实验点拨03典例分析04对点训练05真题感悟(I)在能发生反应的实验中,反应后生成的气体都是氢气。
(2)根据反应时是否有氢气产生,将金属分为两类。
能与盐酸、稀硫酸反应放出氢气的金属有钱金钛,其中反应的剧烈程度从高到低的顺序是铁、锌、铁,不能与盐酸、稀硫酸反应放出氢气的金属有钢。
(3)反应的化学方程式:Mg÷2HCl=MgCh+H?T、Mg+H2SO4=MgSO4+H2↑;Zn+2HC1=ZnCh+⅛t>Zn+H2SO4=ZnSO4+H2↑;Fe+2HC1=FeC12÷⅛↑^Fe+H2SO4=FeSO4+⅛↑o【注意】(1)活泼金属能与盐酸、稀硫酸反应放出氢气。
金属与酸反应越剧烈,其金属活动性越强。
(2)铁与盐酸、稀硫酸反应,生成的是二价铁(亚铁)的化合物FeCI2、FeSo.而不是三价铁的化合物。
(3)含有Fe?+的溶液呈浅绿色.2.置换反应(1)定义:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
(2)置换反应属于堇至反亶类型之一。
(3)特征:单换单。
(4)通式:A+BC→AC+Bo【典例01】把一枚硬币投入稀盐酸中,过一段时间观察到溶液变成浅绿色,说明硬币中一定含有()A.铝 B.镁 C.铁 D.铜【答案】C【详解】A、铝与盐酸反应生成氯化铝,属于无色,故A错误;B、镁与盐酸反应生成氯化镁,氯化镁溶液是无色的,故B错误;C、铁与盐酸反应生成氯化亚铁,氯化亚铁溶液属于浅绿色,故C正确;D、铜与盐酸不反应,溶液颜色仍然属于无色,故D错误。
故选C。
【典例02】某实验小组在探究金属的化学性质时,得到金属与酸反应制取氢气的质量关系(见下图)。
请根据图象信息判断,下列说法正确的是()A.四种金属与酸反应的速率:Al>Mg>Fe>ZnB.四种金属的活动性顺序:Mg>Al>Zn>FeC.同质量的四种金属与足量酸反应得到氢气的质量:Al>Mg>Fe>ZnD.AkMg、Fe、Zn四种金属与酸反应得到氢气的质量比:1/27:1/24:1/56:1/65【答案】C【详解】A、在金属活动性顺序中Mg>Al>Zn>Fe,活动性越强,与酸反应的速率越快,因此反应速率为:Mg>Al>Zn>Fe,但不能根据图像信息判断出此结论,故选项错误;B、在金属活动性顺序中,四种金属的活动性由强到弱的顺序为:Mg>Al>Zn>Fe,但不能根据图像信息判断出此结论,故选项错误;C、根据坐标可知若都是0.9g的Al、Mg、Fe、Zn四种金属,分别跟足量的酸反应产生氢气由多到少的顺序为:AI>Mg>Fe>Zn,故选项正确;D、观察坐标,最终不同质量的四种金属产生的氢气质量相等,故选项错误。
金属与酸反应(讲义)➢知识点睛1.图象题(1)氢气质量与反应时间的关系a.等质量的镁、铝、锌、铁和足量的酸反应(图1),金属反应完,酸有剩余,生成氢气的质量不等,产生氢气的质量由多到少为:____、____、____、____,产生氢气由快到慢为____、____、____、____。
b.足量的镁、铝、锌、铁和等量的酸反应(图2),酸反应完,金属有剩余,生成氢气的质量相等,消耗金属的质量由少到多为:____、____、____、____,产生氢气由快到慢为____、____、____、____。
注:四种金属的产氢能力由强到弱为:___、___、___、___。
(2)氢气质量与反应物质量的关系a.向等质量的镁、铝、锌、铁中加入足量酸(图3),最初酸不足,产生氢气的质量相等,最终酸过量,金属不足,产生的氢气质量不等,产生氢气的质量由多到少为:____、____、____、____。
b.向等质量的酸中加入足量的镁、铝、锌、铁(图4),最初金属不足,等质量的金属参与反应产生氢气的质量不等,产生氢气的质量由多到少为:____、____、____、____,最终酸不足,产生的氢气质量相等。
注:此类图象中斜率的大小不再表示产生氢气的快慢。
2.天平问题天平两边加入金属和酸的量均相等,天平偏转情况:(1)天平首先偏向放出氢气较慢的一侧,即金属活动性较弱的一侧。
(2)天平最终偏向放出氢气的量较少的一侧,即产氢能力弱的一侧。
若两边放出氢气的质量相等,则天平最终平衡。
注:天平最终不可能偏向产氢能力强的一侧。
3.根据金属混合物与酸反应判断金属混合物的成分(1)平均值法计算出金属混合物的平均相对原子质量Ar,利用平均值法,推测金属混合物的成分(将Al的相对原子质量折算成18,氢后金属的相对原子质量折算成无穷大)。
A r(A)<Ar< A r(B)(2)极端假设法假设金属混合物中只含已知的该金属,计算此时应产生的氢气质量,比较其与实际产生的氢气质量的大小关系,根据金属产氢能力,推测金属混合物的成分。
镁,铝,锌,铁和稀盐酸反应方程式铁,镁,铝,锌是几种常见的金属,而稀盐酸是一种无色液体,具有很强的酸性。
铁,镁,铝,锌和稀盐酸之间发生反应是非常常见的一个化学反应,因此它的反应方程式将会被大量的学习和使用。
下面我们将探讨关于这种反应的反应方程式。
首先我们来看看铁和稀盐酸的反应方程式:2Fe + 6HCl → 2FeCl3 + 3H2其中,2Fe代表2mol铁,6HCl代表6mol稀盐酸,2FeCl3代表2mol三氯化铁,3H2代表3mol氢气。
该反应表明,混合2mol铁和6molHCl,可以生成2mol三氯化铁和3mol 氢气。
接下来我们来看镁和稀盐酸的反应方程式:Mg + 2HCl → MgCl2 + H2该反应表明,混合1 mol 镁和2 mol HCl,可以生成1 mol 镁氯化物和1 mol 氢气。
接下来我们来看铝和稀盐酸的反应方程式:2Al + 6HCl → 2AlCl3 + 3H2其中,2Al代表2mol铝,6HCl代表6mol稀盐酸,2AlCl3代表2mol三氯化铝,3H2代表3mol氢气。
该反应表明,混合2mol铝和6molHCl,可以生成2mol三氯化铝和3mol 氢气。
最后,我们来看看锌和盐酸的反应方程式:2Zn + 4HCl → 2ZnCl2 + H2其中,2Zn代表2mol锌,4HCl代表4mol稀盐酸,2ZnCl2代表2mol氯化锌,H2代表1mol氢气。
该反应表明,混合2mol锌和4molHCl,可以生成2mol氯化锌和1mol 氢气。
综上所述,铁,镁,铝,锌和稀盐酸之间的化学反应的反应方程式如下:2Fe + 6HCl → 2FeCl3 + 3H2Mg + 2HCl → MgCl2 + H22Al + 6HCl → 2AlCl3 + 3H22Zn+4HCl →2ZnCl2+H2分别进行这几种反应就会发现它们之间的相似性:它们都是金属和极端酸性物质(稀盐酸)之间的反应,都会生成金属氯化物(且金属氯化物的酸度与稀盐酸的酸度相似)和氢气,其反应方程式都是以一比类似的比例进行:1mol金属与2-6mol稀盐酸反应,可生成1-3mol金属氯化物和1-3molH2;而这些生成物体都是以熔融状态分散在水溶液中,在实验中可以进行捕捉,并有价值可回收再利用。
一、中考初中化学金属与酸反应的图像1.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B 【解析】 【分析】 【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C 、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D 、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。
故选B 。
2.如图所示四个图像,分别对应四个过程,其中不正确的是A .向一定量的锌中加入足量的稀盐酸B .向一定量硫酸铜溶液中加入足量的铁C .足量锌、铁中分别加入等质量、等质量分数的稀硫酸D .等质量的锌和铁中分别加入足量等质量分数的稀硫酸【答案】B 【解析】 【分析】 【详解】A 、向一定量的锌中加入足量的稀盐酸,锌完全反应后质量为0,不符合题意;B 、向一定量硫酸铜溶液中加入足量的铁,铁和硫酸铜反应生成硫酸亚铁和铜,44=Fe+CuSO FeSO +Cu ,每56g 固体铁加入置换出64g 铜单质,反应后固体质量增加,溶液的质量减小,反应完后不再减小,符合题意;C 、足量锌、铁中分别加入等质量、等质量分数的稀硫酸,锌的活动性强,在相同的时间内生成的氢气多,稀硫酸的质量相同,完全反应后生成的氢气相同,不符合题意;D、等质量的锌和铁中分别加入足量等质量分数的稀硫酸,相同的酸反应,生成的氢气质量相同,根据反应方程式:22Zn+2HCl=ZnCl+H↑22Fe+2HCl=FeCl+H↑每生成2g氢气需要锌的质量为65g,需要铁的质量为56g,等质量的锌和铁中分别加入足量等质量分数的稀硫酸,完全反应后,铁生成的氢气多,不符合题意。
相同质量的镁铝锌铁与足量酸反应生成的氢气一、概述金属与酸反应是化学教学中常见的实验。
在这类实验中,学生可以直观地观察到气体的产生和物质的变化。
本文将针对相同质量的镁、铝、锌、铁与足量酸反应生成的氢气进行介绍和探讨。
二、实验目的本实验的目的是通过观察不同金属在足量酸中产生氢气的情况,比较它们的反应强度和产气量,并探讨其中的原因。
三、实验材料和方法1. 实验材料:镁丝、铝粉、锌粉、铁末、盛装酸的试管、足量酸(硫酸)、烧杯、气体收集瓶、气密瓶、草纸。
2. 实验方法:(1)将相同质量的镁丝、铝粉、锌粉、铁末分别放入盛有足量酸的试管中。
(2)观察并比较金属与酸反应生成的氢气气泡。
(3)使用气体收集瓶和气密瓶收集产生的氢气。
(4)记录实验现象和产气量。
四、实验结果与分析经过实验观察和数据记录,可以得出以下实验结果:1. 镁与酸反应生成的氢气产量最大,气泡数最多,且反应最为剧烈。
2. 铝与酸反应生成的氢气产量次之,气泡数较多,反应较为剧烈。
3. 锌与酸反应生成的氢气产量较小,气泡数较少,反应较为平和。
4. 铁与酸反应生成的氢气产量最小,气泡数最少,反应最为缓慢。
以上实验结果可以得出结论:金属与酸反应的剧烈程度和产气量取决于金属的活泼性,活泼性越强的金属与酸反应越剧烈,产气量越大。
在这个实验中,镁的活泼性最强,因此产生的氢气量最大,而铁的活泼性最弱,产生的氢气最少。
五、实验总结通过本次实验,我们加深了对金属与酸反应产生氢气的理解。
我们也发现了金属的活泼性对产氢反应的影响。
活泼性越强的金属与酸反应越剧烈,产氢量越大。
这对于我们理解金属活性规律和相关化学知识有着重要的意义。
希望在以后的学习中能够更深入地探讨金属与酸反应的相关知识。
六、参考资料1. 《化学实验技术与指导》2. 《化学实验教程》3. 《高中化学实验教程》以上为本实验的全部内容,希望本次实验对学生的化学学习有所帮助,同时也希望本文的撰写能够对相关领域的研究工作有所帮助。
(4)金属与酸反应的图像题1.将等质量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相间的三份稀硫酸中,反应完成后,生成氢气的质量关系图不可能的是( )A. B.C. D.2.将足量X、Y、Z、M四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属Y、Z分别投入硝酸银溶液中(反应关系如图乙),据此判断X、Y、Z、M 的金属活动性顺序是( )A.M>X>Y>ZB.M>X>Z>YC.X>M>Z>YD.X>M>Y>Z3.一定质量的M、N两种金属,分别与相同质量和相同质量分数的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示。
分析图像得到的以下结论中,不正确的是( )A.两种金属的活动性:M>NB.两种金属生成氢气的质量:M=NC.两种金属消耗稀硫酸的质量:M=ND.充分反应后,得到溶液的质量:M=N4.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。
下列分析正确的是( )A.ab 段主要发生的化学反应:22Fe 2HCl FeCl H ++↑B.bc 段主要发生的化学反应:2332Fe O 6HCl 2FeCl 3H O ++C.影响cd 段压强变化的主要因素是温度D.d 点时恰好完全反应,且d 点温度高于a 点5.两个烧杯中各装有等质量的镁、铁金属,然后分别向烧杯中逐渐加入相同质量、相同浓度的稀硫酸,加入硫酸的质量和产生氢气的质量关系如图所示。
下列说法正确的有( ) ①从图象可得出,镁比铁的活动性强②从图象可得出,a 点时消耗两种金属质量相同 ③若硫酸有剩余,两种金属产生的氢气质量相同 ④若两种金属有剩余,二者消耗硫酸的质量相同A.1种B.2种C.3种D.4种6.兴趣小组同学用图甲所示装置,将相同形状、相同质量的铁、镁、铝、锌四种金属分别和等浓度、等体积的足量稀盐酸混合进行实验,反应过程中装置内压强变化如图乙所示。
规律:
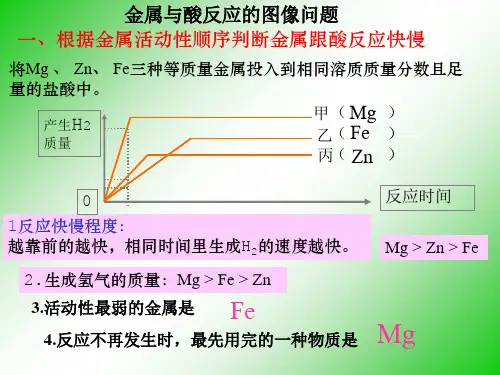
1.镁、铝、锌、铁和稀盐酸或稀硫酸反应产生氢气的快慢:Mg > Al > Zn > Fe
分析:金属与酸反应产生氢气的快慢由金属的活动性决定
2.等质量的镁、铝、锌、铁和足量的稀盐酸或稀硫酸反应产生氢气的多少:Al > Mg > Fe >Zn
分析:酸足量的时候,金属反应完,产生氢气的质量由金属决定。
①等量不等价态的金属与足量的酸反应,金属价态越高,产生氢气的质量越多!
②等量等价态的金属与足量的酸反应,金属的相对原子质量越小,产生的氢气质量越多。
3.将一定量的镁、铝、锌、铁和足量的稀盐酸或稀硫酸反应,完全反应后,生成等质量的氢气,则需要镁、铝、锌、铁的质量Al < Mg < Fe < Zn
①不等价态的金属与足量的酸反应产生等质量氢气,价态越高,需要金属的质量越少!
②等价态的金属与足量的酸反应产生等质量氢气,金属的相对原子质量越大,需要金属的质量越多。
4.四份相同的(质量、浓度都一样)稀盐酸或稀硫酸和足量镁、铝、锌、铁反应产生
氢气的质量相等
分析:金属足量,说明酸反应完,产生氢气的质量由酸决定;又因为酸的质量、浓度都相等,所以产生氢气的质量相等。
图像:
①斜率越大,反应的速率越快,则金属的活动性越强;
②产生氢气不相等,说明金属反应完,酸剩余;
③线越高,表示生成氢气越多,化合价越高;如果化合价相同生成氢气越多,则相对原子质量越小。
①斜率越大,反应的速率越快,则金属的活动性越强;
②产生氢气相等,说明酸反应完,金属剩余;
③金属剩余分两种情况:
a.金属都剩余;
b.化合价不同时,化合价高金属的剩余,
化合价相同时,相对原子质量小的金属剩余。