高三化学 盖斯定律计算技巧口诀
- 格式:docx
- 大小:147.63 KB
- 文档页数:4


【高中化学】高中化学知识点:化学反应热的计算
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合
理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使
用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固
→液→气变化时。
会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带“+”“-”,比较反应放出或吸收的热量多少时要去掉“+”“-” .
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出
的热量Q2,即
.
感谢您的阅读,祝您生活愉快。

谈盖斯定律的应用技巧摘要:盖斯定律在求算反应热中的应用,属于高考的新增热点,但学生计算起来费时且易算错。
本文通分步求解的方法,快速解决学生会而不对的困境,具有很强的实用性。
关键词:盖斯定律反应热热化学方程式盖斯定律在求算反应热中的应用,属于新课程高考的热点,经考不衰,如 2013年全国卷Ⅱ,2008-2010 年江苏高考、2009 和 2010 年广东高考等都出现盖斯定律的应用。
在高中化学教学中,盖斯定律是个难点,不是盖斯定律的内涵不容易理解,而是学生很难找到切入点,计算起来费时且易算错,所以寻找出一种快捷、高效的方法可以避免学生对盖斯定律的畏难情绪。
我在教学实践中总结出了分步求解的方法,可以快速解决目标热化学反应方程式和已知热化学方程式之间的关系,学生也很容易掌握,取得了不错的效果。
我现将分步求解法运用在盖斯定律中的应用技巧简述如下1.盖斯定律的涵义1840 年,俄国化学家盖斯在分析了许多化学反应的热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。
”这个规律被称作盖斯定律。
盖斯定律表明,一个化学反应的焓变(ΔH)仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。
但是在众多的化学反应中,有些反应的反应速率很慢,有些反应同时有副反应发生,还有些反应在通常条件下不易直接进行,因而测定这些反应的热效应就很困难,运用盖斯定律可方便地计算出它们的反应热。
因此,如何让学生充分理解和熟练运用盖斯定律就成为解决热化学问题的关键。
2.盖斯定律例题分析例1.(2013年全国卷2)在1200。
C时,天然气脱硫工艺中会发生下列反应① H2S(g)+ O2(g)=SO2(g)+H2O(g)△H1② 2H2S(g)+SO2(g)=S2(g)+2H2O(g)△H2③ H2S(g)+O2(g)=S(g)+H2O(g)△H3④ 2S(g) =S2(g)△H4则△H4的正确表达式为A.△H4=(△H1+△H2-3△H3)B.△H4=(3△H3-△H1-△H2)C.△H4=(△H1+△H2-3△H3)D.△H4=(△H1-△H2-3△H3)解析:经分析④是我们研究的目标热化学方程式,首先利用类似于数学中的消元法,将①②③已知热化学方程式进行系数处理和方程式加减(减就是将方程式逆向相加),转化为④,最后对反应热焓变进行同样关系处理即可。

盖斯定律及其计算一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/mol H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。

第三节化学反应热的计算Point 1 盖斯定律(重难点)1.定义:不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
2.从反应途径的角度理解☐某人从山下A到达山顶B,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,其所处的海拔都高了300m☐即山的高度与A、B点的海拔有关,而与由A点到达B点的途径无关☐这里的A相当于反应体系的始态,B相当于反应体系的终态.山的高度相当于化学反应的反应热3.用能量守恒定律论证盖斯定律☐先从始态S变化到到终态L,体系放出热量(△H1<0),然后从L到S,体系吸收热量(△H2>0)。
☐经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即△H1+△H2=04.盖斯定律直观化△H=△H1+△H25.盖斯定律在科学研究中的重要意义:☐有些反应进行得很慢☐有些反应不容易直接发生☐有些反应的产品不纯(有副反应发生)☐这些都给测量反应热造成了困难☐利用盖斯定律可以间接地把它们的反应热计算出来例1:C(s)+ ½ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,(1) C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol(2) CO(g) + ½O2(g) = CO2(g) △H3=-283.0 kJ/mol用盖斯定律就可以算出:☐△H1= △H2+ △H3 = -393.5 kJ/mol -(-283.0 kJ/mol)☐△H2 = △H1- △H3 = -110.5 kJ/mol☐ C (s) + ½ O2 (g) = CO(g) △H=-110.5 kJ/mol1.热化学方程式中化学计量数扩大一定倍数时,焓变也相应的扩大相同的倍数。
2.若将一个热化学方程式中的反应物和生成物颠倒时,则焓变也相应的改变。


专题5.2 利用盖斯定律推测并书写热化学方程式【规律和方法】1、盖斯定律的内容:对于一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的,即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关2、运用盖斯定律的技巧——“三调一加”(1)一调:根据目标热化学方程式,调整已知热化学方程式中反应物和生成物的左右位置,改写已知的热化学方程式(2)二调:根据改写的热化学方程式调整相应ΔH 的符号 (3)三调:调整中间物质的化学计量数(4)一加:将调整好的热化学方程式及其ΔH 相加 3、运用盖斯定律的三个注意事项(1)热化学方程式乘以某一个数时,反应热的数值必须也乘上该数 (2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减 (3)将一个热化学方程式颠倒时,ΔH 的“+”“-”随之改变,但数值不变 4、常用关系式热化学方程式 焓变之间的关系 aA===B ΔH 1 A===1a B ΔH 2ΔH 2=1aΔH 1或ΔH 1=aΔH 2aA===B ΔH 1 B===aA ΔH 2ΔH 1=-ΔH 2ΔH =ΔH 1+ΔH 25、ΔH (1)ΔH =反应物总键能之和-生成物总键能之和(2)ΔH =生成物总能量-反应物总能量=H(生成物)-H(反应物)常见物质中的化学键数目物质 CO 2(C===O) CH 4(C -H)P 4(P -P)SiO 2(Si -O)石墨 金刚石 Si S 8(S -S)键数24641.52281212【真题演练】1、[2020·浙江卷]100 mL 0.200mol·L-1CuSO4溶液与1.95g锌粉在量热计中充分反应。
测得反应前温度为20.1℃,反应后最高温度为30.1℃已知:反应前后,溶液的比热容均近似为4.18 J·(g·℃)-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。

盖斯定律及其计算盖斯定律是描述毛细管流动的一种定律,由法国科学家亨利·盖斯于1799年提出,因此被称为盖斯定律。
它是液体通过毛细管流动时压强变化的定量描述,被广泛应用于理解液体在毛细管中的流动、液体表面张力的测量以及测量一些细小孔隙的直径等领域。
首先,我们来推导一下盖斯定律的数学表达式。
盖斯定律表明,在理想毛细管中,液体通过毛细管的流量与液体在毛细管两侧的压强差成正比。
设液体通过毛细管的流量为Q,液体在毛细管两侧的压强差为ΔP,液体的粘度为η,毛细管的半径为r,则盖斯定律可以表示为:Q=ΔPπr^4/8ηl其中,l为毛细管的长度。
从上述公式可以看出,液体通过毛细管的流量与毛细管的半径的四次方成正比,与压强差成正比,与液体的粘度成反比。
然而,盖斯定律只适用于细长而直径均匀的理想毛细管,在现实中的毛细管流动中有一些修正因素需要考虑。
例如,现实中的毛细管往往存在一定的粗糙度,从而导致流动的摩擦阻力增加,需要考虑修正因子;液体与毛细管表面之间的相互作用也会影响流动情况,需要考虑液-壁作用的修正因子。
这些修正因子可以通过实验测量得到,从而得到更准确的结果。
盖斯定律的一个重要应用就是测量液体的表面张力。
当液体在毛细管中流动时,液体上升的高度可以通过盖斯定律计算,进而得到液体的表面张力。
设液体在毛细管中上升的高度为h,毛细管的直径为d,则表面张力可以通过以下公式计算:T = 4ηh/gd其中,g为重力加速度。
表面张力的测量是盖斯定律在实际应用中的一种重要方式,它可以应用于液体的质量测量、液体粘度的测量以及液体中添加物的测量等领域。
总结起来,盖斯定律是描述液体通过毛细管流动的定律,它可以通过液体在毛细管两侧的压强差来计算液体通过毛细管的流量。
盖斯定律是描述理想毛细管流动的理论,需要考虑一些修正因子才能适用于实际情况。
盖斯定律的一个重要应用就是测量液体的表面张力,通过液体在毛细管中上升的高度可以计算液体的表面张力。

【高三】2021年高考化学考点最后冲刺复习:盖斯定律盖斯定律及其在热化学方程式中的应用一:气体法的要点1840年,瑞士化学家盖斯(g。
h。
hess,1802―1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径完成。
如上图表:已知:h2(g)+o2(g)=h2o(g)△h1=-241.8kj/molh2o(g)=h2o(l);△h2=-44.0kj/mol根据格斯定律△h=△h1+△h2=-241.8kj/mol+(-44.0kj/mol)=-285.8kj/mol气体定律表明,反应热效应取决于系统的恒定状态变化,与过程无关。
因此,可以在热化学方程式之间进行代数变换等数学处理。
使用该定律时,应注意,热效应与参与反应的物质的性质和聚集状态、完成反应的物质数量、反应方式、温度、压力和其他因素有关,这就要求所涉及的每一个反应式都必须是一个严格完整的热化学式。
二:盖斯定律在热化学方程式计算中的应用气体定律的应用价值在于,根据精确测量的反应热,可以知道难以测量或根本无法测量的反应热,而已知的反应热可以用来计算未知的反应热。
,它在热化学方程中的主要应用是求未知反应的反应热,计算物质蒸发所需的能量,计算不完全燃烧时的热损失,判断热化学方程是否正确。
所涉及的反应可能是同素异形体的转变,也可能与物质三种状态的变化有关。
主要调查方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1。
0.3mol的气态高能燃料乙基硼烷(B2H6)在氧气中燃烧,生成固体三氧化硼和液态水,释放649.5kj的热量。
反应的热化学方程式为。
众所周知:H2O(g)=H2O(L);△ h2=-44.0kj/mol,则11.2l(标准条件)乙基硼烷完全燃烧生成气态水时释放的热量为解析:0.3mol乙硼烷完全燃烧生成液态水放出649.5kj热量,则1mol乙硼烷完全燃烧放出的热量为:因此乙硼烷燃烧的热化学反应方程式为:。

高三化学盖斯定律知识点在高三化学学习中,学生们经常会接触到盖斯定律(Gauss's Law)。
盖斯定律是描述电场分布的重要定律,它对于理解电场以及解决与电荷分布相关的问题非常有帮助。
本文将介绍盖斯定律的相关知识点,帮助学生们更好地理解和掌握这一内容。
一、电场概念回顾在进一步了解盖斯定律之前,我们首先来回顾一下电场的概念。
电场是由电荷所产生的力场,在空间中存在着电场力的存在。
在一个点附近,电场力的大小和方向可以通过测量单位正电荷所受到的力来确定。
电场力的方向与正电荷所受力的方向相同,与负电荷所受力的方向相反。
二、盖斯定律的表述盖斯定律是描述电场分布的定律之一,它与电场的闭合性密切相关。
在盖斯定律中,我们通过一个闭合曲面(也可以是一个体积)来计算电场通量。
电场通量是穿过闭合曲面的电场线的数量。
盖斯定律的数学表述可以表示为:∮E·dA = Φ = Q/ε₀其中,∮E·dA表示电场矢量E对闭合曲面A的通量,Φ表示电场通量,Q表示闭合曲面内的总电荷量,ε₀表示真空中的介电常数。
三、定向闭合曲面与电场通量在盖斯定律中,定向闭合曲面的选择非常重要。
通过选择不同方向的闭合曲面,我们可以得到不同方向的电场通量。
一般来说,选择球形闭合曲面是最常见和方便的,因为球形闭合曲面的电场通量可以通过球面上的电场强度来计算。
四、盖斯定律的应用盖斯定律有着广泛的应用。
它可以帮助我们计算闭合曲面内的电场分布情况,以及了解电荷分布对电场的影响。
以下是一些盖斯定律的应用示例:1. 均匀带电球面的电场:当一个均匀带电的球面存在时,可以利用盖斯定律来计算球心处的电场强度。
由于球体对称性,电场强度大小只与球心到球面的距离有关。
2. 均匀带电球体的电场:如果一个均匀带电的球体存在,我们可以利用盖斯定律来计算球体内或球体外的电场强度。
在球体内部,电场强度与距离球心的距离成正比;在球体外部,电场强度则与球体上表面上的电场强度相同。
盖斯定律化学反应热的计算计算反应热的解题方法与技巧:首先需要熟练掌握盖斯定律,其次,平时积累起来的计算机巧在反应热的计算中基本适用。
注意遵循:质量守恒定律,能量守恒定律和盖斯定律。
【方法一】方程式加合法:根据可直接测定的化学反应的反应热间接计算难以直接测定的化学反应的反应热,需要应用盖斯定律来分析问题。
解题时,常用已知反应热的热化学方程式相互加合(加、减等数学计算),得到未知反应热的热化学方程式,则相应的反应热做相同的加合即为所求的反应热。
例1.已知298K时下列两个反应焓变的实验数据:反应1:C(s)+O2(g)====CO2(g)ΔH1=-393.5 kJ·mol-1反应2:CO(g)+1/2 O2(g)====CO2(g)ΔH2=-283.0 kJ·mol-1计算在此温度下反应3: C (s)+1/2 O2(g)====CO(g)的反应焓变ΔH3 解析:根据反应3找起点:C(s),找终点:CO(g);找出中间产物CO2(g);利用方程组消去中间产物:反应1-反应2=反应3;列式ΔH1-ΔH2=ΔH3=-110.5kJ·mol-1【方法二】平均值法:平均值法特别适用于缺少数据而不能直接求解的计算。
当两种或两种以上物质混合时,不论以任何比例混合,总存在一个平均值,解题时只要抓住平均值,就能避繁就简,迅速解题。
平均值法有:平均相对分子质量法、平均分子式法、平均体积法、平均原子法和平均反应热法等。
平均反应热法是利用两种混合物中每摩尔物质在反应中的反应热的平均值推断混合物质组成的解题方法,常用于有两种物质反应热的计算。
例2:CH 4(g )+2O 2(g )==CO 2(g )+2H 2O (l )ΔH =-889.5kJ ·mol -1C 2H 6(g )+27O 2(g )==2CO 2(g )+3H 2O (l )ΔH =-1583.4kJ ·mol -1C 2H 4(g )+3O 2(g )==2CO 2(g )+2H 2O (l )ΔH =-1409.6kJ ·mol -1C 2H 2(g )+25O 2(g )==2CO 2(g )+H 2O (l )ΔH =-1298.4kJ ·mol -1C 3H 8(g )+5O 2(g )==3CO 2(g )+4H 2O (l )ΔH =-2217.8kJ ·mol -1如果1mol 上述烃中的两种混合物完全燃烧后放出1518.8的热量,则下列组合不可能是( )A. CH 4和C 2H 4B.CH 4和C 2H 6C.C 3H 8和C 2H 6D.C 3H 8和C 2H 2 解析:混合烃的平均燃烧热为1518.8kJ ,则混合烃中,一种烃的燃烧热必大于1518.8kJ另一种烃的燃烧热必小于1518.8kJ ,代入各项进行比较,即可确定正确的选项。
第三节化学反应热的计算原创不容易,为有更多动力,请【关注、关注、关注】,谢谢!玉壶存冰心,朱笔写师魂。
——冰心《冰心》1、盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
不管化学反应时一步完成还是分几步完成,其反应热时相同的。
2、反应热的计算:用盖斯定律的计算方法:○1写出目标方程式(或已经给出);○2确定“中间产物”(要消去的物质);○3变换方程式,要同时变化;○4用消元法逐一消去“中间产物”;○5得到目标方程式并进行的计算。
例:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1 ①CO(g)+O2(g)=CO2(g)△H=-283.0kJ•mol-1②C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1③则4Fe(s)+3O2(g)=2Fe2O3(s)的△H为-1641.0 kJ/mol【解答】解:由Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1 ①CO(g)+O2(g)=CO2(g)△H=-283.0kJ•mol-1②C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1③由盖斯定律可知,③×6-①×2-②×6得到4Fe(s)+3O2(g)=2Fe2O3(s),△H=(-393.5kJ•mol-1)×6-(+489.0kJ•mol-1)×2-(-283.0kJ•mol-1)×6=-1641.0 kJ/mol。
故答案为:-1641.0 kJ/mol。
【习题一】(2017春•吉林期末)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1 N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1则2CO(g)+2NOg)═N2(g)+2CO2(g)的△H是()A.-386kJ• B.+386kJ• C.-746kJ• D.+746kJ•【考点】反应热和焓变;用盖斯定律进行有关反应热的计算.【专题】化学反应中的能量变化.【分析】依据盖斯定律内容和含义,结合热化学方程式计算得到所需热化学方程式得到.【解答】解:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1依据盖斯定律计算①-②得到2O(g)+2NO(g)═N2(g)+2CO2(g))△H=-746KJ/mol;故选:C。
“盖斯定律”知识解读作者:李清
来源:《中学化学》2019年第10期
“盖斯定律”是热化学的重要定律,也是各类考试考查的重点。
现对其进行多角度分析,希望对复习有所帮助。
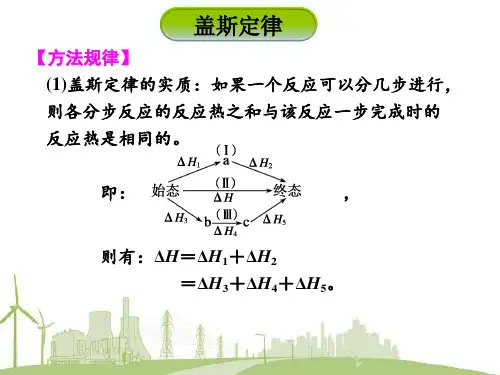
一、盖斯定律的内容
对于一个化学反应,无论是一步完成还是分几步完成,其反应热相同。
即:化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关。
如图1所示,始态和终态相同,反应的途径有三种,则△H=△H1+△H2=△H3+△H4+△H5。
二、盖斯定律的应用
一是应用盖斯定律计算反应热;二是应用盖斯定律判断有关反应热之间的关系;三是应用盖斯定律书写热化学方程式。
三、应用盖斯定律时的注意事项
一是将热化学方程式乘以某一个数时,反应热也必须乘上该数;二是将热化学方程式相加减时,反应热也必须相加减;三是将一个热化学方程式颠倒时,△日的“+”、“一”随之改变,但数值不变。
四、有關盖斯定律的典例赏析
1.利用已知的反应热计算未知的反应热△H
例1火箭推进器常以联氨(N2H4)为燃料,过氧化氢为助燃剂。
已知下列热化学方程式:。
盖斯定律计算反应热的注意事项
化学反应的反应热只与始态和终态有关,而与反应途径无关,利用盖斯定律可以间接计算某些反应的反应热。
1.明确所求反应的始态和终态,各物质系数,及反应是吸热还是放热反应。
2.盖斯定律与反应途径无关,不同途径对应的最终结果是一样的。
3.各反应式相加时,有的反应逆向写,ΔH符号也相反。
有的反应式要扩大或缩小相应倍数,ΔH也要相应扩大或缩小相同的倍数。
4.注意各分步反应的ΔH的正负,放热反应为“—”,吸热反应为“+”,其具备数学意义,可进行大小比较。
5.注意弱电解质的电离、水解反应吸热,浓硫酸的稀释、氢氧化钠固体的溶解放热,都将对反应热产生影响。
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
应用盖斯定律进行计算的方法
1.用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当
数学运算得未知反应的方程式及反应热。
使用盖斯定律需要注意以下问题:
2.当反应式乘以或除以某数时,△H也应该乘以或者除以某数
3.反应方程式进行加减运算时,△H也同样要进行加减运算,并且要带正负号。
4.通过盖斯定律计算并比较反应热的大小时,同样要把△H看做整体。
5.在设计的反应过程中常常会遇到同一物质固液气三态的互相转化,状态由固—>液—>气变化会吸热,反之会放热。
6.当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
例题:氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.可利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);ΔH=-574KJ/mol。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=-1160KJ/mol。
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式是什么?
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574KJ•mol -1,②CH
+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=-1160KJ•mol-4(g)
1,由(①+②)∕2,得:CH
+2NO2(g)=N2(g)+C02(g)+2H2O(g);Δ
4(g)
H=(−574KJ∕mol−1160KJ∕mol)∕2=-867KJ/mol。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。
例如:的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。
分析上述两个反应的关系,即知
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
若按以下思路分析:
2.同一反应物状态不同时
3.两个有联系的不同反应相比
并且据此可写出下面的热化学方程式:。