溶液物质的量及摩尔质量
- 格式:ppt
- 大小:2.32 MB
- 文档页数:40

物质的量的浓度知识点整理一、物质的量的浓度概念和计算方法浓度(C)=物质的量(n)/溶液的体积(V)其中,物质的量通常用摩尔(mol)来表示,溶液的体积则可以用升(L)来表示。
对于溶液来说,还可以通过质量浓度(Cm)来表示,计量单位为g/L。
计算公式为:质量浓度(Cm)=溶质的质量(m)/溶液的体积(V)其中,溶质的质量通常用克(g)来表示,溶液的体积仍然用升(L)来表示。
二、摩尔浓度与质量浓度之间的关系1.摩尔浓度与质量浓度的转换由于摩尔质量可以通过元素的相对原子质量得到,因此可以通过摩尔浓度和质量浓度之间的转换来计算摩尔质量。
摩尔质量(M)=溶质的质量(m)/摩尔浓度(C)质量浓度(Cm)=摩尔浓度(C)×摩尔质量(M)2.摩尔浓度与质量浓度的关系摩尔浓度与质量浓度之间存在一定的关系,可以通过元素的相对原子质量和密度来计算。
摩尔浓度(C)=摩尔浓度(Cm)/摩尔质量(M)质量浓度(Cm)=摩尔质量(M)×摩尔浓度(C)三、摩尔浓度的应用1.定量分析中的应用摩尔浓度在定量分析中起着重要的作用,可以通过摩尔浓度的测定来计算出溶液中的物质的量,从而进行精确的定量测定。
2.摩尔浓度的转化摩尔浓度的转化对于化学反应和化学计算非常重要。
通过计算不同物质的摩尔浓度之比,可以确定反应的化学计量比例,从而计算出反应中所需的物质的量。
3.摩尔浓度的控制摩尔浓度可以通过控制溶质的添加量和溶液的体积来调节。
通过控制摩尔浓度,可以实现溶液中物质的量的精确控制,从而实现对反应速率和产物选择性的调节。
四、质量浓度的应用1.溶液的配置与稀释质量浓度在溶液的配置和稀释中起着重要的作用。
通过计算所需溶质的质量和溶液的体积,可以调节溶液的浓度,从而满足不同实验或工业生产的需求。
2.药剂的制备和应用质量浓度是药剂制备和应用过程中的重要参数之一、通过确定药物的质量浓度,可以实现药物的定量配制和使用,确保药物的疗效和安全性。

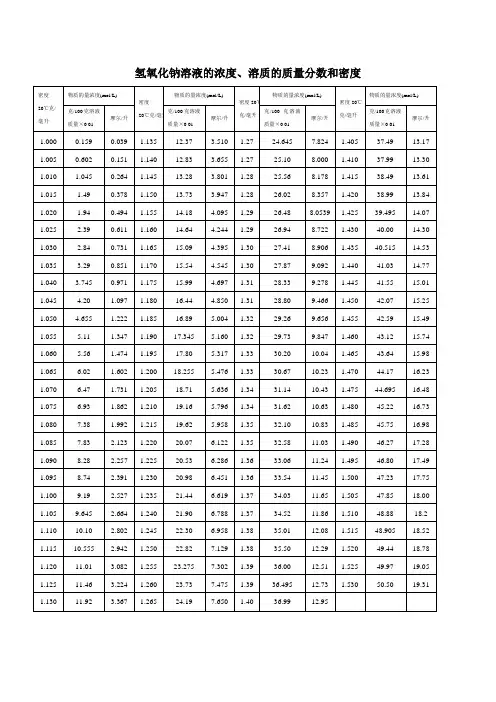
氢氧化钠溶液的浓度、溶质的质量分数和密度
HCl溶液的浓度和密度
常见气体在标准状况下的摩尔体积
标准溶液浓度的一升量值温度不正值表
水的体积和质量分数换算表
(供校准玻璃容量仪器体积用)
V20=W/Wt=1000(ml)(式中V20是指玻璃容器在20℃时所具有的容积)
滴定液的温度校正值
本表列出水和稀的水溶液在t℃时的观测体积换算为20℃时的体积校正值(单位毫升)。
反之,也可以从20℃时所需体积减去或加上校正值而获得的t℃时必须量出的体积。
表中玻璃器皿的体积膨胀系数假定为0.000025
对于某些标准溶液,使用上表换算为20℃的体积,如欲获得更准确的结果,可按下列
露点温度对应水分表
各种不同温度下空气中饱和水蒸汽的压力盒水蒸汽含量
0℃至60℃温度下
注:1mmHg=133.322Pa44
0℃至-60℃温度下
将气压由室温换算至0℃时校正值(Pa)
标准筛目
化学化工中常用的筛网标准又数种,下列是美国筛制和泰勒标准筛、日本。


溶液物质的量分数,密度,质量分数之间的关系
溶液物质的量分数、密度和质量分数之间的关系可以用以下公式表示:
物质的量分数(X)= 物质的质量(m)/ 溶液的总质量(mixture)
物质的量分数(X)= 物质的摩尔质量(M)×物质的摩尔数(n)/ 溶液的总摩尔质量(Mixture)
密度(ρ)= 溶液的总质量(mixture)/ 溶液的体积(V)
物质的质量分数(w)= 物质的质量(m)/ 溶液的总质量(mixture)
由上述公式可以得出以下关系:
物质的质量分数(w)= 物质的量分数(X) ×物质的摩尔质量(M)/ 溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 物质的摩尔质量(M)×溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 溶液的体积(V)。

溶液的摩尔浓度和溶解度溶液是由溶质溶解在溶剂中而形成的一种混合物。
溶液的摩尔浓度和溶解度是描述溶液性质的重要参数。
本文将分析摩尔浓度和溶解度的概念、计算方法,以及它们在化学实验和工业生产中的应用。
一、溶液的摩尔浓度溶液的摩尔浓度是指在一个单位体积的溶剂中所含溶质的物质的量。
通常用符号C表示,摩尔浓度的单位是mol/L或M(molar)。
计算摩尔浓度的公式为:C = n/V其中,C表示摩尔浓度,n表示溶质的物质的量,V表示溶液的体积。
摩尔浓度可以理解为溶质分子或离子在溶剂中的稀密程度,可以用来表示溶液中溶质的含量。
在实际计算中,可以通过称取溶质,加入足够的溶剂并搅拌均匀,然后用试剂瓶等容器进行稀释,最后取适量的溶液用比色计或滴定等方法测定溶液的摩尔浓度。
二、溶解度溶解度是指在一定温度下,溶质在溶剂中能够溶解成溶液的最大量。
溶解度通常用符号S表示,单位是g/L。
溶解度的值与溶质、溶剂的性质以及温度有关。
溶解度与溶质和溶剂之间的相互作用力有关。
溶质和溶剂之间的相互作用力越强,溶质越容易溶解,溶解度就越大;反之,相互作用力越弱,溶质的溶解度就越小。
三、摩尔浓度和溶解度的关系摩尔浓度与溶解度之间存在一定的关系。
一般情况下,溶质在溶剂中的摩尔浓度越高,溶质的溶解度也就越大。
根据摩尔浓度和溶解度的定义可以推导出它们之间的关系式:n = C * V (摩尔浓度与体积的关系)m = S * V (溶解度与体积的关系)其中,n表示溶质的物质的量,m表示溶质的质量,C表示摩尔浓度,V表示溶液的体积,S表示溶解度。
由上述关系式可以得出:m = S * C * V即溶质的质量等于溶解度、摩尔浓度和溶液体积的乘积。
这个关系式可以在实验中使用,通过测量溶质的质量和溶液的体积,可以计算出溶质的溶解度。
四、摩尔浓度和溶解度的应用摩尔浓度和溶解度在化学实验和工业生产中具有重要的应用价值。
1. 在化学实验中,摩尔浓度可以帮助确定反应物的计量比例,从而进行定量分析和反应条件的设计。



液体摩尔浓度计算公式1、已知溶质的质量m,和溶液的体积V,假设溶质的摩尔质量为M 溶质的摩尔浓度为c=m/MV;2、已知溶质的物质的量n,和溶液的体积V,溶质的摩尔浓度为c=n/V;3、已知溶质的质量分数w,和溶液的密度p,溶质的摩尔质量为M 溶质的摩尔浓度为c=1000pw/M;4、已知溶液的质量m,和溶液的体积V,溶液的密度w 溶质的摩尔浓度为c=1000mw/MV。
世界卫生组织提议,凡是已知相对分子质量的物质在体液内的含量均应用物质的量浓度表示。
物质的量浓度在医学上已逐渐推广使用。
扩展资料:将溶质的质量分数换算成物质的量浓度时,首先要计算1L溶液中含溶质的质量,换算成相应物质的量,有时还需将溶液的质量换算成溶液的体积,最后才换算成溶质的物质的量浓度。
将溶质的物质的量浓度换算成溶质的质量分数时,首先要将溶质的物质的量换算成溶质的质量,有时还将溶液的体积换算成质量,然后换算成溶质的质量分数。
注意:1、物质的量浓度公式中的体积是指溶液的体积,而不是溶剂的体积。
2、在一定物质的量浓度溶液中取出任意体积的溶液,其浓度不变,但所含溶质的物质的量或质量因体积的不同而不同。
3、溶质的量是用物质的量来表示的,不能用物质的质量来表示。
例如:配制1mol/L的氯化钠溶液时,氯化钠的式量为23+35.5=58.5,故称取58.5g氯化钠,加水溶解,定容至1000ml即可获得1mol/L的氯化钠溶液。
4、溶质可以是单质、化合物,也可以是离子或分子等其他特定组合,如 c(NaCl)。
非电解质在其水溶液中以分子形式存在,溶液中溶质微粒的浓度即为溶质分子的浓度。
如 1mol/L乙醇溶液中,乙醇分子的物质的量浓度为1mol/L。
强酸、强碱、可溶性盐等强电解质在其水溶液中以阴离子和阳离子形式存在,各种微粒的浓度要根据溶液的浓度和溶质的电离方程式来确定。

物质的量浓度与质量分数之间的换算物质的量浓度和质量分数是化学中常见的两种浓度单位,它们之间可以进行换算。
首先,我们来看一下物质的量浓度和质量分数的定义和计算方法。
物质的量浓度是指单位体积溶液中溶质的物质的量,通常用符号"c"表示,单位是摩尔/升(mol/L)。
计算公式为,物质的量浓度= 溶质的物质的量 / 溶液的体积。
质量分数是指溶液中溶质的质量占整个溶液质量的比例,通常用符号"w"表示,没有单位。
计算公式为,质量分数 = 溶质的质量/ 溶液的质量。
现在我们来讨论物质的量浓度与质量分数之间的换算。
假设我们有一个溶液的物质的量浓度为c(mol/L),我们想要将其换算为质量分数。
首先,我们需要知道溶质的摩尔质量,假设为M(g/mol)。
然后我们可以使用下面的公式进行换算:质量分数= c M / (1000 ρ)。
其中,ρ是溶液的密度(g/mL)。
这个公式的推导是基于物质的量浓度和质量分数的定义,通过代入溶质的摩尔质量和溶液的密度,可以将物质的量浓度转换为质量分数。
另外,如果我们有一个溶液的质量分数为w,想要将其换算为物质的量浓度,可以使用下面的公式:物质的量浓度= w (1000 ρ) / M.通过这个公式,我们可以将质量分数转换为物质的量浓度。
需要注意的是,在进行换算时,要确保使用的单位是一致的,比如摩尔/升、摩尔/千克或者克/升等。
另外,密度ρ的取值也需要准确,因为密度会随着温度和压力的变化而变化。
总之,物质的量浓度和质量分数之间的换算可以通过上述公式进行,这样可以在化学实验和工业生产中方便地进行浓度单位的转换和计算。

溶液浓度和摩尔浓度溶液浓度和摩尔浓度是化学中常用的计量单位,用于描述溶液中溶质的浓度。
溶液浓度表示溶质在溶剂中的含量,而摩尔浓度则是以溶质的摩尔数来计量。
本文将介绍溶液浓度和摩尔浓度的定义、计算方法和实际应用。
一、溶液浓度的定义和计算方法溶液浓度是指溶液中溶质的含量。
常见的溶液浓度单位有质量浓度、体积浓度和摩尔浓度等。
1.质量浓度质量浓度(C)指单位体积溶液中溶质的质量,常用单位是克/升(g/L)或克/毫升(g/mL)。
质量浓度的计算公式如下:C = m/V其中,C为质量浓度,m为溶质的质量,V为溶液的体积。
例如,有100g氯化钠(NaCl)溶解在500mL溶剂中,求其质量浓度。
解:C = m/V = 100g/500mL = 0.2g/mL2.体积浓度体积浓度(C)指单位体积溶液中溶质的体积,常用单位是升/升(L/L)或毫升/升(mL/L)。
体积浓度的计算公式如下:C = V1/V2其中,C为体积浓度,V1为溶质的体积,V2为溶液的体积。
例如,有20mL盐酸(HCl)溶解在100mL溶剂中,求其体积浓度。
解:C = V1/V2 = 20mL/100mL = 0.2mL/mL = 0.23.摩尔浓度摩尔浓度(C)指单位体积溶液中溶质的摩尔数,常用单位是摩尔/升(mol/L)或摩尔/毫升(mol/mL)。
摩尔浓度的计算公式如下:C = n/V其中,C为摩尔浓度,n为溶质的摩尔数,V为溶液的体积。
例如,有0.1 mol氯化钠(NaCl)溶解在200 mL溶剂中,求其摩尔浓度。
解:C = n/V = 0.1 mol/0.2 L = 0.5 mol/L二、摩尔浓度的实际应用摩尔浓度在化学实验和工业生产中有着广泛的应用。
1.反应物质量计算通过摩尔浓度可以计算反应物的质量。
根据化学方程式和摩尔比,可以确定反应物摩尔比例,并计算所需摩尔数。
再结合摩尔质量,可以得到所需质量。
2.稀释计算摩尔浓度可以用于稀释计算。
化学反应中的溶液浓度与摩尔浓度计算在化学反应中,溶液的浓度是一个非常重要的参数,它与摩尔浓度息息相关。
本文将介绍化学反应中的溶液浓度以及如何计算摩尔浓度。
一、溶液浓度的概念和计算溶液浓度是指溶液中溶质(通常为固体或液体)相对于溶剂(通常为液体)的质量或物质的量的比例。
常见的表示溶液浓度的单位有质量分数、摩尔分数、体积分数、摩尔浓度等。
1.1 质量浓度的计算质量浓度是指溶质在溶剂中溶解后的质量与溶剂的质量之比。
计算公式为:质量浓度(mg/mL)= 溶质的质量(mg)/ 溶剂的体积(mL)1.2 摩尔浓度的计算摩尔浓度是指溶质的物质的量与溶剂的体积之比。
计算公式为:摩尔浓度(mol/L)= 溶质的物质的量(mol)/ 溶剂的体积(L)二、摩尔浓度计算的实例为了更好地理解摩尔浓度的计算方法,下面举例说明。
假设有一瓶体积为500 mL的盐水溶液,其中含有25克的氯化钠(NaCl)。
要计算氯化钠的摩尔浓度,可以按照以下步骤进行:1. 将氯化钠的质量转换为摩尔数:氯化钠的摩尔质量为58.44 g/mol,而给定的质量为25 g,所以氯化钠的摩尔数为:摩尔数(mol)= 质量(g)/ 摩尔质量(g/mol)摩尔数(mol)= 25 g / 58.44 g/mol2. 将溶剂体积转换为升数:溶液体积为500 mL,将其转换为升数:体积(L)= 500 mL / 1000 mL/L3. 计算摩尔浓度:摩尔浓度 = 摩尔数(mol)/ 体积(L)将以上计算结果代入公式,摩尔浓度计算如下:摩尔浓度 = (25 g / 58.44 g/mol) / (500 mL / 1000 mL/L)通过计算,可以得出该盐水溶液的摩尔浓度。
三、应用和实际意义摩尔浓度的计算在化学实验和实际应用中具有重要意义。
它可以帮助我们了解溶液中溶质的浓度,从而进一步分析化学反应的发生和控制。
在实验室中,研究人员需要根据摩尔浓度来配制溶液。
在制药工业中,摩尔浓度计算也是药物生产过程中的核心任务之一。
化学反应中的物质的摩尔浓度与物质量在化学反应中,物质的摩尔浓度和物质量是两个重要的概念。
它们关系着反应的进行和结果的确定。
本文将从摩尔浓度与物质量的定义、计算方法以及在化学反应中的应用等方面进行探讨。
一、摩尔浓度的定义和计算方法摩尔浓度(Molar concentration),又称为物质的浓度,是指单位体积(或单位容器内溶液的体积)中所含物质的物质量。
摩尔浓度的计算公式为:摩尔浓度(mol/L) = 物质的物质量(mol) / 溶液的体积(L)例如,若有1 mol的盐溶解在1 L的水中,则该溶液的摩尔浓度为1 mol/L。
摩尔浓度可以反映溶液中溶质的多少,反映了单位体积内溶质的相对浓度。
二、物质的摩尔浓度与反应速率的关系在化学反应中,物质的摩尔浓度与反应速率存在着密切的关系。
根据化学反应速率的定义,反应速率是指单位时间内反应物消耗或生成物产生的量。
根据反应速率的表达式,可以得出以下结论:1. 反应的速率与物质的摩尔浓度成正比。
在一个化学反应中,如果其中一个反应物的摩尔浓度增加,那么反应速率也会随之增加。
反之,如果反应物的摩尔浓度减小,那么反应速率也会减小。
2. 反应速率的计算需要考虑到反应物的摩尔比。
在一个化学反应中,反应速率除了与反应物的摩尔浓度有关外,还与反应物的摩尔比有关。
不同反应物的摩尔数与它们在反应式中的系数有关,需要按照反应物的摩尔比进行计算。
三、物质量与物质的摩尔量的计算关系在化学反应中,物质的摩尔量是指物质的量,用单位mol表示。
物质的摩尔量与物质量有着密切的关系。
可以根据化学反应的平衡方程式,通过化学计算方法,将物质的摩尔量和物质量进行转换。
1. 物质的物质量和摩尔量之间的计算。
物质的物质量可以通过其摩尔量与相应的摩尔质量进行计算。
摩尔质量是指1 mol物质的质量,用单位g/mol表示。
通过摩尔质量可以将物质的摩尔量转换为物质的物质量。
2. 化学反应中物质的物质量变化。
在一个化学反应中,反应物的物质量会发生变化。