碳正离子机理
- 格式:ppt
- 大小:524.50 KB
- 文档页数:10

第五讲 与酸和亲电试剂有关的反应一、 碳正离子酸性介质中的反应可能涉及到碳正离子。
碳正离子的稳定性为:3o > 2o > 1o 〉 +CH3 1. 碳正离子的形成 (1) 离解a. 醇发生质子化后,碳氧单键发生异裂,得到碳正离子。
例如:C CH 3CH 3H 3COH + H +C CH 3CH 3H 3COH 2+C CH 3CH 3H 3C+一般仅限制于生成稳定的碳正离子(SN1或E1反应的中间体为碳正离子).b. 极性介质中,反应物分子中又存在好的离去基团,不需要酸的催化,也会发生键的异裂,生成碳正离子.MeOCH 2OS OOOCF 3H O CF 3SO 3-+MeOCH2+(2) 亲电试剂对双键的加成3H+-OSO 3H(3) 羰基的质子化3H+-OSO 3H(4) 羰基化合物与Lewis 酸的反应+ COClCH 3O3例如,Friedel-Crafts 酰基化反应 该反应的机理是:CCH 3CH 3O3ClCH 33-C ClCH 3AlCl 3O +-AlCl 333+- H +CH 3O2.碳正离子的重排碳正离子重排的驱动力是:生成更稳定的碳正离子。
重排通常涉及到碳正离子中心原子的α—C 上的烷基、苯基或 – H 的迁移. (1)– H 的迁移BrOH + H 2SO 42(2)烷基的迁移下列反应涉及到烷基的迁移,为它提出一个合理的机理。
OH 3O+H机理OH 3O +OH实例1:二烯酮—酚的重排反应反应:OH 3O +OH机理:OH 3O +OH实例2: 片呐醇重排 反应PhPhOH OH H 2SO 4PhOPh H机理:Ph Ph OH OH+H +H 2-H 2O- H+PhPh OH H+Ph Ph O H3. 涉及缺电子氮的正离子重排下列反应为Beckmann 重排:PhPh N OH (1)PCl 5(2)H 2OPhNHOPh机理:PhPhN O P ClCl ClClO PCl 4Ph N Ph +H 2OPhN Ph H 2O +--OPCl 4-H +PhN Ph HOPhNH O PhPCl 5的作用是增大底物分子中氮氧键的极性,帮助其异裂.迁移基团处于离去基团的对面.最后一步可以看成是酮式与烯醇式的互变异构。


有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R —X →R + +X - 在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF 5作为Lewis 酸生成稳定SbF 6一, 会使反应向右进行,有利于碳正离子的生成。
R —Br+ Ag +→R ++ AgBr ; R —F+SbF5→R ++SbF 6-。
但是醇、醚、酰卤在酸或Lewis 酸的催化下也可以离解为碳正离子。
R 一0H → R +-OH 2→R ++H 20 ; CH 3COF+BF 3-→CH 3CO ++BF 4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH 3)3CH + SbF 5·FSO 3H →(CH 3)3C ++ SbF 5·FSO 3-+H 2 2、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
CCH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N 2而生成碳正离子。
RN R +N2 ;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP3杂化角锥构型 SP2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。

碳正离子综述。
分析这种物质对发碳正离子是一种带正电的极不稳定的碳氢化合物教授发现了现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细利用超强酸研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活波的中间体。
碳正离子有一个正电荷,2个原子(或原SP3 杂化轨道与最外层有6 个电子。
带正电荷的碳原子以P与碳原子处于同一个平面。
碳原子剩余的键(T ,子团)结合,形成3个轨道与这个平面垂直。
碳正离子是平面结构。
年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为1963 它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律如下:)苄基型或烯丙型一般较稳定;(1 3°>2°> 1°; (2)其它碳正离子是:碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子下面着重讨论经典碳正离子:碳正离子化学是有机化学非常重要的组成部分,Olah 由于发现在超强酸中稳定存在的碳正离子,获得了1994 年的诺贝尔化学奖。
碳正离子是带有正电荷的含碳离子,是一类重要的活性中间体,可用R3C+表示(R为烷基)。
碳正离子及其反应于20世纪20年代由C.K.英戈尔德等提出的。
碳正离子可以认为是通过共价C-C 单键中一对电子的异裂反应而产生,式中X 为卤素。
-RC++X-C:XR 33杂化,中心原子以三个sp23, —个正电荷,配位数为所形成的碳正离子R3C+轨道垂直于平面,正电荷p 轨道和三个原子成键,三个键轴构成平面,空着的.的共轭效应,诱导效应和立体效应,以及烷基的超Rp 集中在轨道上。
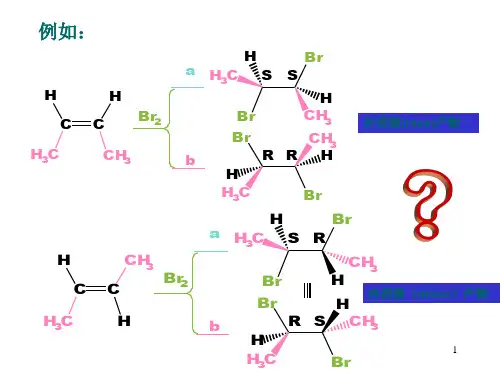

第五讲与酸和亲电试剂有关的反应—、 碳正离子 酸性介质中的反应可能涉及到碳正离子。
碳正离子的稳 定性为:3。
> 2° > 1。
> +CH31.碳正离子的形成 (1) 离解a.醇发生质子化后,碳氧单键发生异裂,得到碳正离子。
例如:CH 3H 3C —C —OH + H ICH 3(3)羰基的质子化:0+ H^OSOH(4) 羰基化合物与Lewis 酸的反应AICI 3 + CH —c —ci ―►例如,Friedel-Crafts 酰基化反应 该反应的机理是:OCH+H 3C —C —OHICH—般仅限制于生成稳定的碳正离子 间体为碳正离子)。
b.极性介质中,反应物分子中又存在好的离去基团,不需要 酸的催化,也会发生键的异裂,生成碳正离子。
_OHO —MeOCH^O —AOCF 3 :热・MeOCH 2 + CF 3SO 3-O—⑵亲电试剂对双键的加成(SN1或E1反应的中CH 3H 3C — C +CH 3Q OSOH+ 'OSOH+ 「OSOHQkAICI 3CH 3 一 C —Cl-O AICI 3H^Jci O CH - H ++0AICI3-OAICI3* CH — L CI-CIAICI 32.碳正离子的重排碳正离子重排的驱动力是:生成更稳定的碳正离子。
重 排通常涉及到碳正离子中心原子的a-C 上的烷基、苯基或H 的迁移。
(1) -H 的迁移OH〜/ + H 2SQBr -BrH O反应: 机理:+严一性2(2)烷基的迁移下列反应涉及到烷基的迁移,为它提出一个合理的机理。
比0\机理实例1: 二烯酮-酚的重排反应百度文库-让每个人平等地提升自我实例 反应机理:HO片呐醇重排2: OHOHPhPhO Ph_ HOH ”\ + H + PhPhOH -H 2O +_ Ph^^^PhOH OH PhHPhPhPPh O PhH3.涉及缺电子氮的正离子重排下列反应为Beckmann 重排:Z OHN ⑴PCl5. ⑵ NOA tPh Ph机理:Ph PhCl I 广——込Cl/1Cl ClH?OPh、O U NH PhCl ,ClCl 一 — ClN ' * H ClOPCI5的作用是增大底物分子中氮氧键的极性,帮助其异裂。


tiffeneau重排机理
Tiffeneau重排反应是一种有机化学反应,涉及一个胺基醇在亚硝酸作用下发生重氮化,然后发生碳正离子重排,最终生成羰基化合物。
以下是该反应的机理:
1. 氨基转化为重氮盐:伯氨基与亚硝酸反应,形成重氮盐或其前驱体三氧化二氮(N₂O₃)。
2. 重氮离子的形成与氮气的释放:重氮盐受到亲电试剂(如伯氨基)的进攻,经过一系列质子转移,形成重氮离子。
这种重氮离子不稳定,很容易放出氮气。
3. 碳正离子的形成与重排:放出氮气后,生成一级碳正离子。
然后,碳正离子发生[1,2]-烷基转移,生成更加稳定的氧鎓离子。
4. 去质子化与环酮的形成:最后,氧鎓离子去质子化,生成环酮。
需要注意的是,这个反应存在竞争反应,例如重氮离去基团可能被溶剂(如水)取代,或者形成可能发生其他重排(如氢化物转移)的碳正离子。
由于氢化物转移的活化熵更高,所以扩环反应有利于Tiffeneau-Demjanov重排反应的进行。

碳正离子机理碳正离子机理是指在空气中通过直流电弧放电,将空气中的气体分离成带正电荷的离子和带负电荷的电子,然后将带正电荷的离子经过一个高速加速的过程,使它们具有足够的能量来进行化学反应,最终得到有用的产物。
碳正离子机理的原理是利用电力产生的高强度电场,使空气中的气体分子通过电离过程形成带正电荷的离子,并在电场力的作用下加速,从而产生能量和动量。
根据能量守恒定律和动量守恒定律,这些离子将在方向和速度上发生变化,因而具有足够的能量和动量来进行化学反应。
具体来说,碳正离子机制的变化过程如下:1.电离过程:在电场力的作用下,电 ARC放电释放出大量的电子和离子,它们与空气分子碰撞产生新的离子。
这些带正电荷的离子被称为碳正离子,它们具有非常高的能量和动量。
2.加速过程:碳正离子经过一个高速加速的过程,使它们具有足够的能量来进行化学反应。
加速过程通常采用电磁场方式,通过垂直于电场的磁场力使离子运动轨迹发生偏转,从而产生加速效果。
3.化学反应过程:在加速过程中,碳正离子与有机物分子之间发生冲击,使有机物分子被分解为原子和自由基,并形成新的分子。
同时,与氧气分子碰撞则可能发生氧化反应,产生氧化产物。
4.离子再结合过程:反应完成后,产生的离子和自由基重新结合成为新的化合物,从而得到有用的产物。
碳正离子机理的应用十分广泛,主要体现在空气净化、水处理、表面改性等领域。
通过调节反应条件和控制材料的组成,可以实现不同类型的产物。
例如,在空气净化方面,氧气和空气中的其他气体成分的反应可以形成氧气,从而减少有害气体的浓度。
在水处理方面,受污染水中的有机污染物可以被分解和处理。
在表面改性方面,适当的反应条件和碳正离子的特殊机理可以实现表面的硬化和增强。
总之,碳正离子机理是一种有效的化学反应机制,可以实现空气净化、水处理和表面改性等领域的应用。
随着对技术的不断改进和发展,碳正离子技术将具有更广泛的应用前景。
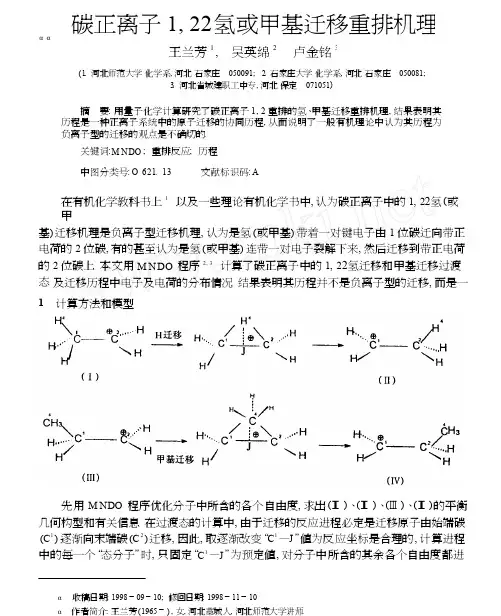
碳正离子1, 22氢或甲基迁移重排机理αα王兰芳1 , 吴英绵2 , 卢金铭3( 1. 河北师范大学化学系, 河北石家庄050091; 2. 石家庄大学化学系, 河北石家庄050081;3. 河北省城建职工中专, 河北保定071051)摘要: 用量子化学计算研究了碳正离子1, 2 重排的氢、甲基迁移重排机理, 结果表明其历程是一种正离子系统中的原子迁移的协同历程, 从而说明了一般有机理论中认为其历程为负离子型的迁移的观点是不确切的.关键词: M N D O ; 重排反应; 历程中图分类号: O 621. 13 文献标识码: A在有机化学教科书上 1 以及一些理论有机化学书中, 认为碳正离子中的1, 22氢(或甲基) 迁移机理是负离子型迁移机理, 认为是氢(或甲基) 带着一对键电子由1 位碳迁向带正电荷的2 位碳, 有的甚至认为是氢(或甲基) 连带一对电子裂解下来, 然后迁移到带正电荷的2 位碳上. 本文用M N DO 程序2, 3 计算了碳正离子中的1, 22氢迁移和甲基迁移过渡态及迁移历程中电子及电荷的分布情况. 结果表明其历程并不是负离子型的迁移, 而是一种计算方法和模型1 Array先用M N D O 程序优化分子中所含的各个自由度, 求出(I)、(I)、(III)、( I) 的平衡几何构型和有关信息. 在过渡态的计算中, 由于迁移的反应进程必定是迁移原子由始端碳(C 1 ) 逐渐向末端碳(C 2 ) 迁移, 因此, 取逐渐改变“C 1 —J ”值为反应坐标是合理的, 计算进程中的每一个“态分子”时, 只固定“C 1 —J ”为预定值, 对分子中所含的其余各个自由度都进收稿日期: 1998 09 10; 修回日期: 1998 11 10αα 作者简介: 王兰芳(1965 ) , 女, 河北藁城人, 河北师范大学讲师.386河北师范大学学报 (自然科学版) 第 23 卷行优化 计 算, 这 样 的 计 算, 相 当 于 平 衡 几 何 构 型“仅 限 定 一 个 自 由 度”的 计 算, 对 此, M N D O 程序是足以胜任的, 故结果是比较可靠的.表 1 从 (I ) 到 (I ) 过程中所取各点的相关数据p y 电子数 键 级长度/nm C 1—J∃H f/(kJ ·m o l - 1)s 电子数 H 4 活化能 /(kJ ·m o l - 1 )C 1C 2C 1 —H 4 C 2 —H 4 C 1 —C 2 919. 23838. 1932. 6950. 2 969. 9 982. 03 3 969. 9 950. 2 932. 6- 0. 035 0 - 0. 019 7 0. 000 0. 020 5 0. 042 2 0. 071 0 0. 101 5 0. 124 5 0. 145 8 0. 844 0. 858 0. 874 0. 886 0. 892 0. 886 0. 892 0. 886 0. 8740. 880 0. 868 0. 840 0. 786 0. 685 0. 492 0. 301 0. 200 0. 1430. 096 0. 111 0. 143 0. 200 0. 301 0. 492 0. 685 0. 786 0. 8411. 1191. 123 1. 142 1. 181 1. 237 1. 285 1. 237 1. 181 1. 1420. 925 0. 860 0. 762 0. 586 0. 391 0. 273 0. 2020. 202 0. 273 0. 391 0. 586 0. 762 0. 860 0. 92562. 8表 2 从 (III ) 到 (I ) 过程中所取各点的相关数据p y 电子数 键 级 长度/nm C 1—Js 电子数H 4活化能/(kJ ·m o l - 1)∃H f/(kJ ·m o l - 1)C 1C 2C 1 —H 4 C 2 —H 4 C 1 —C 2888. 73898. 3918. 0941. 8 955. 2 959. 83 3955. 2 941. 8918. 0- 0. 060 6 - 0. 027 4 0. 000 0. 027 8 0. 049 4 0. 071 1 0. 093 8 0. 116 5 0. 145 7 0. 865 0. 850 0. 8410. 756 0. 670 0. 546 0. 410 0. 290 0. 1800. 091 0. 122 0. 180 0. 290 0. 410 0. 546 0. 670 0. 756 0. 8410. 939 0. 853 0. 761 0. 634 0. 489 0. 366 0. 2460. 246 0. 366 0. 489 0. 634 0. 761 0. 853 0. 9390. 814 0. 826 0. 827 0. 826 0. 8141. 175 1. 204 1. 223 1. 204 1. 17571. 1注: 表 1、表 2 中3 —— 平衡构型; 3 3 —— 过渡态2 结果和讨论计算结果列于表 1 和表 2. 从表中数据可以得出如下主要规律:1) 从表 1 和表 2 中的活化能值可以看出, 氢或甲基迁移的活化能都比较低 ( 分别为 8, 71. 1 kJ ) , 远低于碳氢键或碳碳键均裂时所需要的能量, 而碳氢键或碳碳键异裂产62. 生氢负离子或甲基负离子所需要的能量还要高, 因此不可能是负离子迁移的机理, 而且, 碳骨架部分本来已经带有一个正电荷 ( 缺一个电子) , 此时, 氢或甲基若带着一对电子迁 移, 必然使骨架部分带更多的正电荷, 故不可能. 因为已经缺少一个电子的骨架部分对电 子的吸引力一定比氢或甲基要大. 低活化能表明其历程可能是协同历程.2) 表中 C 1 , C 2 与 H 4 (或 C 4 ) (H 4 , C 4 指迁移原子) 间的键级数值, 清楚地表明在迁移进程中 H 4 与 C 1 ( 端 C ) 之间的键逐步削弱, H 4 与 C 2 ( 迁移末端) 之间的键逐步加强, 削弱与 加强是同时进行的, 这表明该迁移历程是协同历程. 在此过程中,“C 1 —H 4 ”键的削弱以至 4 2第 3 期王兰芳等: 碳正离子 1, 22氢或甲基迁移重排机理387活化能降低.3) 从表中净电荷或电子分布数值可以看出, 在迁移过程中, 迁移的氢原子始终具有一个电子 (0. 9 e 左右) , 迁移中的甲基碳原子也相类似. “C 1 —H 4”Ρ 键中原来的两个电子,一个被 H 4 带着迁移, 另一个依 H 4 离 C 1 和 C 2的远近, 呈平均几率分布在 C 1 和 C 2 的 p y 轨道上, 这两个 p y 轨道与 H 4 的 1s 轨道重叠, 形成三中心二电子键 ( 或两个部分 C —H 4 Ρ 键) , 从而表明其历程是氢原子 (带一个电子) 迁移的协同历程. 从另一角度也可以将迁移进程中的各点看成是氢原子与 C 1 和 C 2间单电子 Π键作用的产物. 作用强时, C 1 和 C 2 间 的单电子 Π键严重削弱, 以至完全破坏 (始、终态时) ; 当作用弱时, 则存在部分 Π键, 过渡态时, H 4 与 C 1 及 C 2的 p y 作用总量最弱, 这时形成的三中心二电子键最弱, C 1 和 C 2 间 Π 键相对最强 (仍然很小). 表中 C 1 —C 2 键级数据表明了这种趋势. 因此, 碳正离子 1, 2 氢迁移或甲基迁移是正离子系统中的原子迁移的协同反应, 不是负离子型的迁移反应. 这种 迁移是包含 2 个电子的同面过程, 是热允许的过程, 符合轨道对称性守恒原理.综上所述, 可以认为: 计算结果证实了碳正离子中的 1, 2 氢迁移和甲基迁移是一种 正离子系统中的原子迁移的协同过程; 一般有机理论中认为负离子型迁移历程只是从始 态和终态分子的价键结构式出发所做出的一种推论, 并不反映客观实际历程, 因此是不确 切的. 参考文献:曾昭琼. 有机化学 [M . 第 3 版. 北京: 高等教育出版社, 1994. 464.D EW A R M J S , T H IEL W . G r o u n d sta t e s o f m o lecu le s 38. th e M N D O m e t ho d ap p ro x i m a t i o n s an d p a r am te r s [J . J A m C h e m S o c , 1977, 99: 4 899.D EW A R M J S , T H IEL W. G r o u n d sta t e s o f m o l ecu le s 39. M N D O re s u lt s fo r m o lecu le s co n ta i n in g h y d r o g en , ca r bo n , n it r o g en an d o x ygen [J . J A m C h e m S o c , 1977, 99: 4 907.1 2 31, 2- H ydrogen orlon sL U J i n 2m i n g 3The Rea r ran g em en t M echan is m of M e thy l W A N G L an 2fan g 1 , in Ca r ben ium W U Y i n g 2m i an 2 , ( 1. D ep a r tm en t o f C h e m ist r y, H ebe i N o r m a l U n ive r sity, Sh ijiazh uang 050091, C h ina; 2. D ep a r tm en t o f C h e m ist ry E ng inee r ing , Sh ijiazh u ang U n ive r sity , Sh ijiazh uang 050081, C h ina ;3. H ebe i C it ie s and T ow n s Co n st ruc t ing Schoo l , Sh ijiazh uang 071051, C h ina )A bs tra c t : T h e rea r ran ge m en t m ech an ism o f 1. 22h yd ro gen o r m e th y l i n ca rb e n i u mi o n s w a s s tu d i ed b y qu an tum ch em i ca l ca lcu la t i o n . T h e ca lcu la ted re su lt s show e d th a t th e m ech an ism w a s co n ce r ted reac t i o n o f th e a tom m i g ra t i o n i n ca rb en i um i o n s . H e n c e , th e po i n t o f v i ew w a s o n ex ac t th a t th e m ech an ism o f an i o n m i g ra t i o n is co n s i d e r ed i n o rd i n a ry o rgan i c th e o ry .Key word s : M N DO ; rea r r an g e m en t reac t i o n ; m ech a n i sm(责任编辑 刘新喜)。

有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R —X →R + +X - 在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF 5作为Lewis 酸生成稳定SbF 6一, 会使反应向右进行,有利于碳正离子的生成。
R —Br+ Ag +→R ++ AgBr ; R —F+SbF5→R ++SbF 6-。
但是醇、醚、酰卤在酸或Lewis 酸的催化下也可以离解为碳正离子。
R 一0H → R +-OH 2→R ++H 20 ; CH 3COF+BF 3-→CH 3CO ++BF 4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH 3)3CH + SbF 5·FSO 3H →(CH 3)3C ++ SbF 5·FSO 3-+H 2 2、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
CCH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N 2而生成碳正离子。
RN R +N2 ;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP 3杂化角锥构型 SP 2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp 2杂化的s 成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P 轨道伸展于平面两侧,便于溶剂化。
碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。
烯烃碳正离子重排
烯烃碳正离子重排(Allylic Rearrangement)是一种常见的有机化学反应,可以将烯丙基碳正离子重排为更稳定的烷基碳正离子。
反应的机理可以分为三步:
1. 烯丙基碳正离子的形成:由于孤对电子的存在,双键上的相邻甲基易于失去一个质子,形成烯丙基碳正离子。
2. 烯丙基碳正离子的重排:烯丙基碳正离子不稳定,易于发生重排,形成更稳定的烷基碳正离子。
3. 烷基碳正离子的退占:烷基碳正离子很稳定,不易再发生反应,因此最终生成烷基。
烯烃碳正离子重排是一种比较常见的反应,常用于有机合成中。
例如,在制备单宁酸类化合物时,常用于将α,β-不饱和羧酸转化为γ-酮酸,从而产生反式的稳定立体构型。
碳正离子机理你知道吗,化学界里有个挺酷炫的家伙,咱们得聊聊它——碳正离子机理。
别一听这名字就皱眉头,其实它挺接地气的,就像咱们生活中的小魔术,藏着不少秘密呢。
想象一下,你手里拿着一根魔术棒,轻轻一挥,哎,空气里的分子就开始变戏法了。
碳正离子机理,就是那根神奇的魔术棒,它让碳原子带上点正电荷,就像是给分子穿上了一件闪亮的金色斗篷,瞬间变得特别耀眼。
这事儿啊,得从碳原子的性格说起。
碳这家伙,真是个多面手,它能跟好多元素手拉手,组成各种各样的化合物,就像咱们的朋友圈,热闹得很。
但有时候,碳原子也想独当一面,展现一下自己的领导魅力,这时候,碳正离子就出现了。
碳正离子啊,就像是化学世界里的单身贵族,带着那么一点点寂寞,却又充满了无限可能。
它的出现,往往意味着一场化学反应的序幕即将拉开。
就像咱们在派对上遇到那个特别的人,心里头就开始琢磨,接下来会发生什么故事呢?这机理啊,说起来简单,其实背后藏着不少门道。
你得先有个“触发器”,比如光照、加热或者加点催化剂什么的,给碳原子来点刺激,让它愿意脱下旧衣服,换上那件闪亮的金色斗篷。
这一换,不得了了,碳原子瞬间变成了万人迷,周围的分子都围了过来,想跟它亲近亲近。
于是,一场化学反应的舞会就开始了。
碳正离子作为领舞,带着一群小伙伴,在化学的舞台上翩翩起舞。
它们旋转、跳跃、交换位置,最后形成了新的化合物,就像是完成了一场精彩的变装秀。
在这个过程中啊,碳正离子可是个挑剔的舞者,它只跟那些“合得来”的分子跳舞。
这就像咱们找朋友一样,得看对眼了才行。
所以啊,化学家们得费尽心思,去研究哪些分子能跟碳正离子跳得欢,哪些则只能在一旁当观众。
不过话说回来啊,这碳正离子机理虽然神奇,但也不是没有缺点。
它就像个有点任性的小孩,有时候喜欢乱来。
比如啊,在反应过程中啊,它可能会突然改变主意,跟别的分子跑了;或者呢,它可能根本就不愿意出现,让化学家们头疼不已。
但正是这些挑战啊,让化学这门学科充满了魅力。