高中高一化学必修一知识点:铝三角
- 格式:docx
- 大小:32.09 KB
- 文档页数:7

铝三角化学
铝三角化学是一种新型的化学学科,它是近年来新兴的重要的化学学科之一。
它涉及原子结构、物理性质、化学特性和化学反应等多方面的内容,从而推动着它的发展和应用。
铝系元素的三角化学利用了铝的配位性和金属性,以及其与氧、硫、氟等无机或有机化合物的配位作用,以及铝原子的共价结合能,可以用来制备出丰富多样的功能性分子。
其中,部分金属配位物,如氯代烷基铝(AlCl3)、氧化铝(Al2O3)等,具有独特的光学和结构性质,广泛应用于许多医药、农药、农膜、防锈防潮剂等领域。
铝三角化学具有独特的化学性质,可以用来合成具有多种物理、化学和生态功能特性的新材料。
目前,有许多以铝三角结构为中心的材料研究正在进行,主要是设计出能够改善生物识别、重组和转换物质的新型功能材料,以满足不同的实际应用。
比如,人们研究开发了铝三角阳离子润湿剂,它具有良好的抗菌和抗霉性能,可用于消毒和抑制细菌繁殖。
此外,铝三角化学也发展出一系列高效、安全、绿色的水处理技术。
通过调节氯铝离子在水中的溶解度,可以有效减少水中的有机物和杂质,从而实现水的净化处理。
同时,通过利用铝的分子结构特性,可以制备抗菌剂,有效控制及消除有害微生物的繁殖,从而满足人们对安全饮用水的要求。
随着社会需求的不断增加,铝三角化学将会面临前所未有的发
展机遇。
国内外专家学者们正在深入探索其中全新的发展和应用方向,以实现铝三角化学在社会经济发展、生态环境保护和保健医疗等方面重要的贡献。
未来,铝三角化学将会发挥更大的作用,在不同领域的发展中将会发挥积极的作用。

高一化学铝三角知识点一、铝的性质铝是一种常见的金属元素,化学符号为Al,原子序数为13,在化学元素周期表中位于第三周期。
它具有以下几个主要的性质。
1.1 物理性质铝是一种轻质金属,其密度约为2.7g/cm³。
它具有良好的导电性和导热性,在常温下不磁性。
此外,铝具有较高的延展性和韧性,可以轻松地拉成细丝或轧制成薄片。
1.2 化学性质铝具有较强的氧化性,但其表面会形成一层致密的氧化铝膜,防止进一步的氧化反应发生。
铝在常温下与大多数非金属元素不发生反应,但在高温下可与氧、硫、卤素等反应。
此外,铝还可以与一些酸性或碱性溶液发生反应。
二、铝的三角知识点在化学学科中,铝的三角知识点主要涉及以下几个方面。
2.1 铝的制取铝的制取主要有金属铝的电解法、铝矾土的热法和金属铝的热还原法等几种方法。
其中,金属铝的电解法是目前最常用的工业制取方法。
在这个过程中,以氧化铝为原料,溶解在氟化铝和氯化钠的混合熔盐中,通过电解进行还原,得到纯度较高的金属铝。
2.2 铝和酸的反应铝在与酸反应时产生的产物取决于所用酸的类型。
在与多数非氧化性酸(如盐酸、硫酸)反应时,铝会被酸溶解生成相应的盐和氢气。
而当与氧化性酸(如硝酸)反应时,铝会被酸氧化生成相应的盐和氧气。
2.3 铝的氧化反应铝与氧气反应产生的氧化物是氧化铝,化学式为Al2O3。
这种氧化物具有很高的熔点和热稳定性,形成了一层致密的氧化铝膜,能够有效地保护铝材表面免受进一步的氧化侵蚀。
2.4 铝的还原反应铝具有较强的还原性,可以被一些金属离子还原成金属。
例如,当铝与铜(II)离子反应时,铜(II)离子被还原为铜金属,而铝本身被氧化为铝离子。
2.5 铝的应用铝具有许多重要的应用。
由于其轻质和良好的延展性,铝被广泛用于制造航空器、汽车、自行车等交通工具的结构部件。
此外,铝还在建筑、电子、包装等领域有广泛的应用。
三、总结铝是一种常见的金属元素,具有轻质、良好的导电性和导热性等物理性质。


高一必修一化学铝知识点铝是一种常见的金属元素,化学符号为Al,原子序数为13。
它是地壳中含量第三高的元素,仅次于氧和硅。
铝具有轻质、耐腐蚀、良好导电导热等特点,被广泛应用于各个领域。
下面将介绍一些高一化学必修一中与铝相关的知识点。
1. 铝的物理性质铝是一种银白色的金属,具有较低的密度和较好的延展性。
它的熔点为660.32摄氏度,沸点约为2450摄氏度。
铝在常温下较为稳定,能抵御大部分物质的腐蚀。
2. 铝的化学性质铝具有良好的物理和化学性质,可以通过与其他元素的反应制备出多种化合物。
例如,与氧反应可以生成氧化铝(Al2O3),与硫反应可以生成硫化铝(Al2S3)。
此外,铝还可以与氢反应生成氢化铝(AlH3)等化合物。
3. 铝的腐蚀性尽管铝自身具有一定的耐腐蚀性,但在一些特殊条件下,如浓硝酸和强碱的存在下,铝会发生腐蚀。
这是因为铝与空气中的氧气反应,形成氧化铝保护层保护自身,但浓硝酸和强碱会破坏这层保护层,导致铝的腐蚀。
4. 铝的应用领域由于铝具有轻质和良好的导电导热性,广泛应用于许多领域。
其中最常见的应用是在航空航天和汽车工业中,用于制造飞机、汽车车身和零部件。
此外,铝还被用于制造罐装饮料、建筑材料、电子产品和家居用品等。
5. 铝的提取与炼制铝的提取主要通过电解法进行。
首先,将含有氧化铝的矿石(如赤铁矿石)经过纯化和粉碎处理,得到氧化铝粉末。
然后,将氧化铝粉末与熔融的硫酸铝混合,这样就得到了电解池的电解液。
在电解池中,通过电流的作用下,将氧化铝还原成铝金属。
6. 铝的环境影响虽然铝在自然界中广泛存在,但铝的过量排放对环境和生物造成一定的影响。
过量的铝会对水资源造成污染,干扰水生生物的生长和繁殖。
此外,铝的工业生产和废弃物处理也会对土壤和大气环境造成一定程度的污染。
在学习高一必修一化学课程时,理解和掌握以上关于铝的知识点对于学生们深入了解金属元素和化学反应有着重要的意义。
通过学习铝的物理和化学特性,我们可以更好地理解其在工业生产和日常生活中的应用,同时也需要注意铝对环境和生态系统的影响,积极采取环保措施。

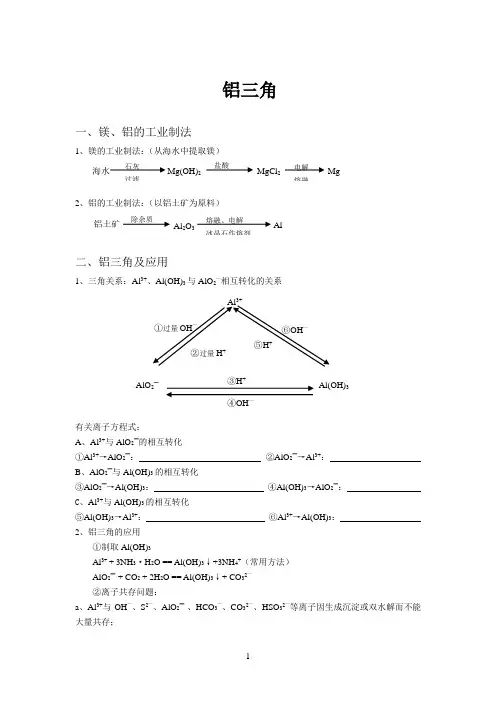
1①过量OH —②过量H+③H +④OH—⑤H + ⑥OH —铝三角一、镁、铝的工业制法1、镁的工业制法:(从海水中提取镁)2、铝的工业制法:(以铝土矿为原料)二、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+:B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存;Al 3+Al(OH)3AlO 2— 石灰过滤 海水Mg(OH)2 盐酸 MgCl 2 电解 熔融Mg铝土矿 除杂质 Al 2O 3 熔融、电解冰晶石作熔剂 Al2 b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
三、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3+ + 3OH —== Al(OH)3↓Al(OH)3 + OH — == AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓ +3NH 4+ 现象:产生白色沉淀,继续加氨水,沉淀不消失。


元素化合物知识作为其他化学知识的载体,在中学化学中占有举足轻重的地位。
纵观近几年的高考试题,铝、氧化铝、氢氧化铝、常见的铝盐(如氯化铝、明矾等)一直是命题的热点。
Al3+、Al(OH)3、AlO2-的相互转化,应用在离子分离(如Mg2+、Al3+的分离)、共存及推断中的试题屡屡出现。
Al与酸反应、Al3+与碱反应,AlO2-与酸反应的离子方程式书写以及计算、图象分析等.传统的教学方式中,往往习惯于采用“铝三角”来教学。
铝三角可以表明Al3+、Al(OH) 3、AlO2-之间存在一定关联,三者之间可以通过加入酸或者碱相互转化。
然而关键的定量关系(Al3+与OH-相互滴加产物的讨论等)不能通过“铝三角”得以体现。
因为,铝三角忽略了最为关键的一点:AlO2-是Al(OH)3在OH-过量时产生的。
为了解决这一问题,笔者大胆提出“线型”学铝策略。
一.线型学铝概念的提出“线型学铝”策略中所谓的“铝线”,其实就是由H+ Al3+ Al(OH)3 AlO2- OH-五个粒子所构成的一条关系线。
出于H+、OH-与Al3+、Al(OH)3、AlO2-的紧密关系考虑,与“铝三角”不同,“铝线”中加入了H+、OH-这两种离子。
感觉上,粒子数的增加,使问题变的更为复杂;而实际上,只是将原本转换关系中隐藏的粒子更直观、更清晰表现出来。
二.线型学铝概念的剖析“线型学铝”基本内容可以由四句话来概括——相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键。
(一)相邻粒子不反应——解决粒子间共存问题有铝元素参加的粒子间共存问题的讨论一直是会考、高考的热点,2004年的浙江省会考试卷中就有两题(第4题、第23题)涉及这一内容。
例:下列物质中,既能跟NaOH溶液反应,又能跟盐酸反应的是( )A.Al(OH)3B.Na2CO3C.NH4ClD.CH3COONa该题考查了“铝线”中的粒子的共存关系。
只要明确“铝线”上相邻粒子是不反应的,不相邻粒子间可以反应,那么选答案A也就十分明确了。

考点6 铝三角的应用【考点定位】本考点考查铝三角的应用,涉及铝盐、偏铝酸盐及氢氧化铝之间的转化条件,特别注意铝盐与碱性溶液及偏铝酸盐与酸之间的反应,以及反应物的物质的量对反应原理的影响。
【精确解读】Al3+、Al(OH)3、AlO2-之间的转化关系1.Al3+―→Al(OH)3(1)可溶性铝盐与少量NaOH溶液反应:AlCl3+3NaOH =Al(OH)3↓+3NaCl(2)可溶性铝盐与氨水反应:AlCl3+3NH3·H2O =Al(OH)3↓+3NH4Cl2.Al(OH)3―→Al3+:Al(OH)3溶于强酸溶液:Al(OH)3+3HCl=AlCl3+3H2O3.Al3+―→AlO2-:可溶性铝盐与过量的强碱反应:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O 4.AlO2-―→Al3+:偏铝酸盐溶液与足量的盐酸反应:NaAlO2+4HCl=AlCl3+NaCl+2H2O 5.AlO2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 6.Al(OH)3―→ AlO2-:Al(OH)3溶于强碱溶液:Al(OH)3+NaOH=NaAlO2+2H2O特别注意:三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【精细剖析】1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO2-→Al(OH)3最好通入CO2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.突破Al(OH)3沉淀图像三个秘诀(1)明晰横、纵坐标含义,然后通过曲线变化特点分析反应原理。


“铝三角”的图像分析及计算一、氢氧化铝沉淀的图象分析1、可溶性铝盐溶液与NaOH溶液反应的图像操作可溶性铝盐溶液中逐滴加入NaOH溶液至过量NaOH溶液中逐滴加入可溶性铝盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失图像离子方程式A→B:Al3++3OH-===Al(OH)3↓B→D:Al(OH)3+OH-===AlO-2+2H2OA→B:Al3++4OH-===AlO-2+2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓2、偏铝酸盐溶液与盐酸反应的图像操作偏铝酸盐溶液中逐滴加稀盐酸至过量稀盐酸中逐滴加偏铝酸盐溶液至过量现象立即产生白色沉淀→渐多→最多→渐少→消失无沉淀→出现沉淀→渐多→最多→沉淀不消失图像离子方程式A→B:AlO-2+H++H2O===Al(OH)3↓B→D:Al(OH)3+3H+===Al3++3H2OA→B:4H++AlO-2===Al3++2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓3、可溶性铝盐溶液与弱碱(氨水)溶液反应的图像、偏铝酸盐溶液与弱酸(CO2)反应的图像操作向AlCl3溶液中逐滴滴入氨水或NaAlO2溶液至过量向NaAlO2溶液中通入CO2至过量现象立即产生白色沉淀→渐多→最多→沉淀不消失立即产生白色沉淀→渐多→最多→沉淀不消失图像离子方程式Al3++3NH3·H2O===Al(OH)3↓+3NH+4Al3++3AlO-2+6H2O===4Al(OH)3↓AlO-2+CO2+2H2O===Al(OH)3↓+HCO-34、可溶性铝盐、镁盐混合液与NaOH溶液反应的图像操作往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量向MgCl2、AlCl3和盐酸的混合溶液(即将Mg、Al溶于过量盐酸所得的溶液)中逐滴滴入NaOH溶液至过量现象开始出现白色沉淀,后沉淀量增多,最后沉淀部分溶解先无沉淀,后出现白色沉淀,然后沉淀量增多,最后沉淀部分溶解图像离子方程式O→A:Al3++3OH-===Al(OH)3↓Mg2++2OH-===Mg(OH)2↓A→B:Al(OH)3+OH-===AlO-2+2H2OO→A:H++OH-===H2OA→B:Al3++3OH-===Al(OH)3↓Mg2++2OH-===Mg(OH)2↓A→B:Al(OH)3+OH-===AlO-2+2H2O5、含不同阳离子的混合盐(或复盐)与碱的反应(1)向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量图像离子方程式O→A:H++OH-===H2OA→B:Al3++3OH-===Al(OH)3↓,Mg2++2OH-===Mg(OH)2↓B→C:NH+4+OH-===NH3·H2OC→D:Al(OH)3+OH-===AlO-2+2H2O(2)把Ba(OH)2溶液逐滴加入到明矾溶液中至过量图像离子方程式O→A:2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+3BaSO4↓+K2SO4 A→B:2Al(OH)3+K2SO4+Ba(OH)2===BaSO4↓+2KAlO2+4H2O二、常见题型类型一图像认识1、向含有盐酸的AlCl3 溶液中慢慢滴入NaOH 溶液,生成沉淀W(g)与所加NaOH 溶液体积V的关系如下图,其中正确的是( )2、如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是()A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.③线表示Al(OH)3的物质的量的变化D.④线表示AlO-2的物质的量的变化3、下列实验操作对应的图像不正确的是()选项实验操作图像A 向MgCl2、AlCl3溶液中(各1 mol),逐滴加入NaOH溶液B 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1 mol),逐滴加入NaOH溶液C 向NaOH、NaAlO2溶液中(各1 mol),逐滴加入HCl溶液D 向NaOH、Na2CO3混合溶液中(各1 mol)滴加稀盐酸类型二有关图像的计算1、向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为()A.3mL B.7.5mL C.15mL D.17.5mL2、现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示,原溶液中Cl-与SO2-4的物质的量之比为()A.1∶3 B.2∶3 C.6∶1 D.3∶13、向混有一定量盐酸的硫酸铝和硫酸镁混合溶液中,逐滴加入2mol/L的NaOH 溶液,所生成沉淀W g 与加入NaOH 溶液的体积V( mL)如图所示,则原混合溶液中c(Cl-)、c(Al3+)、c(Mg2+)之比为 ()A.1:3:1 B.1:2:1 C.1:1:2 D.1:1 :14、某溶液中可能含有H+、NH+4、Mg2+、Al3+、Fe3+、CO2-3、SO2-4、NO-3中的几种。
永久免费组卷搜题网 永久免费组卷搜题网课题23:“铝三角”及其应用【课标要求】了解常见不同类型化合物之间转化的条件和方法,认识金属矿物等自然资源综合利用方面的重要作用。
【考向瞭望】合金、通讯材料的化学成分、相关特性,以及与生产生活的关系可能作为化学与社会联系的切入口进行命题。
【知识梳理】一、“铝三角”①Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+;或Al 3++3OH -=Al(OH)3↓。
②Al(OH)3+3H =Al +3H 2O 。
③Al(OH)3+OH =AlO 2+2H 2O 。
④AlO 2+CO 2+2H 2O =Al(OH)3↓+HCO 3-;或2AlO 2-+CO 2+3H 2O =2Al(OH)3↓+CO 32-;或AlO 2+H +H 2O =Al(OH)3↓。
⑤AlO 2+4H =Al +2H 2O 。
⑥Al 3++4OH -=AlO 2-+2H 2O 。
另外,Al +3AlO 2+6H 2O =4Al(OH)3↓(水解相互促进)。
二、应用(一)制Al(OH)3Al 3++3NH 3·H 2O =Al(OH)3↓+3NH 4+;或AlO 2-+CO 2+2H 2O =Al(OH)3↓+HCO 3-。
(二)离子共存问题Al 3+与OH -、S 2-、AlO 2-、CO 32-、HCO 3-;AlO 2-与H +、Al 3+、Fe 3+、NH 4+因发生反应或水解相互促进而不能大量共存。
(三)Al(OH)3沉淀的有关计算1、铝盐与强碱反应(1)n (Al 3+)︰n (OH -)≥1︰3时:m [Al(OH)3]=78g·mol -1×n(OH -)/3。
(2)n (Al 3+)︰n (OH -)≤1︰4时:m [Al(OH)3]=0。
(3)1︰4<n (Al 3+)︰n (OH -)<1︰3时:m [Al(OH)3]=78g·mol -1×[4n(Al 3+)-n(OH -)]。
铝三角14个离子化学方程式
铝是一种金属元素,在宇宙中非常普遍。
它可用于建造桥梁、建筑物和航空工程,是非常有用的金属元素。
同时,铝也具有很好的化学特性,可以用来形成各种化学物质。
一共有14种铝离子化学方程式,可以分为铝氧离子、铝氢离子和铝氯离子3种。
铝氧离子可以形成的离子化学方程式为:Al$^3$$^+$ + 3OH$^-$$↔$ Al(OH)$^3$ 。
这表明,当铝离子和氧离子反应时,可以形成铝氢正离子和氢氧化物。
铝氢离子可以形成的离子化学方程式为:Al$^3$$^+$ + 3H$^+$$↔$ AlH$^3$$^+$ 。
这表明,当铝离子和氢离子反应时,可以形成铝氢正离子和氢氧化物。
铝氯离子可以形成的离子化学方程式为:Al$^3$$^+$ + 6Cl$^-$$↔$ AlCl$_3$ + 3Cl$^-$$ 。
这表明,当铝离子和氯离子反应时,可以形成三氯化铝和氯离子。
因此,铝可以与多种不同的化合物进行反应,改变它们的物理和化学特性,从而产生不同的离子。
这些不同离子,包括铝氧离子、铝氢离子和铝氯离子,都可以用我们所提到的14个离子化学方程式来描述。
总之,铝具有非常优良的化学和物理性质,可以用来形成各种不同的离子,而14个不同的铝离子化学方程式可以为我们描述铝和其它化合物之间的反应。
①过量OH —②过量H +③H + ④OH —⑤H + ⑥OH —镁和铝重要知识点总结一、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式: A 、Al 3+与AlO2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+: B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3++ 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存; b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
二、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3++ 3OH —== Al(OH)3↓ Al(OH)3 + OH —== AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3++ 3NH 3·H 2O == Al(OH)3↓ +3NH 4+现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3++ 4OH —== AlO 2—+ 2H 2OAl 3++3 AlO 2—+ 6 H 2O == 4Al(OH)3↓Al 3+ Al(OH)3AlO 2—4、向AlCl 3溶液中逐滴滴入NaAlO 2溶液至过量(如图④)有关反应: Al 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓ 现象:产生白色沉淀,继续滴加,沉淀不变化。
高一化学必修一知识点:铝三角高一化学必修一知识点:铝三角铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
点击图片可在新窗口打开铝三角主要体现了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反应铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2点击图片可在新窗口打开2Al2O3;2Al+3S点击图片可在新窗口打开Al2S3;2Al+3Cl2点击图片可在新窗口打开2AlCl3;2.铝与酸反应这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2Al+6HCl=2AlCl3+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;3.铝与强碱反应大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)2Al+2NaOH+2H2O==2NaAlO2+3H2↑;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2↑;该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3点击图片可在新窗口打开2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
高中化学新课程标准教材
化学教案( 2019 — 2020学年度第二学期 )
学校:
年级:
任课教师:
化学教案 / 高中化学 / 高一化学教案
编订:XX文讯教育机构
高一化学必修一知识点:铝三角
教材简介:本教材主要用途为通过学习化学知识和做实验,可以让学生培养自己的严谨精神、提高动手能力、合作沟通能力,本教学设计资料适用于高中高一化学科目, 学习后学生能得到全面的发展和提高。
本内容是按照教材的内容进行的编写,可以放心修改调整或直接进行教学使用。
铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
点击图片可在新窗口打开
铝三角主要体现了铝及其化合物的两性
一、单质铝(al)
铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:al-3e-=al3+。
1.铝与非金属反应
铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4al+3o2点击图片可在新窗口打开2al2o3;2al+3s点击图片可在新窗口打开al2s3;2al+3cl2点击图片可在新窗口打开2alcl3;
2.铝与酸反应
这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2al+6hcl=2alcl3+3h2↑;2al+3h2so4=al2(so4)3+3h2↑;
3.铝与强碱反应
大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)
2al+2naoh+2h2o==2naalo2+3h2↑;对应离子方程式:2al+2oh-+2h2o==2alo2-+3h2↑;
该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2al+6h2o=2al(oh)3+3h2↑;然后,氢氧化铝与氢氧化钠反应,2al(oh)3+2naoh=2naalo2+4h2o。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应
铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2al+fe2o3点击图片可在新窗口打开2fe+al2o3,
铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
二、氧化铝(al2o3)
氧化铝熔点较高,硬度较大,可以与酸碱反应。
1.氧化铝与酸反应
al2o3+6hcl=2alcl3+3h2o;对应离子方程式:al2o3+6h+=2al3++3h2o;
2.氧化铝与碱反应
al2o3+2naoh=2naalo2+h2o;对应离子方程式:al2o3+2oh-=2alo2-+h2o;
3.电解氧化铝生成金属铝
2al2o3点击图片可在新窗口打开4al+3o2↑;加入冰晶石可以降低电解温度。
三、氯化铝(alcl3)
氯化铝,这里主要说明铝离子的性质,可以与碱反应。
1.氯化铝与弱碱反应
alcl3+3nh3.h2o=al(oh)3↓+3nh4cl;对应离子方程式:al3++3nh3•h2o=al(oh)3↓+3nh4+;
2.氯化铝与强碱反应
少量氢氧化钠:alcl3+3naoh=al(oh)3↓+3nacl;
大量氢氧化钠:alcl3+4naoh=naalo2+3nacl+h2o;
依据上述反应方程式,可以得出以下结论,①向氯化铝溶液中逐滴滴加氢氧化钠,首先
生成白色沉淀,最后沉淀消失;②向氢氧化钠溶液中逐滴滴加氯化铝溶液,首先没有明显现象,最后生成白色沉淀;③通过两种溶液互相滴加,可以鉴别氯化铝和氢氧化钠。
四、氢氧化铝(al(oh)3)
氢氧化铝是典型的两性氢氧化物,白色不溶于水的胶状物质,具有吸附作用。
可以与强酸或强碱反应。
氢氧化铝可以进行酸式水解可碱式水解,h++alo2-+h2o点击图片可在新窗口打开al(oh)3点击图片可在新窗口打开al3++3oh-.
1.氢氧化铝与强酸反应
al(oh)3+3hcl=alcl3+3h2o;对应离子方程式:al(oh)3+3h+=al3++3h2o。
2.氢氧化铝与强碱反应
al(oh)3+naoh=naalo2+2h2o;对应离子方程式:al(oh)3+oh-=alo2-+2h2o
3.氢氧化铝加热分解
2al(oh)3点击图片可在新窗口打开al2o3+3h2o
五、偏铝酸钠(naalo2)
高中化学中,偏铝酸钠只是在体现铝、氧化铝、氢氧化铝的两性的时候出现,这里只说明偏铝酸钠与酸的反应。
1.偏铝酸钠与弱酸反应
naalo2+2h2o+co2=al(oh)3↓+nahco3
2naalo2+3h2o+co2=2al(oh)3↓+na2co3
2.偏铝酸钠与强酸反应
naalo2+4hcl=alcl3+nacl+2h2o
六、硫酸铝钾(kal(so4)2)
kal(so4)2•12h2o,十二水合硫酸铝钾,俗名:明矾。
因为al(oh)3具有很强的吸附型,所以明矾可以做净水剂。
kal(so4)2=k++al3++2so42-,al3+会水解:al3++3h2o=al(oh)3+3h+
附加:氢氧化铝的制法
1.铝离子与弱碱反应
铝离子与强碱反应容易过量,不好控制。
alcl3+3nh3•h2o=al(oh)3↓+3nh4cl;离子方程式:al3++3nh3•h2o=al(oh)3↓+3nh4+;
2.偏铝酸根与弱酸反应
偏铝酸根与强酸容易生成铝离子。
naalo2+2h2o+co2=al(oh)3↓+nahco3;离子方程式:alo2-+2h2o+co2=al(oh)3↓+hco3-,
3.偏离酸根与铝离子反应
偏铝酸根与氯离子发生双水解生成氢氧化铝。
3naalo2+alcl3+6h2o=4al(oh)3↓+3nacl;离子方程式:3alo2-+al3++6h2o=4al(oh)3↓;
XX文讯教育机构
WenXun Educational Institution。