无机化学第三版下册答案第二十一章第十七章_碱金属和碱土金属
- 格式:doc
- 大小:92.50 KB
- 文档页数:4

碱金属和碱土金属1.试说明为什么Be2+、Mg2+、Ca2+、Sr2+、Ba2+的水合热依次减弱?2.某酸性BaCl2溶液中含少量FeCl3杂质。
用Ba(OH)2或BaCO3调节溶液的pH值,均可把Fe3+沉淀为Fe(OH)3而除去。
为什么?利用平衡移动原理进行讨论。
3.试解释为什么碱金属的液氨溶液,(1)有高的导电性;(2)是顺磁性的;(3)稀溶液呈兰色。
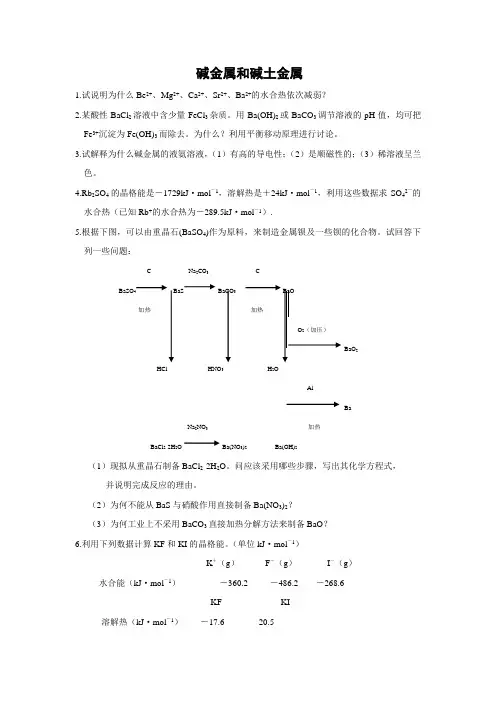
4.Rb2SO4的晶格能是-1729kJ·mol-1,溶解热是+24kJ·mol-1,利用这些数据求SO42-的水合热(已知Rb+的水合热为-289.5kJ·mol-1).5.根据下图,可以由重晶石(BaSO4)作为原料,来制造金属钡及一些钡的化合物。
试回答下列一些问题:C Na2CO3 CBaSO4BaS BaCO3加热BaO2HCl HNO3H2OAlBaNa2NO3 加热BaCl2·2H2O Ba(NO3)2Ba(OH)2(1)现拟从重晶石制备BaCl2·2H2O。
问应该采用哪些步骤,写出其化学方程式,并说明完成反应的理由。
(2)为何不能从BaS与硝酸作用直接制备Ba(NO3)2?(3)为何工业上不采用BaCO3直接加热分解方法来制备BaO?6.利用下列数据计算KF和KI的晶格能。
(单位kJ·mol-1)K+(g)F-(g)I-(g)水合能(kJ·mol-1)-360.2 -486.2 -268.6KF KI溶解热(kJ·mol-1)-17.6 20.5由计算结果再联系有关理论加以讨论。
7.讨论Li+、Na+、K+、Rb+、Cs+系列在水溶液的迁移率大小顺序?若在熔融盐中是否具有相同的顺序?8.Na2O2可作为潜水密闭舱中的供氧剂,这是根据它的什么特点?写出有关反应式。
9.写出M2O、M2O2、MO2与水反应的方程式,并加以比较。
10.如何用离子势概念说明碱金属、碱土金属氢氧化物的碱性是随M+、M2+离子半径的增大增强。


第十七章碱金属和碱土金属1.试根据碱金属和碱土金属元素的电子层构型说明它们化学活泼性的递变规律。
答:碱金属元素的价层结构为ns1,自上而下,随着原子序数的增加,半径增大,第一电离势减小,电负性变小,金属的活泼性依次增强。
2.试比较锂和钾;锂和镁的化学性质有哪些相似点和区别。
答:锂和钾的相似性:都是活泼金属。
不同点更多:在空气中加热的产物MOH M2CO3MNO3受热MOH受热锂:Li3N,Li2O 溶解性差热稳定性差Li2O,NO2,O2Li2O钾:KO2 易溶稳定KNO2,O2不分解锂与镁有对角线相似性:锂镁在O2中加热:Li2O MgO氢氧化物受热:Li2O MgO碳酸盐受热:Li2O+CO2MgO+CO2难溶于水的盐:LiF,Li2CO3,Li3PO4 MgF2,MgCO3,Mg3(PO4)2硝酸盐受热:Li2O,NO2,O2 MgO,NO2,O2镁的水合氯化物受热生成碱式盐。
区别:锂与冷水反应,但渐慢(因为生成溶解性差的LiOH);镁与冷水不反应。
3.金属钠是强还原剂,试写出它与下列物质的反应方程式:H2O,NH3,C2H5OH,Na2O2,NaOH2,NaNO2,MgO,TiCl4答:2Na + 2H2O =2NaOH + H2↑2Na + 2NH3 = 2NaNH2 + H2↑2Na + 2C2H5OH = 2NaOC2H5 + H2↑2Na + Na2O2 = 2Na2ONaH催化无水,450℃2Na + 2NaNO2(s) 4Na2O + N2Na + MgO = Mg + Na2O2Na + TiCl4 = Ti +4NaCl4.写出过氧化钠和下列物质的反应式:NaCrO 2,CO 2,H 2O ,H 2SO 4答:2NaCrO 2+3Na 2O 2 +2H 2O = 2Na 2CrO 4 + 4NaOH3Na 2O 2 +2CO 2 = 2Na 2CO 3 +3O 2Na 2O 2 + H 2O H 2O 2 + 2NaOH 冷2Na 2O 2 + 2H 2O 4NaOH +ONa 2O 2 + H 2SO 4冷Na 2SO 4 + H 2O 2 5.写出氢氧化钠和氢氧化钙的主要化学性质和用途。


《无机化学》下册(第三版)习题参考答案武汉大学、吉林大学等校编曹锡章、宋天佑、王杏乔修订高等教育出版社屮国石油大学(华东)化学化工学院第十二章卤族元素1. 单质的活泼性次序为:F 2»Cl 2>Br 2>I 2从F 2到Cl 2活泼性突变,其原因归结为F 原了和厂离了的半径特别小。
F Cl Br I 厂 cr Br _ 厂r/pm 64 99114 133 136 181 195 216 (1)由于F 的原了半径非常小,F —F 原了间的斥力和非键电了对的斥力较大,使 F2的解离能(155KJ/mol)远小于CH 的解离能(240KJ/mol)。
(2)山于F 离了半径特别小,因此在形成化合物时,氟化物的离了键更强,键能或 晶格能更大。
(3) 由于F 离子半径特别小,F"的水合放热比其他卤素离子多。
2. 氧化性顺序为:F2>C12>Bf2>l2 ;还原性顺序为:I->BF>C 「>F. 尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氛卤索单质绘很强的氧化剂,随着原子半径的增大,卤素的氧化能力依次减弱。
尽管在同 族屮氯的电子亲合能最高,但最强的氧化剂却是氟。
一种氧化剂在常温下,在水溶液屮 氧化能力的强弱,可用具标准电极电势值來表示,0&值的大小和下列过程有关(见课本 P524)3. (1)2C12+Ti =TiCl 4 加热, 干燥 (2)3C12+2A1 =2A1C13 加热, 干燥 (3)C12+H 2=2HC1 点燃 (4)3Cb+2P (过量)=2PCb 干燥 5Cb(过量)+2P=2PC15干燥 (5) C12+H 2O=HC1O +HC1(6) C12+2K2C03+H2OKC1+KC10+2KHC034. (1) CC14为非极性溶剂,【2溶在CC14中后仍为分子状态,显示出12单质在蒸气时的紫颜 色。

武汉⼤学版⽆机化学课后习题答案第三版第17章d区元素1 D区元素(1)1.钛的主要矿物是什么?简述从钛铁矿制取钛⽩得反应原理。
解:钛的主要矿物有钛铁矿FeTiO2反应原理:FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2OTiOSO4 + 2H2O =TiO2?H2O↓ + H2SO4TiO2?H2O = TiO2 + H2O2.解释TiCl3和[Ti(O2)OH(H2O)4]+ 有⾊得原因。
解:TiCl3显⾊是因为产⽣了电核跃迁,[Ti(O2)OH(H2O)4]+有⾊是因为O22-离⼦变形性较强,d—d跃迁所引起。
3.完成并配平下列反应⽅程式。
(1)Ti + HF(2)TiO2 + H2SO4(3)TiCl4 + H2O(4)FeTiO3 + H2SO4(5)TiO2 + BaCO3(6)TiO2 + C + Cl2解:(1) Ti + 5HF = H2TiF6 + 2H2↑(2)TiO2 + H2SO4 = TiOSO4 + H2O(3)TiCl4 + 2H2O = TiO2 + 4HCl(4)FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O(5)TiO2+ BaCO3 = BaTiO3 + CO2↑(6)TiO2 + 2C + 2Cl2 = TiCl4+ 2CO↑4.完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯⽓中加热;(3)向含有TiCl得⽔溶液加⼊过量得氨;(4)向VCl3的⽔溶液加⼊过量的氨;(5)将VCl2的固体加到HgCl2⽔溶液中。
解:(1) TiI4 = Ti + 2I2(2) 2FeTiO 3 + 6C + 5Cl 2 = 2FeCl 3 + 2TiCl 4 + 6CO(3) TiCl 62- + NH 3 = [Ti(NH 3)6]4+ + 6Cl -(4) VCl 3 + Na 2SO 3 =(5) VCl 2 + HgCl 2=5. 根据下列实验写出有关的反应⽅程式:将⼀瓶TiCl 4打开瓶塞时⽴即冒⽩烟。

16. 完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→+H+→(5)H2S+ClO-3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2S2O3+Cl2→(9)SO2+H2O+Cl2→(10)H2O2+KMnO4+H+→(11)Na2O2+CO2→(12)KO2+H2O→(13)Fe(OH)2+O2+OH-→→(14)K2S2O8+Mn2++H++NO-3(15)H2SeO3+H2O2→答:(1)H2S+H2O2=S+2H2OH2S+4H2O2(过量)=H2SO4+4H2O(2)H2S+Br2=2HBr+SH2S+4Br2(过量)+4H2O=8HBr+H2SO4(1)H2S+I2=2I-+S+2H+(2)2H2S+O2=2S+2H2O(3)3H2S+ClO3-=3S+Cl-+3H2O(4)2S2-+SO32-+6H+=3S+3H2O(5)2Na2S2O3+I2=Na2S4O6+2NaI(6)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(7)SO2+Cl2+2H2O=H2SO4+2HCl(8)5H2O2+2MnO4-+6H+=2Mn2++5O2+8H2O(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm 3含有O 3的氧气,若其中所含O 3完全分解后,体积增加到52 cm 3。
如将分解前的混合气体通入KI 溶液中,能析出多少克碘?分解前的混合气体中O 3的体积分数是多少?解:5.68mg ,8.1%18.每升含12.41克Na 2S 2O 3·5 H 2O 的溶液35.00 cm 3,恰好使50.00 cm 3的I -3溶液退色,求碘溶液的浓度?解:I 3-+2S 2O 32-=S 4O 62-+3I -1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。

第二十一章过渡金属(II)1.解释下列问题:(1)在Fe3+离子溶液中加入KSCN溶液时出现了血红色,但加入少许铁粉后,血红色立即消失,这是什么道理?(2)为什么Fe3+盐是稳定的?而Ni+3盐尚未制得?(3)为什么不能在水溶液中由Fe3+盐和KI制得FeI3?(4)当Na2CO3溶液作用于FeCl3溶液时,为什么得到的是Fe(OH)3而不是Fe2(CO3)3?(5)变色硅胶含有什么成分?为什么干燥时呈蓝色,吸水后变粉红色?答:(1) Fe3+ + nSCN- = Fe(SCN)n3-nn= 1—6血红色,加入铁粉后,铁粉将 FeⅢ还原,生成的Fe2+不与SCN-生成有色的配合物,因而血红色消失2Fe(SCN)n3-n + Fe = 3Fe2+ + nSCN-(2)铁的外层电子构型为3d64s2,Fe3+的3d5半满电子构型使它比Fe2+的3d6电子构型稳定,镍的外层电子构型为3d84s2,其中3d的电子超过半满状态较难失去,所以一般情况下,镍表现为+2氧化态,在特殊条件下也可以得到不稳定的Ni(III)化合物,如Ni2O3和NiAl。
(3)ϕθ(Fe3+,Fe2+)>ϕθ(I2/I-),在水溶液中Fe3+将I-氧化得不到FeI3:2 Fe3+ + 2 I- = 2Fe2+ + I2(4)Na2CO3在水中发生水解: CO32- + H2O ⇔ HCO3- + OH-溶液中[CO32-]和[OH-]相差不大,而Fe(OH)3的溶解度远小于Fe2(CO3)3,故FeCl3与Na2CO3溶液想遇产生Fe(OH)3沉淀,而不是生成Fe2(CO3)3沉淀。
2Fe3+ + 3CO32- + 6H2O = 2 Fe(OH)3↓ + 3H2CO3(5)变色硅胶中含吸湿指示剂CoCl2,所含结晶水的数目不同,颜色不同。
CoCl2•6H2O ⇔ CoCl2•2 H2O ⇔ CoCl2• H2O ⇔ CoCl2粉红色紫红色蓝紫色蓝色所以无水CoCl2显蓝色,CoCl2结晶水较多时显粉红色。

《⽆机化学》(下)习题答案第1章原⼦结构与元素周期律1-1在⾃然界中氢有三种同位素,氧也有三种同位素,问:总共有多少种含有不同核素的⽔分⼦?由于3H 太少,可忽略不计,问:不计3H 时天然⽔中共有多少种同位素异构⽔分⼦?解:共有18种不同核素的⽔分⼦共有9种不同核素的⽔分⼦1-2.答:出现两个峰1-3⽤质谱仪测得溴的两种天然同位素的相对原⼦质量和同位素丰度分别为 79Br 78.9183 占 50.54%,81Br 80.9163 占49.46%,求溴的相对原⼦质量。
解:1-4铊的天然同位素203Tl和205Tl 的核素质量分别为202.97u 和204.97u ,已知铊的相对原⼦质量为204.39,求铊的同位素丰度。
解:设203Tl 的丰度为X ,205Tl 的丰度为1-X 204.39 = 202.97X + 204.97(1-X) X= 29.00%1-5等质量的银制成氯化银和碘化银,测得质量⽐m (AgCl ):m (AgI )= 1:1.63810,⼜测得银和氯的相对原⼦质量分别为107.868和35.453,求碘的原⼦量。
解: X= 126.911-8为什么有的元素原⼦量的有效数字的位数多达9位,⽽有的元素的原⼦量的有效数字的位数却少⾄3~4位?答:单核素元素只有⼀种同位素,因⽽它们的原⼦量⼗分准确。
⽽多核素元素原⼦量的准确性与它们同位素丰度的测量准确性有关(样品的来源、性质以及取样⽅式⽅法等)。
若同位素丰度涨落很⼤的元素,原⼦量就不可能取得很准确的数据。
1-13.解:(1)r=c /λ=(3×108)/(633×10-9) = 4.74×1014 Hz 氦-氖激发是红光(2)r=c/λ=(3.0×108)/(435.8×10-9) = 6.88×1014 Hz 汞灯发蓝光18)33(313131323=+=+c c c c 9)21(313121322=+?=?+?c c c c 91.79%46.499163.80%54.509183.78)Br (=?+?=Ar X 107.86835.453107.86863810.11)AgI ()AgCl (++==m m(3)r=c/λ=(3.0×108)/(670.8×10-9) = 4.47×1014 Hz 锂是紫红1-14 Br 2分⼦分解为Br 原⼦需要的最低解离能为190kJ.mol -1,求引起溴分⼦解离需要吸收的最低能量⼦的波长与频率。
第十章 P333作业参考答案思考题1、(4)极化力与极化率极化力:描述阳离子对阴离子变形的影响能力。
极化率:描述离子(主要指阴离子)本身变形性的大小。
13、离子的极化力、变形性与离子电荷、半径、电子层结构有何关系?离子极化对晶体结构和性质有何影响?举例说明。
答:(1)离子极化力的影响因素:阳离子的正电荷越高半径越小极化力越大;当阳离子的电荷相同和半径相近时,阳离子极化力大小与其最外电子层结构关系是18e-、18+2 e->9~17 e->8 e-。
(2)离子变形性的影响因素:阴离子半径愈大、变形性愈大;阳离子变形性与它最外层电子构型有关:18e-、18+2 e->9~17 e->8 e-。
(3) 离子极化结果:使离子键向共价键过渡、阴阳离子间的配位数减小、溶解度减小、熔点降低、颜色加深。
14、试用离子极化的概念讨论,Cu+与Na+半径相近,但CuCl在水中的溶解度比NaCl小得多的原因。
答:Cu+最外层电子结构是18e-而Na+是8e-。
Cu+的极化力大于Na+, CuCl中的离子键向共价键过渡、使离子键减弱,所以CuCl在水中的溶解度小于NaCl。
17、形成氢键具备的条件是:元素的电负性大、原子半径小、有孤对电子(F、O、N三种元素具备条件)。
习题:1、填充下表物质晶体中微粒名称微粒间作用力晶体类型熔点℃KICrBN立方BBr3K+ I-Cr原子和离子B原子 N原子BBr3分子离子键金属键共价键分子间力离子晶体金属晶体原子晶体分子晶体88019073300-467、下列物质中,何者熔点最低?NaCl KBr KCl MgO 答:KBr熔点最低(因为阴阳离子的半径均大,晶格能小)8、熔点由高到低:(1)从NaF到NaI熔点降低。
9、下列离子的最外层电子构型属于哪种类型?Ba2+8 e- Cr3+9~17 e- Cd2+ 18 e- Pb2+ 18+2 e- S区 d区 ds区 p区10*、I-的半径最大、极化率最大。
第十二章卤素1.卤素中哪些元素最活泼?为什么有氟至氯活泼性变化有一个突变?答:单质的活泼性次序为:F2>>Cl2>Br2>I2从F2到Cl2活泼性突变,其原因归结为F原子和F—离子的半径特别小。
F Cl Br I F—Cl—Br—I—r/pm 64 99 114 133 136 181 195 216(1)由于F的原子半径非常小,F—F原子间的斥力和非键电子对的斥力较大,使F2的解离能(155KJ/mol)远小于Cl2的解离能(240KJ/mol)。
(2)由于F-离子半径特别小,因此在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
由于F-离子半径特别小,F-的水合放热比其他卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-还原性递变规律,并说明原因。
答:氧化性顺序为:F2 >Cl2 >Br2>I2 ;还原性顺序为:I- >Br->Cl->F-.尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氟卤素单质是很强的氧化剂,随着原子半径的增大,卤素的氧化能力依次减弱。
尽管在同族中氯的电子亲合能最高,但最强的氧化剂却是氟。
一种氧化剂在常温下,在水溶液中氧化能ϕ值的大小和下列过程有关(见课本P524)力的强弱,可用其标准电极电势值来表示,θ3.写出氯气与钛、铝、氢、水和碳酸钾作用的反应式,并注明必要的反应条件。
答:(1)2Cl2+Ti =TiCl4加热,干燥(2)3Cl2+2Al =2AlCl3 加热,干燥(3)Cl2+H2 =2HCl 点燃(4)3Cl2+2P(过量)=2PCl3 干燥5Cl2(过量)+2P=2PCl5干燥(5)Cl2+H2O=HClO +HCl(6) Cl2+2K2CO3+H2O=KCl+KClO+2KHCO34.试解释下列现象:(1)I2溶解在CCl4中得到紫色溶液,而I2在乙醚中却是红棕色。
(2)I2难溶于水却易溶于KI中。
1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
第十七章碱金属和碱土金属
1.试根据碱金属和碱土金属元素的电子层构型说明它们化学活泼性的递变规律。
答:碱金属元素的价层结构为ns1,自上而下,随着原子序数的增加,半径增大,第一电离势减小,电负性变小,金属的活泼性依次增强。
2.试比较锂和钾;锂和镁的化学性质有哪些相似点和区别。
答:锂和钾的相似性:都是活泼金属。
不同点更多:
在空气中加热的产物MOH M2CO3MNO3受热MOH受热
锂:Li3N,Li2O 溶解性差热稳定性差Li2O,NO2,O2Li2O
钾:KO2 易溶稳定KNO2,O2不分解锂与镁有对角线相似性:
锂镁
在O2中加热:Li2O MgO
氢氧化物受热:Li2O MgO
碳酸盐受热:Li2O+CO2MgO+CO2
难溶于水的盐:LiF,Li2CO3,Li3PO4 MgF2,MgCO3,Mg3(PO4)2
硝酸盐受热:Li2O,NO2,O2 MgO,NO2,O2
镁的水合氯化物受热生成碱式盐。
区别:锂与冷水反应,但渐慢(因为生成溶解性差的LiOH);镁与冷水不反应。
3.金属钠是强还原剂,试写出它与下列物质的反应方程式:
H2O,NH3,C2H5OH,Na2O2,NaOH2,NaNO2,MgO,TiCl4
答:2Na + 2H2O =2NaOH + H2↑
2Na + 2NH3 = 2NaNH2 + H2↑
2Na + 2C2H5OH = 2NaOC2H5 + H2↑
2Na + Na2O2 = 2Na2O
NaH催化
无水,450℃
2Na + 2NaNO2(s) 4Na2O + N
2Na + MgO = Mg + Na2O
2Na + TiCl
4 = Ti +4NaCl
4.写出过氧化钠和下列物质的反应式:
NaCrO 2,CO 2,H 2O ,H 2SO 4
答:2NaCrO 2
+3Na 2O 2 +2H 2O = 2Na 2CrO 4 + 4NaOH
3Na 2O 2 +2CO 2 = 2Na 2CO 3 +3O 2
Na 2O 2 + H 2O H 2O 2 + 2NaOH 冷2Na 2O 2 + 2H 2O 4NaOH +O
Na 2O 2 + H 2SO 4
冷Na 2SO 4 + H 2O 2 5.写出氢氧化钠和氢氧化钙的主要化学性质和用途。
答:氢氧化钠主要的化学性质是强碱性,主要用作工业原料:①分解矿样:硅酸盐等矿样的分解;②用于造纸业:分解纤维,造纸浆;③制造玻璃;④生产肥皂;⑤用于石油工业等。
氢氧化钙的突出性质有较强的碱性,溶解性差。
主要用于工业方面:①制悬浮液即石灰乳来生产漂白粉;②调节溶液的pH 值来分离某些物质;③用于建筑材料;④用于树干杀虫。
6.写出以食盐为原料制备金属钠、氢氧化钠、过氧化钠、碳酸钠的过程,并写出它们的化学反应方程式。
答: O H CO Na CO NaOH O Na O Na Cl H NaOH O H NaCl Cl Na NaCl 23222
2222222222222+→+−−→−+↑
+↑+−−→−+↑
+−−→−点燃电解电解
2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2↑
7.碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明原因。
答:碱土金属有2个价电子,金属键强,所以熔点、硬度均比ⅠA 金属的高。
8.钙在空气中燃烧所得的产物与水反应时放出大量的热,并能嗅到氨的气味。
试以化学反应方程式表示这些反应。
答: 3Ca+N 2=Ca 3N 2; Ca 3N 2 + 6H 2O = 3Ca(OH)2 + 2NH 3↑
9.为什么元素铍与其它非金属成键时,化学键带有较大的共价性,而其它碱土元素与非金属所成的键则带有较大的离子性?
答:铍与锂的半径小,铍的第Ⅰ、Ⅱ电离势高,形成的化合物有较大的共价性,而ⅡA 的其它金属半径渐大,电离能渐小,与非金属形成的化合物离子性强。
如氯化物、硫化物等。
Be 的电负性较大(1.57),Be 2+的半径较小(约31pm ),使其极化能力很强,所以BeCl 2中Be-Cl 键以共价性为主,BeCl 2为共价化合物。
而其他碱土金属的电负性较小但离子半径却比Be 2+大的多,MgCl 2,CaCl 2中的键以离子性为主,化合物为离子化合物。
10.利用镁和铍的性质上的哪些差别可以区分和分离Be(OH)2和Mg(OH)2;BeCO 3和MgCO 3;BeF 2和MgF 2?
答:Be(OH)2有两性,而Mg(OH)2只有碱性,当与过量强碱如NaOH 反应时Be(OH)2溶解而Mg(OH)2不溶:
Be(OH)2 + 2NaOH(过量) = Na 2BeO 2 + 2H 2O
Be(OH)2 + NaOH = NaHBeO 2 + H 2O
BeCO 3有较低的分解温度(100℃),而MgCO 3分解温度较高(540℃),可将它们区别开来。
另外,BeCO 3与(NH 4)2CO 3作用可形成可溶性的(NH 4)2[Be 4O(CO 3)6],而MgCO 3则不具这种性质。
BeF 2易溶于水,而MgF 2微溶于水;或BeF 2易形成-24BeF ,而MgF 2则不能,可将它们分开。
11.写出以重晶石为原料制备BaCl 2,BaCO 3,BaO ,BaO 2的过程。
答: BaSO 4 + 4C == BaS + 4CO
BaSO 4 + 4CO == BaS + 4CO 2
BaS + 4H 2O == Ba(HS)2 + 4Ba(OH)2
Ba(HS)2 + CO 2 + H 2O == BaCO 3↓ + 2H 2S
BaCO 3 + 2HCl == BaCl 2 + CO 2 + H 2O
BaCO 3 △ BaO + CO 2
BaO + O 2 点燃
BaO 2
12.写出往BaCl 2和CaCl 2的水溶液里分别加入碳酸铵,接着加入醋酸、再加入铬酸钾的反应式。
答:BaCl 2 + (NH 4)2CO 3 = BaCO 3↓+ 2NH 4Cl
CaCl 2 + (NH 4)2CO 3 = CaCO 3↓+ 2NH 4Cl
BaCO 3 + 2H + = Ba 2+ + CO 2↑+ H 2O
)
(BaCrO CrO Ba 42
42黄↓=+-+
CaCO 3 + 2H + = Ca 2+ +CO 2↑+ H 2O
Ca 2+与-24CrO 不生成沉淀(Ac -
妨碍CaCrO 4↓,有NH 3·H 2O 或Ca 2+很浓时与-2
4CrO 有沉淀。
)
13.设用两种途径得到NaCl(s)。
用盖斯定律分别求)s (NaCl H o m f ∆,
并作比较。
(温度298K ) (1) Na(s) + H 2O(l) → NaOH(s) + 2
1H 2(g) 1o m r mol ·kJ 89.140H --=∆ )g (H C l )g (Cl 2
1)g (H 2122→+ 1o m r m o l ·kJ 31.92H --=∆ HCl(g) + NaOH(s) → NaCl(s) +H 2O(l) 1o m r mol ·kJ 80.177
H --=∆ (2) )g (HCl )g (Cl 2
1)g (H 2122→+ 1o m r mol ·kJ 31.92H --=∆ )g (H 21)s (N a C l )g (H C l )s (Na 2+→+
1o m r m o l ·kJ 69.318
H --=∆ 答:(1)①+②+③得:
)s (N a C l )g (Cl 2
1)s (Na 2=+
H 0m(NaCl,s)=f r 1H 0m r 3H 0
m ++r 2H 0m =(-140.89)+(-92.31)+(-177.80)=-411(kJ·mol -1)
(2)①+②得: )s (N a C l )g (Cl 2
1)s (Na 2=+ )m o l ·kJ (410)69.318()31.92
(H 10)s ,N aCl (m f --=-+-=∆。