《碳及其重要化合物转化关系》方程式的书写
- 格式:doc
- 大小:40.00 KB
- 文档页数:1

九年级化学下册《第十单元酸与碱》单元测试卷(带答案)一、单选题1.价类图是学习物质性质的一种重要工具,如图是碳及其化合物之间的价类转化关系。
下列说法错误的是A.A点可表示多种不同的单质B.A→B→C都只能通过与O2的反应来实现C.C→D的反应类型为化合反应D.E可由C与碱溶液反应制得2.下列有关实验现象的描述中,正确的是()A.打开盛有浓盐酸的试剂瓶,在瓶口观察到白烟B.硫在氧气中燃烧,发出蓝紫色火焰C.细铁丝在空气中燃烧,火星四射,生成黑色固体D.镁条在空气中燃烧发出耀眼的白光,生成氧化镁3.下列描述属于氢氧化钙化学性质的是()A.白色固体B.微溶于水C.溶液有滑腻感D.能与CO2反应4.下列实验现象描述正确的是A.打开盛有浓盐酸的试剂瓶的瓶盖,瓶口出现白烟B.铁与稀盐酸反应,溶液由无色变成浅绿色C.硫在空气中燃烧发出明亮的蓝紫色火焰D.木炭还原氧化铜,生成红色的铜5.下列说法正确的是A.KNO3 20℃时的溶解度大于80℃时溶解度B.氯化钠溶液能够导电是因为溶液中存在自由移动的阴、阳离子C.加热KClO3时,用MnO2作催化剂,能提高氧气的产量D.相同条件下,NaCl溶于水时溶液温度高于NaOH溶于水时溶液温度6.区分下列各组物质,所加试剂或操作方法都正确的是选项需区分的物质方法一方法二A烧碱和熟石灰滴加稀盐酸,观察是否产生气泡溶于水观察溶解性B黄金和黄铜灼烧后观察颜色加入稀盐酸C氧气和氢气通入紫色石蕊试液通过灼热的氧化铜D 食盐水和稀硫酸闻气味滴加硝酸银溶液A.A B.B C.C D.D7.下列有关图中实验的相关判断错误的是A.T1<T2B.固体X可能是CaOC.锥形瓶℃中的溶液为不饱和石灰水D.锥形瓶℃和℃中Ca(OH)2的质量分数相等8.下列对于实验现象的描述正确的是A.红磷在氧气中燃烧产生大量的白雾并发出蓝光B.氧化铜与盐酸反应,溶液颜色变为蓝绿色,加水后,逐渐变为蓝色C.电解水时正负极产生气体体积比是2℃1D.硫在氧气中燃烧产生淡蓝色火焰9.下列实验方法不能达到实验目的的是A.用盐酸清洗水壶中的水垢B.用肥皂水区别硬水和软水C.往饱和石灰水中通入少量二氧化碳,使溶液变成不饱和石灰水D.一氧化碳还原氧化铁的实验中,将尾气通入氢氧化钠溶液,清除剩余的一氧化碳10.硫酸是一种重要的化工原料,下列说法正确的是A.浓硫酸可作所有气体的干燥剂B.稀硫酸不可用于金属表面除锈C.浓硫酸有脱水性,可使木材、纸张炭化D .实验室可用块状石灰石与稀硫酸制备CO 211.下列除杂试剂正确的是A .用过量的2O 除去2CO 中COB .用过量的4FeSO 溶液除去Zn 中FeC .用过量的NaOH 除去2CaCl 溶液中HClD .用过量的HCl 溶液除去Cu 中CuO二、填空题12.氢氧化钠(化学式:__)因有强烈的腐蚀性,故俗称为__、__或__,白色固体,__溶于水,且放出大量的热,暴露在空气中容易吸收水分发生潮解;可用于干燥中性或碱性气体(如O 2、H 2、NH 3等),但不能干燥酸性气体(如__、__、__等)。

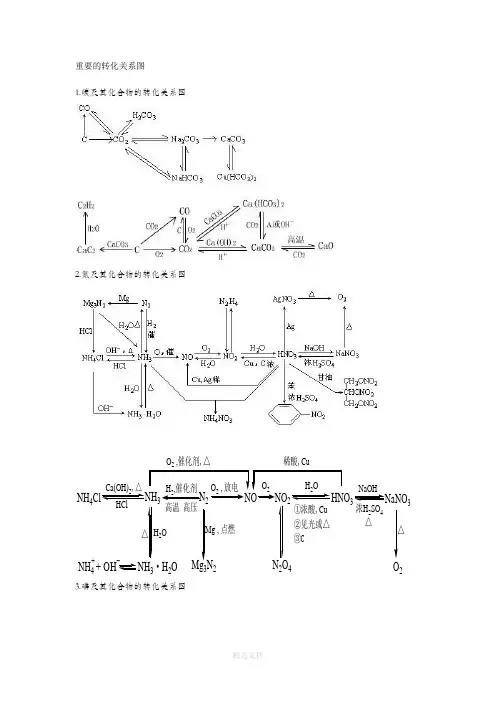
重要的转化关系图1.碳及其化合物的转化关系图2.氮及其化合物的转化关系图NH 4N 324Mg 3N 23·H 2ONH 4+ OH -+Ca(OH)2,△HClH 2,催化剂高温 高压O 2 , 放电O 2H 2O NaOH O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O△△O 2 ,催化剂,3.磷及其化合物的转化关系图4.铁及其化合物的转化关系图5.镁及其化合物的转化关系图6氯及其化合物的转化关系图Cl 2CuCl 2PCl 3、PCl HClO O 2Ca(ClO)2①C O 2+H 2O②C l P ,点燃2点燃NaClNaOH H 2S O 4(浓)△MnO 2、△N a , △①电解熔融盐②电解食盐水H 2O光照A gN O3Ag N O 3Ca(OH)27硫及其化合物的转化关系图H 2SSSO 2SO 3Na 2SO 4FeS FeS 2Na 2SO 3H 2SO 3H 2SO 4BaSO 4HClH 2,△O 2,燃烧H 2SO 2,燃烧①加热分解②不完全燃烧O 2,催化剂,△NaOHNaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△8硅及其化合物的转化关系图[此文档可自行编辑修改,如有侵权请告知删除,感谢您的支持,我们会努力把内容做得更好]。

碳及其化合物化学方程式的书写1 碳在氧气中燃烧:方程式:(氧气足量)(氧气不足)2 碳和水蒸气反应制备水煤气3 CO2与水4 CO2通入到过量的氢氧化钠溶液化学方程式:。
离子方程式:________________________________________5 用澄清的石灰水检验二氧化碳化学方程式:。
离子方程式:________________________________________6 把二氧化碳通入到碳酸钠溶液中化学方程式:。
离子方程式:________________________________________7实验室制备二氧化碳的原理化学方程式:。
离子方程式:________________________________________8 把碳酸钠溶液滴加到盐酸溶液中制备碱化学方程式:。
离子方程式:________________________________________9把盐酸滴到碳酸钠溶液中化学方程式:。
离子方程式:________________________________________10 碳酸钠与氢氧化钙溶液的反应化学方程式:。
离子方程式:________________________________________11 碳酸氢钠与盐酸的反应化学方程式:。
离子方程式:________________________________________12 碳酸氢钠溶液与氢氧化钠溶液反应化学方程式:。
离子方程式:________________________________________13 把碳酸氢钠溶液滴加到氢氧化钙溶液中化学方程式:。
离子方程式:________________________________________14 把氢氧化钙溶液滴加到碳酸氢钠溶液中化学方程式:。
离子方程式:________________________________________15 用氯化钡溶液区分碳酸氢钠溶液与碳酸钠溶液化学方程式:。

碳及碳的化合物间的所有化学方程式1碳在氧气中充分燃烧:C + O2点燃CO22碳在氧气中不充分燃烧:2C + O2点燃2CO3一氧化碳在氧气中燃烧:2CO + O2点燃2CO24甲烷在空气中燃烧:CH4+ 2O2 点燃CO2+ 2H2O5酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2+ 3H2O6碳酸不稳定而分解:H2CO3=== H2O + CO2↑7高温煅烧石灰石:CaCO3高温CaO + CO2↑8木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑9焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑10焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑11一氧化碳还原氧化铜:CO+ CuO △Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO212一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO213苛性钠暴露在空气中变质:2NaOH + CO2==== Na2CO3+ H2O14大理石与稀盐酸反应:CaCO3+ 2HCl ===CaCl2+ H2O + CO2↑15碳酸钠与稀盐酸反应: Na2CO3+ 2HCl===2NaCl + H2O + CO2↑16碳酸镁与稀盐酸反应: MgCO3+ 2HCl ===MgCl2+ H2O + CO2↑17消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O18硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑19二氧化碳溶解于水:CO2 + H2O === H2CO3文案编辑词条B 添加义项?文案,原指放书的桌子,后来指在桌子上写字的人。
现在指的是公司或企业中从事文字工作的职位,就是以文字来表现已经制定的创意策略。
文案它不同于设计师用画面或其他手段的表现手法,它是一个与广告创意先后相继的表现的过程、发展的过程、深化的过程,多存在于广告公司,企业宣传,新闻策划等。
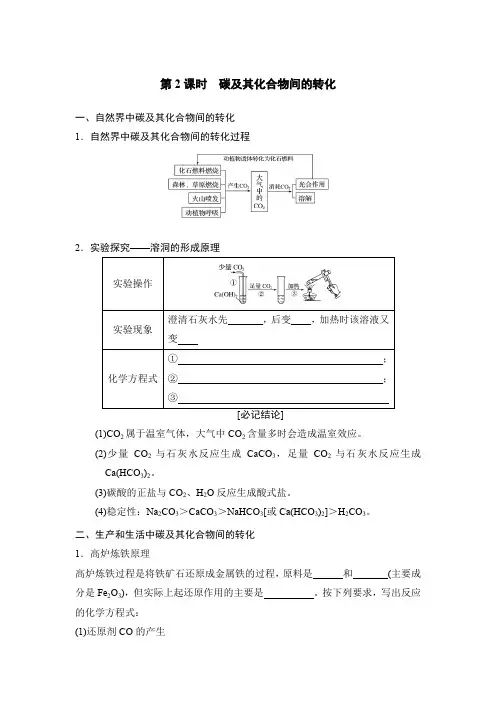
第2课时 碳及其化合物间的转化一、自然界中碳及其化合物间的转化 1.自然界中碳及其化合物间的转化过程2.实验探究——溶洞的形成原理(1)CO 2属于温室气体,大气中CO 2含量多时会造成温室效应。
(2)少量CO 2与石灰水反应生成CaCO 3,足量CO 2与石灰水反应生成Ca(HCO 3)2。
(3)碳酸的正盐与CO 2、H 2O 反应生成酸式盐。
(4)稳定性:Na 2CO 3>CaCO 3>NaHCO 3[或Ca(HCO 3)2]>H 2CO 3。
二、生产和生活中碳及其化合物间的转化 1.高炉炼铁原理高炉炼铁过程是将铁矿石还原成金属铁的过程,原料是 和 (主要成分是Fe 2O 3),但实际上起还原作用的主要是 。
按下列要求,写出反应的化学方程式: (1)还原剂CO 的产生① ; ② 。
(2)CO 还原氧化铁,生成铁 3Fe 2O 3+CO=====高温2Fe 3O 4+CO 2② ③ 2.碳及其化合物之间的转化碳及其化合物间的转化有的属于单质、氧化物和盐之间的转化,有的属于盐与盐、氧化物与氧化物之间的转化,其转化关系为 具体转化的过程如图:写出各步反应的化学方程式:3.我们使用的自来水中往往含有碳酸氢钙和碳酸氢镁,因此水壶、传送热水的管道内壁常常积有水垢。
由此你推测水垢中一定含有哪种物质?它是怎样形成的?如何除去水壶中的水垢?写出相关的化学方程式。
(1)成分: 、Mg(OH)2。
(2)形成过程反应的化学方程式:① 。
②Mg(HCO 3)2=====△MgCO 3↓+H 2O +CO 2↑, MgCO 3+H 2O =====△Mg(OH)2+CO 2↑。
4.碳在无机物和有机物间也可转化。
1828年,德国化学家维勒用无机化合物氰酸铵(NH 4CNO)首次合成了有机化合物 ,开创了以含碳无机化合物合成有机化合物的先河。
[必记结论](1)C 、CO 一般表现还原性,CO 2只有氧化性。
(2)CO 2具有酸性氧化物通性:与水反应生成碳酸;与碱反应生成碳酸盐和水。

碳及其化合物的化学方程式和离子方程式总结(注:带*的不要求记住,但要求能理解)一、碳1、碳在少量的氧气中燃烧:2C+O22CO2、碳在足量的氧气中燃烧:C+O2CO2*3、碳和硫蒸气高温反应:C+2S CS24、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑6、碳和水蒸气高温反应:C+H2O(g)CO+H27、碳和二氧化碳在高温下反应:C+CO22CO8、碳与浓硫酸共热:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O9、碳与浓硝酸共热:C+4HNO3(浓)CO2↑+4NO2↑+2H2O10、工业上制备粗硅:SiO2+2C Si+2CO↑*11、工业上制备金刚砂:SiO2+3C SiC+2CO↑*12、工业上制备碳化钙:CaO+3C CaC2+CO↑二、一氧化碳1、一氧化碳在氧气中燃烧:2CO+O22CO22、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO23、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO24、一氧化碳和水蒸气反应:CO+H2O(g)CO2+H2三、二氧化碳1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C2、碳和二氧化碳在高温下反应:C+CO22CO3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO34、氧化钙与二氧化碳反应:CaO+CO2CaCO35、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑6、二氧化碳和水反应:CO2+H2O H2CO37、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、工业上生产碳酸氢铵:NH3+CO2+H2O NH4HCO310、向澄清石灰水中通入少量二氧化碳:Ca(OH)2+CO2CaCO3↓+H2OCa2++2OH-+CO2CaCO3↓+H2O11、向澄清石灰水中通入足量二氧化碳:Ca(OH)2+CO2Ca(HCO3)2OH-+CO2 HCO3-12、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-*13、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓14、向四羟基合铝酸钠溶液中通入少量二氧化碳气体:2Na[Al(OH)4]+CO22Al(OH)3↓+Na2CO3+H2O2[Al(OH)4]-+CO2+3H2O2Al(OH)3↓+CO32-+H2O15、向四羟基合铝酸钠溶液通入足量二氧化碳气体:Na[Al(OH)4]+CO2Al(OH)3↓+NaHCO3[Al(OH)4]-+CO2Al(OH)3↓+HCO3-16、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓17、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓18、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-19、向苯酚钠溶液中通入少量二氧化碳气体:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-20、向次氯酸钠溶液中通入少量二氧化碳气体:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-21、向次氯酸钙溶液中通入少量二氧化碳:Ca(ClO)2+CO2+H2O CaCO3↓+2HClOCa2++2ClO-+CO2+H2O CaCO3↓+2HClO 22、向次氯酸钙溶液中通入足量二氧化碳:Ca(ClO)2+2CO2+2H2O Ca(HCO3)2+2HClOClO-+CO2+H2O HCO3-+HClO四、碳酸钙1、碳酸钙溶于稀盐酸:CaCO3+2HCl CaCl2+CO2↑+H2OCaCO3+2H+Ca2++CO2↑+H2O2、碳酸钙溶于醋酸:CaCO3+2CH3COOH(CH3COO)2Ca+CO2↑+2H2OCaCO3+2CH3COOH2CH3COO-+Ca2++CO2↑+H2O*3、碳酸钙溶于氯化铁溶液:3CaCO3+2FeCl3+3H2O2Fe(OH)3+3CaCl2+3CO2↑3CaCO3+2Fe3++3H2O2Fe(OH)3+3CO2↑+3Ca2+4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑5、高温分解碳酸钙:CaCO3CaO+CO2↑6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-五、碳酸氢钙1、碳酸氢钙与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2OHCO3-+H+CO2↑+H2O2、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O3、向碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O 4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2OCa2++HCO3-+OH-CaCO3↓+H2O5、加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O6、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓六、碳酸钠1、向碳酸钠溶液中逐滴加入稀盐酸至过量:Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O总式:Na2CO3+2HCl2NaCl+CO2↑+H2O 离:CO32-+2H+CO2↑+H2O2、碳酸钠溶液与氢氧化钙溶液反应:Na2CO3+Ca(OH)22NaOH+CaCO3↓Ca2++CO32-CaCO3↓3、碳酸钠溶液与氯化钙溶液反应:Na2CO3+CaCl22NaCl+CaCO3↓Ca2++CO32-CaCO3↓七、碳酸氢钠1、向碳酸氢钠溶液中加入稀盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O2、碳酸氢钠溶液与少量氢氧化钙溶液反应:Ca(OH)2+2NaHCO3CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O 3、碳酸氢钠溶液与足量氢氧化钙溶液反应:Ca(OH)2+NaHCO3 CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O4、碳酸氢钠溶液与氢氧化钠溶液反应:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH- CO32-+H2O5、加热碳酸氢钠:2NaHCO3Na2CO3+CO2↑+H2O。
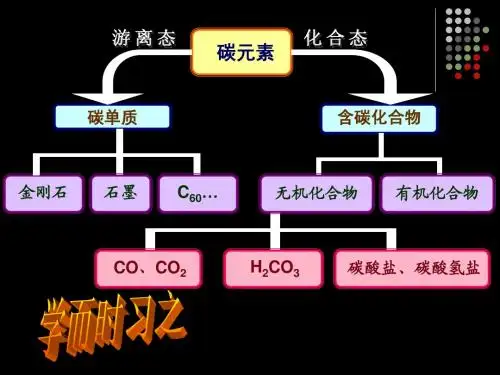


1碳在氧气中充分燃烧:C + O2点燃 CO2
2碳在氧气中不充分燃烧:2C + O2点燃 2CO
3一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2
4甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
5酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
6碳酸不稳定而分解:H2CO3 === H2O + CO2↑
7高温煅烧石灰石:CaCO3高温 CaO + CO2↑
8木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
9焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑
10焦炭还原四氧化三铁:2C+ Fe3O4高温 3Fe + 2CO2↑
11一氧化碳还原氧化铜:CO+ CuO △ Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温 2F
e + 3CO2
12一氧化碳还原四氧化三铁:4CO+ Fe3O4高温 3Fe + 4CO2
13苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
14大理石与稀盐酸反应:CaCO3 + 2HCl ===CaCl2 + H2O + CO2↑
15碳酸钠与稀盐酸反应: Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
16碳酸镁与稀盐酸反应: MgCO3 + 2HCl ===MgCl2 + H2O + CO2↑
17消石灰放在空气中变质:Ca(OH) 2 + CO2 ==== CaCO3↓+ H2O
18硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
19二氧化碳溶解于水:CO2 + H2O === H2CO3。
第2课时物质的转化(见学生用书P91)[A级新教材落实与巩固]1.纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。
下列文物修复和保护的过程中涉及化学变化的是( A )A. B. C. D.银器用除锈剂除锈变形的金属香炉复原古画水洗除尘木器表面擦拭烫蜡【解析】银器用除锈剂除锈过程中有新物质生成,属于化学变化,A项正确;变形的金属香炉复原主要原理是通过施加外力使器物恢复原状,未涉及化学变化,B项错误;古画水洗除尘是用水洗掉尘土,该过程未涉及化学变化,C项错误;木器表面擦拭烫蜡没有新物质生成,该过程未涉及化学变化,D项错误。
2.下列选项中的诗句内容不涉及化学变化的是( B )A.爆竹声中一岁除,春风送暖入屠苏B.美人首饰侯王印,尽是沙中浪底来C.千锤万凿出深山,烈火焚烧若等闲D.春蚕到死丝方尽,蜡炬成灰泪始干【解析】燃放烟花爆竹过程中会生成CO2等新物质,属于化学变化,A项错误;“美人首饰侯王印,尽是沙中浪底来”主要描述的是从河水泥沙中淘金的过程,该过程没有新物质生成,属于物理变化,B项正确;“烈火焚烧”指的是烧炼石灰石的过程,该过程有新物质生成,属于化学变化,C项错误;蜡烛燃烧时有CO2等新物质生成,属于化学变化,D项错误。
3.KOH是我国古代纺织业常用于漂洗的洗涤剂。
古代制取KOH的流程如图所示:草木灰(K2CO3)贝壳(CaCO 3)――→煅烧生石灰(CaO)―→KOH水上述流程中没有涉及的化学反应类型是( C )A .化合反应B .分解反应C .置换反应D .复分解反应【解析】该过程中发生的反应依次是CaCO 3=====△CaO +CO 2↑(分解反应);CaO +H 2O===Ca(OH)2(化合反应);Ca(OH)2+K 2CO 3===CaCO 3↓+2KOH(复分解反应)。
4.下列物质可直接与其他物质反应生成盐的有( D )①金属 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸A .①②③B.①④⑥C .②⑤⑥D.全部【解析】金属与酸反应可生成盐,如Fe 、Zn 等与稀硫酸反应生成硫酸盐,故①⑥正确;碱性氧化物与酸或酸性氧化物反应可生成盐,如Na 2O 与H 2SO 4反应生成Na 2SO 4,Na 2O 与CO 2反应生成Na 2CO 3,故②⑤⑥正确;碱与酸或酸性氧化物反应可生成盐,如NaOH 与HCl 反应生成NaCl,NaOH 与CO 2反应可生成Na 2CO 3,故③⑤⑥正确;非金属单质与金属反应可生成盐,如Fe 与Cl 2反应生成FeCl 3,故①④正确。
c转化为co的化学方程式
化学方程式为,2C + O2 → 2CO.
标题,C转化为CO的化学方程式解析。
文章内容,在化学反应中,碳(C)可以与氧气(O2)发生反应,生成一种新的化合物一氧化碳(CO)。
这个反应的化学方程式可以
表示为2C + O2 → 2CO。
这个方程式告诉我们,两个碳原子与一个
氧气分子反应,最终生成两个一氧化碳分子。
这个反应在工业生产
中有着重要的应用,例如在一氧化碳的生产过程中。
同时,这也是
一种重要的燃烧反应,例如在燃烧过程中碳会与氧气反应生成一氧
化碳。
通过理解这个化学方程式,我们可以更深入地了解碳与氧气
之间的化学反应过程,以及其在生产和环境中的重要性。