-北京高考电化学专题汇编
- 格式:doc
- 大小:1.03 MB
- 文档页数:9

19-18年北京电化学试题汇编19年丰台二模:19年丰台一模:19年朝阳二模:19年朝阳二模:28.(15分)某小组探究Na 2SO 3溶液和KIO 3溶液的反应。
实验I :向某浓度的KIO 3酸性溶液(过量)中加入Na 2SO 3溶液(含淀粉),一段时间(t 秒)后,溶液突然变蓝。
资料:IO 3-在酸性溶液氧化I -,反应为IO 3-+5I -+6H +=3I 2+3H 2O (1)溶液变蓝,说明Na 2SO 3具有性。
(2)针对t 秒前溶液未变蓝,小组做出如下假设:i .t 秒前未生成I 2,是由于反应的活化能(填“大”或“小”),反应速率慢导致的。
ii .t 秒前生成了I 2,但由于存在Na 2SO 3,(用离子方程式表示),I 2被消耗。
(3)下述实验证实了假设ii 合理。
实验II :向实验I 的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na 2SO 3溶液和KIO 3溶液反应的过程,装置如下。
实验III :K 闭合后,电流表的指针偏转情况记录如下表:表盘时间/min 0~t 1t 2~t 3t 4偏转位置右偏至Y指针回到“0”处,又返至“X”处;如此周期性往复多次……指针归零①K 闭合后,取b 极区溶液加入盐酸酸化的BaCl 2溶液,现象是。
②0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。
判断IO3-在a极放电的产物是。
③结合反应解释t2~t3时指针回到“0”处的原因:。
(5)综合实验I、II、III,下列说法正确的是。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化B.对比实验I、III,t秒前IO3-未发生反应C.实验III中指针返回X处的原因,可能是I2氧化SO32-19北京海淀一模:19房山二模:19顺义二模:19门头沟一模19西城一模(5)利用铁的不同价态的转化设计电池:。
电池所涉及的能量变化如下图所示。


原电池、电解池专题知识梳理教学重、难点作业完成情况典题探究例例1.次磷酸(H3PO2)是一元弱酸,工业可用下图所示装置电解NaH2PO2制H3PO2。
(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是A.阳极室有H2生成B.阴极室溶液pH减小C.原料室溶液pH保持不变D.阳极室可能有H3PO4生成例2.(15分)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20o C)AgCl:1.5×10-4 g Ag2SO4:0.796 g(1)甲同学的实验如下:序号操作现象实验Ⅰ将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中产生白色沉淀,随后有黑色固体产生取上层清液,滴加KSCN溶液溶液变红注:经检验黑色固体为Ag①白色沉淀的化学式是。
②甲同学得出Ag+氧化了Fe2+的依据是。
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。
偏移的方向表明:电子由石墨经导线流向银。
放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是。
②b中电压表指针逆向偏移后,银为极(填“正”或“负”)。
③由实验得出Ag+和Fe2+反应的离子方程式是。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:序号操作现象实验Ⅲ将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中银镜消失实验Ⅳ将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中银镜减少,未消失实验Ⅴ将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中银镜消失①实验Ⅲ(填“能”或“不能”)证明Fe3+氧化了Ag,理由是。
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:。

第四章电化学基础【学习目标】原电池电解池电极名称_____极(电子流出)__________反应_____极(电子流入)__________反应_____极(与电源负极相连)__________反应_____极(与电源正极相连)__________反应电极反应(以铜锌原电池为例)正极:__________________________负极:__________________________总反应:________________________ (以电解氯化铜溶液为例)阴极:_______________________________ 阳极:_______________________________ 总反应:_____________________________电子移动方向能量转化__________能转化为_________能__________能转化为_________能2、化学电池(1)一次电池:常见的有碱性锌锰电池、锌银电池、锂电池等。
写出碱性锌锰电池的电极反应:负极:________________________________________________________正极:________________________________________________________总反应:______________________________________________________(2)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
写出铅蓄电池放电的电极反应:负极:________________________________________________________正极:________________________________________________________总反应:______________________________________________________(3)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池。

11.光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。
下列说法不正确的是(西一)A.该装置将光能转化为化学能并分解水B.双极性膜可控制其两侧溶液分别为酸性和碱性C.光照过程中阳极区溶液中的n(OH-)基本不变D.再生池中的反应:2V2++2H2O ==== 2V3++2OH-+H2↑12.如图所示装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),a、b为多孔石墨电极。
闭合S1一段时间后,a附近溶液逐渐变红;断开S1,闭合S2,电流表指针发生偏转。
下列分析不.正确..的是(东一)A.闭合S1时,a附近的红色逐渐向下扩散B.闭合S1时,a附近液面比b附近的低C.断开S1、闭合S2时,b附近黄绿色变浅D.断开S1、闭合S2时,a上发生反应:H2 ˗ 2e- = 2H+10.疫情期间某同学尝试在家自制含氯消毒剂。
用两根铅笔芯(C1和C2)、电源适配器和水瓶组装如图所示的装置。
接通电源观察到:C1周围产生细小气泡,C2周围无明显现象;持续通电一段时间后,C2周围产生细小气泡。
此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。
关于该实验的说法不.正确..的是(朝一)A.C1电极产生气泡原因:2H2O+2e-=== H2↑+2OH-电解B.自制消毒剂的总反应为:NaCl+H2O === NaClO+H2↑C.可以用两根铁钉代替铅笔芯完成实验D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全10.直接碳固体氧化物燃料电池作为全固态的能量转换装置,采用固体碳作为燃料,以多孔 Pt 作电极、氧化锆为电解质,其工作原理如下图。
下列说法不正确...的是 (丰一)已知:CO 2(g)+C (s)2CO(g) △H =+172.5 kJ ·mol-1 CO(g)+1/2O 2(g) CO 2(g) △H =﹣283 kJ ·mol -1 A .电极a 为正极,电子由b 经过导线到aB .电极b 发生的电极反应为:CO +O 2--2e - CO 2C .依据装置原理可推测,该条件下CO 放电比固体C 更容易D .若1 mol C(s)充分燃烧,理论上放出的热量为110.5 kJ12.潮湿环境、Cl -、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。

高考化学十年真题专题汇编解析-电化学题型一:原电池的工作原理金属的电化学腐蚀与防护1.(2019·全国Ι·12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
下列说法错误的是A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动【答案】B【解析】本题考查原电池工作原理,涉及酶的特性、电极反应式的书写和电解质中离子迁移方向等知识,考查的核心素养是证据推理与模型认知、宏观辨识与微观探析。
由题图和题意知,电池总反应是3H2+N 22NH3。
该合成氨反应在常温下进行,并形成原电池产生电能,反应不需要高温、高压和催化剂,A项正确;观察题图知,左边电极发生氧化反应MV+-e -MV2+,为负极,不是阴极,B项错误;正极区N2在固氮酶作用下发生还原反应生成NH3,C项正确;电池工作时,H+通过交换膜,由左侧(负极区)向右侧(正极区)迁移,D项正确。
【解后反思】分析装置图时,抓住粒子流向与物质转化,整体认识合成氨原理。
联系原电池原理综合作出判断。
电解池的电极分阴极、阳极,阴极发生还原反应,阳极发生氧化反应;原电池的电极分正极、负极,正极发生还原反应,负极发生氧化反应。
2.(2019·江苏·10)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。
下列有关该实验的说法正确的是A.铁被氧化的电极反应式为Fe-3e-Fe3+B.铁腐蚀过程中化学能全部转化为电能C.活性炭的存在会加速铁的腐蚀D.以水代替NaCl溶液,铁不能发生吸氧腐蚀【答案】C【解析】本题考查金属的电化学腐蚀,考查的核心素养是证据推理与模型认知。
A项,铁和炭的混合物用NaCl溶液湿润后构成原电池,铁作负极,铁失去电子生成Fe2+,电极反应式为Fe-2e-Fe2+,错误;B项,铁腐蚀过程中化学能除了转化为电能外,还可转化为热能等,错误;C项,构成原电池后,铁腐蚀的速率变快,正确;D项,用水代替NaCl溶液,Fe和炭也可以构成原电池,Fe失去电子,空气中的O2得到电子,铁发生吸氧腐蚀,错误。
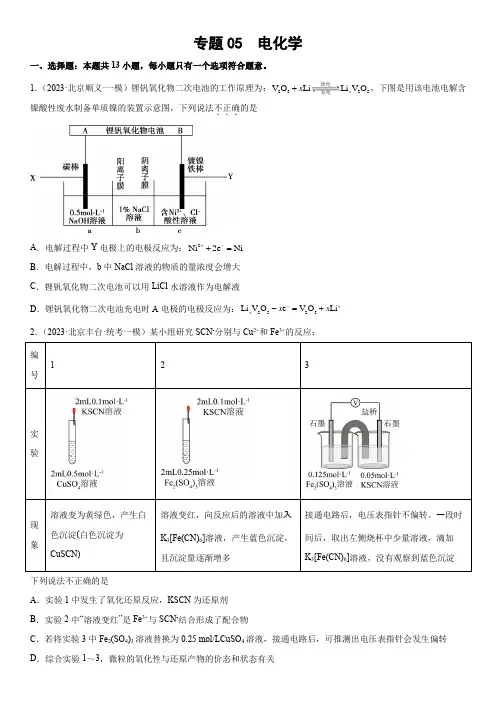
2Li Li V O x 放电充电下列说法不正确的是A .实验1中发生了氧化还原反应,KSCN 为还原剂B .实验2中“溶液变红”是Fe 3+与SCN -结合形成了配合物C .若将实验3中Fe 2(SO 4)3溶液替换为0.25 mol/LCuSO 4溶液,接通电路后,可推测出电压表指针会发生偏转D .综合实验1~3,微粒的氧化性与还原产物的价态和状态有关3.(2023·北京房山·统考一模)某种培根型碱性氢氧燃料电池示意图如所示,下列有关该电池的说法不正确...的是A .电池放电时,K +向镍电极Ⅰ的方向迁移B .正极电极反应为:22O 2H O 4e 4OH --++=C .出口Ⅰ处有水生成D .循环泵可使电解质溶液不断浓缩、循环4.(2023·北京房山·统考一模)锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以()24Zn OH /Zn -和()()3466Fe CN /Fe CN --作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
下列说法不正确...的是 A .放电过程中,左侧池中溶液pH 逐渐减小B .放电过程中,总反应为()()()3246462Fe CN Zn 4OH =Zn OH 2Fe CN ----+++ C .充电过程中,阴极的电极反应为()24Zn OH 2e =Zn 4OH ---++ D .充电过程中,当2 molOH -通过PBI 膜时,导线中通过1 mol e -5.(2023·北京朝阳·统考一模)将铜棒插入浓、稀()32Cu NO 溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓()32Cu NO 溶液的铜棒变粗。
下列说法不正确的是下列说法不正确的是8.(2023·北京海淀·北理工附中校考·一模)我国研究锂硫电池获得突破,电池的总反应是16Li+S88Li2S,充放电曲线如图所示,下列说法不正确的是()下列说法不正确的是:(3Cu NH ⎡⎣中溶液的小,Cu 缓慢析出,镀层更致密一模)有机电化学合成是目前公认的一种绿色可持续性合成策略,电化学合参考答案:1.C【分析】电解含镍酸性废水制备单质镍,镀镍铁棒为阴极,发生反应Ni 2++2e -=Ni ,B 是锂钒氧化物二次电池的负极,A 是正极,碳棒是电解池的阳极。

2023年高考化学真题分类汇编—电化学部分(真题部分)128.(2023广东6)负载有Pt和Ag的活性炭,可选择性去除C1-实现废酸的纯化,其工作原理如图。
下列说法正确的是A.Ag作原电池正极B.电子由Ag经活性炭流向PtC.Pt表面发生的电极反应:O2+2H2O+4e-=4OH-D.每消耗标准状况下11.2L的O2,最多去除1 mol Cl-129.(2023海南8)利用金属Al、海水及其中的溶解氧可组成电池,如图所示。
下列说法正确的是A.b电极为电池正极B.电池工作时,海水中的Na+向a电极移动C.电池工作时,紧邻a电极区域的海水呈强碱性D.每消耗1kgAl,电池最多向外提供37mol电子的电量130.(2023湖南8)葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:下列说法错误的是A .溴化钠起催化和导电作用B .每生成1mol 葡萄糖酸钙,理论上电路中转移了2mol 电子C .葡萄糖酸能通过分子内反应生成含有六元环状结构的产物D .葡萄糖能发生氧化、还原、取代、加成和消去反应131.(2023北京5)回收利用工业废气中的CO 2和SO 2,实验原理示意图如下。
下列说法不正确的是A .废气中SO 2排放到大气中会形成酸雨B .装置a 中溶液显碱性的原因是HCO 3−的水解程度大于HCO 3−的电离程度C .装置a 中溶液的作用是吸收废气中的CO 2和SO 2D .装置b 中的总反应为SO 32−+CO 2+H 2O 电解HCOOH +SO 42−132.(2023湖北10)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。
该装置工作时阳极无Cl 2生成且KOH 溶液的浓度不变,电解生成氢气的速率为x mol ⋅h −1。
下列说法错误的是A.b电极反应式为2H2O+2e−=H2↑+2OH−B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜D.海水为电解池补水的速率为2x mol⋅h−1133.(2023广东13)利用活性石墨电极电解饱和食盐水,进行如图所示实验。


专题07电化学及其应用考点三年考情(2022-2024)命题趋势考点1电化学及其应用◆原电池、化学电源:2024安徽卷、2024全国甲卷、2024新课标卷、2024河北卷、2024江苏卷、2024北京卷、2023广东卷、2023全国乙卷、2023新课标卷、2023山东卷、2023辽宁卷、2022全国甲卷、2022全国乙卷、2022福建卷、2022广东卷、2022浙江卷、2022辽宁卷、2022山东卷、2022湖南卷◆电解池的工作原理及应用:2024黑吉辽卷、2024湖北卷、2024山东卷、2024湖南卷、2024甘肃卷、2024广东卷、2023全国甲卷、2023湖北卷、2023辽宁卷、2023北京卷、2023广东卷、2023湖南卷、2023浙江卷、2022广东卷、2022天津卷、2022海南卷、2022辽宁卷、2022重庆卷、2022湖北卷、2022北京卷、2022河北卷、2022浙江卷◆金属的腐蚀与防护:2024浙江卷、2024广东卷、2022辽宁卷、2022河北卷、2022湖北卷、2022广东卷高考对于电化学板块内容的考查变化变化不大,主要考查陌生的原电池装置和电解池装置的分析,对于电解池的考查概率有所提高,特别是利用电解池生产化工品和处理环境污染物成为命题特点。
问题的落脚点主要是在电极的极性判断、两极发生的反应情况和电解液成分的参与情况这些问题上。
考法01原电池、化学电源1.(2024·安徽卷)我国学者研发出一种新型水系锌电池,其示意图如下。
该电池分别以Zn-TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn 为电极,以ZnSO 4和KI 混合液为电解质溶液。
下列说法错误的是A.标注框内所示结构中存在共价键和配位键B.电池总反应为:-2+-3I +Zn Zn +3I 放电充电C.充电时,阴极被还原的Zn 2+主要来自Zn-TCPPD.放电时,消耗0.65gZn ,理论上转移0.02mol 电子2.(2024·全国甲卷)科学家使用δ-MnO 2研制了一种MnO 2-Zn 可充电电池(如图所示)。

2020-2021学年北京高考热点考题《电化学基础》专题训练1、(14年北京高考)下列电池工作时,O2在正极放电的是( )A.锌锰电池B.氢燃料电池C.铅蓄电池D.镍镉电池2、铜锌原电池(如图)工作时,下列叙述正确的是( )A.正极反应为Zn-2e-===Zn2+B.电池反应为Zn+Cu2+===Zn2++CuC.在外电路中,电子从正极流向负极D.盐桥中的K+移向ZnSO4溶液3、(15年北京高考)在通风橱中进行下列实验:步骤现象Fe表面产生大量无色气泡,液面上方变为红棕色Fe表面产生少量红棕色气泡后,迅速停止Fe、Cu接触后,其表面产生红棕色气泡下列说法中不正确...的是:()A.Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化4、科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料。
电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-。
下列对该电池的说法不正确是( ) A.在熔融电解质中,O2-由负极移向正极B.该电池的总反应是C3H8+5O2===3CO2+4H2OC.电路中每通过5 mol电子,约有5.6 L标准状况下的丙烷被完全氧化D.通入丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-===3CO2+4H2O5、生铁在pH = 2和pH = 4的盐酸中发生腐蚀。
在密闭容器中,用压强传感器记录该过程的压强变化,如右图所示。
下列说法中,不正确...的是()A.两容器中负极反应均为Fe - 2e-== Fe2+B.曲线a记录的是pH = 2的盐酸中压强的变化C.曲线b记录的容器中正极反应是O2 + 4e-+ 2H2O ==4OH-D.在弱酸性溶液中,生铁能发生吸氧腐蚀6、【2020新课标2卷】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。
八、电化学-练习(北京卷)26.氯碱工业中电解饱和食盐水的原理示意图如右图所示(1)溶液A的溶质是;(2)电解饱和食盐水的离子方程式是(3)电解时用盐酸控制阳极区溶液的P H在2~3,用化学平衡移动原理解释盐酸的作用(4)电解所用的盐水需精制。
去除有影响的Ca2+、Mg2+、NH+3、SO2-2,[c(SO2-2)]>c(Ca2+)]。
精制流程如下(淡盐水和溶液A来电解池):①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg / L,则处理10m3 盐水b ,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计)。
(山东卷)29.科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为。
要清洗附着在试管壁上的硫,可用的试剂是。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+x S=Na2Sx,正极的电极反应式为。
M(由Na2O和Al2O3制得)的两个作用是。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的倍。
(Pb:207)(3)Na2S溶液中离子浓度由大到小的顺序为,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为(用离子方程式表示)。
(江苏卷)18.Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。
反应方程式为2AgNO3+4KOH+K2S2O8=Ag2O2+2KNO3+2K2SO4+2H2O回答下列问题:(1)上述制备过程中,检验洗涤是否完全的方法是。
2021年北京高三化学总复习《电化学基础》专题训练一、选择题目(每小题2分,共40分)1、.在如图所示的水果(柠檬)电池中,外电路上的电流从X电极流向Y电极。
若X为铁,则Y可能是( )A.锌B.石墨C.银D.铜答案 A2、用石墨作电极电解氯化铜溶液,下列说法正确的是( )A.在阳极上析出金属铜B.在阴极上析出金属铜C.在阴极上产生有刺激性气味的气体D.阳极上发生还原反应答案 B3、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )A.利用电池外壳的金属材料B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C.防止电池中渗漏的电解液腐蚀其他物品D.回收其中石墨电极答案 B4、用石墨作电极,电解碘化钾溶液(含有少量酚酞和淀粉)。
下列说法错误的是( )A.阴极附近溶液呈红色B.阴极逸出气体C.阳极附近溶液呈蓝色D.溶液的pH减小答案 D5、下列说法错误的是( )A.氧化还原反应所释放的化学能,是化学电池的能量来源B.化学电池中的负极材料不一定参加电极反应C.二次电池的充电和放电过程是可逆反应D.丢弃废旧电池不但会污染环境,而且是资源的极大浪费答案 C6、我国某大城市今年夏季多次降下酸雨。
据环保部门测定,该城市整个夏季酸雨的pH平均值为3.2。
在这种环境中的铁制品极易被腐蚀。
对此条件下铁的腐蚀的叙述不正确的是( )A.此腐蚀过程有化学腐蚀也有电化学腐蚀B.发生电化学腐蚀时,正极反应式为2H2O+O2+4e-===4OH-C.在电化学腐蚀过程中有氢气产生D.发生电化学腐蚀时,负极反应式为Fe-2e-===Fe2+答案 B7、下列有关图甲和图乙的叙述不正确的是( )A.均发生了化学能转化为电能的过程B.Zn和Cu既是电极材料又是反应物C.工作过程中,电子均由Zn经导线流向CuD.相同条件下,图乙比图甲的能量利用效率高答案 B8.关于镀铜和电解精炼铜,下列说法中正确的是( )A.都用粗铜作阳极、纯铜作阴极B.电解液的成分都保持不变C.阳极反应都只有Cu-2e-===Cu2+D.阴极反应都只有Cu2++2e-===Cu答案 D9.(2020·福建)某原电池装置如图所示。
热点题型九电化学1.某燃料电池的工作原理如图所示,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。
下列说法正确的是( )A.该电池放电时K+向石墨Ⅰ电极迁移B.石墨Ⅰ附近发生的反应:NO2-e-N2O5C.O2在石墨Ⅱ附近发生氧化反应,Y为NOD.相同条件下,放电过程中消耗的NO2和O2的体积比为2∶12.电池式氧传感器原理构造如图所示,可测定O2的含量。
工作时铅电极表面会逐渐附着Pb(OH)2。
下列说法不正确的是( )A.Pt电极上发生还原反应B.工作时,电解液的pH逐渐减小C.消耗a mol O2,理论上可使Pb电极增重68a gD.Pb电极上的反应式为Pb+2OH--2e-Pb(OH)23.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述错误的是( )A.放电时,正极附近溶液的碱性增强B.充电时,锌电极与外电源正极相连C.放电时,每转移3 mol电子,正极有1 mol K2FeO4被还原D.充电时,阳极反应式为Fe(OH)3 -3e-+5OH-2O4.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。
电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。
下列叙述错误的是( )A.M室发生的电极反应为:2H2O-4e-O2↑+4H+B.a%<b%C.产品室发生的反应是H3BO3+H2OD.理论上每生成1 mol产品,阴极可生成标准状况下5.6 L气体5.H2O2被称为绿色氧化剂。
下图是以甲烷燃料电池为电源,电解制备H2O2的示意图。
下列有关叙述中正确的是( )A.电解池装置应选择阳离子交换膜B.d 极的电极反应式为O2+2e-+2H+H2O2C.当有16 g甲烷参与原电池反应时,可制备4 mol H2O2D.工作时,a、c电极附近的pH均增大6.现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。