反应热与焓变
- 格式:pptx
- 大小:19.27 MB
- 文档页数:16



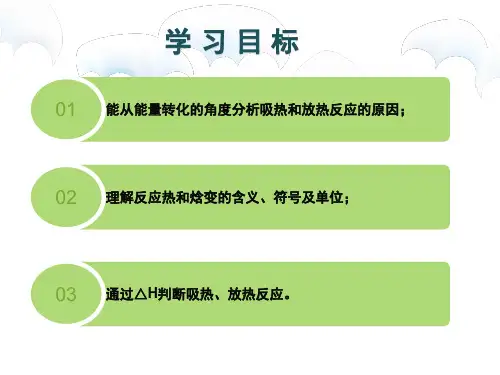
化学反应中能量的变化第一讲反应热与焓变一、放热反应、吸热反应和反应热1.放热反应:具有的总能量大于的总能量时,反应释放能量,ΔH 0(填“>”或“<”)。
2.吸热反应:具有的总能量小于的总能量时,反应吸收能量,ΔH 0(填“>”或“<”)。
二、化学反应的焓变1.焓(H)用于描述物质具有的能量的物理量。
2.焓变(ΔH)始、终状态焓的变化表示为ΔH=H(反应产物)-H(反应物)3.反应热的含义:化学反应过程中所释放或吸收的能量,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol;反应热随反应物的物质的量变化而变化,反应热随反应前后物质的聚集状态变化而变化,一个“可逆的”化学反应,它的正反应和逆反应的焓变(ΔH)大小相等符号相反。
4..化学反应热的计算ΔH=E(生成物的总能量)—E(反应物的总能量)ΔH=E(反应物的键能总和)—E(生成物的键能总和)例题:1. (07年全国II理综)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ 的能量;下列叙述正确的是( C )A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g)B.氢气和氯气反应生成2 mol氯化氢气体,反应的∆H = 183 kJ/molC.氢气和氯气反应生成2 mol氯化氢气体,反应的∆H =-183 kJ/molD.氢气和氯气反应生成1 mol氯化氢气体,反应的∆H =-183 kJ/mol解析:ΔH=E(反应物的键能总和)—E(生成物的键能总和)=436 kJ/mol+243 kJ/mol-2×431 kJ/mol= -183 kJ/mol变式练习1.(2011重庆) SF6是一种优良的绝缘气体,分子结构中只存在S-F键。


反应热和焓变反应热和焓变是化学反应中重要的热力学概念,用来描述反应过程中的能量变化。
在本文中,我们将探讨反应热和焓变的定义、测定方法以及其在化学领域中的应用。
一、反应热和焓变的定义反应热(ΔH)指的是化学反应在标准条件下所伴随的热量变化。
正值的反应热表示反应吸热,也就是吸收了热量;负值的反应热则表示反应放热,即释放了热量。
反应热的单位通常用焦耳(J)或千焦(kJ)表示。
焓变(ΔH)也是表示化学反应中的能量变化,但它的定义与反应热略有不同。
焓变指的是反应物到生成物之间焓的差异,也就是化学反应中产生的热量变化。
与反应热类似,正值的焓变表示反应吸热,负值的焓变表示反应放热。
二、焓变的测定方法测定反应热和焓变的方法有许多,下面介绍两种常用方法。
1. 热量计法热量计法是通过在一个绝热容器中进行反应,并测量反应过程中容器的温度变化来计算反应热和焓变的方法。
通过测量温度变化,结合热容量的知识,可以推算出反应过程中释放或吸收的热量。
2. 常压下的燃烧法常压下的燃烧法适用于涉及到燃烧反应的焓变测定。
通过将反应物燃烧并与大量水接触,测量水的温度变化,然后利用热容量的知识计算出反应热和焓变。
三、反应热和焓变在化学领域中的应用反应热和焓变在化学领域中有广泛的应用,下面列举几个例子。
1. 反应的放热或吸热性质通过测定反应热或焓变的正负值,可以确定一个化学反应是放热反应还是吸热反应。
这对于了解化学反应的特性和动力学过程非常重要。
2. 化学反应的平衡性质焓变与化学反应的平衡性质密切相关。
根据焓变的正负值可以判断某个反应是放热反应还是吸热反应,从而对反应的平衡性质进行分析和预测。
3. 反应活性与能量变化的关系焓变也可以用来研究反应的活性和反应速率。
一般来说,焓变越大,反应也越活跃。
因此,通过研究焓变可以对不同反应的活性进行比较和评估。
4. 反应热的工业应用反应热在工业化学反应中有重要的应用价值。
通过测定反应热可以确定不同化学反应的热效应,从而为工业生产提供相关的设计和控制依据。

反应热与焓变的计算化学反应中的热能变化计算在化学反应中,热能变化(ΔH)是一个重要的物理性质,在计算中起着关键作用。
本文将介绍如何计算化学反应中的热能变化,具体包括反应热和焓变的计算。
1. 反应热的计算反应热是指在常压下,物质在一定温度范围内进行化学反应时所吸收或释放的热量。
反应热可以通过燃烧实验或通过实验室反应器测定得到。
在计算反应热时,可以使用以下公式:反应热(ΔH)= 反应前的热量 - 反应后的热量其中,反应前的热量是指反应物在初始温度下的热量,反应后的热量是指生成物在最终温度下的热量。
2. 焓变的计算焓变是指物质在化学反应过程中,由于化学键的断裂和形成而引起的热量变化。
焓变可以通过标准反应焓变(ΔH°)来表示,标准反应焓变是指在标准温度(298K)和标准压力(1 atm)下,物质完全转化为生成物所伴随的热量变化。
在计算焓变时,可以使用以下公式:焓变(ΔH)= ∑(生成物的摩尔数 ×反应焓) - ∑(反应物的摩尔数 ×反应焓)其中,反应焓是指每个物质在反应中产生或吸收的热量,可以通过实验或者化学手册中的标准值来获取。
3. 热能变化的计算热能变化是指化学反应中反应热和焓变的总和。
在计算热能变化时,可以使用以下公式:热能变化(ΔE)= 反应热(ΔH)+ 焓变(ΔH)热能变化的值可以表示反应的放热性质或吸热性质。
当热能变化为负值时,表示反应为放热反应,释放热量;当热能变化为正值时,表示反应为吸热反应,吸收热量。
4. 实例分析例如,我们考虑以下反应:2H2(g) + O2(g) → 2H2O(l) ΔH° = -571.6 kJ/mol我们可以计算该反应的反应热和焓变。
首先,计算反应热:反应热(ΔH)= 反应前的热量 - 反应后的热量反应前的热量:2 × 0 kJ/mol (H2的标准热量) + 1 × 0 kJ/mol (O2的标准热量) = 0 kJ/mol反应后的热量:2 × (-285.8 kJ/mol) (H2O的标准热量) = -571.6kJ/mol反应热(ΔH)= 0 kJ/mol - (-571.6 kJ/mol) = 571.6 kJ/mol接下来,计算焓变:焓变(ΔH)= ∑(生成物的摩尔数 ×反应焓) - ∑(反应物的摩尔数 ×反应焓)焓变(ΔH)= 2 × (-285.8 kJ/mol) - (2 × 0 kJ/mol + 1 × 0 kJ/mol) = -571.6 kJ/mol最后,计算热能变化:热能变化(ΔE)= 反应热(ΔH)+ 焓变(ΔH) = 571.6 kJ/mol + (-571.6 kJ/mol) = 0 kJ/mol根据计算结果,可以得出该反应的热能变化为0 kJ/mol,即该反应为热力学平衡反应。




反应热与焓变反应热和焓变是热力学领域中的重要概念。
它们描述了化学反应中能量的转化和变化过程。
本文将从基本概念、计算方法以及相关应用等方面,详细介绍反应热和焓变的相关知识。
一、基本概念反应热是指在化学反应过程中释放或吸收的能量,是指反应物与生成物之间的能量差。
反应热可以分为放热反应和吸热反应。
放热反应是指反应过程中释放出能量,使周围温度升高;吸热反应则是指反应过程中吸收了能量,使周围温度降低。
反应热的单位通常用焦耳(J)或千焦(kJ)来表示。
焓变是指化学反应过程中系统焓的变化量。
焓是一个物质在恒定压力下的热力学状态函数,它包括了内能和对外界做的功。
焓变可以分为正焓变和负焓变。
正焓变表示反应过程中系统吸收了热量,负焓变表示系统释放了热量。
焓变的单位通常用焦耳(J)或千焦(kJ)来表示。
二、计算方法计算反应热和焓变的方法有多种。
其中一种常用的方法是通过热量计实验来测定反应热。
热量计实验是将反应物与生成物溶解在水中,通过测量溶液温度的变化来计算反应热。
根据热量守恒定律,反应物释放的热量等于溶液吸收的热量。
通过测量前后溶液的温度差,可以计算出反应热的大小。
另一种计算反应热的方法是利用热力学数据表。
热力学数据表中列出了各种物质的标准反应热值。
标准反应热是指在标准状态下,1摩尔物质参与反应时释放或吸收的能量。
通过将反应物和生成物的标准反应热值相加或相减,可以计算出反应热的大小。
焓变的计算方法与反应热类似。
可以通过实验测定焓变,也可以利用热力学数据表中的标准焓变值进行计算。
对于气体反应,还可以利用热力学循环法来计算焓变。
热力学循环法是通过将气体反应与一系列已知焓变的反应构成热力学循环,从而计算出气体反应的焓变。
三、相关应用反应热和焓变在化学工程、能源领域以及环境科学等方面有广泛的应用。
在化学工程中,反应热和焓变可以用来设计反应器和优化反应过程。
通过控制反应热和焓变,可以提高反应效率,减少能量损失。
在能源领域,反应热和焓变可以用来评估燃料的能量释放量。
焓变、反应热【考点精讲】 1. 反应热和焓变(1)反应热:当化学反应在一定温度下进行时,反应所吸收或释放的热量。
(2)焓变(ΔH ):反应产物的总焓与反应物的总焓之差。
即ΔH =H (反应产物)-H (反应物)。
(3)化学反应的反应热用一定条件下的焓变表示,符号为ΔH ,单位为kJ·mol -1。
(4)比较△H 的大小时要带着“﹢”“-”进行比较。
2. 放热反应、吸热反应 反应物生成物吸收能量E 1E 2放出能量化学反应E 1E 2>E 1E 2<吸热反应放热反应【典例精析】例题1下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是(ΔH用于表示反应中的热量变化,ΔH>0表示反应吸热,ΔH<0表示反应放热)()A. 石墨转变为金刚石是吸热反应B. 白磷比红磷稳定C. S(g)+O2(g)===SO2(g)ΔH1;S(s)+O2(g)===SO2(g)ΔH2,则ΔH1>ΔH2D. CO(g)+H2O(g)===CO2(g)+H2(g)ΔH1>0思路导航:根据图象可知,石墨的总能量低于金刚石的总能量,所以石墨转变为金刚石是吸热反应,A正确;白磷的总能量高于红磷的总能量,所以根据能量越低越稳定可知,红磷比白磷稳定性强,B不正确;气态S的总能量高于固态S 的总能量,所以气态S燃烧放出的热量多,但放热越多反应热△H越小,所以C中ΔH 2>ΔH 1,C 不正确;D 中反应物的总能量高于生成物的总能量,反应是放热反应,D 不正确,答案选A 。
答案:A例题2 下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是(g 、l 、s 分别表示气体、液体、固体)( ) A. 2222H (g)O (g)2H O(l)+= 2222H (g)O (g)2H O(g)+=B. C (石墨)+O 2(g )=CO 2(g ) C (金刚石)+O 2(g )=CO 2(g )(石墨比金刚石稳定)C.22C(s)O (g)CO (g)+= D. 22S(s)O (g)SO (g)+=22S(g)O (g)SO (g)+=思路导航:由于液态水的能量低于气态水的能量,则氢气完全燃烧生成液态水时放热多,所以选项A 正确;B 中石墨比金刚石稳定,这说明石墨的总能量低于金刚石的总能量,所以金刚石燃烧放出的热量多;C 中碳完全燃烧放热多;D 中固态S 的总能量低于气态S 的总能量,所以气态S 完全燃烧放热多,答案选A 。