无机及分析化学答案
- 格式:doc
- 大小:166.00 KB
- 文档页数:33

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。

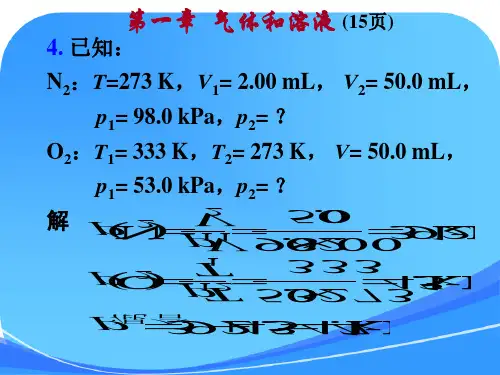
第一章 气体和溶液2. 解:根据理想气体状态方程:nRTV p =可得: RTpV M n ==m 则: mol /0.160.250L101.3kPa K 298K mol L kPa 315.8164.0-11g g pV mRT M ≈⨯⨯⋅⋅⋅⨯==-该的相对分子质量为16.04. 解:由题意可知,氮气为等温变化,氧气为等容变化 kPa 92.350.0mL2.00mL kPa 0.98211N 2=⨯==V V p p kPa 45.43333K 732kPa 0.53121O 2=⨯==K T T p p 根据道尔顿分压定律:kPa4.4792.345.4322O N ≈+=+=p p p 总7. 解: T =(273+15)K = 288K ; p 总 =100kPa ;V =1.20L 288K 时,p (H 2O)=1.71kPaM (Zn)=65.39则 p 氢气= (100-1.71)kPa = 98.29kPa mol 0493.0K288K mol L 8.315kPa L 20.18.29kPa 911-=⨯⋅⋅⋅⨯==-RT pV n 氢气根据: Zn(s) + 2HCl → ZnCl 2 + H 2(g)65.39g 1molm (Zn)=? 0.0493mol解得m (Zn)=3.22g则杂质的质量分数 w (杂质) = (3.45-3.22)/ 3.45 = 0.06714. 解:因溶液很稀,可设ρ ≈1 g·mL -1(1) 14113L mol 1054.1K293K mol L kPa 315.8kPa 10375-----⋅⨯=⋅⋅⋅⋅⨯=∏=RT c (2) mol g L L g cV m n m M /1069.6mol 1054.1010.50515.04143⨯=⋅⨯⨯⨯===--- 血红素的相对分子质量为41069.6⨯ (3) K1086.2kg mol 1054.1mol kg K 86.14141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T f f K1088.7kg mol 1054.1mol kg K 512.05141----⨯=⋅⨯⨯⋅⋅=⋅=∆b K T b b (4)由于沸点升高和凝固点下降的值太小,测量误差很大,所以这两种方法不适用。

第一章补充习题一、选择题1. 与0.58% NaCl 溶液产生的渗透压较接近的是溶液()。
(A) 0.1 mol/L 蔗糖溶液 (B) 0.2 mol/L 葡萄糖溶液 (C) 0.1 mol/L 葡萄糖溶液(D) 0.1 mol/L BaCb 溶液2. 25°C 时,总压为10 atm 时,下面几种气体的混合气体中分压最大的是:( )。
(A) O.lg H 2 (B) 1.0 g He (C) 1.0 g N 2 (D) 1.0 g CO 23. 气体与理想气体更接近的条件是( )。
6. 一定愠度下,等体积的甲醛(HCHO)溶液和葡萄糖(C6H12O6)溶液的渗透压相等,溶液中甲醛和葡萄糖的质量比是( )。
(A) 6 : 1(B)1 :6(C) 1:3(D) 3:1 7. 下列相同浓度的稀溶液,蒸气压最高的是( )o(A) HAc 溶液 (B) CaCh 溶液 (C)蔗糖水溶液 (D) NaCl 水溶液 8. 取相同质量的下列物质融化路面的冰雪,效果最好的是()。
(A)氯化钠 (B)氯化钙 (C)尿素[CO(NH 2)2] (D)蔗糖9. 在一定的外压下,易挥发的纯溶剂A 中加入不挥发的溶质B 形成稀溶液。
此稀溶液的沸点随着加的增加而 ()。
(A) 升高(B)降低 (C)不发生变化 (D) 无一定变化规律 10.室温25°C 时,0.1 mol/L 糖水溶液的渗透压为()o(A) 25 kPa(B) 101.3 kPa (C) 248 kPa (D) 227 kPa11. 盐碱地的农作物长势不良,甚至枯萎,其主要原因为()。
(A)天气太热 (B)很少下雨 (C)肥料不足 (D)水分从植物向土壤倒流12. 37°C,人体血液的渗透压为780kPa,与血液具有相同渗透压的葡萄糖静脉注射液浓度是()。
(A) 85 g/L (B) 5.4 g/L (C) 54 g/L (D)8.5 g/L 13. 有一半透膜,将水和某溶质水溶液隔开,其结果是()。

无机及分析化学知到章节测试答案智慧树2023年最新齐鲁工业大学第一章测试1.无机及分析化学就是将无机化学和分析化学有机整合,集二者的基础性和实用性于一身的一门化学专业基础课程,是大学化学的基石和化学研究的起点。
参考答案:对2.测定常量组分的某样品中硫酸根的含量,可采用硫酸钡重量分析法。
参考答案:对3.从历史上看,无机化学是发展最早的一门化学分支学科,是化学研究的先驱。
参考答案:对4.以化学反应为基础的分析方法,称为:参考答案:化学分析法5.通常所说的四大化学是指?参考答案:物理化学;有机化学;无机化学;分析化学6.本课程包含化学的哪两个二级学科?参考答案:分析化学;无机化学7.下列哪些内容属于无机化学的研究对象?参考答案:电化学;配位化学;化学热力学;结构化学;化学动力学;元素化学第二章测试1.已知置信度为90%,n = 6 时,t =2.015,在一组平行测定中, 所得测定结果如下: 8.44, 8.32, 8.45, 8.52, 8.69, 8.38,下列内容正确的是参考答案:置信度为90%时平均值的置信区间8.47±0.11;标准偏差为0.132.已知n = 6 时,Q0.90 = 0. 56。
在一组平行测定中,所得测定结果如下:10.56,10.44,10.57,10.64,10.81,10.50,则参考答案:所有数据都是可靠值3.系统误差具有重现性,是可测误差参考答案:对4.带有偶然误差的测量数据,不能参加平均值的计算参考答案:错5.滴定分析中,指示剂确定的滴定终点与化学计量点不一致,由此产生的误差属于试剂误差。
参考答案:错6.系统误差主要影响分析测定中的准确度参考答案:对7.pM=-lg[Mn+]=3.00,金属离子浓度[Mn+]有效数字位数为3位参考答案:错8.对于同一组测定数据,置信度越小,置信区间越小。
参考答案:对9.用分析天平采用减量法称量试样,要使称量误差不大于0.1%,至少要称取试样参考答案:0.2g10.已知 pH=5.25,则[ H+ ]=5.62×10-6mol•L-1 。

第一章 物质构造根底1-1.简答题(1)不同之处为:原子轨道的角度分布一般都有正负号之分,而电子云角度分布图均为正值,因为Y 平方后便无正负号了;除s 轨道的电子云以外,电子云角度分布图比原子轨道的角度分布图要稍“瘦〞一些,这是因为︱Y ︱≤ 1,除1不变外,其平方后Y 2的其他值更小。
(2) 几率:电子在核外某一区域出现的时机。
几率密度:电子在原子核外空间某处单位体积内出现的几率,表示微粒波的强度,用电子云表示。
(3) 原子共价半径:同种元素的两个原子以共价单键连接时,它们核间距离的一半。
金属半径:金属晶体中相邻两个金属原子核间距离的一半。
范德华半径:分子晶体中相邻两个分子核间距离的一半。
(4) BF 3分子中B 原子采用等性sp 2杂化成键,是平面三角形;而NF 3分子中N 原子采用不等性sp 3杂化,是三角锥形。
〔5〕分子式,既说明物质的元素组成,又表示确实存在如式所示的分子,如CO 2、C 6H 6、H 2;化学式,只说明物质中各元素及其存在比例,并不说明确实存在如式所示的分子,如NaCl 、SiO 2等;分子构造式,不但说明了物质的分子式,而且给出了分子中各原子的具体联接次序和方式,像乙酸的构造式可写为C HH HC OO H其构造简式可记为CH 3COOH 。
1-2解 1错;2错;3对;4对;5对;6错。
7对;8错;9对 10错;11错;12错。
1-3波动性;微粒性1-4. 3s=3p=3d=4s ;3s< 3p< 4s <3d ;3s< 3p< 3d< 4s ; 1-5 32;E 4s < E 4p < E 4d < E 4f ; 第六周期;La 系;2;铈(Ce)1-6HF>HCl>HBr>HI ;HF>HCl>HBr>HI; HF<HCl<HBr<HI; HF>HI>HBr>HCl 。

第一章测试1.配合物K[Pt(NH3)Br2Cl2F]名称是一氨∙一氟∙二氯∙二溴合铂(II)化钾。
()A:对B:错答案:B2.配位滴定用的EDTA常用其二钠盐而不是乙二胺四乙酸。
()A:错B:对答案:B3.EDTA在水溶液中有七种存在形体,其中只有Y4-能与金属离子直接配位。
()A:错B:对答案:B4.金属指示剂与金属离子形成的配合物不够稳定,这种现象称为指示剂的僵化。
()A:对B:错答案:B5.酸效应系数越大,配合物稳定性越大。
()A:对B:错答案:B6.在配离子[CuI2]-中,Cu+离子接受配体孤对电子的杂化轨道是()。
A:spB:sp3C:sp3d2D:dsp2答案:A7.一般情况下,EDTA与金属离子形成的络合物的络合比是()。
A:2:1B:1:3C:1:1D:1:2答案:C8.αM(L) = 1表示()A:M与L没有副反应B:M的副反应较小C:[M]=[L]D:M与L的副反应相当严重答案:A9.EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而A:减小B:增大C:不变D:先增大后减小答案:B10.产生金属指示剂的僵化现象是因为()。
A:K′MIn < K′MYB:MIn溶解度小C:指示剂不稳定D:K′MIn > K′MY答案:D第二章测试1.Ag2CrO4、PbCrO4、BaCrO4均溶于强酸。
()A:对B:错答案:A2.KMnO4在酸中、碱中、受热、见光都不稳定。
()A:错B:对答案:B3.对于锰的各种氧化数的化合物,下列说法中错误的是()。
A:MnO2在碱性溶液中是强氧化剂。
B:Mn2+在酸性溶液中是最稳定的。
C:Mn3+在酸性或碱性溶液中很不稳定。
D:K2MnO4在中性溶液中发生歧化反应。
答案:A4.清洗长期盛放KMnO4的试剂瓶,应选用()。
A:稀HClB:HNO3C:酸性FeSO4 溶液D:浓H2SO4答案:C5.饮用含Cr(Ⅵ)的水会损害人的肠胃,而Cr(Ⅲ)毒性只有Cr(Ⅵ)的0.5%。

无机及分析化学练习册答案无机及分析化学是一门研究无机物质的化学性质、结构、反应及其分析方法的学科。
以下是一份无机及分析化学练习册的答案,供参考:练习一:配位化合物的命名1. 给定化合物[Co(NH3)5Cl]Cl2,其名称是五氨氯化钴(II)氯化物。
2. 化合物[Fe(CN)6]3-的名称是六氰合铁(III)酸根离子。
3. 化合物[Cu(en)2(H2O)2]SO4的名称是乙二胺二水合铜(II)硫酸盐。
练习二:酸碱滴定1. 已知某酸的浓度为0.1M,若用0.05M的NaOH溶液滴定,滴定终点时消耗NaOH溶液的体积为20mL,则该酸的浓度为0.1M。
2. 假设滴定某碱溶液,使用0.1M的HCl溶液,滴定终点时消耗HCl溶液的体积为25mL,若碱溶液的体积为50mL,则碱的浓度为0.05M。
练习三:氧化还原反应1. 给定反应式Zn + CuSO4 → ZnSO4 + Cu,Zn的氧化态从0变为+2,Cu的氧化态从+2变为0。
2. 反应式2H2 + O2 → 2H2O中,H的氧化态从0变为+1,O的氧化态从0变为-2。
练习四:沉淀反应1. 已知Ba2+和SO42-反应生成BaSO4沉淀,若溶液中Ba2+的浓度为0.01M,SO42-的浓度为0.005M,则生成的BaSO4沉淀的量为0.005摩尔。
2. 如果溶液中Ag+的浓度为0.02M,Cl-的浓度为0.01M,则生成的AgCl沉淀的量为0.01摩尔。
练习五:配位化学1. 配位体是含有孤对电子的分子或离子,能够与中心金属离子形成配位键。
2. 配位数是指一个中心金属离子周围配位体的数量,例如在[Fe(CN)6]3-中,Fe3+的配位数是6。
结束语:以上是无机及分析化学练习册的部分答案,希望能够帮助同学们更好地理解和掌握无机化学的基本概念和计算方法。
在实际学习过程中,还应结合具体题目和实验操作,深入理解无机化学的原理和应用。

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。

无机及分析化学期末考试题及答案一、单选题1.无机化合物中的离子反应属于()A.不化反应B.单纯化学反应C.催化反应D.电解反应答案:B2.以下哪一种化学反应并不属于“催化反应”( )A.歧化反应B.过氧化呋喃反应C.银离子捕获氧反应D.还原缩合反应答案:A3.碱金属的无机盐的共价键的分类属于()A.金属–离子键B.金属–氧键C.共价键D.金属–气体键答案:A4.稀硫酸中的sulfur氧化物分子具有以下哪个稳定式()A.SO3B.SO4C.SO2D.S2O答案:B5.根据量子理论,氮原子键定电子主要发生在()A.1s orbitB.2s orbitC.2p orbitD.3d orbit答案:C二、多选题1.汞元素的共价键()A.金属–阴离子键B.金属–酸根键C.金属–气体键D.金属–离子键答案:A、B、D2.Friedel-Crafts的acylation反应的活性变为极性的物质有()A.稀硫酸B.硝酸C.硫酸D.氯化物答案:A、B、C3.化学分析中所用的主要的检测方法有()A.光谱定性分析B.滴定测定C.物质量分析D.比色测定答案:A、B、D4.下列分子结构中,属于共价键的是()A.HClB.H2OC.CH4D.NH3答案:B、D三、填空题1.细胞折射定理是 __ 物质会有折射率的理论。
答案:变性剂2.氯气可以缓慢氧化形成氯___ 。
答案:水。

无机及分析化学智慧树知到课后章节答案2023年下长江师范学院长江师范学院第一章测试1.化学主要是在分子、原子或离子等层次上研究物质的组成,结构,性能,相互变化以及变化过程中能量关系的科学。
()A:错 B:对答案:对2.卢瑟福提出了量子化原子模型,揭示了原子内部的构造奥秘,认识了物质的无限可分性。
()A:对 B:错答案:错3.化学变化的特点是()A:反应前后质量守恒,且有新物质生成B:电荷守恒C:质量守恒D:能量守恒答案:反应前后质量守恒,且有新物质生成4.把分子中的原子重新组合,但原子不变的运动称为()A:物理运动B:核反应运动C:化学运动D:微观运动答案:化学运动5.被恩格斯称为化学之父的科学家是:()A:盖斯B:拉瓦锡C:道尔顿D:门捷列夫答案:道尔顿6.发现氧元素的科学家是()。
A:波义尔B:道尔顿C:拉瓦锡D:门捷列夫答案:拉瓦锡第二章测试1.稀溶液的依数性中起决定性的性质是溶液的蒸气压下降。
()A:对 B:错答案:对2.质量相同的N2和O2,在同温同压下,它们的体积比为7:8。
()A:错 B:对答案:错3.理想气体状态方程用于真实气体的条件是()A:高温、高压B:低温、低压C:高温、低压D:低温、高压答案:高温、低压4.由过量KBr溶液与AgNO3溶液混合得到的溶胶,其()A:溶胶是负溶胶B:反离子是NO3-C:电位离子是Ag+D:扩散层带负电答案:溶胶是负溶胶5.比较① 0.1 mol·L-1 Na2SO4溶液;② 0.1 mol·L-1 CH3COOH溶液;③ 0.1mol·L-1 C6H12O6溶液④ 0.1 mo l·L-1 NaCl溶液。
各水溶液的渗透压从大到小的顺序为:()A:①﹥③﹥④﹥②B:④﹥③﹥①﹥②C:①﹥④﹥②﹥③D:①﹥②﹥③﹥④答案:①﹥④﹥②﹥③6.68%HNO3(相对分子质量为63,密度ρ为1.40g.ml-1)水溶液,质量摩尔浓度为()。
第一章 化学计量、误差和数据处理题解1-1称取纯金属锌0.3250g,溶于HCl 后,在250ml 容量瓶中定容,计算该标准Zn 2+溶液的浓度。
解:1Zn Zn Zn L mol 01988.02500.039.653250.0V M m c 2−⋅=×=×=+1-2计算下列溶液的滴定度T ,以g / ml 表示:①c (HCl) = 0.2015mol·L -1的HCl 溶液,用来测定Ca(OH)2、NaOH; ②c (NaOH) = 0.1732mol·L -1的NaOH 溶液,用来测定HClO 4、CH 3COOH。
解:(1)Ca(OH)2 + 2HCl = CaCl 2 + 2H 2O ; NaOH + HCl = NaCl + H 2O令x 表示待测物的计量系数,b 表示测定滴定物的计量系数,则滴定度滴与定物的量浓度的关系为:3/10−=x B B x M C bxTmlg M C T mlg M C T NaOH B HCl NaOH OH Ca B HCl OH Ca /10060.800.40102015.0111011/10465.709.74102015.0211021333/33)(3/)(22−−−−−−×=×××=××=×=×××=××=(2)3/10−=x B B x M C bx Tmlg M C T mlg M C T COOH CH B NaOH COOH CH HClO B NaOH HClO /1004.105.60101732.01011/1074.146.100101732.01011233/233/3344−−−−−−×=××=××=×=××=××=1-3有一NaOH 溶液,其浓度为0.5450mol·L -1,取该溶液100.0ml,需加水多少ml 方能配成0.5000mol·L -1溶液?解:设需加水x mL ,则 0.5450×100.0=0.5000(100.0+x)x =-109.0-100.0 =9.00 mL1-4欲配制c (HCl) = 0.5000mol·L -1的HCl 溶液。
无机及分析化学习题及解答无机及分析化学习题解答严新徐茂蓉葛成艳编第一章绪论1.1判断下列误差属于何种误差?①在分析过程中,读取滴定管读数时,最后一位数字n次读数不一致,对分析结果引起的误差。
②标定HCl溶液用的NaOH标准溶液中吸收了CO2,对分析结果所引起的误差。
③移液管、容量瓶相对体积未校准,由此对分析结果引起的误差。
④在称量试样时,吸收了少量水分,对结果引起的误差。
答:①偶然误差;②系统误差中的试剂误差;③系统误差中的仪器误差;④过失误差1.2测得Cu百分含量为41.64%、41.66%、41.58%、41.60%、41.62%、41.63%,计算测定结果的平均值、平均偏差、相对平均偏差。
(无须舍去数据)解:41.64%41.66%41.58%41.60%41.62%41.63%41.62%6x+++++==1id x xn=-∑=2.2×10-4 100%rddx=⨯=0.053%1.3测定某样品中铁的百分含量,结果如下:30.12%、30.05%、30.07%、30.05%、30.06%、30.03%、30.02%、30.03%根据Q检验法,置信度为90%时是否有可疑数要舍去,计算分析结果的平均值、标准偏差、变异系数和对应的置信区间。
解:排序:30.02%、30.03%、30.03%、30.05%、30.05%、30.06%、30.07%、30.12%先检验最大值30.12%:30.12%30.07%0.530.12%30.02%Q-==-Q0.9=0.47 < 0.5,所以舍去30.12%继续检验最大值30.07%,30.07%30.06%0.230.07%30.02%Q-==-,Q0.9=0.51>0.2,不应舍去,30.07%应该保留。
检验最小值30.02%,30.03%30.02%0.230.07%30.02%Q-==-Q 0.9=0.51>0.2,不应舍去,30.02%应该保留。
《无机及分析化学》在线作业参考资料一、单选题1.在1溶液中,用0.05滴定0.05溶液,化学计量点的电势为1.06V,滴定突跃0.86V~1.26V,选择下列哪种指示剂最好(C)A.二苯胺磺酸钠()B.邻苯胺基磺酸钾()C.邻二氮菲-亚铁()D.硝基邻二氮菲-亚铁()2.标定KMnO4溶液浓度时,应使用的基准物质是(D)A K2Cr2O7B Na2CO3C Na2S2O3D Na2C2O43.对钠,铝,磷,氯四种元素,随原子序数增加元素性质变化叙述正确的有(B)A第一电离能依次增加B最高氧化值依次增大C原子半径依次增大D电负性依次增大4.基态13Al原子最外层电子的四个量子数应是(A)A 3,1,+1,+1/2B 4,1,0,+1/2C 3,2,1,+1/2D 3,2,2,+1/2,5.邻苯二甲酸分子间存在的分子间力有(C)A色散力 B取向力 C诱导力 D氢键6.若将氮原子的电子排布式写成1s22s22px22py1,它违背(D)A能量守恒原理 B泡利不相容原理 C能量最低原理 D洪特规则7.下列分子中偶极矩不为零的是(B)A CCl4B NH3C SF6D BeCl28.下列函数均为状态函数的是(C)A H,G,UB U,S,QC G,W,UD G,S,W9.下列结论正确的是(B)A 当△H>0,△S<0时,反应自发进行B当△H<0,△S>0时,反应自发进行C 当△H<0,△S<0时,任何温度下均不自发进行D当△H>0,△S>0时,任何温度下均不自发进行10.下列哪一组数值是原子序数19的元素的价电子的四个量子数(依次为n,l,m,ms)(B)A 1,0,0,+1/2B 2,1,0,+1/2C 3,2,1,+1/2D 4,0,0,+1/211.下列物质中,常用作基准物质来标定NaOH溶液浓度的是(B)A H2CO3 B邻苯二甲酸氢钾 C苯酚 D H2C2O4 ·2H2O12.选出核外电子排布正确的粒子(D)A (Cu1+(Z=29)) [Ar]3d10;B (Fe3+(Z=26)) [Ar]3d5;C (Ba(Z=56)) 1s22s22p63s23p64s23d104p65s24d105p66s2;D (Zr(Z=40)) [Ar]4d25s2;13.原子核外电子排布主要应遵循(A)A统计规律 B能量最低原理 C泡利不相容原理 D洪特规则14.原子序数为33的元素,其原子在n=4,l=1,m=0的轨道中的电子数为(D)A 1B 2C 3D 4E 515.在l=3的亚层中,最多能容纳的电子数是(B)A 2B 6C 10D 1416.离子的空间构型是(C)A.平面正方形B.三角锥形C.四面体D.八面体17.已知某弱酸HA在水中的解离平衡常数为,则的为(C)A.B.C.D.18.的溶液中分子间主要存在的作用力是(A)A.色散力B.取向力C.取向力、诱导力、色散力D.氢键、诱导力、色散力19.下列电极电势最大的是(D)A.B.C.D.20.下列分子中心原子是杂化的是(C)A.B.C.D.21.下列分子或离子中,键角最小的是(B)A.HgCl2B.H2OC.NH3D.PH322.下列说法正确的是(C)A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体;B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。
《无机及分析化学实验》复习题及参考答案1、化学试剂分为几大类?实验室中最普遍使用的一般试剂分为几个等级?如何选用化学试剂?答:化学试剂的选用应以实验要求,如分析任务、分析方法的灵敏度和选择性、分析对象的含量及对分析结果正确度要求等为依据,合理选用不同等级的试剂。
不同等级的试剂价格差别很大,纯度越高价格越贵,试剂选用不当,将会造成资金浪费或影响实验结果,故在满足实验要求的前提下,选择试剂的级别应就低而不就高。
此外应注意,不同厂家、不同原料和工艺生产的化学试剂在性能上有时会有显着差异,甚至同一厂家、不同批号的同一类试剂在性质上也很难完全一致,因此在较高要求的分析中,不尽要考虑试剂的等级,还应注意生产厂家、产品批号等事项,必要时应作专项检验和对照实验。
2、在容量分析实验中使用的玻璃仪器中,哪些玻璃仪器在用蒸馏水淋洗后,还要用待装溶液淋洗?简述玻璃仪器的一般洗涤过程及其是否洗净的检验方法。
答:容量分析操作中常用的玻璃仪器有滴定管、移液管、吸量管、容量瓶和锥形瓶,其它可能使用的玻璃仪器还有烧杯、量筒等,其中滴定管、移液管和吸量管在清洗干净和用蒸馏水淋洗后,还需用少量待装溶液淋洗2~3次,各次淋洗时待装溶液的用量约为10mL、5mL、5mL。
玻璃仪器的洗涤方法应根据实验的要求、污物的性质及其弄脏程度来选择,洗涤玻璃仪器的一般步骤是:⑴用自来水刷洗:用大小合适的毛刷刷洗,使附着在器壁上的灰尘和不溶性杂质脱落,再用自来水冲刷掉已脱落的灰尘、不溶性杂质和可溶性杂质。
⑵用去污粉或合成洗涤剂刷洗:用大小合适的毛刷蘸取去污粉或合成洗涤剂刷洗,使附着器壁的有机物和油污脱落,再用自来水冲洗;若油垢和有机物仍洗不干净,可将合成洗涤剂或肥皂液适当加热再洗涤。
⑶用洗液洗涤:先将玻璃仪器中的水尽量除去,再把洗液加入玻璃仪器内,洗液用量约为玻璃仪器总容量的1/5,倾斜仪器并慢慢转动(注意!勿将洗液流出),使仪器内壁全部被洗液润湿。
数分钟后,将洗液倒回洗液瓶中(可反复使用至洗液颜色变绿色时才失效),再用自来水完全洗去残留在器壁上的洗液。
您的本次作业分数为:94分单选题1.HCl和H2O两分子间形成的分子间作用力有()。
• A 色散力• B 取向力• C 诱导力• D 以上三者全有.正确答案:D•单选题2.从精密度好就可以断定分析结果可靠的前提是()。
• A 随机误差小• B 系统误差小• C 平均偏差小• D 标准偏差小正确答案:B•单选题3.称取同样质量的两种难挥发的电解质A和B,分别溶解在1升水中,测得A溶液的凝固点比B溶液的凝固点低,则()。
• A B的分子量小于A的分子量• B A的分子量和B的分子量相同• C B的分子量大于A的分子量正确答案:C•单选题4.两成键原子的原子轨道沿核间连线以“肩并肩”方式重叠形成()。
• A σ键• B 离子键• C Π键• D 氢键正确答案:C•单选题5.在酸碱滴定中,选择指示剂可不必考虑的因素是()。
• A pH突跃范围• B 指示剂的变色范围• C 指示剂的颜色变化• D 指示剂的分子结构正确答案:D•单选题6.多电子原子中决定电子能量的量子数为()。
• A n• B n,l• C n,l,m• D n,l,m,si正确答案:B•单选题7.可以减少分析测试中随机误差的措施是()。
• A 增加平行测定次数• B 进行方法校正• C 进行空白试验• D 进行仪器校正正确答案:A•单选题8.溶胶发生电泳时,向某一方向定向移动的是()。
• A 胶核• B 吸附层• C 胶团• D 胶粒正确答案:D•单选题9.某金属与其离子溶液组成电极,若溶液中金属离子生成配合物后,其电极电势值()。
• A 变小• B 变大• C 不变• D 难以确定正确答案:A•单选题10.用EDTA 直接滴定有色金属离子,终点所呈现的颜色是()。
• A 指示剂-金属离子配合物的颜色• B 游离指示剂的颜色• C EDTA-金属离子配合物的颜色• D (B)和(C)的混合颜色正确答案:D•单选题11.19号元素K基态最外层电子的四个量子数为()。
第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
1.根据下列酸碱的解离常数,选取适当的酸度是共轭碱来配置PH=4.50和PH=10.00的缓冲溶液,其共轭酸,碱的浓度比应是多少?HAC,NH3·H2O,H2C2O4 ,NaHCO3 ,H3PO4 ,NaAC,NaHPO4,C6H5NH2,NH4cl解:选择HAC和NaAC来配置PH=4.50的缓冲液,共轭酸碱的浓度比可由以下来计算检表得:K aΘ(HAC)=1.8×10-5K bθ(AC-)=Kw/K aΘ=10-14/(1.85×10-5)=5.6×10-10由PH=14-Pk bθ+lg((C(AC-))/(C(HAC)))可得4.50=14-lg(5.6×10-10)+lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=4/7=1.74选择NH3·H2O和NH4cl来配制PH=10.00的缓冲液,共轭酸碱的浓度比如下K bθ(NH3·H2O)=1.8×10-5PH=14- K bθ(NH3·H2O)+lg(C(NH3·H2O)/C(NH4cl))10=14-lg(1.8×10-5)+ lg(C(NH3·H2O)/C(NH4cl))解得:C(NH3·H2O)/C(NH4cl)=5:12.欲配制250mlPH=5.00的缓冲液,问在125ml,1.0mol·L-1NaAC溶液中应加入多少毫升6.0 mol·L-1溶液?解:由题意得可设还应加入xml,6.0 mol·L-1的HAC溶液检表得K aΘ(HAC)=1.8×10-5PH=Pk aθ(HAC)+ lg((C(AC-))/(C(HAC)))5=-lg(1.8×10-5)+ lg((C(AC-))/(C(HAC)))解得:(C(AC-))/(C(HAC))=1.82n(AC-)=0.125×1mol·L-1=0.125mol;n(HAC)=6x×10-3mol0.125/(0.125+x×10-3)/(6x×10-3/(0.125+x×10-3))=0.125/(6x×10-3)解得:x=11.6ml3.计算下列各溶液的PH:(3)20.0ml 0.10 mol·L-1NaOH和20.0ml 0.20 mol·L-1NH4cl 溶液混合解:由题意的检表可得K b(NH3)θ= 1.8×10-5 ; K aθ(NH4+)=Kw/ K b(NH3)θ=10-14/(1.8×10-5 )=5.56×10-10n(OH-)=0.002mol n(NH4+)=0.004molC(NH3·H2O)=0.002/(0.02+0.02)=0.05 mol·L-1C(NH4+)=0.02/(0.02+0.02)=0.05 mol·L-1PH=Pk aθ(NH4+)+lg(C(NH3·H2O)/C(NH4cl))=-lg(5.56×10-10)+0=9.26(5)20.0ml 0.10 mol·L-1Hcl和20.0ml 0.20 mol·L-1NaAC溶液混合混合前:n(H+)=0.002mol n(AC-)=0.0004mol混合后:C(HAC)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1 C(AC-)=0.002/(0.02+0.02)mol·L-1=0.05 mol·L-1 PH=Pk aθ(HAC)+lg((C(AC-))/(C(HAC)))检表得:Pk aθ(HAC)=1.8×10-5=-lg(1.8×10-5)+lg(0.05/0.05)=4.74(9)300.0ml 0.5 mol·L-1H3PO4与400.0ml 1.00 mol·L-1 NaOH 的混合液n(H3PO4)=0.3×0.5=0.15mol C(OH-)=0.4×1mol=0.4molK aθ(HPO42-)=4.5×10-13混合后:n(Na3PO4)=0.1moln(Na2HPO4)=0.05mol则:n(Na3PO4)/ n(Na2HPO4)=2PH= K aθ(HPO42-)+lg2=-lg(4.5×10-13)+lg2=12.651.今有2.00L的0.5001.00 mol·L-1NH3(aq)和2.0L的0.500 mol·L-1 Hcl溶液,若配制PH=9.00的缓冲溶液,不允许再加水,最多能配制多少升缓冲溶液,其中C(NH3),C(NH4+)各为多少?解:由表可知: K b(NH3)θ=1.8×10-5则PH=14- K bθ(NH3·H2O)+ lg(C(NH3·H2O)/C(NH4cl))=9即:PH=14-4.74+ lg(C(NH3·H2O)/C(NH4cl))=9得lg(C(NH3·H2O)/C(NH4cl))=-0.26解得C(NH3·H2O)/C(NH4cl)=0.55设 xL NH3·H2O yL HCl则有 C(NH3·H2O )=n(NH3·H2O )/V总=0.5(x-y)/(x +y) mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1即C(NH3·H2O )/ C(NH4+)=0.55解得x/y=1.55若要溶液最多,只需令x=2.00L,则y=1.3L此时 C(NH3·H2O )=0.5(x-y)/(x+y) mol·L-1 =0.11 mol·L-1C(NH4+)=n(Hcl)/ V总=0.5y/(x+y) mol·L-1 =0.2 mol·L-12.列表指出下列配合物的形成体、配体、配位原子和形成体的配位数;确定配离子和形成体的配位数;确定配离子和形成体的电荷数,并给出他们的命名。
(1)[Crcl2(H2O)4]cl (3)K2[Co(Ncs)4] (5)[Ptcl2(NH3)2](7)[Fe(edta)]- (9)Cr(Co)6 (11)[Mn(CN)5]3.计算下列取代反应的标准平衡常数(1)Ag(NH3)2+(aq)+2S2O32-(aq)=Ag(S2O3)22-(aq)+2NH3(aq)(2)Fe(C2O4)33-(aq)+6CN-(aq)=Fe(CN)63-(aq)+3C2O42-(aq) (3)Co(NCS)42-(aq)+4NH3(aq)=Co(NH3)42+(aq)+4NCS-(aq)解:(1)KѲ=C[Ag(S2O3)23-]C2(NH3)/(C[Ag(NH3)2+]C2(S2O32-))KѲ=K fѲ[Ag(S2O3)23-]/ K fѲ C[Ag(NH3)2+]=2.9×1013/(1.67×107)=1.7×10^6(2)KѲ=C([Fe(CN)63-])C3(C2O42-)/(C[Fe(C2O4)33-]C6(CN-)=K fѲ[Fe(CN)63-]/ KfѲ[Fe(C2O4)33-]=4.1×1052/(2.56×1032)=2.56×1032(3) KѲ=C[Co(NH3)42+]C4(NCS-)/(C[Co(NCS)42-]C4(NH3))= K fѲ[Co(NH3)42+]/ K fѲ[Co(NCS)42-]=1.16×105/(103)=1.16×10222.在500.0ml的0.01 mol·L-1Hg(NO3)2溶液中,加入65.0gkI (s),生成[HgI4]2-。
计算溶液中的Hg2+,H股I2-,I-的浓度解:C(I-)=m/MV=65.0/(1669×0.5)=0.783 (mol·L-1 )查表得 K fѲ[HgI42-]=5.66×1029,所以反应进行的很完全Hg2+ +4I- = [HgI4]2-起始浓度 0.01 0.783 0反应后 0 0.783-4×0.01 0.01反应完后HgI42-]开始解离,设[HgI42-]解离x mol·L-1后达到平衡HgI42- =Hg+ +4I-起始浓度 0.01 0 0.743平衡 0.01-x x 0743+4x1/K fѲ[HgI4]2-=C(Hg)C4(I-)/C([HgI4]2-)=x(0.743+4x)4/(0.01-x)=1/(5.66×1029)解得 x=5.8×10-32C(I-)=0.743 C([HgI4]2-)=0.0123.Cr3+与EDTA的发应为Cr3+(aq)+H2Y2-(aq)=CrY-(aq)+2H+在PH=6.00的缓冲溶液中,最初浓度为0.0010 mol·L-1Cr3+和0.050 mol·L-1 Na2H2Y反应。
计算平衡Cr3+的浓度Cr3+(aq) + H2Y2-(aq) = CrY-(aq)+ 2H+(aq)起始浓度0.001 0.05 0 1×10-6平衡浓度 x 0.05-0.001+x 0.001-x1×10-6KѲ=C(CrY-)C2(H+)C(Y4-)C(HY3-)/(C(Cr3+)C(H2Y2-)C(Y4-)C(HY3-))=(0.001-x)( 1×10-6 )^2/(x(0.049+x))解得 x=5.01×10-2125.在25℃时,Ni(NH3)62+溶液中,C(Ni(NH3)62+)为0.1 mol·L-1 C(NH3)=1.0 mol·L-1加入乙二胺(en)后,使开始时C(en)=2.3 mol·L-1。
计算平衡时溶液中Ni(NH3)62+,NH3,Ni(en)32+的浓度解: Ni(NH3)62+ + 3en = Ni(en)32+ + 6NH3起始浓度 0.1 2.3 0 1平衡浓度 x (2.3-0.1×3+3x) 0.1-x 1+0.1×6-6xKѲ= K fѲ(Ni(en)22+)/ K fѲ(Ni(NH3)62+)=`C6(NH3)C(Ni(en)32+)/(C(Ni(NH3)62+)C3(en))=(1.6-6x)6(0.1-x)/(x(2+3x))3=2.1×1018/8.97×108x=9×10-11C(Ni(NH3)62+)=9×10-11mol·L-1(NH3)=1.6 mol·L-1 C(Ni (en)32+)=0.11.6 mol·L-13.在化学手册中查到下列各物质的溶解度。