专题有关金属及其化合物的计算(课件)-2016-2017学年高一化学上册.pdf
- 格式:pdf
- 大小:1.14 MB
- 文档页数:11


第11讲铁及其化合物知识导图模块一铁的单质知识精讲一、铁的存在形态铁在自然界中可以像陨铁中的铁那样以______形态存在,但主要是以____价和____价_______的形态存在于矿石中;铁元素在地壳中的含量仅次于_____、_____和_____,居第四位。
【答案】单质,+2,+3,化合物,氧,硅,铝二、铁的物理性质纯铁具有金属的通性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性。
三、铁的化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
资料卡片——生铁与纯铁的抗腐蚀性能1.Fe与非金属反应:(横线上填化学方程式)2.Fe与酸反应:(横线上填氧化产物及还原产物)3.Fe与水反应(1)反应原理:_____________________________________________。
【答案】3Fe + 4H2O(g) =====高温Fe3O4 + 4H2(2)实验装置思考与交流【答案】1.提供水蒸气;2.检验反应中生成的H2;3.铁与水反应是有条件的,铁在高温条件下与水蒸气反应,铁不与冷、热水反应,故可以用铁壶盛水。
纯铁的抗腐蚀性能比生铁好。
原因是生铁中含有碳等物质,在有电解质溶液(比如雨水等)情况下会形成原电池,铁作为负极被加速腐蚀。
1.湿棉花的作用:______________________________________________________。
2.肥皂液的作用:______________________________________________________。
3.铁与水可以发生反应,为什么还可以用铁壶来盛水呢?4.铁与盐溶液反应:(横线上填化学方程式)5.常温下,铁在浓硫酸或浓硝酸中会发生钝化。
资料卡片——钝化原理归纳总结——铁的还原性四、铁单质的冶炼(高炉炼铁)铁单质冶炼的原理就是利用还原剂将铁从矿石中还原出来。

2017届高三二轮复习讲练测之讲案【新课标版化学】专题十一金属及其化合物(1)考纲要求1.了解金属(如Na、Al、Fe、Cu等)在周期表中的位置及其性质递变的规律。
2.了解常见金属元素及其重要化合物的主要性质及应用。
3.了解合金的概念及其重要应用。
4.以上各部分知识的综合应用。
(2)命题规律钠、铝、铁、铜及其化合物是日常生活中非常重要的金属元素,特别是铁在国民经济中占有极其重要的地位,这部分内容一直是高考考查的重点。
如以钠及其化合物(特别是Na2O2、NaHCO3、Na2CO3)的性质为载体的推断题或实验题、铝及其化合物的两性、Fe2+与Fe3+之间的转化关系、铜的冶炼及Cu(OH)2的性质等。
钠及其化合物、合金与硝酸的反应是每年高考的必考知识点。
估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力。
因此在复习时要注意元素单质及其化合物之间的相互转化,如“铝三角”、“铁三角”,同时在复习时要加强化合物知识与理论部分的联系。
【例1】【2016年高考新课标Ⅱ卷】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为()A.NaHCO3、Al(OH)3B.AgCl、NaHCO3C.Na2SO3、BaCO3D.Na2CO3、CuSO4【例2】【2016年高考上海卷】已知NaOH+Al(OH)3→N a[Al(OH)4]。
向集满CO 2的铝制易拉罐中加入过量NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。
上述实验过程中没有发生的离子反应是 ( )A .CO 2+2OH −→CO 32−+H 2OB .Al 2O 3+2OH −+3 H 2O→2 [Al(OH)4]−C .2 Al+2OH −+6H 2O→2 [Al(OH)4] −+3 H 2↑D .Al 3++4 OH −→[Al (OH)4]−1、钠及其化合物(1)知识网络(2)注意事项①钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。

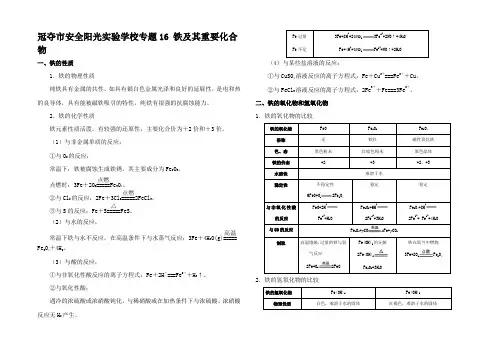
冠夺市安全阳光实验学校专题16 铁及其重要化合物一、铁的性质1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应: ①与O 2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃时:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
Fe 过量 3Fe+8H ++23NO -3Fe 2++2NO↑+4H 2O Fe 不足Fe+4H ++3NO -Fe 3++NO↑+2H 2O(4)与某些盐溶液的反应:①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。
二、铁的氧化物和氢氧化物 1.铁的氧化物的比较铁的氧化物 FeO Fe 2O 3 Fe 3O 4 俗称 无 铁红 磁性氧化铁 色、态 黑色粉末 红棕色粉末黑色晶体 铁的价态 +2+3 +2、+3水溶性 难溶于水 稳定性不稳定性 6FeO+O 22Fe 3O 4 稳定稳定与非氧化性酸的反应 FeO+2H+Fe 2++H 2O Fe 2O 3+6H+2Fe 3++3H 2OFe 3O 4+8H+2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +y COx Fe+y CO 2制取高温熔融,过量的铁与氧气反应 2Fe+O 22FeOFe(OH)3的分解 2Fe(OH)3Fe 2O 3+3H 2O铁在氧气中燃烧 3Fe+2O 2Fe 3O 42.铁的氢氧化物的比较铁的氢氧化物Fe(OH)2Fe(OH)3物理性质白色,难溶于水的固体红褐色,难溶于水的固体化学性质 (1)与非氧化性强酸反应Fe(OH)2+2H+Fe 2++2H 2O(2)与氧化性酸反应3Fe(OH)2+10HNO 33Fe(NO 3)3+NO↑+8H 2O(3)空气中放置被氧化4Fe(OH)2+2H 2O+O 24Fe(OH)3(1)与酸反应Fe(OH)3+3H +Fe 3++3H 2O(2)受热分解2Fe(OH)3Fe 2O 3+3H 2O制备①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH 溶液,赶走溶解的氧气 ③配制FeSO 4溶液,加少量的还原铁粉④用长滴管将NaOH 溶液送入FeSO 4溶液液面以下Fe 2++2OH −Fe(OH)2↓将NaOH 溶液滴入Fe 2(SO 4)3溶液中Fe 3++3OH −Fe(OH)3↓三、“铁三角”及其应用 “铁三角”的四应用:(1)判断离子共存......: Fe 3+、Fe 2+与3HCO -、2AlO -、23CO -等在溶液中因发生相互促进水解反应而不能大量共存;Fe 2+与3NO -(H +)、ClO −、4MnO -(H +),Fe 3+与S 2−、I −、HS −、23SO -在溶液中因发生氧化还原反应而不能大量共存。



常见合金及其应用高考频度:★★★☆☆难易程度:★☆☆☆☆典例在线碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点B.它易导电、导热,具有延展性C.它的熔、沸点比Zn的低D.它的硬度和强度比Cd的大【答案】A【解析】碲锌镉晶体是由Te、Zn、Cd按一定比例熔合而成的具有金属特性的合金,只要比例确定,其组成就固定,因而有固定的熔、沸点;合金具有比成分金属低的熔、沸点,具有较高的硬度和强度。
解题必备一、常见的合金(1)铜合金(2)钢——用量最大、用途最广的合金。
(3)铝合金(4)钛合金二、对合金的深化理解1.合金是混合物而不是纯净物。
2.不锈钢的抗腐蚀能力比纯铁强。
3.合金具有许多优良的物理、化学和机械性能,在许多方面不同于各成分金属,不是简单加合;但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
4.并非所有的金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度范围内都能熔化,若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
学霸推荐1.合金的应用极大地促进了人类社会的发展。
下列不属于...合金的是A.狗头兽首铜像B.柔性显示屏C.流通硬币D.潜水器外壳(钛、铝等)2.下列说法正确的是A.金属元素在不同的化合物中化合价均相同B.所有合金都只含有金属元素C.可利用铝热反应冶炼单质镁D.镁合金的硬度和强度均高于纯镁3.下列说法不正确的是A.钢是铁合金,钢的含碳量低于生铁,性能优于生铁B.金属具有的物理通性是具有良好的延展性、导热性、导电性,并有银白色光泽C.符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质D.焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点4.将9.4克的铜铝合金,投入到足量的稀硫酸中充分反应后,共收集到标准状况下氢气6.72升,计算:(1)参加反应的H2SO4的物质的量;(2)合金中金属铜的质量。



第2课时碳及其化合物间的转化一、自然界中碳及其化合物间的转化1.转化形式2.溶洞及钟乳石、石笋的形成(1)溶洞形成的化学方程式为_______________________________________________。
________________________________________________________________________(2)钟乳石、石笋形成的化学方程式为______________________________________________________________________________________________________________。
二、生产和生活中碳及其化合物间的转化1.高炉炼铁(1)原料:______和__________(主要成分是______)。
(2)过程(实际起还原作用的是______)①CO的产生相关反应的化学方程式为:_______________________________________________②铁矿石被还原相关反应的化学方程式为_________________________________________________;________________________________________________________________________;________________________________________________________________________。
2.木炭燃烧(用化学方程式表示)①________________________________________________________________________,②________________________________________________________________________,③________________________________________________________________________,④________________________________________________________________________。
专题五 钠、镁、铝及其化合物课标要求1.结合真实情境中的应用实例或通过实验探究,了解钠及其重要化合物的主要性质。
2.了解钠及其化合物在生产、生活中的应用。
3.认识钠及其化合物的多样性。
4.认识钠及其化合物的转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
5.能说明金属冶炼对社会发展的价值、对环境的影响。
核心考点核心命题角度考题取样命题情境素养能力钠及其化合物过氧化钠的制备与性质2019全国卷Ⅱ,11C生活实践分析与推测混合物中碳酸钠质量分数的测定2016浙江4月选考,28学习探索探究与创新碱金属及其化合物的性质 焰色反应碱金属及其化合物的性质 焰色反应2018全国卷Ⅰ,7生活实践分析与推测镁及其化合物镁及其化合物性质的实验探究2019全国卷Ⅱ,10B学习探索探究与创新铝及其化合物以“微型流程”为载体考查铝及其化合物的性质(热点角度)2016海南,14生活实践分析与推测有关Al2O3或Al的制备工艺流程(热点角度)2017浙江下半年选考,31学习探索探究与创新高考怎么考 高考中常以一个选项或一个填空的形式考查钠与过氧化钠的性质、镁及其化合物的性质、铝及其化合物的性质和用途、碳酸钠与碳酸氢钠的鉴别及有关计算,体现高考命题的基础性和应用性。
另外,高考也常结合电化学原理对锂、镁等进行考查,在工艺流程题或实验探究题中也会涉及对镁、钙和铝等的考查,体现了高考命题的创新性。
预计2022年高考以选择题形式考查物质的结构与性质(如钠的活泼性、过氧化钠的结构与性质、碳酸氢钠的热不稳定性)的概率较大;对镁、铝、锂、铅、锡及其化合物的考查会结合铁、铜及其化合物等的性质和应用以工艺流程的形式出现考点1 钠及其化合物考点帮·必备知识通关考法帮·解题能力提升考法1钠的性质及应用考法2 过氧化钠的性质及应用考法3 碳酸钠、碳酸氢钠的性质考点2碱金属及其化合物的性质 焰色反应考点帮·必备知识通关考法帮·解题能力提升考法4 碱金属及其化合物的性质 焰色反应考点3 镁及其化合物考点帮·必备知识通关考法帮·解题能力提升考法5 镁及其化合物的性质考点4 铝及其化合物考点帮·必备知识通关考法帮·解题能力提升考法6 “铝三角”转化关系及其应用考法7 与Al(OH)3沉淀的生成相关的图像高分帮 “双一流”名校冲刺析素材·专题突破素材1 有关锂的化合物的性质和应用素材2 有关钙及其化合物的性质和应用素材3 有关硼及其化合物的性质和应用素材4 有关铅、锡及其化合物的性质和应用考点帮▪必备知识通关1.钠的性质、制备、保存及用途物理性质银白色,有金属光泽,质地柔软,熔点低,密度比水小、比煤油大化学性质(1)与O 2反应常温:4Na+O 2 2Na 2O(白色); 加热或点燃:2Na+O 2 Na 2O 2(淡黄色)。
三、教学目标【知识与技能】1、了解FeO、Fe2O3、Fe3O4的性质和应用2、掌握Fe(OH)2和Fe(OH)3的制备和性质。
【过程与方法】1、学会运用实验、观察等获取科学事实的基本方法,研究物质的性质。
2、初步学会运用:分类、比较、分析、归纳、演绎等整理科学事实的基本方法,学习物质的性质。
3、学会预测陌生物质化学性质的基本思路【情感态度与价值观】1、通过实验和观察,培养学生的科学探究精神和实事求是的科学品质。
2、通过铁的化合物的性质与用途的学习,使学生进一步认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用,提高学习化学的兴趣,增强学好化学,服务社会的责任感和使命感。
四、教学重点、难点铁的重要化合物的氧化性或还原性五、教学流程图2:教学流程图六、教学过程教学活动设计意图教师活动学生活动【环节一】引入“价-类”二维图这个工具、提炼学习元素化合物的思维方法【任务1】以铁化合物的类别为横轴坐标,化合价为纵座标,画出铁的化合物的类别-价态二维图【思考】如何从化学角度去学习和认识这些物质呢?(即怎么学?)补充完善,学生代表评析(1)类别角度:学习物质通性;(2)价态角度:学习物质的氧化还原反应。
引导学生从类别、价态角度学习物质,渗透学习元素化合物的思维方法;【环节二】运用方法,自主预测铁的氧化物的性质,渗透价态观、类别观的学习。
【提问】铁的化合物在生活中有广泛应用,初三也接触过一些,一起来回顾一些例子:【任务2】从类别,价态角度预测铁的氧化物的性质。
[思考]1、由红砖(含Fe2O3)如何烧制青砖(含Fe3O4),应加入什么物质?2、如果由磁铁矿或赤铁矿冶炼单质铁,该如何实现?【学生回顾】细铁丝燃烧、磁铁成分、外墙涂料、补血口服液、天然赤铁矿、磁铁矿、红砖、青砖等图片情景,列举:Fe3O4、Fe2O3、FeSO4等。
自己预测,分流分享:类别:FeO 碱性氧化物Fe2O3 碱性氧化物Fe3O4复杂氧化物可以与酸反应从价态特点预测三种氧化物可能的性质:Fe2O3(+3)仅有氧化性FeO(+2)Fe3O4(+3、+2)氧化性,还原性学生代表交流分享归纳整理完善表格引导学生从类别、价态角度认识铁的氧化物,渗透类别观、价态观的学习;在过程中引导学生利用小组合作评价、完善性质的学习。