高一化学必修1苏教版化学方程式完全总结
- 格式:doc
- 大小:2.95 MB
- 文档页数:9

高一化学方程式专题1 化学家眼中的物质世界1、碱性氧化物与酸反应:CaO + 2HCl =CaCl2 + H2O2、酸性氧化物与见反应:CO2 + Ca(OH)2= CaCO3↓ + H2O3、单质→化合物:2H2O + O2==2H2O点燃4、碱性氧化物→碱:CaO + H2O==Ca(OH)25、酸性氧化物→酸:SO3 + H2O == H2SO46、酸→盐:H2SO4+BaCl2== BaSO4↓ + 2HCl7、置换反应:Fe + CuSO4 == Cu + FeSO48、化合反应:CaO + H2O==Ca(OH)29、分解反应:CaCO3 == CaO + CO2↑高温10、复分解反应:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH11、氧化铁高温下与CO反应:Fe2O3 + 3CO == 2Fe + 3CO2↑高温12、过氧化氢分解生成氧气和水:2H2O2 ====H2O + 2O2↑MnO213、粗盐提纯:MgCl2 + 2NaOH ==Mg(OH)2↓+ 2NaCl14、氯化铵与强碱溶液混合加热:NH4Cl + NaOH === NaCl + H2O + NH3↑△15、Cl-与硝酸银的反应:NH4Cl + AgNO3== AgCl↓+NH4NO316、SO42-与Ba2+的反应:(NH4)2SO4+ BaCl2== BaSO4↓ +2NH4Cl专题2 从海水中获得的化学物质1、工业制法——氯碱工业:2、氯的实验室制法:MnO2+4HCl (浓) =△ = MnCl2+2H2O+Cl2↑3、钠在氯气中燃烧,产生白烟:4、铁在氯气中燃烧,产生棕褐色烟:5、铜在氯气中点燃,产生棕黄色烟:Cu + Cl2 ===CuCl2点燃6、氢气在氯气中燃烧,发出苍白色火焰:H2 + Cl2 ===2HCl点燃7、P在氯气中燃烧产生大量白色烟雾:8、Cl2 与碱的反应: Cl2+2NaOH=NaCl+NaClO+H2O2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 9、Ca(ClO)2与酸反应:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO 漂白粉长时间放置于空气中将失效。
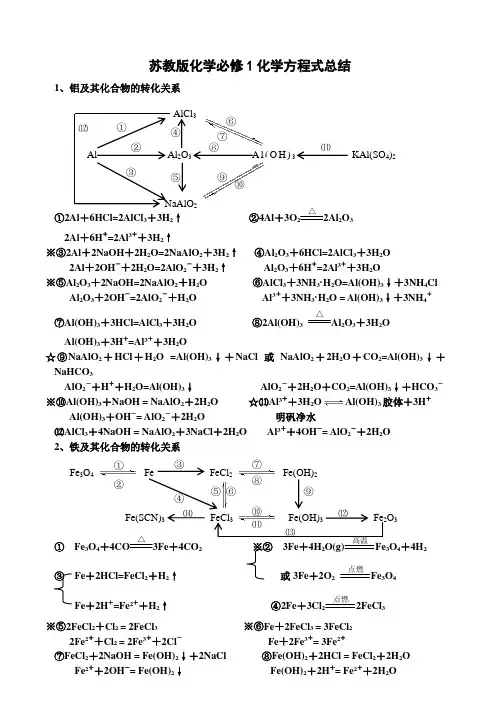
苏教版化学必修1化学方程式总结1、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 2、铁及其化合物的转化关系 ① Fe 3O 4+4CO △ 3Fe +4CO 2 ※② 3Fe +4H 2O(g) Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2OFe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⒁ 2O 3 A l (O H )3 KAl(SO 4)22AlCl 3 ④ ⑤ ⑥⑦⑧ ⑨⑩⑾※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3 3、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 4、硫及其化合物的转化关系①S +O 2 点燃SO 2 ②2H 2S +SO 2=3S +2H 2O ※③SO 2+O 2 催化剂加热 2SO 3NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂④① S 4 ②④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2 △2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓)△CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClO6、氮及其化合物的转化关系 ※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦⑧ ⑨ ⑩ ① ⑨ ⑧⑦ ⑥ N 2 NH 3 NH 4Cl NO NO HNO 3 ② ③ 点燃或光照 光照光照 高温或放电 光照※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。

苏教版《必修1》化学方程式汇总专题 1 化学家眼中的物质世界1) 2KClO 32KCl+3O 2↑ 2) 2H 2O 22H 2O+O 2↑3) 2KMnO 4K 2MnO 4+MnO 2+O 2↑4) NH 4HCO 3NH 3↑+H 2O+CO 2↑5) NH 4Cl+NaOH =NaCl+NH 3·H 2O6) (NH 4)2SO 4+2NaOH =Na 2SO 4+2NH 3·H 2O7) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O8) NH 4Cl+NaOH NaCl+NH 3↑+H 2O9) (NH 4)2SO 4+2NaOH Na 2SO 4+2NH 3↑+2H 2O 10) NH 4NO 3+NaOH NaNO 3+NH 3↑+H 2O11) NH 4Cl+AgNO 3=AgCl ↓+ NH 4NO 312) (NH 4)SO 4+BaCl 2=BaSO 4↓+2NH 4Cl专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物1) 2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑2) MnO 2+4HCl (浓) MnCl 2+Cl 2↑+2H 2O3) 2Fe+3Cl 2 2FeCl 3 (棕褐色的烟)4) Cu+Cl 2 CuCl 2 (棕黄色的烟)5) 2Al+3Cl 2 2AlCl 36) 2Na+Cl 2 =2NaCl (白烟)7) H 2+Cl 2 2HCl (苍白色火焰)8) Cl 2+H 2O HCl+HClO (Cl 2只有少量的与水反应,大量的Cl 2以分子形式存在于水溶液中,所以氯水呈黄绿色)9) 2HClO 2HCl+O 2↑10) Cl 2+2NaOH =NaCl+NaClO+H 2O11) 2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O (工业生产漂粉精)12) Ca(ClO)2+2HCl =CaCl 2+2HClO13) Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO14) Cl 2+2NaBr =2NaCl+Br 215) Cl 2+2KI =2KCl+I 216) Br 2+2KI =2KBr+I 217)* 2F 2+2H 2O =4HF+O 218) NaBr+AgNO 3=AgBr ↓+ NaNO 319) KI+AgNO 3=AgI ↓+ KNO 3点燃 点燃 点燃 点燃 铵离子 的检验通电 MnO 2 光照 漂白原理第二单元 钠、镁及其化合物1) 2Na+2H 2O =2NaOH+H 2↑2) 4Na+O 2=2Na 2O3) 2Na+O 2Na 2O 2 4) 2Na+Cl 2=2NaCl (白烟)5) 2Na+S =Na 2S (研磨爆炸)6) 4Na+TiCl 4 Ti+4NaCl7) 2NaCl 2Na+Cl 2↑8) Na 2O+H 2O =2NaOH9) 2Na 2O 2+2H 2O =4NaOH +O 2↑10) Na 2O+CO 2=Na 2CO 311) 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑12) Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 13) CaCO 3+2HCl =CaCl 2+H 2O+CO 2↑ CaCl 2或BaCl 2溶液中通入CO 2无CaCO 3或 BaCO 3沉淀生成,原因弱酸一般..不制强酸14) NaHCO 3+ HCl =NaCl+H 2O+CO 2↑(比Na 2CO 3和盐酸反应剧烈)15) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑16) NaHCO 3+NaOH =Na 2CO 3+H 2O17) CO 2 +H 2O+Na 2CO 3=2NaHCO 318) CO 2+2NaOH =Na 2CO 3+H 2O 19) CH 3COOH+NaOH =CH 3COONa+H 2O20) 2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑21) CH 3COOH CH 3COO -+H +常见的弱酸有H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、 CH 3COOH 、H 3PO 4(中强)、HCN (极弱)、H 2SiO 3(不溶) 常见的强酸有H 2SO 4、HNO 3、HCl 、HBr 、HI22) CaCO 3CaO+ CO 2↑23) CaO+H 2O =Ca(OH)2 24) Ca(OH)2+MgCl 2=Mg(OH)2↓+CaCl 2 25) Mg(OH)2+2HCl =MgCl 2+2H 2O 26) MgCl 2Mg+Cl 2↑27) 3Mg+N 2Mg 3N 228) 2Mg+CO 22MgO+C29)* Mg+2H 2O Mg(OH)2+H 2↑ 专题3 从矿物到基础材料第一单元 从铝土矿到铝合金 1) Al 2O 3+2NaOH =2NaAlO 2+H 2O 2) NaAlO 2+2H 2O+CO 2(过量)=Al(OH)3↓+NaHCO 3 3) 2Al(OH)3 Al 2O 3 +3H 2O 4) 2Al 2O 34Al+3O 2↑通电 从铝土矿中提取铝点燃 强酸制弱酸点燃 700~800℃ 通电 通电 点燃 高温 镁的提取5) 2Al+6HCl= 2AlCl 3+3H 2↑6) 2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2↑Al 与冷的浓硫酸、冷的浓硝酸钝化 7) 2Al+Fe 2O 3 Al 2O 3+2Fe 利用铝热反应还可以把 其它过渡元素从它们的氧化物(如MnO 2、Fe 3O 4、Cr 2O 3、 V 2O 5等)中还原出来8) Al(OH)3+3HCl =AlCl 3+3H 2O9) Al(OH)3+NaOH =NaAlO 2+2H 2O 10) AlCl 3+3NaOH =Al(OH)3↓+3NaCl 11) Al(OH)3+NaOH =NaAlO 2+2H 2O 12)* AlCl 3+4NaOH (过量)=NaAlO 2+3NaCl+2H 2O 13)* 2NaAlO 2+3H 2O+CO 2(少量) =2Al(OH)3↓+ Na 2CO 314)* AlCl 3+ 3NaAlO 2+6H 2O =4Al(OH)3↓+3NaCl15) KAl(SO 4)2=K ++Al 3++2SO 42- (电离方程式)16) Al 3++3H 2O Al(OH)3(胶体)+3H + (水解方程式)第二单元 铁、铜的获取及应用1) H 2、CO 、Al 、C 都可以把铁从化合物(FeO 、Fe 3O 4、Fe 2O 3)中还原出来2) CaCO 3CaO+ CO 2↑3) SiO 2+CaO CaSiO 3 4) Fe+S FeS 5) 2Cu+S Cu 2S6) 2Fe+3Cl 22FeCl 37) Cu+Cl 2CuCl 28) FeSO 4+2NaOH=Fe(OH)2↓+Na 2SO 49)* 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3白色沉淀迅速变成灰绿色最后变成红褐色10) FeCl 3+3KSCN =3KCl+Fe(SCN)3Fe 3++3SCN -=Fe(SCN)311) 2FeCl 2+Cl 2=2FeCl 312) 2FeBr 2+Br 2=2FeBr 32Fe 2++X 2=2Fe 3++2X - (X=Cl 、Br )13)* 2Fe 3++2I -=2Fe 2++I 2 (离子方程式)14) 2FeCl 3+Fe =2FeCl 315) 2FeCl 3+Cu =2FeCl 2+CuCl 2Al 是两性元素高温 高温高温 炼铁中的造渣反应点燃 点燃 AlCl 3中逐滴加入NaOH 溶液至过量Al(OH)3是两性元素第三单元 含硅矿物与信息材料1) Na 2SiO 3+2HCl =2NaCl+H 2SiO 3↓ 2) Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓ 3) 2NaOH+H 2SiO 3=Na 2SiO 3+2H 2O4) H 2SiO 3SiO 2+H 2O (SiO 2与水不反应)5) SiO 2+CaO CaSiO 36) SiO 2+2NaOH =Na 2SiO 3+H 2O7) SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃)氢氟酸与玻璃反应因此氢氟酸保存在塑料瓶中8)* SiO 2+CaCO 3CaSiO 3+CO 2↑9)* SiO 2+ Na 2CO 3Na 2SiO 3+CO 2↑10) SiO 2+2C Si+2CO ↑ (工业制粗硅)11) Si+2Cl 2SiCl 4 12) SiCl 4+2H 2Si+4HCl 13) Si+2NaOH+H 2O =Na 2SiO 3+2H 2↑14)* Si+4HF =SiF 4↑+2H 2↑15) Si+O 2SiO 2 专题4 硫、氮和可持续发展 第一单元 含硫化合物的性质和应用1) SO 2+H 2O H 2SO 32) SO 2+2NaOH =Na 2SO 3+H 2O3) 2SO 2+O 22SO 34) SO 3+H 2O =H 2SO 45)* SO 2+X 2+2H 2O =H 2SO 4+2HX (X=Cl 、Br 、I )6)* Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑(实验室制取SO 2)7) 2H 2SO 3+O 2=2H 2SO 4 (亚硫酸变质)8) 2Na 2SO 3+O 2=2Na 2SO 4 (Na 2SO 3溶液变质)9) 2CaSO 3+O 2=2CaSO 410)* SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2(除CO 2中SO 2用饱和的NaHCO 3溶液)11) Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl 12) Na 2SO 3+2HCl =2NaCl+H 2O+SO 2↑13) NaHSO 3+HCl =NaCl+H 2O+SO 2↑14) Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O15) C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O16)* 4FeS 2+11O 22Fe 2O 3+ 8SO 2↑17)* H 2S + H 2SO 4(浓)=S ↓+SO 2↑+ 2H 2O18)* 2H 2S +SO 2=3S + 2H 2O (若在溶液中进行的S 打↓)19) FeS+H 2SO 4(稀)=FeSO 4+H 2S ↑(实验室制取H 2S 用稀硫酸或稀盐酸)20) FeS+2HCl (稀)=FeCl 2+H 2S ↑21) S+ H 2 H 2SSi 不与硫酸、硝酸反应,SiO 2不与酸(除氢氟酸)反应 强酸制弱酸高温 粗硅的提纯高温 高温催化剂高温 高温 高温22) S+ Fe FeS23) S+ 2Cu Cu 2S24) S+ Hg =HgS25)* 3S+6KOH 2K 2S+K 2SO 3+3H 2O第二单元 生产生活中的含氮化合物1) N 2 + 3 H 2 2NH 3 (工业合成氨)2) N 2+O 22NO3) 2NO+O 2=2NO 2 (红棕色气体)4) 3NO 2+H 2O =2HNO 3+NO5) NH 3+H 2O NH 3·H 2O(大量NH 3已转化为一水合氨,一水合氨只有少量电离)6) NH 3+HCl =NH 4Cl (大量白烟)7) 4NH 3+ 5O 24NO+6H 2O (氨的催化氧化,工业制硝酸的基础)8) NH 3·H 2O NH 3↑+H 2O9) NH 3·H 2O+HCl =NH 4Cl+H 2O10) 2NH 3·H 2O+H 2SO 4=(NH 4)2SO 4+2H 2O 11) NH 3·H 2O+HNO 3=NH 4NO 3+H 2O 12) 2NH 3·H 2O+MgCl 2=Mg(OH)2↓+2NH 4Cl 13) 3NH 3·H 2O+AlCl 3=Al(OH)3↓+3NH 4ClAlCl 3溶液中滴入过量的氨水白色沉淀不溶解14) NH 4Cl NH 3↑+HCl ↑15) (NH 4)2CO 32NH 3↑+H 2O+CO 2↑16) 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+H 2O(实验室制氨气)NH 3与CaCl 2、CuSO 4、浓硫酸都反应,所以干燥NH 3不用CaCl 2、CuSO 4、浓硫酸而用碱石灰17) NH 4NO 3+NaOH =NaNO 3+NH 3·H 2O18) 4HNO 3 4NO 2↑+O 2↑+2H 2O19) Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 20) 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化21) C+4HNO 3(浓)=4NO 2↑+CO 2↑+2H 2O22) HNO 3(常见强氧化剂)与某些还原性物质[如H 2S 、BaSO 3、HI 、HBr 、Fe 2+、S 2-、SO 32-、 I -、Br -(常见强还原剂)等] 发生氧化还原反应 高温、高压催化剂 放电碱的通性催化剂 光照。

高一化学《必修一》方程式总结第一、二章:1、硫酸根离子的检验: 2 + 24 = 4↓+ 22、碳酸根离子的检验: 2 + 23 = 3↓ + 23、银离子的检验: - + + = ↓4、木炭还原氧化铜: 2 + C高温2 + 2↑5、铁片与硫酸铜溶液反应: + 4 = 4 + 6. 镁在二氧化碳中燃烧 : 2 + 2 点燃2 + C第三章: 一、钠1、钠在空气中燃烧(黄色的火焰):2 + O 2 2O 22、 钠块在空气中变暗 :4+O 2=22O3、2O 在空气中加热(变黄):22O +O 2 △22O 24、金属锂在空气中燃烧 :4 + O 2△22O5、钠与水反应(浮、熔、游、响、红)2 + 2H 2O = 2+ H 2 ↑ 2 + 2H 2O = 2+ + 2 - + H 2 ↑2O 、2O 2的相关反应:1、碱性氧化物2O 与水的反应 :2O +H 2O =22、过氧化钠与水的反应(放热反应、2O 2是强氧化剂,可用于漂白)22O 2 + 2H 2O = 4 + O 2 ↑ 22O 2 + 2H 2O = 4++4 -+O 2↑3、碱性氧化物2O 与2的反应2O + 2 = 234、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),缘由是:22O2+ 22= 223+ O25、2O +2=232O2+2=246、2O +2 = 2 + H2O7、22O2+4 = 4 + 2 H2O + O2↑3与231、小苏打受热分解: 23△23+ H2O +2↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热3+△23+ H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:3+=23+ H2O3-+-= H2O +32-4、向溶液中通入少量2 :2 +2=23+ H2O5、接着通入过量2 :23+2+ H2O = 23总反应方程式: +2 =36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液23+ 2 = 2 + H2O +2↑32-+ 2H+= H2O +2↑②纯碱溶液中滴加盐酸,至过量23+=3+32-+ H+=3-3+=+H2O+2↑3-+H+= H2O +2↑7、(1)23溶液、3溶液与()2反应:23 +()2= 3↓+23+()2(多)= 3↓++H2O23+()2(少)= 3↓+ 23 +2H2O8、 23溶液、3溶液与2反应:23 +2 = 3↓+23溶液与 2 不反应;1、铝与氯气反应:2 + 32点燃232、铝片与稀盐酸反应2 + 6 = 23 + 3H 2↑ 2 + 6H + = 23+ +3H 2↑ 3、铝与氢氧化钠溶液反应 2+2 +2H 2O = 22 +3H 2↑ 2 + 2 - +2H 2O = 22- + 3H 2↑4、4 + 3O 2 △22O 3 电解熔融的氧化铝:22O 34 + 3O 2↑5、铝与三氧化二铁高温下反应【铝热反应】:2 + 2O 3 高温2 + 2O 36、不稳定性:2()3△2O 3 + 3H 2O7、硫酸铝溶液中滴过量氨水【试验室制备()3】2(4)3 +63·H 2O2()3↓+(4)24 3++ 3 3·H 2O = ()3↓+ 34+8、向 2 溶液中通入222 +2 +3H 2O = 2()3↓+ 23 22- +2 +3H 2O = 2()3↓+ 32- 9、氧化铝溶于氢氧化钠溶液2O 3 + 2 22 +H 2O 2O 3 + 2 - = 22- + H 2O 10、氧化铝溶于盐酸:2O 3 + 6 = 23 + 3 H 2O 2O 3 + 6H + = 23++3 H 2O11、()3溶液中加盐酸:()3 + 3 = 3 + 3H 2O ()3 + 3H + = 3+ + 3H 2O电解12、()3与溶液反应:()3+2+2 H2O ()3+-=2-+2 H2O13、铝盐、偏铝酸盐反应生成()3 32-+3++ 6H2O = 4 ()3↓1、铁与硫加热反应+ S2、铁与氧气加热反应 3+2O23O 43. 铁在氯气中加热反应 2+32 234、高温下铁与水蒸气反应: 3 + 4H2O(g)高温3O4+ 4H25、铁与盐酸反应:+ 2 =2+ H2↑+ 2H+=2++ H2↑6.铁的氧化物、2O3、3O4溶于盐酸中:1) + 2 =2+ H2O + 2H+=2++ H2O2)2O3+ 6 = 23+ 3H2O2O3+ 6H+= 23++ 3H2O3)3O4+ 8 =2+23+4H2O3O4+ 8H+=2++23++4 H2O7()2、()3的制备:1)4+ 2 = ()2↓+242++ 2 -= ()2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)3+ 3 = ()3↓+3 3++ 3 -= ()3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀快速变成灰绿色,最终变为红褐色沉淀)3)4 ()2+ O2+ 2H2O = 4 ()34)不稳定性:2()3 △2O3+ 3H2O82+、3+之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水)22+2= 232 2++2= 2 3++ 2-2)氯化铁溶液中加入铁粉:23 + = 32 23+ + = 32+3)用检验3+的存在:离子方程式:3++3-= ()3 (血红色)4)印刷电路板:23 + = 22 +2 第四章: 硅(1)工业制单质硅(碳在高温下还原二氧化硅):2 + 2C高温+ 2↑(硅单质的试验室制法,粗硅的制取)(2)硅单质与氢氟酸、 +4 = 4 ↑+ 2H 2↑ (3)硅单质与溶液反应: + 2 + H2O = 23 +2H2↑ 与其化合物: (一)二氧化硅(1)二氧化硅与氢氧化钠反应2 + 2 = 23 + H 2O 2 + 2 - = 32- + H 2O (2)二氧化硅与氧化钙高温反应:2 +高温3(3)二氧化硅与氢氟酸反应:2 + 4 = 4↑+ 2 H 2O (二)硅酸(H 23)(1)往硅酸钠溶液中通入二氧化碳:23 + 2 + H2O = 23 + H 23↓ (2)硅酸钠与盐酸反应:23 + 2 = 2 + H 23(胶体) (3)硅酸受热分解:H 23△2 + H 2O(4)工业制玻璃原理:2 + 23高温23 + 2↑2 +3 高温3 + 2↑氯(一)氯气(1)氯气试验室制法:(仪器:分液漏斗,圆底烧瓶)2+4(浓)2+2↑+2H2O2+4H++2-2++2↑+2H2O2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中猛烈燃烧(棕色烟):+2点燃2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:2 +2点燃 2(3)铁在氯气中猛烈燃烧:2 + 32点燃33(4)氢气在氯气中燃烧(苍白色火焰):H2+2点燃 2(5)氟气与氢气反应(黑暗处即可爆炸):H2+F2=2B、氯气与水反应(6)氯气溶于水(新制氯水中含H+、-、-、-、2、、H2O)2+ H2O =+2+ H2O = H++-+新制氯水注入盛溴化钠溶液的试管中(7)2+ 2 =2+ 22+ 2-=2+ 2-(8)2+ 2 = 2 + I22+2I-=I2+ 2-(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2 2 + O2↑C、氯气和碱和的反应:(10)工业制漂白粉的原理:2()2 + 22=()2+2+ 2H2O2()2 +22=22++2-+2 -+2H2O(11)漂白粉长期置露在空气中失效的原理:()2+2+H2O=3↓+2 2 + O2↑光照光照2++2-+2+ H2O =3↓+ 2(12)制漂白液(或氯气尾气处理):2 +2 = + + H2O硫和氮的化合物:(1)硫与非金属:S + O2 点燃 2 H2+ S △ H2S(2)硫与金属: + S △ 2 + S △ 2S(3)二氧化硫与水反应:2 + H2O H23(4)二氧化硫与碱性氧化物反应:2 + = 3(5)二氧化硫与碱反应:2 + 2 = 23 + H2O 2 + ()2 = 3↓ + H2O(6)二氧化硫与硫化氢气体反应:2H2S 2 = 3S↓ + 2H2O(7)二氧化硫通入氯水中:2 + 2 + 2H2O = 2 + H24(2可换作2、I2)(8)二氧化硫被O2氧化:22 + O2 23(9)三氧化硫与水反应:3 + H2O = H24(10)三氧化硫与碱反应:3 + ()2 = 4↓ + H2O(12)工业合成氨:N2+ 3H2催化剂高温高压23(13)氨的催化氧化:43+5O24 + 6H2O(14)3在水中的反应:3+ H2O3• H2O 4++ -(15)氨水受热分解:3•H2O △↑ + H2O (16)试验室制取氨气:24 + ()2 △↑+ 2H2O(17)碳酸氢铵受热分解:43△3↑+ H2O↑+2↑(18)用浓盐酸检验氨气(白烟生成):+3=4(19)氯化铵受热分解:4△3↑ + ↑(20)硫酸铵溶液与氢氧化钠溶液混合加(4)24+2△23↑+24+2H2O4++-△3↑+ H2O催化剂△(21)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验4+的方法)43+=3↑+H2O +3 4++-=3↑+H2O(22)氮气和氧气放电下反应(雷雨发庄稼)N2+ O22 2 + O222(23)二氧化氮溶于水:32+ H2O 23+32+ H2O 2H++ 23-+(24)2、O2的混合气通入水中无剩余气体: 42+ O2+ 2H2O = 43(25)、O2的混合气通入水中无剩余气体: 4+ 3O2+ 2H2O = 43(26)、2的回收:2+ + 2 = 22+ H2O5、浓硫酸、3与反应:、遇浓3、浓硫酸钝化(常温)(27)与浓3加热:+43(浓)= (3)2+22↑+ 2H2O(28)与稀3反应:3+83(稀)= 3(3)2+2↑+ 4H2O(29)铜与浓硫酸反应:+2H24 (浓)4+2H2O+2↑(30)浓硫酸与木炭反应:C+2H24(浓) 2H2O+2↑+22↑(31)浓硝酸与木炭反应:C+43(浓) 2H2O+2↑+42↑放电。

...高一化学方程式总结〔1〕.Fe与O2:3Fe+2O2Fe3O4 一.钠:〔2〕.Al2O3电解:2Al2O34Al+3O2↑〔1〕.Na在空气中与O2:4Na+O2=2Na2O〔白色〕〔2〕.Na在O2中燃烧:2Na+O2Na2O2〔淡黄色〕〔3〕.Na与S:2Na+S=Na2S〔研磨即爆炸〕〔4〕.Na与Cl2:2Na+C2l2NaCl〔5〕.Na与H2O:2Na+2H2O=2NaOH+H2↑〔2Na+2H2O +-=2Na+2OH+H2↑〕+〔6〕.Na与HCl:2Na+2HCl=2NaCl+H2↑〔2Na+2H +=2Na+H2↑〕〔7〕.Na与CuSO4溶液:2Na+2H2O+CuSO4=Na2SO4+ Cu(OH)2↓+H2↑〔8〕.Na与FeC3l溶液:6Na+6H2O+2FeC3l=6NaCl+ 〔3〕.Fe与H2O〔g〕高温:3Fe+4H2O〔g〕Fe3O4+4H23+2+〕〔4〕.FeCl3+Fe:2FeCl3+Fe=3FeC2l〔2Fe+Fe=3Fe2+3+〔5〕.FeCl2+Cl2:2FeCl2+Cl2=2FeCl3〔2Fe+Cl2=2Fe -+2Cl〕〔6〕.FeCl3与Cu:2FeCl3+Cu=2FeC2l+CuC2l(用于雕刻3+2+2+〕铜线路板)〔2Fe+Cu=2Fe+Cu〔7〕.FeO与HCl:FeO+2HCl=FeC2l+H2O〔同H2SO4〕+2+〔FeO+2H=Fe+H2O〕〔8〕.Fe2O3与HCl:Fe2O3+6HCl=2FeC3l+3H2O〔同+=2Fe3++3H2O〕H2SO4〕〔Fe2O3+6H〔9〕.Fe3O4与HCl:Fe3O4+8HCl=2FeC3l+FeC2l+4H2O +2+3+〔同H2SO4〕〔Fe3O4+8H=Fe+2Fe+4H2O〕〔10〕.FeSO4与NaOH:FeSO4+2NaOH=Fe(OH)2↓+2Fe(OH)3↓+3H2↑〔9〕.Na2O与H2O:Na2O+H2O=2NaOH 〔10〕.Na2O与CO2:Na2O+CO2=Na2CO32+-=Fe(OH)2↓〕Na2SO4〔Fe+2OH〔11〕.FeCl3与NaOH:FeCl3+3NaOH=Fe(OH)3↓+3NaCl〔11〕.Na2O2与H2O:2Na2O2+2H2O=4NaOH+O2↑+-〔2Na2O2+2H2O=4Na+4OH+O2↑〕〔12〕.Na2O2与CO2:2Na2O2+2CO2=2Na2CO3+O2〔供氧〕〔13〕.Na2CO3与HCl:Na2CO3+2HCl=2NaCl+H2O+2-+CO2↑〔互滴鉴别〕〔CO3+2H=H2O+CO2↑〕〔14〕.NaHCO3与HCl:NaHCO3+HCl=NaCl+H2O+CO2 -+↑〔HCO3+H=H2O+CO2↑〕〔15〕.NaHCO3与NaOH:NaHCO3+NaOH=Na2CO3+H2O --2-〔HCO3+OH=CO3+H2O〕〔16〕.Na2CO3与H2O与CO2:Na2CO3+H2O+CO2=2--〕2NaHCO3〔鉴别、除杂〕〔CO3+H2O+CO2=2HCO33+-=Fe(OH)+3OH3↓〕+〔Fe(OH)3+3H3+=Fe〔Fe〔12〕.Fe(OH)2与H2O与O2:4Fe(OH)2+2H2O+O2=4Fe(OH)3〔白色沉淀→灰绿色沉淀→红褐色沉淀〕〔13〕.Fe(OH)2与HCl.Fe(OH)2+2HCl==FeC2l+2H2O+2+〔Fe(OH)2+2H=Fe+2H2O〕〔14〕.Fe(OH)3与HCl:Fe(OH)3+3HCl==FeC3l+3H2O+3H2O〕〔15〕.Fe(OH)3加热:2Fe(OH)3Fe2O3+3H2O 〔16〕.FeCl3与KSCN F:eCl3+3KSCN==Fe(SCN3+)3KCl 3+-3+〔Fe=Fe(SCN3)〕(红色溶液,用于鉴别Fe +3SCN)〔17〕.NaHCO3分解:2NaHCO3Na2CO3+H2O+CO2↑〔18〕.NaOH与CO2(少量):2NaOH+CO2(少量)=Na2CO3 -2-+H2O〔2OH+CO2(少量)=CO3 +H2O〕〔17〕.FeCl3与H2S(少量):2FeCl3+H2S(少量)=2FeC2l+2HCl+S↓〔18〕.FeCl3与KI:2FeCl3+2KI=2FeC2l+2KCl+2I↓〔19〕.FeCl3与H2O:FeCl3+3H2OFe(OH)3(胶体)+3HCl〔19〕.NaOH与CO2〔过量〕:NaOH+CO2〔过量〕=NaHCO3〔OH --〕+CO2〔过量〕=HCO3二.铝:〔20〕.C与H2O:C+H2OCO+H2(生成水煤气) 四.硅:〔1〕Si与NaOH与H2O:Si+2NaOH+H2O=Na2SiO3+-2-2H2↑〔Si+2OH+H2O=SiO3+2H2↑〕...〔1〕.Al与6HCl:2Al+6HCl=2AlC3l+3H2↑〔同H2SO4〕〔2Al+6H+=2Al3++3H2↑〕〔2〕Si与HF:Si+4HF=SiF4+2H2↑〔3〕Si与F2:Si+2F2=SiF4〔2〕.Al与NaOH与H2O:2Al+2NaOH+2H2O=2--NaAlO2+3H2↑〔2Al+2OH+2H2O=2AlO2+3H2↑〕〔3〕.Al2O3与HCl:Al2O3+6HCl=2AlC3l+3H2O+3+〔Al2O3+6H=2Al+3H2O〕〔4〕.Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O--〔Al2O3+2OH=2AlO2+H2O〕〔5〕.Al(OH)3与HCl:Al(OH)3+3HCl=AlC3l+3H2O+3+〔Al(OH)3+3H=Al+3H2O〕〔6〕.Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O--〔Al(OH)3+OH=AlO2+2H2O〕〔7〕.2Al(OH)3Al2O3+3H2O〔8〕.AlCl3与NH3·H2O:AlCl3+3NH3·H2O=Al(OH)3↓+3++3NH4Cl〔Al+3NH3·H2O=Al(OH)3↓+3NH4〕〔9〕.NaAlO2与HCl与H2O:-+NaAlO2+HCl+H2O=NaCl+Al(OH)3↓〔AlO2+H+H2O=Al(OH)3↓〕〔4〕Si与O2:Si+O2SiO2〔研细的硅与纯氧〕〔5〕Si与C:Si+CSiC〔6〕C与SiO2:2C+SiO22CO↑+Si〔工业制粗硅〕〔7〕Cl2:与Si:2Cl2+Si=SiC4l〔8〕SiC4l与H2:SiCl4+2H2=Si+4HC〔l粗硅提纯〕〔9〕SiO2与NaOH:SiO2+2NaOH=Na2SiO3+H2O-2-〔SiO2+2OH=SiO3+H2O〕〔10〕CaO与SiO2::CaO+SiO2CaSiO3〔11〕SiO2与HF:SiO2+4HF=SiF4+2H2O〔12〕Na2SiO3与HCl:Na2SiO3+2HCl=2NaCl+H2SiO3↓〔13〕Na2SiO3与H2O与CO2:Na2SiO3+H2O+CO2=NaCO+HSiO↓〔强酸制弱酸〕2323〔14NaH〕SiOOCO()NaSiO+HO+2CO与23222322与过量:()=2NaHCO+HSiO过量↓323〔10〕.NaAlO2与CO2(少量)与H2O:2NaAlO2+CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3-2-〕〔12〕.AlO2+CO2(少量)+3H2O=2Al(OH)3↓+CO3〔11〕.NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3--〕〔AlO2+CO2(过量)+2H2O=Al(OH)3↓+HCO3〔12〕.Al与O2:4Al+3O2=2Al2O3〔15〕SiO2与Na2CO3:SiO2+Na2CO3Na2SiO3+CO2↑〔16〕SiO2与CaCO3:SiO2+CaCO3CaSiO3+CO2↑〔工业制玻璃〕〔17〕H2SiO3与NaOH:H2SiO3+2NaOH==Na2SiO3+ 2H2O〔18〕H2SiO3分解:H2SiO3SiO2+H2O五.氯:三.铁:〔1〕Cu与Cl2:Cu+Cl2CuCl2(棕黄色烟) CaSO3↓+H2O〔11〕Ca(OH)2与SO2(过量):Ca(OH)2+SO2(过量)〔2〕Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟)〔高价产物〕=Ca(HSO3)2〔12〕CaO与SO2:CaO+SO2=CaSO3〔13〕SO2与O2:2SO2+O22SO3〔3〕Na与Cl2:2Na+Cl22NaCl(白烟) 〔14〕Cl2与SO2:Cl2+SO2+2H2O=H2SO4+2HCl(同Br2、+2--I2)〔Cl2+SO2+2H2O=4H+SO4+2Cl)〔15〕H2S与SO2:2H2S+SO2=2H2O+3S↓〔4〕Cl2与H2:Cl2+H22HCl(燃烧苍白色火焰,光照〔16〕SO3与H2O:SO3+H2O=H2SO4〔17〕CaO与SO3:CaO+SO3=CaSO4会爆炸)〔5〕Cl2与P:3Cl2+2P2PCl3(液体) 〔18〕H2S与O2(少量):2H2S+O2(少量)2H2O+2S〔6〕Cl2与P:5Cl2+2P2PCl5(固体)〔白色烟雾〕〔7〕Cl2与H2O:Cl2+H2OHCl+HClO(新制氯水成分+,Cl-,ClO-,OH-)三分子H2O,C2l,HClO四离子H〔8〕Cl2与2NaOH:Cl2+2NaOH=NaCl+NaClO+H2O〔9〕Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaC2l+Ca(ClO)2+2H2O 〔19〕H2S+O2(足量):2H2S+3O2(足量)2H2O+2SO2 〔20〕FeS与HCl:FeS+2HCl=H2S↑+FeC2l(同H2SO4,实验室制备H2S)〔21FeSO4FeS〕与:+11O2FeO+8SO2222232〔22SOH〕与O SO+HO=HSO〔工业制硫酸〕:323224〔工业制漂白粉〕〔10〕漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量):七.氮Ca(ClO)2+H2O+CO2(少量)=CaCO3↓+2HClO〔强酸制弱酸〕〔1〕N2与H2:N2+3H22NH3〔工业合成氨〕〔11〕漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):〔2〕N2与O2:N2+O22NOCa(ClO)+HO+CO()=CaCO+2HClO少量↓22232HClO2HCl+O2↑〔12〕FeCl2与Cl2:2FeCl2+C2l=2FeC3lN2与Mg:N2+3MgMg3N2〔3〕〔4〕NO与O2:2NO+O2=2NO2〔13〕NaBr与Cl2:2NaBr+Cl2==2NaCl+Br2〔2Br -+C2l〔5〕2NO2N2O4-==2Cl+Br2〕- 〔14〕KI+C2l:2KI+C2l==2KCl+2I〔2I -+Cl2==2Cl + 〔6〕NO2与H2O:3NO2+H2O=2HNO3+NO〔7〕NO与3O2与2H2O:NO+3O2+2H2O=4HNO3〔8〕NO2与O2与H2O:4NO2+O2+2H2O=4HNO3I2〕〔15〕实验室制备氯气MnO2与HCl(浓):MnO2+4HCl(浓)+-MnCl2+Cl2↑+2H2O〔MnO2+4H+2Cl 〔9〕Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2+H2O〔实验室制备SO2〕〔10〕Na2SO3+O2:2Na2SO3+O2=2Na2SO4 〔11〕SO2(少量)与NH3与H2O:SO2(少量)+2NH3+H2O=2+Mn+Cl2↑+2H2O〕〔16〕NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3〔X=Cl,Br,I〕(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子) (NH4)2SO3++OH-〔12〕NH3+H2ONH3·H2ONH4〔13〕NH3与HCl:NH3+HCl=NH4Cl(白烟) 〔14〕NH3与HNO3:NH3+HNO3=NH4NO3(白烟)〔17〕NaCl与AgNO3:NaCl+AgNO3=AgCl↓+NaN3O 〔15〕NH3与H2SO4:2NH3+H2SO4=(NH4)2SO4(白色沉淀)〔18〕NaBr与AgNO3:NaBr+AgNO3=AgBr↓+NaN3O (浅黄色沉淀) 〔16〕NH3与O2:4NH3+5O24NO+6H2O〔17〕NO+O2:2NO+O2=2NO2〔18〕NO2+H2O:3NO2+H2O=2HNO3+NO〔工业制硝酸〕〔19〕KI与AgNO3:KI+AgNO3=AgI↓+KN3O(黄色沉淀)〔19〕NH4Cl受热分解:NH4ClNH3↑+HCl↑〔20〕NH4HCO3六.硫:受热分解:NH4HCO3NH3↑+H2O+CO2↑〔1〕Na与S加热:2Na+SNa2S〔2〕Fe与S:Fe+SFeS 〔21〕(NH4)2SO4与NaOH:(NH4)2SO4+2NaOH〔3〕Cu与S:2Cu+SCu2S〔低价产物〕+ Na2SO4+2NH3↑+2H2O(用于检验NH4)〔4〕H2与S:H2+SH2S 〔22〕NH4Cl与Ca(OH)2:2NH4Cl+Ca(OH2)CaCl2+2NH3↑+2H2O〔实验室制氨气〕〔5〕S与O2:S+O2SO2八.硫酸〔6〕S与NaOH:3S+6NaOH2Na2S+Na2SO3+ 〔1〕H2SO4(浓)与Cu:2H2SO4(浓)+CuCuSO4+-2-2-3H2O〔3S+6OH2S+SO3+3H2O〕〔7〕SO2:与H2O:SO2+H2OH2SO3〔注意“可逆反响〞的定义〕〔8〕NaOH与SO2(少量):2NaOH+SO2(少量)=Na2SO3+ 2H2O+SO2↑〔2〕HSO2↑2SO4(浓)与Zn:2H2SO4(浓)+Zn=ZnSO4+2H2O+〔3〕H2SO4(浓)与Fe〔少量〕:6H2SO4(浓)+2FeFe2(SO4)3+6H2O+3SO2↑(Fe少量)H2O 〔4〕H2SO4(浓)与C:2H2SO4(浓)+CCO2↑+2H2O〔9〕NaOH与SO2〔过量〕:NaOH+SO2〔过量〕=NaHSO3+2SO2↑〔10〕Ca(OH)2与SO2(少量):Ca(OH)2+SO2(少量)= 〔5〕H2SO4(浓)与S:2H2SO4(浓)+S2H2O+3SO2↑〔6〕H2S+H2SO4(浓):H2S+H2SO4(浓)=S↓+SO2↑+2+SO2↑+2H2O〔7〕HBr+H2SO4(浓):2HBr+H2SO4(浓)=Br2H2O〔8〕HNO3遇光分解:4HNO34NO2↑+O2↑+2H2O〔硝酸显黄色的原因〕〔9〕Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O +-2+〔Cu+4H+2NO3=Cu+2NO2↑+2H2O〕(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O+-2+〔3Cu+8H+2NO3=3Cu+2NO↑+4H2O〕〔11〕HNO3(浓)与Fe:6HNO3(浓)+FeFe(NO3)3+3H2O+3NO2↑〔12〕HNO3(稀)与Fe(足量):8HNO3(稀)+3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O〔13〕HNO3(稀)与Fe(少量):4HNO3(稀)+Fe(少量)= Fe(NO3)3+NO↑+2H2O〔14〕C与HNO3(浓):C+4HNO3(浓)CO2↑+4NO2↑+2H2O。


苏教版化学必修一反应方程式大全反应方程式是化学中的一项重要工具,用于描述化学反应的物质转化过程。
它由反应物、生成物以及反应条件组成,是化学变化的核心描述。
下面将详细介绍苏教版化学必修一中的反应方程式大全。
首先,我们来看一些基本的反应方程式。
在化学反应中,最常见的反应类型是氧化还原反应。
其基本形式可表示为:2Mg + O2 → 2MgO这个简单的反应方程式表明,两个镁原子与一个氧原子发生反应,生成两个氧化镁的分子。
另一种常见的反应类型是酸碱中和反应。
例如:HCl + NaOH → NaCl + H2O这个反应方程式描述了盐酸和氢氧化钠发生中和反应,生成氯化钠和水。
除了氧化还原反应和酸碱中和反应,还有一些其他的常见反应类型。
例如,双替换反应:AgNO3 + NaCl → AgCl + NaNO3这个反应方程式描述了硝酸银和氯化钠发生双替换反应,生成氯化银和硝酸钠。
在苏教版化学必修一中,还包括了一些特殊的反应类型和实例。
例如,光化学反应:2AgBr → 2Ag + Br2这个反应方程式描述了溴化银发生光化学反应,分解为银和溴。
此外,还有一些有机化学反应方程式。
例如,醇的酸催化脱水反应:ROH → R+ + H2O这个反应方程式描述了醇分子在酸催化下发生脱水反应,生成烷基阳离子和水分子。
除了以上列举的例子,苏教版化学必修一中还包含了更多的反应方程式,涵盖了氧化反应、还原反应、酸碱反应、置换反应、析出反应等多个领域。
在进一步深入分析和讨论相应的内容时,我们可以对每个类型的反应方程式进行详细介绍,并解释其中的反应机制和实际应用。
此外,我们还可以提供更多的实例,以帮助读者更好地理解和应用这些反应方程式。
总的来说,苏教版化学必修一中的反应方程式大全为学习者提供了丰富的反应类型和实例,通过理解和熟练应用这些方程式,读者能够更好地把握化学反应的本质和规律,进而在实际应用中发挥作用。


高一上学期化学方程式汇总【必修一】(一)氯气1.氯气的生产原理(电解饱和食盐水)2222NaCl +2H O 2NaOH H Cl +↑+↑通电2.实验室制氯气22224()2MnO HCl MnCl Cl H O ++↑+浓3.氯气与(非)金属反应222322232Na Cl NaClCu Cl CuClFe Cl FeCl +++点燃点燃点燃 ()2222/22H Cl HClHClO O HCl+↑+点燃/光照苍白色火焰爆炸光照4.尾气处理:222NaOH Cl NaCl NaClO H O +=++5.工业制漂白粉:222222()()2Cl Ca OH CaCl Ca ClO H O +=++6.漂白粉原理(变质):222322()2()22Ca ClO CO H O CaCO HClO Ca ClO HCl CaCl HClO++=++=+或(二)卤素——氟、氯、溴、碘2.卤素的化学性质 ①与水反应2222H O Cl HClO HCl H O Br HBrO HBr ++++和②卤素间的置换反应2222222222222()22()22()Cl NaBr NaCl Cl Br Cl KI KCl I Cl I Br KI KBr I Br I +=+>+=+>+=+>③卤素的检验333333aCl Cl +a ()aBr Br +a ()aI I +a ()N AgNO Ag N NO N AgNO Ag N NO N AgNO Ag N NO +=↓+=↓+=↓白色沉淀浅黄色沉淀,用于制感光材料、胶片黄色沉淀,用于人工降雨 (三)金属钠1.钠的化学性质(易失电子,强还原性)222222242()()2();Na O Na O Na O Na O Na Cl NaCl Na S Na S+=+++①白色;②2点燃淡黄色③2点燃白烟④2点燃2.钠的制备222NaCl Na Cl +通电3.钠在空气中的反应222222322322322242221010()22Na O Na O Na O H O NaOHNaOH CO Na CO H O Na CO H O Na CO H O Na H O NaOH H •+=+=+=+=++=+↑①;②③;④风化,化学变化⑤2(浮、熔、游、消、变)4.钠与盐溶液反应422422323222()333()3Na CuSO H O Na SO Cu OH H Na FeCl H O NaCl Fe OH H ++=+↓+↑++=+↓+↑①②5.钠与熔融的盐反应4700~80044Na TiCl Ti NaCl ++℃(四)碳酸钠的性质与应用1.一些基本反应2323232323223323222322322()2;22;222;Na CO Ca OH CaCO NaOH Na CO CaCl CaCO NaCl Na CO CO H O NaHCO NaHCO Na CO CO H O Na CO HCl NaCl H O CO NaHCO HCl NaCl H O CO +=↓++=↓+++=+++=++↑+=++↑;;2.互滴法鉴别碳酸钠和碳酸氢钠233322()Na CO HCl NaHCO NaCl NaHCO HCl NaCl H O CO +=++=++↑不足;3.碳酸氢钠与碱反应()()32322332322()21()11NaHCO Ca OH CaCO H O Na CO NaHCO Ca OH CaCO H O NaOH +=↓+++=↓++2::4.侯式制碱法32234323222NaCl NH CO H O NaHCO NH Cl NaHCO Na CO CO H O+++=+++①②(五)金属镁1.镁的提取32222222222222222();()();()2;66HCl CaCO CaO CO CaO H O Ca OH MgCl Ca OH CaCl Mg OH Mg OH HCl MgCl H O MgCl H O MgCl H O MgCl Mg Cl •+↑+=+=+↓+=+++↑气氛;;通电 2.镁的化学性质:2232322232222236()22()Mg O MgO Mg N Mg N Mg N H O Mg OH NH Mg CO MgO C Mg H O Mg OH H +++=↓+↑+++↓+↑点燃(黑色固体);点燃(白色固体);;点燃;(六)金属铝1.铝的提取32322322Al(OH)Al O +3H O ; 2Al O 4Al+3O ↑通电2.铝的化学性质()2324242232222233Al O +3H SO =Al SO 3H O ; Al O +2NaOH=2NaAlO H O NaAlO +CO H O=Al(OH)NaHCO +++↓+332343323222323AlCl +3NH H O=Al(OH)3NH Cl ; Al(OH)+3HCl=AlCl 3H O Al(OH)+NaOH=NaAlO 2H O 2Al+Fe O 2Fe+Al O •↓+++;高温322222Al+6H=AlCl +3H 2Al+2NaOH 2H O=2NaAlO +3H ↑+↑;3.明矾的净水作用+3+2-3++42423KAl(SO )K +Al 2SO Al 3H O=Al(OH)()+3H =++和胶体(七)金属铁、铜1.铁的冶炼(高炉炼铁)222232233233C+O CO CO +C 2CO 3CO+Fe O 2Fe+3CO CaCO CaO+CO CaO+SiO2CaSiO CaCO +SiO2CO CaSiO ↑⇔↑+原料:(两石一炭)铁矿石、石灰石、焦炭还原剂形成:点燃;还原铁矿石:高温炉渣形成:高温;高温高温2.铁的化学性质23423Fe+4H O Fe O +4H ↑高温 ……略电解。

高中化学(苏教版 必修一)方程式及离子方程式汇总从海水中获得的化学物质(1)工业制氯气(氯碱工业)—电解饱和食盐水:2NaCl + 2H 2O 2NaOH+H 2↑+Cl 2↑ 2Cl - +2H 2O 2OH -+H 2↑+Cl 2↑(2)实验室制氯气:MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O MnO 2+4H + +2Cl -Mn 2+ +Cl 2↑+2H 2O(3)铁与氯气的反应:2Fe + 3Cl 2 2FeCl 3 (棕褐色的烟)(4)* 铜与氯气的反应:Cu + Cl 2 CuCl 2 (棕黄色的烟) (5)* 钠与氯气的反应:2Na + Cl 2 2NaCl (白烟) (6)氢气与氯气的反应:H 2 + Cl 2 2HCl (苍白色火焰) H 2 + Cl 2 2HCl (7) 氯气溶于水:Cl 2 +H 2O HCl +HClO Cl 2 + H 2OH + + Cl - + HClO (8)次氯酸见光分解: 2HClO 2HCl + O 2↑ (9)氯气的尾气处理:Cl 2+2NaOH =NaCl+NaClO+H 2O Cl 2 + 2OH - = Cl - + ClO - +H 2O(10)漂白粉的生产原理:2Ca(OH)2 + 2Cl 2 == Ca(ClO)2 + CaCl 2 + 2H 2OCl 2 + 2OH - =Cl - +ClO - +H 2O(11)漂白粉消毒原理:Ca(ClO)2+2HCl =CaCl 2+2HClO ClO - + H + = HClOCa(ClO)2 +CO 2 +H 2O == CaCO 3 ↓+ 2HClO Ca 2+ +2ClO - +CO 2 + H 2O= CaCO 3↓+2HClO(12)氯、溴、碘之间的置换反应:Cl 2 + 2KBr == Br 2 + 2KCl Cl 2 + 2Br - == Br 2 + 2Cl –(Cl 2使湿润的淀粉KI 试纸变蓝):Cl 2 + 2KI == I 2 + 2KCl Cl 2 + 2I - == I 2 + 2Cl –Br 2 + 2KI == I 2 + 2KBr Br 2 + 2I - == I 2 + 2Br –(13)氯、溴、碘离子的检验: KCl+AgNO 3 == AgCl ↓+KNO 3 Ag + +Cl - ==AgCl ↓(白色沉淀)NaBr+AgNO 3==AgBr ↓+NaNO 3 Ag + +Br - == AgBr ↓(淡黄色沉淀)NaI + AgNO 3 == AgI ↓+ NaNO 3 Ag + + I - == AgI ↓(黄色沉淀)(14)钠放置在空气中被氧化(常温):4Na + O 2 == 2Na 2O (氧化钠,白色固体)(15)钠在空气中燃烧:2Na + O 2 Na 2O 2 (过氧化钠,淡黄色固体) (16)钠与水的反应:2Na + 2H 2O == 2NaOH + H 2↑ 2Na + 2H 2O == 2Na + + 2OH -+H 2↑ (17)钠与四氯化钛的反应:TiCl 4 + 4Na Ti + 4NaCl (18)钠的工业制法:2NaCl(熔融) 2Na + Cl 2↑(19)氧化钠和水反应:Na 2O+H 2O ==2NaOH Na 2O+H 2O ==2Na + + 2OH -(20)氧化钠是碱性氧化物:Na 2O+CO 2=Na 2CO 3 (21)过氧化钠与二氧化碳的反应:2Na 2O 2 + 2CO 2 == 2Na 2CO 3 +O 2 (22) 过氧化钠与水的反应:2Na 2O 2 + 2H 2O == 4NaOH + O 2↑ (23)碳酸钠与氢氧化钙的反应:Na 2CO 3+Ca(OH)2==CaCO 3↓+2NaOH Ca 2++CO 32-==CaCO 3↓(24)碳酸钠与氯化钡的反应:Na 2CO 3+BaCl 2==BaCO 3↓+2NaCl Ba 2+ + CO 32-==BaCO 3↓(25)碳酸钠溶液中通入CO 2:Na 2CO 3+CO 2+H 2O==2NaHCO 3 CO 32- + CO 2 + H 2O==2HCO 3 –(26)NaHCO 3与NaOH 溶液反应:NaHCO 3+NaOH==Na 2CO 3+H 2O HCO 3 - +OH -==CO 32- +H 2O(27)少量 NaHCO 3与Ca(OH)2溶液反应:NaHCO 3+ Ca(OH)2==CaCO 3↓+NaOH +H 2OHCO 3 - + Ca 2+ + OH - == CaCO 3↓+ H 2O(28)过量NaHCO 3与Ca(OH)2溶液反应:2NaHCO 3+ Ca(OH)2==CaCO 3↓+ Na 2CO 3 +2H 2O2HCO 3 - + Ca 2+ + 2OH - == CaCO 3↓+ CO 32- +2H 2O(29)NaHCO 3与盐酸反应:NaHCO 3+HCl==Na 2CO 3+CO 2↑+H 2O HCO 3 - + H + == CO 2↑+ H 2O(30)碳酸钠(纯碱)与不足的盐酸反应:Na 2CO 3+HCl==NaHCO 3+NaCl CO 32- + H + == HCO 3-(31)碳酸钠与足量的盐酸反应:Na 2CO 3+2HCl==2NaCl+CO 2↑+H 2O CO 32-+2H +==CO 2↑+H 2O(32)少量CO 2通入碱溶液:CO 2+2NaOH =Na 2CO 3+H 2O CO 2 + 2OH - = CO 32- + H 2O(33)过量CO 2通入碱溶液:CO 2 + NaOH =NaHCO 3 CO 2 +OH - = HCO 3- 通电 通电 点燃 点燃 光照点燃 点燃光照 点燃700~800℃通电 Na 2O 2既是氧化剂又是还原剂(34)碳酸氢钠(小苏打)固体受热分解:2NaHCO 3Na 2CO 3+H 2O+CO 2↑(35)* 侯氏制碱法:NaCl + NH 3 + CO 2 + H 2O == NaHCO 3 + NH 4Cl(36)醋酸的电离方程式:CH 3COOH CH 3COO - + H +(37) Na 2CO 3溶液与过量醋酸溶液:2CH 3COOH+Na 2CO 3=2CH 3COONa+H 2O+CO 2↑2CH 3COOH+CO 32-=2CH 3COO - +H 2O+CO 2↑(38)一水合氨的电离方程式:NH 3·H 2O NH 4+ + OH -常见的弱酸:H 2CO 3、H 2SO 3、HClO 、H 2S 、HF 、CH 3COOH 、 H 2SiO 3(不溶)。

高一化学方程式总结一.钠:(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)(2).Na在O2中燃烧:2Na + O2Na2O2(淡黄色)(3).Na与S:2Na + S = Na2S(研磨即爆炸)(4).Na与Cl2:2Na + Cl22NaCl(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH- + H2↑)(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+ =2Na+ + H2↑ )(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑(9).Na2O与H2O:Na2O + H2O = 2NaOH(10).Na2O与CO2:Na2O + CO2= Na2CO3(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2↑(HCO3- + H+ = H2O + CO2↑)(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O (HCO3- + OH- = CO32- + H2O)(16).Na2CO3与H2O 与CO2 :Na2CO3 + H2O + CO2 =2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3-)(17).NaHCO3 分解:2NaHCO3Na2CO3+H2O+ CO2↑(18).NaOH与CO2 (少量):2NaOH + CO2 (少量) = Na2CO3 + H2O (2OH-+ CO2 (少量) = CO32- + H2O)(19).NaOH 与CO2(过量):NaOH + CO2(过量)= NaHCO3(OH -+ CO2(过量)= HCO3-)二.铝:(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)(2Al+6H+ =2Al3+ + 3H2↑ )(2).Al 与NaOH 与H2O:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)(3).Al2O3与HCl:Al2O3 + 6HCl = 2AlCl3 + 3H2O(Al2O3 + 6H+ =2Al3+ + 3H2O)(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3 + 2OH- = 2AlO2- + H2O )(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O(Al(OH)3 + 3H+ = Al3+ + 3H2O)(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O (Al(OH)3 + OH- = AlO2- + 2H2O)(7).2Al(OH)3Al2O3 + 3H2O(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)(9).NaAlO2与HCl与H2O:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +H2O = Al(OH)3↓ )(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-)(11).NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)(12).Al 与O2 :4Al + 3O2 = 2Al2O3三.铁:(1).Fe与O2:3Fe+2O2Fe3O4(2).Al2O3电解:2Al2O34Al+3O2↑(3).Fe与H2O(g)高温:3Fe+4H2O(g)Fe3O4+4H2(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2(2Fe3+ + Fe = 3Fe2+)(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3(2Fe2+ + Cl2 = 2Fe3++2Cl-)(6).FeCl3与Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+)(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)(FeO+2H+=Fe2+ +H2O )(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4)(Fe2O3 + 6H+=2Fe3+ + 3H2O)(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4)(Fe3O4 + 8H+=Fe2+ +2Fe3+ +4H2O)(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +Na2SO4(Fe2+ + 2OH-=Fe(OH)2↓)(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl (Fe3+ + 3OH-=Fe(OH)3 ↓)(12).Fe(OH)2 与H2O 与O2:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O(Fe(OH)2 + 2H+=Fe2+ + 2H2O)(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)(15).Fe(OH)3加热:2Fe(OH)3Fe2O3 + 3H2O(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl(Fe3++ 3SCN- = Fe(SCN)3)(红色溶液,用于鉴别Fe3+) (17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓ (18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓(19).FeCl3与H2O:FeCl3+3H2O Fe(OH)3(胶体)+3HCl (20).C与H2O:C+H2O CO+H2 (生成水煤气)四.硅:(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑(3)Si与F2:Si+ 2F2 = SiF4(4)Si与O2:Si+O2SiO2 (研细的硅与纯氧)(5)Si 与C:Si + C SiC(6)C与SiO2:2C+ SiO22CO↑+Si(工业制粗硅)(7)Cl2:与Si:2Cl2+Si= SiCl4(8)SiCl4 与H2:SiCl4 +2H2=Si+4HCl(粗硅提纯)(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O(SiO2 + 2OH- = SiO32-+ H2O )(10)CaO与SiO2::CaO+SiO2CaSiO3(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓(13)Na2SiO3 与H2O与CO2:Na2SiO3 + H2O+CO2 =Na2CO3 + H2SiO3↓(强酸制弱酸)(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓(15)SiO2与Na2CO3:SiO2 + Na2CO3Na2SiO3+ CO2↑ (16)SiO2 与CaCO3:SiO2 + CaCO3CaSiO3+ CO2↑(工业制玻璃)(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +2H2O(18)H2SiO3分解:H2SiO3 SiO2 + H2O五.氯:(1)Cu与Cl2:Cu+Cl2CuCl2 (棕黄色烟)(2)Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)(3)Na 与Cl2 :2Na + Cl2 2NaCl (白烟)(4)Cl2 与H2:Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)(5)Cl2 与P:3Cl2 + 2P 2PCl3 (液体)(6)Cl2 与P:5Cl2 + 2P 2PCl5(固体) (白色烟雾)(7)Cl2与H2O:Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)(8)Cl2 与2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (工业制漂白粉)(10)漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量) :Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO2HClO2HCl+O2↑(12)FeCl2与Cl2:2FeCl2 + Cl2 = 2FeCl3(13)NaBr 与Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2 == 2Cl- + Br2)(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- + I2)(15)实验室制备氯气MnO2与HCl(浓):MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-Mn2+ + Cl2↑ + 2H2O)(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)(17)NaCl 与AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)(18)NaBr 与AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀)(19)KI 与AgNO3:KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)六.硫:(1)Na 与S加热:2Na + S Na2S(2)Fe与S:Fe+S FeS(3)Cu与S:2Cu+S Cu2S (低价产物)(4)H2与S:H2 + S H2S(5)S 与O2:S + O2 SO2(6)S 与NaOH:3S + 6NaOH 2Na2S + Na2SO3 + 3H2O (3S + 6OH-2S2- + SO32- + 3H2O)(7)SO2:与H2O:SO2+H2O H2SO3(注意“可逆反应”的定义)(8)NaOH与SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 + H2O(9)NaOH与SO2(过量):NaOH+ SO2(过量)= NaHSO3(10)Ca(OH)2 与SO2 (少量) :Ca(OH)2 + SO2 (少量) =CaSO3↓+ H2O(11)Ca(OH)2 与SO2(过量):Ca(OH)2 + SO2(过量)=Ca(HSO3)2(12)CaO与SO2:CaO+ SO2 = CaSO3(13)SO2与O2:2SO2+O2 2SO3(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)(15)H2S 与SO2:2H2S + SO2= 2H2O + 3S↓(16)SO3与H2O:SO3+H2O=H2SO4(17)CaO与SO3:CaO+ SO3 = CaSO4(18)H2S 与O2(少量):2H2S + O2(少量) 2H2O+2S (19)H2S + O2(足量):2H2S + 3O2(足量) 2H2O + 2SO2(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2(同H2SO4,实验室制备H2S)(21)FeS2与O2:4FeS2+11O22Fe2O3 + 8SO2(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)七.氮(1)N2与H2:N2+3H22NH3(工业合成氨)(2)N2与O2:N2+O22NO(3)N2 与Mg:N2 + 3Mg Mg3N2(4)NO 与O2:2NO + O2 = 2NO2(5)2NO 2 N2O4(6)NO2与H2O:3NO2+H2O = 2HNO3+NO(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2 +H2O (实验室制备SO2)(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4(11)SO2(少量) 与NH3 与H2O: SO2(少量) + 2NH3 + H2O = (NH4)2SO3(12)NH3+H2O NH3·H2O NH4++OH-(13)NH3 与HCl :NH3 + HCl = NH4Cl(白烟)(14)NH3 与HNO3:NH3 + HNO3 = NH4NO3(白烟)(15)NH3 与H2SO4:2NH3 + H2SO4 = (NH4)2SO4(16)NH3与O2:4NH3+5O2 4NO+6H2O(17)NO + O2:2NO + O2 = 2NO2(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑(20)NH4HCO3受热分解:NH4HCO3NH3↑+ H2O +CO2↑(21)(NH4)2SO4与NaOH:(NH4)2SO4 + 2NaOHNa2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)(22)NH4Cl 与Ca(OH)2:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O(实验室制氨气)八.硫酸(1)H2SO4(浓) 与Cu:2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2FeFe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)(4)H2SO4(浓) 与C:2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑(5)H2SO4(浓) 与S:2H2SO4(浓) + S 2H2O + 3SO2↑(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O(8)HNO3遇光分解:4HNO3 4NO2↑+ O2↑+ 2H2O(硝酸显黄色的原因)(9)Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O)(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O)(11)HNO3(浓)与Fe:6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2O(14)C与HNO3(浓):C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。
一、复分解反应(非氧化还原反应)1、酸性氧化物与碱反应生成盐和水①.二氧化硅与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O②.三氧化硫与Ca(OH)2溶液反应:SO3+Ca(OH)2=CaSO4+H2O2、碱性氧化物与酸反应生成盐和水①.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O②.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O3、两性氧化物与酸反应生成盐和水Al2O3与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O4、两性氧化物与碱反应生成盐和水Al2O3与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O5、酸性氧化物的特殊反应二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O6、碱与酸反应生成盐和水①.Al(OH)3与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O7、盐与酸反应生成新盐和新酸①.硅酸钠与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓②.漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO8、盐水解生成新酸和新碱Fe(OH)3胶体的制备:FeCl3+3H2O加热Fe(OH)3(胶体)+3HCl9、两性氢氧化物与碱反应生成盐和水Al(OH)3与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O10、盐与碱反应生成新盐和新碱①.实验室制取氢氧化铝(铝盐溶液加氨水):Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4②.氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=3NaCl+Fe(OH)3↓(红褐色)③.硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Na2SO4+Fe(OH)2↓(白色)④.硝酸铵与氢氧化钠反应:NH4NO3+NaOH加热NH3↑+NaNO3+H2O⑤.氨气的实验室制取法:2NH4Cl+Ca(OH)2加热CaCl2+2H2O+2NH3↑⑥.硫酸铵与氢氧化钠反应:(NH4)2SO4+2NaOH加热2NH3↑+Na2SO4+2H2O二、置换反应(氧化还反应)1、还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜:2CuO+C高温2Cu+CO2↑2、金属单质置换出还原性非金属单质①.金属与水的反应:铁与水蒸气反应:3Fe+4H2O(g)加热Fe3O4+4H2↑钠与水反应:2Na+2H2O=2NaOH+H2↑②.金属与酸的反应:Al与盐酸反应:2Al +6HCl=2AlCl3+3H2↑③.两性金属与碱溶液的反应:Al与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑三、属于氧化还原反应的化合反应1、金属与氧气发生的氧化反应①.常温下钠与氧气反应:4Na+O2=2Na2O(白色)②.钠在空气中燃烧:2Na+O2加热Na2O2(淡黄色)③.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4(黑色)2、非金属单质与氧气的氧化反应①.硫的燃烧S+O2点燃SO2②.氮气与氧气在放电下反应:N2+O2放电2NO3、低价非金属氧化物与氧气的氧化反应①.二氧化硫与氧气反应:2SO2+O2催化剂加热2SO3②.一氧化氮与氧气反应:2NO+O2=2NO24、非金属氢化物与氧气的反应氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O5、低价碱的氧化反应氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)36、单质与氯气发生的氧化反应①.氯气与金属反应:铁与氯气反应产生棕色烟2Fe+3Cl2点燃2FeCl3铜与氯气反应产生棕黄色烟Cu+Cl2点燃CuCl2钠在氯气中燃烧有白烟2Na+Cl2点燃2NaCl②.氯气与非金属反应:氢气在氯气中燃烧产生苍白色火焰有白雾H2+Cl2加热2HCl ③.氯气与氯化亚铁反应生成氯化铁2FeCl2+Cl2=2FeCl37、高价铁盐的还原反应FeCl3溶液与铁粉反应:2FeCl3+Fe=3FeCl28、非金属与氢气的化合反应合成氨反应:N2+3H2催化剂高温高压2NH3四、不属于氧化还原反应的化合反应1、酸性氧化物与碱性氧化物反应生成含氧酸盐①.二氧化硅与氧化钙高温反应生成硅酸钙SiO2+CaO高温CaSiO3②.三氧化硫与氧化钙反应生成硫酸钙SO3+CaO=CaSO42、酸性氧化物与水反应生成含氧酸①.二氧化硫与水反应生成亚硫酸SO2+H2OH2SO3②.三氧化硫与水反应生成硫酸SO3+H2O=H2SO43、氨气与水的化合反应氨气溶于水生成氨水:NH3+H2O=NH3•H2O4、氨气与酸的化合反应氨气与氯化氢反应生成氯化铵:NH3+HCl=NH4Cl五、属于氧化还原反应的分解反应次氯酸光照分解:2HClO光照2HCl+O2↑六、不属于氧化还原反应的分解反应1、铵盐受热分解①氯化铵受热分解:NH4Cl加热NH3↑+HCl↑②.碳酸氢氨受热分解:NH4HCO3加热NH3↑+H2O↑+CO2↑2、氨水受热分解氨水受热分解:NH3•H2O加热NH3↑+H2O3、不溶性碱受热分解①.氢氧化铁加热分解生成氧化铁和水:2Fe(OH)3加热3H2O+Fe2O3②.氢氧化铝加热分解生成氧化铝和水:2Al(OH)3加热Al2O3+3H2O七、不属于基本类型的氧化还原反应1、过氧化钠氯气二氧化氮的歧化反应①.过氧化钠与水反应生成氢氧化钠和氧气2Na2O2+2H2O=4NaOH+O2↑②.过氧化钠与二氧化碳反应生成碳酸钠和氧气2Na2O2+2CO2=2Na2CO3+O2③.③.氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HCl+HClO④.氯气与氢氧化钠溶液反应生成氯化纳和次氯酸钠:Cl2+2NaOH=NaCl+NaClO+H2O⑤.氯气与消石灰反应制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O⑥.二氧化氮与水反应生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO2、氧化性酸的还原反应①.浓硫酸与碳发生的还原反应C+2H2SO4(浓)加热CO2↑+2SO2↑+2H2O②.浓硫酸与铜发生的还原反应Cu+2H2SO4(浓)加热CuSO4+2H2O+SO2↑③.浓硝酸与铜发生的还原反应:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑④.稀硝酸与铜发生的还原反应:3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑3、还原性酸的氧化反应氯气的实验室制法:MnO2+4HCl(浓)加热MnCl2+Cl2↑+H2O4、高价金属化合物的还原反应:FeCl3溶液与铜反应:2FeCl3+Cu=2FeCl2+CuCl2Welcome To Download !!!欢迎您的下载,资料仅供参考!。
化学方程式必修一1、Fe(OH)3胶体的制备FeCl3+3H2O△Fe(OH)3(胶体)+3HCl2、常温下钠与氧气反应4Na + O2 = 2Na2O (白色)3、钠在空气中燃烧2Na + O2△ Na2O2(淡黄色)4、钠与水反应2Na + 2H2O = 2NaOH + H2↑5、过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑6、过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O27、铁与水蒸气反应3Fe + 4H2O(g) △Fe3O4 + 4H2↑8、硫酸亚铁与氢氧化钠溶液反应FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓(白色)9、氢氧化亚铁被氧气氧化成强氧化亚铁4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)310、FeCl3溶液与铁粉反应2FeCl3 + Fe = 3FeCl211、氯化亚铁中通入氯气2FeCl2 + Cl2 = 2FeCl312、FeCl3溶液与铜反应2FeCl3 + Cu = 2FeCl2+CuCl213、实验室制取氢氧化铝(硫酸铝溶液加氨水)Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4 14、铝与氢氧化钠溶液反应2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑15、Al2O3与盐酸反应Al2O3 + 6HCl ===2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应Al2O3 + 2NaOH === 2NaAlO2 + H2O17、氢氧化铝与氢氧化钠溶液反应Al(OH)3 + NaOH === NaAlO2 + 2H2O18、氢氧化铝加热分解2Al(OH)3△Al2O3 + 3H2O19、二氧化硅与氢氟酸反应SiO2 + 4HF = SiF4↑+ 2H2O20、二氧化硅与氧化钙高温反应SiO2 + CaO 高温 CaSiO321、二氧化硅与氢氧化钠反应SiO2 + 2NaOH = Na2SiO3 + H2O22、硅酸钠与盐酸反应Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓23、氯气的实验室制法MnO2+4HCl(浓)△MnCl2+Cl2↑+H2O24、氯气与非金属反应H2+Cl2 点燃2HCl (苍白色火焰,有白雾生成)25、氯气与水反应Cl2 + H2O = HCl + HClO26、次氯酸光照分解2HClO2↑27、氯气与氢氧化钠反应Cl2 + 2NaOH = NaCl + NaClO + H2O28、氯气与氢氧化钙反应2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O29、漂白粉(主要成分为次氯化钙)长期置露在空气中Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO30、二氧化硫与氧气反应2SO2+O2催化剂加热2SO331、三氧化硫与氧化钙反应SO3+CaO=CaSO432、三氧化硫与Ca(OH)2溶液反应SO3 + Ca(OH)2 = CaSO4+H2O 33、氮气与氧气在放电下反应光照N 2 + O 2 2NO34、一氧化氮与氧气反应2NO + O 2 = 2NO 235、二氧化氮与水反应3NO 2 + H 2O = 2HNO 3 + NO36、合成氨反应N 2+3H 2 催化剂 高温高压 2NH 337、氨气与氯化氢反应NH 3 + HCl = NH 4Cl38、碳酸氢氨受热分解NH 4HCO 3 △NH 3↑ + H 2O ↑ + CO 2↑39、硝酸铵与氢氧化钠反应 NH 4NO 3 + NaOH △3↑ + NaNO 3 + H 2O40、氨气的实验室制取法 2NH 4Cl + Ca(OH)2 △CaCl 2 + 2H 2O + 2NH 3↑41、浓硫酸与铜反应Cu + 2H 2SO 4(浓) △4 + 2H 2O + SO 2↑42、浓硫酸与木炭反应C + 2H 2SO 4(浓) △CO 2 ↑+ 2SO 2↑ + 2H 2O43、浓硝酸与铜反应Cu + 4HNO 3(浓) ===Cu(NO 3)2 + 2H 2O + 2NO 2↑44、稀硝酸与铜反应3Cu+8HNO 3(稀)=== 3Cu(NO 3)2+4H 2O+2NO ↑放电或高温。
化学反应方程式必修1第一部分:金属元素 钠、镁、铝、铁、铜1 钠、镁、铝、铁、铜的制备 2NaCl (熔融)2Na+Cl 2↑ MgCl 2(熔融)Mg+Cl 2↑ 2Al 2O 34Al+3O 2↑yCO+Fe x O y ===xFe+yCO 2 (H 2、C 、Al 也可还原铁、铜等较活泼金属的氧化物)2 钠、镁、铝、铁及其化合物钠:1) 4Na+O 2=2Na 2O (白色固体) 2Na+O 2Na 2O 2 (淡黄色固体)2) 2Na+2H 2O =2NaOH+H 2↑(浮熔游响红) 离子反应方程式:2Na+2H 2O =2Na ++OH -+H 2↑ Na 投入CuSO 4溶液:2Na+Cu 2++2H 2O =2Na ++Cu(OH)2↓+H 2↑ Na 投入FeCl 3溶液:6Na+2Fe 3++6H 2O =6Na ++2Fe(OH)3↓+3H 2↑ Na 投入NH 4Cl 溶液:2Na+2NH 4+=2Na ++2NH 3↑+ H 2↑3) 4Na+TiCl 4 Ti+4NaCl (熔融情况下Na 可冶炼贵重金属)4) Na 2O+H 2O =2NaOH 2Na 2O 2+2H 2O =4NaOH +O 2↑(Na 2O 2既是氧化剂,又是还原剂)Na 2O+CO 2=Na 2CO 3 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑(Na 2O 2是供氧剂,又可作漂白剂) 5) Na 2CO 3+2HCl =2NaCl+H 2O+CO 2↑ 离子反应方程式:CO 32-+2H +=H 2O+CO 2↑NaHCO 3+ HCl =NaCl+H 2O+CO 2↑ 离子反应方程式:HCO 3-+H +=H 2O+CO 2↑ 6) 2NaHCO 3Na 2CO 3+H 2O+CO 2↑(NaHCO 3固体转化为Na 2CO 3固体)7) NaHCO 3+NaOH =Na 2CO 3+H 2O (NaHCO 3溶液转化为Na 2CO 3溶液) 离子反应方程式:HCO 3-+OH -=CO 32-+H 2O类比:NaHCO 3与澄清石灰水反应(不可用来鉴别NaHCO 3溶液与Na 2CO 3溶液) ①NaHCO 3过量:2NaHCO 3+Ca(OH)2=CaCO 3↓+ Na 2CO 3+2H 2O 离子反应方程式:2HCO 3-+Ca 2++2OH -=CaCO 3↓+CO 32-+2H 2O ②澄清石灰水过量:NaHCO 3+Ca(OH)2=CaCO 3↓+ NaOH+H 2O 离子反应方程式: HCO 3-+Ca 2++OH -=CaCO 3↓+H 2O8) CO 2 +H 2O+Na 2CO 3=2NaHCO 3 (饱和NaHCO 3溶液可除CO 2中的HCl )离子反应方程式:CO 2 +H 2O+CO 32-=2HCO 3-饱和碳酸钠中通CO 2: CO 2 +H 2O+Na 2CO 3=2NaHCO 3↓ 离子方程式:CO 2 +H 2O+2Na ++CO 32-=2NaHCO 3↓点燃通电 700~800℃通电通电高温9) CO 2+2NaOH =Na 2CO 3+H 2O (少量CO 2) CO 2+NaOH =NaHCO 3(足量CO 2) 10) 侯氏制碱:NH 3+NaCl+H 2O+CO 2==NaHCO 3↓+NH 4Cl 2NaHCO 3Na 2CO 3+H 2O+CO 2↑离子反应方程式:NH 3+Na ++H 2O+CO 2==NaHCO 3↓+NH 4+镁:1) 3Mg+N 2Mg 3N 2 2Mg+O 22MgO (Mg 在空气中燃烧的主要反应)2) 2Mg+CO 22MgO+C (金属单质置换出非金属单质典型反应)3) Mg+2H 2O (热)Mg(OH)2+H 2↑铝:1) 2Al+Fe 2O 3 Al 2O 3+2Fe (利用铝热反应可把其他难熔金属从它们的氧化物中还原来)2) 2Al+6HCl= 2AlCl 3+3H 2↑离子反应方程式:2Al+6H += 2Al 3++3H 2↑ (遇冷浓硫酸、冷浓硝酸钝化)2Al+2NaOH+2H 2O= 2NaAlO 2+3H 2离子反应方程式:2Al+2OH -+2H 2O= 2AlO 2-+3H 2↑ 3) Al 2O 3+6HCl = 2AlCl 3+3H 2O 离子反应方程式:Al 2O 3+6H += 2Al 3++3H 2O Al 2O 3+2NaOH =2NaAlO 2+H 2O 离子反应方程式:Al 2O 3+2OH -=2AlO 2-+H 2O 4) Al(OH)3+3HCl =AlCl 3+3H 2O 离子反应方程式:Al(OH)3+3H +=Al 3++3H 2O Al(OH)3+NaOH =NaAlO 2+2H 2O 离子反应方程式:Al(OH)3+OH -=AlO 2-+2H 2O5) AlCl 3+3NaOH (少量)=Al(OH)3↓+3NaCl 离子方程式:Al 3++3OH -=Al(OH)3↓AlCl 3+4NaOH(过量)=NaAlO 2+3NaCl+2H 2O 离子方程式:Al 3++4OH -(过量)=AlO 2-+2H 2O 6) NaAlO 2+HCl (少量)+H 2O =Al(OH)3↓+ NaCl 离子方程式:AlO 2-+H ++H 2O =Al(OH)3↓NaAlO 2+4 HCl (过量) =AlCl 3+ NaCl+2H 2O 离子方程式: AlO 2-+4 H +=Al 3++2H 2O 7) 制备氢氧化铝最佳方案:从铝盐制备:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH 4+从偏铝酸盐:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-(足量CO 2)2AlO 2-+CO 2+3H 2O=2Al(OH)3↓+CO 32-(少量CO 2)8) 明矾净水原理 :KAl(SO 4)2•12H 2O===K ++Al 3++2SO 42-+12H 2OAl 3++3H 2O===Al(OH)3(胶体)+3H +提升:明矾溶液中加入Ba(OH)2溶液①恰好使SO 42-完全沉淀:Al 3++2SO 42-+ 2Ba 2++4OH -===AlO 2-+2BaSO 4↓+2H 2O ②恰好使Al 3+完全沉淀:2Al 3++3SO 42-+ 3Ba 2++6OH -===2Al(OH)3↓+3BaSO 4↓铁:1) Fe 2+的检验:Fe 2++2OH -=Fe(OH)2↓ 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3↓(白色沉淀迅速变成灰绿色最后变成红褐色) 2FeCl 2+Cl 2=2FeCl 3 (先加KSCN 再加氯水,通过检验Fe 3+的存在证明Fe 2+)点燃点燃点燃高温 两性氧化物两性氢氧化物2) Fe 3+的检验: Fe 3++3SCN -=Fe(SCN)3 (血红色) Fe 3++3OH -=Fe(OH)3↓(红褐色) 3) Fe 2+→Fe 3+: 2Fe 2++X 2=2Fe 3++2X -(X=Cl 、Br) 4) Fe 3+→Fe 2+: 2Fe 3++Fe =3Fe2+2Fe 3++Cu =2Fe 2++Cu 2+(印刷电路板的反应)【强弱氧化剂氧化Fe 的总结】第二部分:非金属元素 氯、溴、碘、硅、硫 1氯、溴、碘:1) 氯碱工业:2NaCl+2H 2O 2NaOH+H 2↑+Cl 2↑(工业制氯气)离子反应方程式:2Cl -+2H 2O2OH -+H 2↑+Cl 2↑ (阳极产生氯气,阴极产生氢气和OH -)2) 实验室制氯气:MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O离子反应方程式:MnO 2+4H ++Cl -Mn 2++Cl 2↑+2H 2O (用饱和NaCl 除HCl 气体,浓硫酸除H 2O ) 3)2Fe+3Cl 22FeCl 3 (棕褐色的烟)Cu+Cl 2CuCl 2 (棕黄色的烟)H 2+Cl 22HCl(苍白色火焰) 4)Cl 2+H 2OHCl+HClO 离子反应方程式:Cl 2+H 2OH ++Cl -+HClO5) Cl 2+2NaOH =NaCl+NaClO+H 2O (Cl 2尾气吸收)离子反应方程式:Cl 2+2OH -=Cl -+ClO -+H 2O 6)工业制漂白粉:2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 主要成分CaCl 2和Ca(ClO)2有效成份Ca(ClO)27) 漂白粉漂白原理:Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (水溶液中的反应)离子反应方程式:Ca 2++2ClO -+H 2O+CO 2=CaCO 3↓+2HClO Ca(ClO)2溶液中通过量CO 2:ClO -+H 2O+CO 2=HCO 3-+HClO 8) 漂白粉失效:Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO 2HClO2HCl+O 2↑9) Cl 2+2NaBr =2NaCl+Br 2 Cl 2+2NaI =2NaCl+I 2 湿润的淀粉碘化钾试纸可检验Cl 2Br 2+2KI =2KBr+I 2离子反应方程式:Cl 2+2Br -=2Cl -+Br 2 Cl 2+2I -=2Cl -+I 2 Br 2+2I-=2Br -+I 2 (氧化性Cl 2﹥Br 2﹥I 2 还原性I —﹥Br —﹥Cl —)点燃点燃通电通电光照点燃10) Br -的检验:Br — +Ag +=AgBr ↓(淡黄色沉淀) I -的检验: I —+Ag +=AgI ↓(黄色沉淀)2硅、硫:硅:1) 工业制粗硅:SiO 2+2CSi+2CO ↑ 提纯:Si+2Cl 2SiCl 4SiCl 4+2H 2Si+4HCl2) SiO 2+CaO CaSiO 33) 硅酸的制备:(SiO 2与水不反应,只能用可溶性硅酸盐与酸反应制得) SiO 2+2NaOH =Na 2SiO 3+H 2O (氢氧化钠试剂瓶不用玻璃塞) Na 2SiO 3+CO 2+H 2O =Na 2CO 3+H 2SiO 3↓4) SiO 2+4HF =SiF 4↑+2H 2O (用于雕刻玻璃,因此氢氟酸保存在塑料瓶中) 5) 普通玻璃的制备 SiO 2+CaCO 3 CaSiO 3+ CO 2↑ SiO 2+ Na 2CO 3Na 2SiO 3+CO 2↑6) Si+2NaOH+H 2ONa 2SiO 3+2H 2↑硫:1) 硫酸型酸雨的形成:液相:SO 2+H 2OH 2SO 3 2H 2SO 3+O 2=2H 2SO 4 气相:2SO 2+O 22SO 3 SO 3+H 2O =H 2SO 42) SO 2+2NaOH =Na 2SO 3+H 2O (少量SO 2) SO 2+NaOH =NaHSO 3(足量SO 2)2Na 2SO 3+O 2=2Na 2SO 4 (Na 2SO 3溶液变质)3) SO 2的还原性:SO 2+Cl 2+2H 2O =H 2SO 4+2HCl 离子反应方程式:SO 2+Cl 2+2H 2O =4H ++SO 42-+2Cl -SO 2+Br 2+2H 2O =H 2SO 4+2HBr SO 2+H 2O 2=H 2SO 4 (SO 2与酸性KMnO 4、Fe 3+反应同样体现还原性) 4) 工业制硫酸:4FeS 2+11O 22Fe 2O 3+ 8SO 2↑ SO 2+O 22SO 3 SO 3+H 2O =H 2SO 45) 实验室制取SO 2:Na 2SO 3+H 2SO 4(浓)=Na 2SO 4+H 2O+SO 2↑6) SO 2+2NaHCO 3=Na 2SO 3+ H 2O +2CO 2 (用饱和的NaHCO 3溶液除CO 2中SO 2) 7) Na 2SO 3+2HCl =2NaCl+H 2O+SO 2↑ NaHSO 3+HCl =NaCl+H 2O+SO 2↑ 8) Cu+2H 2SO 4(浓)CuSO 4+ SO 2↑+2H 2O (也可用于实验室制备SO 2) C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O9) Na 2SO 3+BaCl 2=BaSO 3↓+2NaCl 10) S+ FeFeS S+ 2CuCu 2S S+ Hg =HgS3氮族元素:① 工业制备硝酸:4NH 3+ 5O 24NO+6H 2O (氨的催化氧化)2NO+O 2=2NO 2 3NO 2+H 2O =2HNO 3+NO (NO 与NO 2的相互转化)② 氨气使湿润的红色石蕊试纸变蓝:NH 3+H 2ONH 3·H 2O NH 4++OH -催化剂 △高温高温高温高温高温高温催化剂催化剂点燃③ 氨气的制备:N 2 + 3 H 2 2NH 3 (工业合成氨,条件不可省)2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O (实验室制氨气干燥用碱石灰)NH 3·H 2ONH 3↑+H 2O (浓氨水受热或加CaO 快速制氨气)④ 硝酸强氧化性与酸性的体现:(Fe 、Al 遇冷的浓硝酸、或冷的浓硫酸钝化) Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O Cu+4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO ↑+4H 2O 3Cu+8H ++2 NO 3- =3Cu 2++2NO ↑+4H 2O ⑤ 硝酸强氧化性的体现:C+4HNO 3(浓) 4NO 2↑+CO 2↑+2H 2O⑥ 浓硝酸久置显黄色:4HNO 34NO 2↑+O 2↑+2H 2O第二部分:元素周期表A 、B 、C 为元素周期表第三周期的元素,A 是除稀有气体外,原子半径最大的元素;B 元素的最高价氧化物对应的水化物呈两性;C 元素形成的气态氢化物最稳定。
苏教版高中化学方程式总结化学方程式是化学学习的重要基石,它不仅反映了化学反应的本质,还为我们定量研究化学反应提供了依据。
在苏教版高中化学教材中,涉及众多的化学方程式,以下为大家进行较为全面的总结。
一、无机化学部分1、碱金属(1)钠与氧气在常温下反应:4Na + O₂= 2Na₂O(2)钠在空气中燃烧:2Na + O₂点燃 Na₂O₂(3)钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑2、卤素(1)氯气与金属钠反应:2Na + Cl₂点燃 2NaCl(2)氯气与氢气反应:H₂+ Cl₂点燃 2HCl(3)氯气与水反应:Cl₂+ H₂O ⇌ HCl + HClO(4)氯气与氢氧化钠溶液反应:Cl₂+ 2NaOH = NaCl + NaClO+ H₂O3、氧族元素(1)硫在空气中燃烧:S + O₂点燃 SO₂(2)二氧化硫与氧气反应:2SO₂+ O₂催化剂加热 2SO₃(3)二氧化硫与水反应:SO₂+ H₂O ⇌ H₂SO₃4、氮族元素(1)氮气与氧气在放电条件下反应:N₂+ O₂放电 2NO (2)一氧化氮与氧气反应:2NO + O₂= 2NO₂(3)二氧化氮与水反应:3NO₂+ H₂O = 2HNO₃+ NO (4)氨气与水反应:NH₃+ H₂O ⇌ NH₃·H₂O(5)氨气与氯化氢反应:NH₃+ HCl = NH₄Cl5、碳族元素(1)碳在氧气中充分燃烧:C + O₂点燃 CO₂(2)碳在氧气中不充分燃烧:2C + O₂点燃 2CO(3)二氧化碳与碳反应:CO₂+ C 高温 2CO二、金属元素部分1、镁、铝(1)镁在空气中燃烧:2Mg + O₂点燃 2MgO(2)镁与二氧化碳反应:2Mg + CO₂点燃 2MgO + C (3)铝与氧气反应:4Al + 3O₂= 2Al₂O₃(4)铝与盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑2、铁(1)铁与氧气反应:3Fe + 2O₂点燃 Fe₃O₄(2)铁与盐酸反应:Fe + 2HCl = FeCl₂+ H₂↑(3)铁与硫酸铜溶液反应:Fe + CuSO₄= FeSO₄+ Cu三、有机化学部分1、烃(1)甲烷燃烧:CH₄+ 2O₂点燃 CO₂+ 2H₂O(2)乙烯与溴水反应:CH₂=CH₂+ Br₂ → CH₂Br—CH₂Br (3)乙烯的加聚反应:nCH₂=CH₂催化剂 CH₂—CH₂n2、烃的衍生物(1)乙醇与钠反应:2CH₃CH₂OH +2Na → 2CH₃CH₂ONa +H₂↑(2)乙醇的催化氧化:2CH₃CH₂OH + O₂催化剂加热2CH₃CHO + 2H₂O以上只是苏教版高中化学中的部分重要化学方程式,掌握这些方程式对于理解化学概念、解决化学问题具有重要意义。
高中化学方程式〔苏教版必修一〕总结必修一一、氯1.钠与氯气反应Na+Cl2 2NaCl2.铜与氯气反应Cu+Cl2 CuCl23.铁与氯气反应2Fe+3Cl2 2FeCl34.氢气与氯气反应H2+Cl2 2HCl(氢气在氯气中点燃,只有导管口部分发生反应,反应的范围较小,反应很平稳,所以氢气安静的燃烧。
而氢气和氯气混合,光照的条件下,瓶内的氢气和氯气迅速发生反应,在有限的空间中反应很剧烈,所以发生爆炸。
〕5.水与氯气反应H2O+Cl2 HCl+HClO6.次氯酸光照分解2HClO 2HCl+O2↑7.氢氧化钠与氯气反应〔氯气尾气处理〕2NaOH+Cl2=NaCl+NaClO+H2O8.氢氧化钙与氯气反应〔工业制漂白粉〕2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+H2O9.次氯酸钙漂白〔与CO2、H2O反应〕Ca(ClO)2+CO2+H2O=CaCO3+2HClO10.电解饱和食盐〔氯碱工业〕2NaCl+2H2O 2NaOH+H2+Cl2↑〔正极生成氯气,负极生成氢气和氢氧化钠。
〕11.二氧化锰与浓盐酸反应MnO2+4HCl〔浓〕MnCl2+2H2O+Cl212.溴化钾、碘化钾与氯气反应2KBr+Cl2=2KCl+Br22KI+Cl2=2KCl+I213.碘化钠与溴水反应2NaI+Br2=2NaBr+I2★注:氯水中的成分:Cl2 H2O HClO Cl- H+ OH- ClO-二、钠1.钠与氧气反应〔两种〕①4Na+O2=2Na2O②2Na+O2 Na2O22.钠与硫反应2Na+S=Na2S〔条件为点燃。
〕3.钠与水反应〔现象:浮游熔响红〕2Na+2H2O=2NaOH+H2↑4.钠与硫酸铜溶液反应2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2+Na2SO45.钠与四氯化钛反应4Na+TiCl4 4NaCl+Ti6.电解熔融的氯化钠2NaCl 2Na+Cl2↑7.氧化钠与水反应Na2O+H2O=2NaOH8.过氧化钠与水反应2Na2O2+2H2O=4NaOH+O2↑9.氧化钠与二氧化碳反应Na2O+CO2=Na2CO310.过氧化钠与二氧化碳反应2Na2O2+2CO2=2Na2CO3+O211.氧化钠与盐酸反应Na2O+2HCl=2NaCl+H2O12.过氧化钠与盐酸反应2Na2O2+4HCl=4NaCl+2H2O+O2↑13.过量烧碱与二氧化碳反应CO2+2NaOH=Na2CO3+H2O14.苏打与盐酸反应:总反应Na2CO3+2HCl=2NaCl+H2O+CO2↑分反应①Na2CO3+HCl=NaCl+NaHCO3②NaHCO3+HCl=NaCl+H2O+CO2↑15.小苏打与盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑16.纯碱溶液与二氧化碳反应Na2CO3+CO2+H2O=2NaHCO317.碳酸氢钠与氢氧化钠反应NaHCO3+NaOH=Na2CO3+H2O18.碳酸钠溶液与澄清石灰水反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH19.碳酸氢钠溶液与澄清石灰水反应少量碳酸氢钠NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH过量碳酸氢钠2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO320.碳酸钠溶液与氯化钙溶液反应Na2CO3+CaCl2=CaCO3↓+2NaCl21.小苏打受热分解2NaHCO3 Na2CO3+H2O+CO2↑22.侯氏制碱第一部反应NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl〔侯氏制碱法的方法是在饱和的碳酸钠里面通入二氧化碳.因为碳酸钠是饱和溶液,而碳酸氢钠的溶解度比碳酸钠小,所以在不断通入二氧化碳的过程中,碳酸钠转化为碳酸氢钠而析出.〕三、镁1.石灰石分解CaCO3 CaO+CO2↑2.生石灰与水反应CaO+H2O=Ca(OH)23.石灰乳与氯化镁溶液反应Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl24.氢氧化镁与盐酸反应Mg(OH)2+2HCl=MgCl2+2H2O5.电解熔融的氯化镁MgCl2 Mg+Cl2↑6.镁与氧气反应2Mg+O2 2MgO7.镁与氮气反应3Mg+N2 Mg3N28.镁与二氧化碳反应2Mg+CO2 2MgO+C9.镁与稀盐酸反应Mg+2HCl=MgCl2+H2↑10.氧化镁与盐酸反应MgO+2HCl=MgCl2+H2O11.氢氧化镁与盐酸反应Mg(OH)2+2HCl=MgCl2+2H2O12.氢氧化镁分解Mg(OH)2 MgO+H2O四、铝1.氢氧化铝加热2Al(OH)3 Al2O3+3H2O2.电解熔融的氧化铝2Al2O3 4Al+3O2↑3.偏铝酸钠溶液通入二氧化碳少量CO2 2NaAlO2+CO2+3H2O=2Al(OH)3↓+ Na2CO3过量CO2 NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO34.偏铝酸钠溶液与盐酸反应少量盐酸NaAlO2+HCl+H2O=Al(OH)3↓+NaCl过量盐酸NaAlO2+4HCl=AlCl3+NaCl+2H2O5.铝与氧气反应4Al+3O2=2Al2O36.铝与盐酸反应2Al+6HCl=2AlCl3+3H2↑7.铝与硫酸反应2Al+3H2SO4=Al2(SO4)3+3H2↑8.铝与氢氧化钠反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑9.铝与硫酸铜反应2Al+3CuSO4=Al2(SO4)3+3Cu10.铝与氧化铁反应2Al+Fe2O3 2Fe+Al2O311.氧化铝与硫酸反应Al2O3+3H2SO4=Al2(SO4)3+3H2O12.氧化铝与氢氧化钠反应Al2O3+2NaOH=2NaAlO2+H2O13.氢氧化铝与盐酸反应Al(OH)3+3HCl=AlCl3+3H2O14.氢氧化铝与氢氧化钠反应Al(OH)3+NaOH=NaAlO2+2H2O15.氯化铝与氨水反应AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl16.氯化铝与氢氧化钠反应少量氢氧化钠AlCl3+3NaOH=Al(OH)3↓+3NaCl过量氢氧化钠AlCl3+4NaOH=NaAlO2+3NaCl+2H2O五、铁1.高炉炼铁石灰石分解CaCO3 CaO+CO2↑碳复原二氧化碳C+CO2 2CO氧化铁与一氧化碳反应Fe2O3+3CO Fe+3CO22.氧化亚铁与稀硫酸反应FeO+H2SO4=FeSO4+H2O3.氧化铁与稀硫酸反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O4.四氧化三铁与稀硫酸反应Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O5.氢氧化亚铁在空气中反应4Fe(OH)2+O2+2H2O=4Fe(OH)3〔白色沉淀→灰绿色→红褐色〕6.氢氧化铁加热2Fe(OH)3 Fe2O3+3H2O7.硫酸亚铁与氢氧化钠溶液反应FeSO4+2NaOH=Fe(OH)2↓+Na2SO48.氯化铁与氢氧化钠溶液反应FeCl3+3NaOH=Fe(OH)3↓+3NaCl9.硫氰化钾溶液检验Fe3+的离子方程式〔产生血红色〕Fe3++3SCN-=Fe(SCN)310.铁与氧气反应3Fe+2O2 Fe3O411.铁在氯气中燃烧〔产生棕黄色烟〕2Fe+3Cl2 2FeCl312.铁与水蒸气反应3Fe+4H2O(g) Fe3O4+4H213.铁与稀硫酸反应Fe+H2SO4=FeSO4+H2↑14.铁与稀盐酸反应Fe+2HCl=FeCl2+H2↑15.铁与氯化铁反应Fe+2FeCl3=3FeCl216.氯化亚铁与氯水反应Cl2+2FeCl2=2FeCl317.氯化铁与铜反应2FeCl3+Cu=2FeCl2+CuCl218.铁与硫酸铜溶液反应Fe+CuSO4=FeSO4+Cu19.硫酸铁与铜反应Fe2(SO4)3+Cu=2FeSO4+CuSO4六、铜1.铜与氧气反应2Cu+O2 2CuO2.铜与氯气反应Cu+Cl2 CuCl23.铜与硝酸银反应Cu+2AgNO3=Cu(NO3)2+2Ag4.加热氢氧化铜Cu(OH)2 CuO+H2O5.胆矾加热CuSO4•5H2O CuSO4+5H2O6.硫酸铜与水反应〔检验水蒸气〕CuSO4+5H2O=CuSO4•5H2O〔白色→蓝色〕七、硅1.硅酸钠与水、二氧化碳反应Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓2.硅酸钠与盐酸反应Na2SiO3+2HCl=2NaCl+H2SiO3↓3.碳酸钠与二氧化硅反应Na2CO3+SiO2 Na2SiO3+CO2↑4.碳酸钙与二氧化硅反应CaCO3+SiO2 CaSiO3+CO2↑5.氧化钙与二氧化硅反应CaO+SiO2 CaSiO36.氟化氢与二氧化硅反应4HF+SiO2=SiF4↑+2H2O 〔玻璃雕花原理〕〔HF保存在塑料瓶中〕7.氢氧化钠与二氧化硅反应2NaOH+SiO2=Na2SiO3+H2O 〔保存时不用玻璃塞〕8.硅的制备与精制碳和二氧化硅反应2C+SiO2 Si+2CO↑硅与氯气反应Si+2Cl2 SiCl4四氯化硅与氢气反应SiCl4+2H2 Si+4HCl9.硅与氟化氢反应Si+4HF=SiF4↑+2H2↑10.硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑11.硅与氧气反应Si+O2 SiO2八、硫1.二氧化硫与水反应SO2+H2O H2SO32.二氧化硫与氢氧化钠溶液反应少量氢氧化钠SO2+NaOH=NaHSO3过量氢氧化钠SO2+2NaOH=Na2SO3+H2O3.二氧化硫与亚硫酸钠反应SO2+Na2SO3+H2O=2NaHSO34.二氧化硫通入澄清石灰水并至过量SO2+Ca(OH)2=CaSO3↓+H2OSO2+CaSO3+H2O=Ca(HSO3)25.二氧化硫与氧化钙反应SO2+CaO=CaSO36.二氧化硫与氧气反应2SO2+O2 2SO37.二氧化硫与水、卤素反应SO2+X2+2H2O=H2SO4+2HX 〔X=Cl、Br、I〕8.二氧化硫与硫化氢反应SO2+2H2S=3S+2H2O9亚硫酸与氧气反应2H2SO3+O2=2H2SO410.亚硫酸与双氧水反应H2SO3+H2O2=H2SO4+H2O11.制硫酸原理①硫与氧气反应S+O2 SO2或硫化铁与氧气反应4FeS2+11O2 2Fe2O3+8SO2②二氧化硫与氧气反应2SO2+O2 2SO3③三氧化硫与水反应SO3+H2O=H2SO412.铜与浓硫酸反应Cu+2H2SO4〔浓〕CuSO4+SO2↑+2H2O13.碳与浓硫酸反应C+2H2SO4〔浓〕CO2↑+2SO2↑+2H2O14.硫磺去除汞Hg+S=HgS15.实验室制二氧化硫Na2SO3+H2SO4〔浓〕=Na2SO4+H2O+SO2↑16.亚硫酸钠与氧气反应2Na2SO3+O2=2Na2SO417.亚硫酸钙与氧气反应2CaSO3+O2=2CaSO4九、氮1.氮气与镁反应3Mg+N2 Mg3N22.氮气与氧气反应N2+O2 2NO3.氮气与氢气反应〔工业制氨气〕N2+3H2 2NH34.一氧化氮与氧气反应2NO+O2=2NO2 〔无色→红棕色〕5.二氧化氮与水反应3NO2+H2O=2HNO3+NO6.二氧化氮与氧气、水反应4NO2+O2+2H2O=4HNO37.一氧化氮与氧气、水反应4NO+3O2+2H2O=4HNO38.氨气与水反应NH3+H2O NH3•H2O9.氨水加热NH3•H2O NH3↑+H2O10.浓盐酸检验氨气NH3+HCl=NH4Cl11.氨气与硫酸反应2NH3+H2SO4=(NH4)2SO412.氨气催化氧化4NH3+5O2 4NO+6H2O13.加热氯化铵NH4Cl NH3↑+HCl↑14.加热碳酸氢铵NH4HCO3 NH3↑+H2O+CO2↑15.加热碳酸铵(NH4)2CO3 2NH3↑+H2O+CO2↑16.氯化铵与熟石灰反应〔实验室制氨气〕2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O17.硝酸见光分解4HNO3 4NO2↑+O2↑+2H2O18.氧化铁与硝酸反应Fe2O3+6HNO3=2Fe(NO3)3+3H2O19.氢氧化钙与硝酸反应Ca(OH)2+2HNO3=Ca(NO3)2+2H2O20.硝酸与碳酸钠溶液反应2HNO3+Na2CO3=2NaNO3+CO2↑+H2O21.铜与浓硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 22.铜与稀硝酸反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 23.碳与浓硝酸反应C+4HNO3(浓) CO2↑+4NO2↑+2H2O24.工业制硝酸氨气与氧气反应4NH3+5O2 4NO+6H2O一氧化氮与氧气反应2NO+O2=2NO2二氧化氮与水反应3NO2+H2O=2HNO3+NO。
高一必修一化学方程式汇编§1◆碱金属元素1、4Na+O2===2Na2O (白色)2、4Na+2O 22Na2O2(淡黄色)3、2Na2O+ O2Na2O24、2Na+2H2O===2NaOH+H2↑(置换反应)Mg + 2H2O(沸水)===Mg(OH)2 + H2↑3Fe + 4H2O Fe3O4 + 4H2↑5、Na2O+H2O===2NaOH CaO+H2O===Ca(OH) 26、2Na2O2+2H2O===4NaOH+O2↑7、Na2O+CO2===Na2CO38、2Na2O2+2CO2===2Na2CO3+O2(呼吸面具)9、Na2CO3+HCl(少量)=NaHCO3+NaCl 10、Na2CO3+2HCl=2NaCl+ H2O+ CO2↑11、NaHCO3+HCl===NaCl+H2O+CO2↑(与HCl反应比Na2CO3更快更剧烈)12、NaHCO3 + NaOH== Na2CO3 + H2O13、2NaHCO3(固体)Na2CO3+ H2O+ CO2↑(NaHCO3热不稳定性)14、Na2CO3(溶液)+ CO2 + H2O= 2NaHCO3 Na2SO3+ SO2+ H2O= 2NaHSO315、2NaOH+ CO2 (少量)== Na2CO3 + H2O NaOH+ CO2(过量)== NaHCO316、2NaOH+ SO2 == Na2SO3 + H2O 2NaOH+ SO2 (过量)== NaHSO317、Na2CO3 + Ca(OH)2=Ca CO3↓+2 NaOH(有白色沉淀)18、2NaHCO3 + Ca(OH)2(少量)= Ca CO3↓+ 2H2O + Na2CO3(也有白色沉淀)19、NaHCO3 + Ca(OH)2(过量)= Ca CO3↓+ H2O + NaOH20、NaOH + HCl===NaCl+H2O21、Ca(OH)2 + CO2===CaCO3↓+H2O Ca(OH)2 + SO2 ==== CaSO3↓+ H2O22、Ca(OH)2 + CO2(过量)===Ca(HCO3)223、Na2O + 2HCl=== 2NaCl + H2O (Na2O是碱性氧化物)24、2Na2O2 + 4HCl=== 4NaCl + 2H2O + O2↑ (Na2O2不是碱性氧化物)26、2NaOH+ SO3 == Na2SO4 + H2O27、CaCO 3CaO+CO2↑28、MgCO 3MgO+CO2↑29、2NaCl2Na +Cl2↑(工业制取Na)30、2NaCl+2H2O2NaOH + H2↑ +Cl2↑(电解饱和NaCl溶液是氯碱工业)§7卤族元素31 、2 Na+Cl 22Na Cl(白烟) 2Fe + 3Cl 2 2FeCl3 (棕褐色的烟)Cu+Cl 2Cu Cl2(棕黄色的烟)(生成最高价金属的氯化物)32、H2+Cl 2HCl (苍白色火焰)H2+Cl 2HCl (爆炸)2NaCl+H2SO4(浓) Na2SO4+2HCl↑(实验室制取HCl↑)33、2 P+3Cl22PCl3 (雾) 34、2P+5Cl 2 2PCl5 (白烟)35、Cl2+H2O HCl+HClO (新制氯水含:Cl2、H2O、HCl、HClO )2HClO2HCl+O2↑(久置氯:HCl溶液)36、2F2 +2H2O===4HF+O2 (F2置换出O2)37、Cl2+ 2NaOH===NaCl+NaClO+H2O (吸收尾气氯气,防止污染)38、2Cl2+2Ca(OH)2 (石灰乳) == CaCl2+Ca(ClO)2 + 2H2O (工业制漂白粉)39、Ca(ClO)2+ CO2+ H2O=Ca CO3↓+2HClO 2HClO2HCl+O2↑(漂白粉的变质)40、MnO2 + 4HCl(浓)MnCl2+Cl2↑+2H2O (Cl2实验室制法)41、H2 + F2 == 2H(HF最稳定)H2 + Cl2 2HCl H2 + Br2 == 2H Br (500o C)H2 + I 22HI (HI不稳定,易分解)(活泼性、氧化性:F2> Cl2 > Br2 >I2 )42、2 NaBr + Cl2==2NaC l+ Br2(C l2置换出Br2 ,Br2水橙黄色,Br2在CCl4中橙红)2 K I + Br2 ==2 KBr + I2 (Br2置换出I2 ,I2水黄褐色,I2在CCl4中紫红色)Cl2 +2 K I ===2 K Cl+I2 (活泼性、氧化性:Cl2 > Br2 >I2 )43、AgNO3+ NaCl === AgCl↓(白)+Na NO3AgNO3 + NaBr = AgBr↓(浅黄)+NaNO3AgNO3 + NaI == AgI↓ (黄) + Na NO344、2AgBr2Ag+Br2(AgBr做照相底片感光剂)(AgCl、AgI类似)45、化合价高变低氧化剂氧化性,得电子,被还原,发生还原反应,得到还原产物46、强氧化剂: O2 、O3、Cl2、Br2、H2O2、Na2O2、HClO、HNO3、浓H2SO4、KMnO4、Fe3+强还原剂: 活泼金属、Fe2+、I—、S2- 、SO32-(SO2的水溶液,HSO3-)§6氧族元素47、.H2 + S H2SFe + S FeS 2Cu + S Cu2S (较低价金属的硫化物)48、S + O 2SO249、4FeS2 + 11O 22Fe2O3 + 8SO2 (工业制硫酸)2SO2 + O2 2SO3 (工业制硫酸)SO3 + H2O = H2SO4 (工业制硫酸)50、SO2 + H2O H2SO3 (酸雨的形成)2H2SO3 + O2 = 2H2SO4(酸雨的形成)51、3O 22O3 (O3消毒柜)52、2H2O 2 2H2O+ O2↑(快速且方便制O2)53、2H2S+SO2==3S↓+2H2O (气体反应或溶液反应)54、2H2S + O2(少量)2H2O + 2S2H2S + 3O2(足量)2H2O + 2SO255、CuSO4+H2S = CuS↓+ H2SO4 (特殊:弱酸制强酸)56、Cl2+ SO2 + 2H2O=H2SO4+2HCl (Br2、I2 类似) (SO2 的还原性)57、Cu+2H2SO4(浓)CuSO4+2H2O +SO2↑(浓H2SO4的酸性和强氧化性)58、C+2H2SO4(浓) CO2↑+ 2H2O + 2SO2↑(浓H2SO4的强氧化性)59、2Na2SO3 + O2 =2Na2SO4 (Na2SO3要密封保存)60-、Na2SO3+H2SO4(较浓)=Na2SO4+SO2 +H2O (SO2的实验室制法)61、FeS+2HCl=H2S↑+FeCl2(H2S的实验室制法)62、SO2(少量)+2NH3+H2O===(NH4)2SO3§2、3几种常见的金属63、2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑64、2Al + 2NaOH +2H2O==2NaAlO2 + 3H2↑(氧化剂只有水)65、Al2O3 + 6HCl==2AlCl3+ 3H2O (Al2O3是酸性氧化物)66、Al2O3 + 2NaOH==2NaAlO2 + H2O (Al2O3是碱性氧化物)67、Al(OH)3 + 3HCl==AlCl3 + 3H2O Al(OH)3是酸68、Al(OH)3 + NaOH==NaAlO2 + 2H2O Al(OH)3是碱69、2Al(OH)3Al2O3 + 3H2O (Fe(OH)3、Cu(OH)2类似)70、AlCl3 + 3NH3·H2O=Al(OH)3↓+3NH4Cl 由AlCl3制取Al(OH)3最好的方法71、AlCl3 + 3NaOH(少量)=Al(OH)3↓+3NaCl Al(OH)3 + NaOH==NaAlO2 + 2H2O72、AlCl3 + 4NaOH(过量)=NaAlO2+3NaCl + 2H2O73、NaAlO2+ HCl(少量)+ H2O=NaCl+Al(OH)3↓Al(OH)3 + 3HCl==AlCl3 + 3H2O74、NaAlO2+4 HCl(过量)+ H2O=NaCl+ AlCl3↓+2H2O75、NaAlO2+ CO2 (过量)+2H2O=Al(OH)3↓+ NaHCO3 NaAlO2由NaAlO2制取Al(OH)3最好的方法,不选用HCl76、3NaAlO2+AlCl3+6H2O= 4Al(OH)3↓+ 3 NaCl(双水解反应)77、2Mg +O22MgO3Mg +N 2Mg3N2 2Mg+CO 22MgO(白)+C(黑)剧烈Mg + 2H2O(沸水)===Mg(OH)2 + H2↑78、海水含NaCl 、MgCl2、CaCl2、Na2SO4等中提取Mg79、CH3COOH、、H2CO3、、H2S、、≤Mg(OH)80、非电解质:CO2、SO2、SO3、NH3、CCl4、酒精、葡萄糖、蔗糖、淀粉、油脂制熟石灰CaCO3CaO+CO2↑,CaO+H2O Ca(OH)2沉淀MgCl2+Ca(OH)2Mg(OH)2↓+CaCl2酸化Mg(OH)2+2HCl MgCl2+2H2O蒸发结晶析出MgCl2·6H2O脱水在氯化氢气流中使MgCl2·6H2O脱水制得无水MgCl2电解电解熔融氯化镁制得镁:MgCl2(熔融)Mg+Cl2↑。
高一化学方程式专题1 化学家眼中的物质世界1、碱性氧化物与酸反应:CaO + 2HCl =CaCl 2 + H 2O2、酸性氧化物与见反应:CO 2 + Ca(OH)2 = CaCO 3↓ + H 2O3、单质→化合物:2H 2O + O 2==2H 2O点燃4、碱性氧化物→碱:CaO + H 2O==Ca(OH)25、酸性氧化物→酸:SO 3 + H 2O == H 2SO 46、酸→盐:H 2SO 4+BaCl 2 == BaSO 4↓ + 2HC l7、置换反应:Fe + CuSO 4 == Cu + FeSO 48、化合反应:CaO + H 2O==Ca(OH)29、分解反应:CaCO 3 == CaO + CO 2↑高温10、 复分解反应:Ca(OH)2 + Na 2CO 3 == CaCO 3↓+ 2NaOH 11、 氧化铁高温下与CO 反应:Fe 2O 3 + 3CO == 2Fe + 3CO 2↑高温12、 过氧化氢分解生成氧气和水:2H 2O 2 ====H 2O + 2O 2↑MnO 213、 粗盐提纯:MgCl 2 + 2NaOH ==Mg(OH)2↓+ 2NaCl14、氯化铵与强碱溶液混合加热:NH 4Cl + NaOH === NaCl + H 2O + NH 3↑△15、 Cl -与硝酸银的反应:NH 4Cl + AgNO 3 == AgCl ↓+NH 4NO 3 16、 SO42-与Ba 2+的反应:(NH 4)2SO 4 + BaCl 2 == BaSO 4↓ +2NH 4Cl专题2 从海水中获得的化学物质1、工业制法——氯碱工业 :阳极(石墨棒)2NaCl + 2H 2O通电2NaOH + H 2↑ + Cl 2↑阴极(铁棒)2、氯的实验室制法:MnO 2+4HCl (浓) =△ = MnCl 2+2H 2O +Cl 2↑3、钠在氯气中燃烧,产生白烟:2Na+Cl 2点燃2NaCl4、铁在氯气中燃烧,产生棕褐色烟:5、铜在氯气中点燃,产生棕黄色烟:Cu + Cl 2 ===CuCl 2点燃6、氢气在氯气中燃烧,发出苍白色火焰:H 2 + Cl 2 ===2HCl点燃7、P在氯气中燃烧产生大量白色烟雾:2P+3Cl2点燃2PCl3PCl3+Cl2点燃PCl58、Cl2 与碱的反应:Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O9、Ca(ClO)2与酸反应:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO漂白粉长时间放置于空气中将失效。
Ca(ClO)2 + 2HCl= CaCl2+2HclO10、氯气与水反应:11、Cl2+SO2 +2H2O=H2SO4 +2HCl12、次氯酸见光易分解放出氧气:13、溴、碘的提取:Cl2+2KBr2KCl+Br2Cl2+2KI2KI+I213、Br置换出I:Br2 + 2KI ==I2 + 2KBr14、Br-与Ag+的反应:NaBr + AgNO3==AgBr↓+ NaNO315、I-与Ag+的反应:NaI + AgNO3==Ag I↓+ NaNO316、钠与水的反应:2Na + 2H2O === 2NaOH + H2↑(浮、熔、游、响、红)17、钠与O2、Cl2、S 等非金属单质的反应:4Na + O2 === 2Na2O (白色)加热2Na + O2 === Na2O2 (淡黄色固体)18、Na2O与水反应:Na2O +H2O ==2NaOHNa2O在空气中加热(变黄)△2Na2O+O2=2 Na2O219、Na2O与酸反应:Na2O+ 2HCl=2NaCl + H2O20、过氧化钠Na2O2与水反应:Na2O2 +2H2O == 4 NaOH + O2↑21、过氧化钠Na2O2与CO2反应:2Na2O2+ 2CO2==2 Na2CO3 + O222、电解熔融NaCl:2NaCl(熔融)====2Na + Cl2↑电解23、Na从钛、锆、铌等金属的氯化物中置换出金属单质:TiCl4 + 4Na ========= Ti + 4NaCl700-800℃24、Na2CO3+ Ca(OH)2 == CaCO3↓+ 2NaOHNa2CO3+ CaCl2 == CaCO3↓+ 2NaClBaCl2+Na2CO3BaCO3 +2NaClNa2CO3+CO2+H2O2NaHCO325、NaOH+CO2NaHCO3小苏打受热分解:2NaHCO32Na2CO3+H2O+OC2↑NaHCO3+Ca(OH)2CaCO3↓+NaOH+H2O2NaHCO3+Ca(OH)2CaCO3↓+Na2CO3+2H2ONaHCO3 + NaOH==Na2CO3 + H2O26、侯氏制碱法:NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl27、Mg的提取的相关反应:煅烧CaCO3 === CaO + CO2↑ CaO + H2O ===Ca(OH)2(石灰乳)Ca(OH)2 + MgCl2 ===Mg (OH)2↓+ CaCl2Mg(OH)2 + 2HCl === MgCl2 + 2H2OHCl气氛MgCl2· 6H2O ====== MgCl2 + 6H2O加热通电MgCl2(熔融) === Mg + Cl2↑28、Mg与非金属反应:2Mg + O2 == 2MgO, Mg + Cl2 == MgCl2,3Mg + 3N2 == Mg3N2点燃Mg能在CO2中燃烧:2Mg + O2 ==2MgO + C点燃29、Mg与沸水反应:Mg + 2H2O(沸水)== Mg(OH)2 + H2↑30、与酸反应:与非强氧化性酸反应:Mg + H2SO4 === MgSO4 + H2↑31、与某些盐溶液反应:Mg + 2FeCl3 == 2FeCl2 + MgCl2,Mg + FeCl2 == Fe + MgCl232、MgO 与水反应:MgO + H2O == Mg(OH)2,33、MgO 与酸反应:MgO + 2HCl == MgCl2 + H2O专题3 从矿物到基础材料1、从铝土矿中提取铝的相关反应:溶解铝土矿(主要成分是Al2O3):Al2O3+2NaOH === 2NaAlO2+H2O 酸化:NaAlO2+CO2+2H2O === Al(OH)3↓+NaHCO3灼烧:2Al(OH)3 = =Al2O3 + H2O△电解:通电2Al2O3(熔融) == 4Al+3O2↑2、Al2O3与酸反应:Al2O3 + H2SO4 ==Al2(SO4)3 +3H2OAl2O3与碱反应:Al2O3 + 2NaOH==2NaAlO2 + H2O3、AlCl3与氨水反应,生成白色胶状沉淀(Al(OH)3的制备):AlCl3 + NH3·H2O == Al(OH)3↓+ NH4Cl4、Al(OH)3与酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O离子反应:Al(OH)3 + 3H + =Al 3+ +3H2OAl(OH)3与碱反应:Al(OH)3 + NaOH = NaAlO 2 + 2H 2O离子反应:Al(OH)3 + 3OH - =AlO 2- +2H 2O5、明矾的净水作用:KAl(SO 4)2====K + + Al 3+ + 2SO 42 Al 3+ + 3H2O==Al(OH)3(胶体)+ H +6、Al 与酸反应:2Al + 6HCl ==2AlCl 3 + 3H 2↑7、Al 与强碱溶液反应:2Al +2NaOH + 2H 2O == 2NaAlO 2+ 3H 2↑ 8、铝热效应:高温2Al+Fe 2O 3====Al 2O 3+2Fe高温2Al + 3CuO ==== Al 2O 3 + 3Cu9、铝三角反应式:(1) 2Al +2NaOH + 2H 2O == 2NaAlO 2+ 3H 2↑ (2) 2Al + 6HCl ==2AlCl 3 + 3H 2↑ (3) Al 2O 3 + 2NaOH==2NaAlO 2 + H 2O (4) Al 2O 3 + H 2SO 4 ==Al 2(SO 4)3 +3H 2O (5)高温2Al+Fe 2O 3====Al 2O 3+2FeAl + O 2 ==Al 2O 3(6) 通电2Al 2O 3(熔融) == 4Al+3O 2↑(7) NaAlO 2+CO 2+2H 2O === Al(OH)3↓+NaHCO 3 (8) Al(OH)3 + NaOH = NaAlO 2 + 2H 2O (9) Al(OH)3 + 3HCl = AlCl 3 + 3H 2O(10) A lCl 3 + NH 3·H 2O == Al(OH)3↓+ NH4Cl (11) Al(OH)3 === Al 2O 3 + 3 H 2O10、 高炉炼铁——工业炼铁相关反应式: (1) C + O 2 ===CO 2点燃(2)高温C + CO 2 === CO(3)高温3CO + Fe 2O 3=== 2Fe + 3CO 2(4)高温CaCO 3 === CaO + CO 2↑(5)高温CaO + SiO 2 ==== CaSiO 311、 Fe 在氧气里灼烧:12、Fe在氯气中燃烧:点燃2Fe + 3Cl2 ===2FeCl313、铁与硫加热反应△Fe + S === FeS14、铁与盐酸反应: Fe + 2HCl = FeCl2 + H2↑Fe + 2H+= Fe2++ H2↑15、高温下铁与水反应高温3Fe + 4H2O(g)=== Fe3O4 + 4H2↑16、Fe + CuSO4 ==Cu + FeSO417、Fe + FeCl3 ===3FeCl218、用KSCN检验Fe3+的存在离子方程式 Fe3++3SCN-= Fe(SCN)319、氧化铁溶于盐酸中 Fe2O3+ 6HCl = 2FeCl3+ 3H2O20、氯化铁中滴入氢氧化钠溶液(红褐色沉淀):FeCl3+ 3NaOH = Fe(OH)3 ↓+3NaCl21、氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀):4Fe(OH)2+ O2+ 2H2O = 4Fe (OH)322、氯化亚铁溶液中通入氯气:2FeCl2+ Cl2= 2FeCl323、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO424、氯化铁溶液中加入铁粉:2FeCl3+ Fe = 3FeCl225、氢氧化铁加热分解:△2Fe(OH)3 === Fe2O3 + 3H2O↑26、湿法炼铜:Fe + CuSO4 = FeSO4 + Cu27、铜与氧气加热反应:△Cu +O2 === 2CuO28、铜在氯气中燃烧,产生棕黄色的烟:点燃Cu + Cl2=== CuCl229、铜与S加热:△2Cu + S === Cu2S30、铜与硝酸银溶液反应:Cu +2 AgNO3 ===2 Ag + Cu(NO3)231、木炭还原氧化铜:高温2CuO + C === 2Cu + CO2↑32、铜与FeCl3溶液反应:Cu + FeCl3 ===2FeCl2 + CuCl233、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓34、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓35、硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑36、Si +2F2 == SiF4(气态)37、Si +2NaOH + H2O == Na2SiO3 +2H2↑38、Si高温或加热下能与某些非金属单质反应:高温Si + O2=== SiO2高温Si + C== =SiC高温Si + 2H2===SiH4高温Si + 2Cl2=== SiCl439、 二氧化硅与氢氟酸反应:SiO 2 + 4HF == SiF 4 ↑+ 2H 2O (雕刻玻璃的反应——实验室氢氟酸应保存在塑料瓶中)40、41、 高温与碱性氧化物反应: SiO 2 + Na 2O===Na 2SiO 342、与某些盐反应:43、 SiO 2 的氧化性: SiO 2 +2C===Si +2CO ↑ SiO 2 +2Mg===Si +2MgO高温高温44、 工业生产硅的相关反应:高温SiO 2 + 2C=== Si(粗硅) + 2CO↑高温Si + 2Cl 2 ===SiCl 4 (液态) SiCl 4 + 2H 2 ===Si(高纯硅) + 4HCl高温45、专题4 硫、氮和可持续发展1、SO 2 是酸性氧化物:2、SO 2与O2反应:SO 2 + O 2 <==== > 2SO 3催化剂加热3、SO 2能使溴水褪色: SO 2 + Br 2 + 2H 2O ===H 2SO 4 +2HBr4、SO 2与H 2O 2反应: SO 2 + H 2O 2 === H 2SO 45、SO 2的氧化性:SO 2 + 2H 2S ===3S ↓+ 2H 2O6、酸雨的形成:SO 2 + O 2 <==== > 2SO 3 SO 3 + H 2O === H 2SO 4催化剂加热SO 2 + H 2O<===> H 2SO 3 2H 2SO 3 + O 2 == 2H 2SO 47、石灰石-石膏法脱硫(钙基固硫法):CaO + SO 2 = CaSO 3, SO 2 + Ca(OH)2 = CaSO 3 + H 2O ,2CaSO 3 + O 2 = 2CaSO 48、氨水脱硫:SO 2 + 2NH 3+H 2O =(NH4)2SO 3, 2(NH 4)2SO 3 + O 2 = 2(NH 4)2SO 4 9、硫酸的工业制法中的反应式:高温4FeS 2 + 11O 2 === 2Fe 2O 3 + 8SO 2点燃S + O 2=== SO 2催化剂加热SO 2 + O 2 <==== > 2SO 3SO 3 + H 2O == H 2SO 410、硫酸的工业制法中尾气中SO 2的处理:用氨水处理后,再用硫酸处理: SO 2 + 2NH 3+H 2O =(NH4)2SO 3, SO 2 + NH 3+H 2O =NH4HSO 311、 浓硫酸难挥发,可制取易挥发性酸:加热2NaCl + H 2SO 4 ===Na 2SO 4 +HCl↑12、 稀硫酸用于酸洗除锈:Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O 13、浓硫酸的强氧化性:14、 硫及含硫化合物之间的转化反应:(1)-2价硫到0价硫:硫化氢不完全燃烧:点燃H 2S + O 2 ===2S↓ + 2H 2O硫化氢通入卤水中:H 2S + X 2==S ↓ + 2HX (X 代表CL 、Br 、I )现象:卤水溶液褪色,产生淡黄色沉淀。