人教版高中化学选修4第二章《化学反应速率和化学平衡》的知识点整理归纳
- 格式:doc
- 大小:254.00 KB
- 文档页数:13
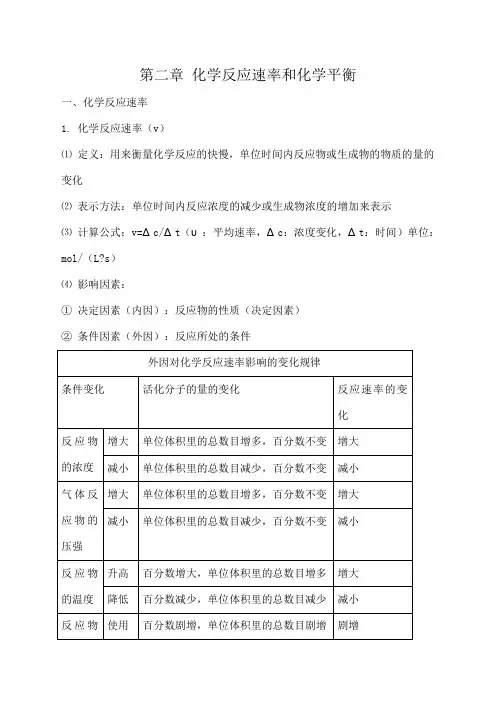
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L?s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1.定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据②在单位时间内消耗了n m olB同时消耗了p但(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小, V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。

人教版化学反应速率与化学平衡知识点
1. 反应速率:指单位时间内反应物质的浓度变化量。
反应速率可以通过实验测定某个反应物质的浓度随时间的变化来确定。
2. 影响反应速率的因素:温度、浓度、反应物质的物理状态、催化剂等因素都可以影响化学反应的速率。
增加温度、浓度、细粒度反应物以及催化剂的存在都可以增加反应速率。
3. 反应速率的表达:反应速率可以通过反应物质浓度的变化与时间的关系来表达,一般通过反应速率的初速度或者平均速率来描述。
4. 反应速率与反应机理:反应速率与反应机理有关,反应速率常常受到反应物质分子之间碰撞的频率和能量的影响。
理解反应机理有助于推导出反应速率的表达式。
5. 化学平衡:当反应物与生成物的浓度在一定条件下不再发生明显变化时,称为化学反应达到平衡。
在化学平衡状态下,正向反应和逆向反应的速率相等。
6. 平衡常数:平衡常数是描述化学平衡条件的物理量,记为K。
平衡常数表征了反应物与生成物浓度的比例关系,反映了平衡位置的倾向性。
不同反应有不同的平衡常数表达式。
7. 影响化学平衡的因素:温度、压强、浓度等因素可以改变化学平衡的位置。
根据勒沃尔定律,提高温度对于吸热反应有利于正向反应,而对于放热反应有利于逆向反应。
8. 平衡与化学工业过程:了解反应速率与化学平衡的知识对于控制工业生产过程中的反应速率和平衡位置至关重要,可以提高生产效率和产品质量。
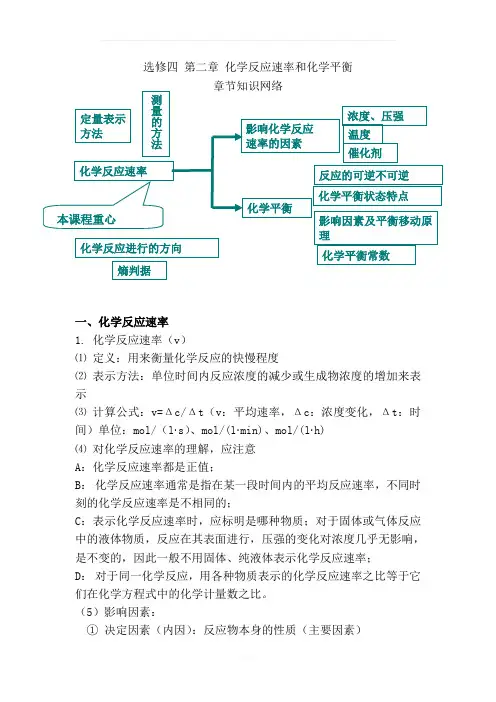
选修四 第二章 化学反应速率和化学平衡 章节知识网络一、化学反应速率1. 化学反应速率(v )⑴ 定义:用来衡量化学反应的快慢程度⑵ 表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶ 计算公式:v=Δc/Δt (v :平均速率,Δc :浓度变化,Δt :时间)单位:mol/(l ·s )、mol/(l ·min)、mol/(l ·h)⑷ 对化学反应速率的理解,应注意A :化学反应速率都是正值;B : 化学反应速率通常是指在某一段时间内的平均反应速率,不同时刻的化学反应速率是不相同的;C :表示化学反应速率时,应标明是哪种物质;对于固体或气体反应中的液体物质,反应在其表面进行,压强的变化对浓度几乎无影响,是不变的,因此一般不用固体、纯液体表示化学反应速率;D : 对于同一化学反应,用各种物质表示的化学反应速率之比等于它们在化学方程式中的化学计量数之比。
(5)影响因素:① 决定因素(内因):反应物本身的性质(主要因素)本课程重心 化学反应速率 影响化学反应 速率的因素 化学反应进行的方向化学平衡 测量的方法 反应的可逆不可逆 化学平衡状态特点 化学平衡常数 影响因素及平衡移动原理熵判据浓度、压强 温度 催化剂 定量表示方法②条件因素(外因):反应所处的外界条件(浓度、压强、温度、催化剂及其他条件)外界条件对化学反应速率影响的变化规律※注意:惰性气体对于速率的影响:(该处知识为易错点,请注意) ①恒温恒容时:充入惰性气体→总压增大,但是各分压不变,各物质浓度不变→反应速率不变②恒温恒压时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢2 有效碰撞、活化能:能够发生化学反应的分子的碰撞,把能够发生有效碰撞的分子叫活化分子。
活化分子具有比普通分子更高的能量,多出的那部分能量叫活化能。
注:浓度、压强、温度、催化剂影响反应速率的实质是改变了单位体积内活化分子的数目。

第二章 化学反应速率化学平衡知识点总结要点一 化学反应速率大小的比较 (一)化学反应速率 1.表示方法通常用单位时间内反应物浓度的_______________或生成物浓度的_______________来表示。
2.数学表达式:,单位为。
对于Δc (反应物)=c(初)—c(末), 对于Δc (生成物)=c (末)-c(初)。
Δt 表示反应所需时间,单位为等。
3.单位一般为_______________或_____________或______________。
4、对某一具体的化学反应来说,用不同物质的浓度变化来表示化学反应速率时,数值往往不同,其数值之比等于。
(二)根据化学方程式对化学反应速率的计算 求解化学反应速率的计算题一般按以下步骤: ①写出有关反应的化学方程式;②找出各物质的起始量、转化量、某时刻量; ③根据已知条件列方程式计算.例如:反应 mA + nB pC起始浓度(mol/L ) a b c 转化浓度(mol/L ) x 某时刻浓度(mol/L)a-x要点二 化学反应速率大小的比较(1)同一化学反应速率用不同物质表示时数值,但比较反应速率的快慢不能只看数值的大小,而要通过转化换算成同一物质表示,再比较数值的大小。
(2)比较化学反应速率与化学计量数的比值,如aA+bB==pY+qZ ,即比较与若则A 表示的反应速率比B 大。
(3)注意反应速率单位的一致性。
(4)注意外界条件对化学反应速率的影响规律. 在反应A+3B2C+2D 中,若某条件下v(A)=0。
15 mol/ (L·min ) , 则此时用v(B )表示该反应的化学反应速率为v (B )= _________ ;若起始条件下,物质C 的物质的量为0,经过5秒后,C 的物质的量浓度为0。
45 mol/L ,则用v(C )表示该反应的化学反应速率为_________. (三)化学反应速率的测定按图安装两套装置,通过分液漏斗分别加入40 mL 1 mol/L 和 40 mL 4 mol/L 的硫酸,比较二者收集10 mL H 2所用的时间。


第二章化学反应速率化学平衡知识点总结思维导图:意义:表示化学反应快慢的物理量;化学反应速率:单位时间内反应物浓度的减小或生成物浓度增大公式:V(A)=Δc(A)/Δt;单位:mol•L-1•s-1或mol•L-1•min -1。
⑴对于同一个反应来说,用不同的物质来表示该反应的速率时,其数化表示方法值往往不同,但数值之比等于方程式中各物质化学计量数之比.C+d D,则有:v(A): v学说明如:对于方程式a A+b(B):v(C):v(D) =反a:b:c:d,v(A)/a= v(B) /b=v(C)/c =v(D)/d 应⑵一般不用固体或纯液体物质表示物质的反应速率速率内因 :(主要因素)反应物的性质⑴在其他条件不变的情况下,增大反应物的浓度,化学反浓度应速加快,反之减慢⑵固体或纯液体时,浓度为常数,改变固体或纯液体的量,影响因素不改变浓度,不影响化学反应速温度:其他条件不变时,升高温度化学反应速率加快,反之减慢外因⑴对有气体参加化学反应,若其他条件不变,增大压强,压强反应速率加快,反之减慢⑵改变压强必须改变浓度,否则速率不变,如通稀有气体催化剂:使用催化剂一般能加快化学反应速率其他:光、电磁波、固体颗粒大小、形成原电池等概念:在一定条件下的可逆反应里,当正、逆两个方向的反应速率相等,反应体系中所有参加反应的物质的浓度保持恒定的状态特征:逆、等、动、定、变⑴增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动浓度增大生成物的浓度或减小反应物的浓度,平衡向逆反应方向移动化⑵增大或减小固体(纯液体)的量不影响平衡学影响因素⑴增大压强向体积减小的方向移动;减小压强向体积增大方向移动平压强⑵对于没有气体参加和生成的可逆反应,改变压强,平衡不移动衡⑶对于气体体积没有改变的可逆反应,改变压强,平衡不移动温度:升高温度,平衡向吸热方向移动;降低温度;平衡向放热方向移动化学平衡常数意义:平衡常数数值的大小可以反映可逆反应进行的程度大小,K值越大,反应进行越完全,反应物转化率越高,反之则越低特征:化学平衡常数只与温度有关知识点讲解:一、化学反应速率1。

第二章化学反应速率和化学平衡一、化学反应速率(1)化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
(2)化学反应速率的表示方法对于反应体系体积不变的化学反应,通常用单位时间内反应物或生成物的物质的量浓度的变化值表示。
某一物质A的化学反应速率的表达式为:式中——某物质A的浓度变化,常用单位为mol·L-1。
——某段时间间隔,常用单位为s,min,h。
υ——物质A的反应速率,常用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反应速率的计算规律①同一反应中不同物质的化学反应速率间的关系同一时间内,用不同的物质表示的同一反应的反应速率数值之比等于化学方程式中各物质的化学计量数之比。
②化学反应速率的计算规律同一化学反应,用不同物质的浓度变化表示的化学反应速率之比等于反应方程式中相应的物质的化学计量数之比,这是有关化学反应速率的计算或换算的依据。
(4)化学反应速率的特点①反应速率不取负值,用任何一种物质的变化来表示反应速率都不取负值。
②同一化学反应选用不同物质表示反应速率时,可能有不同的速率数值,但速率之比等于化学方程式中各物质的化学计量数之比。
③化学反应速率是指时间内的“平均”反应速率。
小贴士:①化学反应速率通常指的是某物质在某一段时间内化学反应的平均速率,而不是在某一时刻的瞬时速率。
②由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
其化学反应速率与其表面积大小有关,而与其物质的量的多少无关。
通常是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加快反应速率。
③对于同一化学反应,在相同的反应时间内,用不同的物质来表示其反应速率,其数值可能不同,但这些不同的数值表示的都是同一个反应的速率。
因此,表示化学反应的速率时,必须指明是用反应体系中的哪种物质做标准。
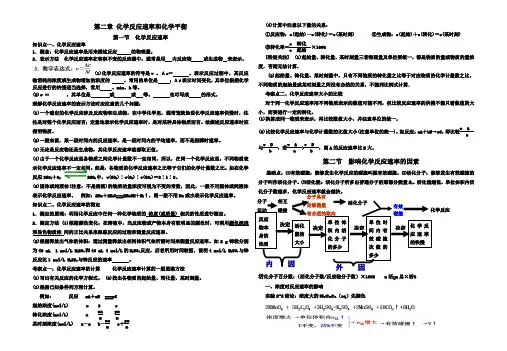
第二章 化学反应速率和化学平衡第一节 化学反应速率知识点一、化学反应速率1.概念:化学反应速率是用来描述反应 的物理量。
2.表示方法 化学反应速率在容积不变的反应器中,通常是用 内反应物 或生成物 来表示。
(1)化学反应速率的符号是v 。
Δc = 。
表示反应过程中,其反应物消耗的浓度或生成物增加的浓度的 ,常用的单位是 ;Δt 表示时间变化,其单位根据化学反应进行的快慢适当选择,常用 、min 、h 等。
(2)v = ,其单位是 或 或 等。
也可写成 的形式。
理解化学反应速率的表示方法时应注意的几个问题:(1)一个确定的化学反应涉及反应物和生成物,在中学化学里,通常笼统地说化学反应速率快慢时,往往是对整个化学反应而言;定量地表示化学反应速率时,是对某种具体物质而言。
故描述反应速率时应指明物质。
(2)一般来说,某一段时间内的反应速率,是一段时间内的平均速率,而不是指瞬时速率。
(3)无论是反应物还是生成物,其化学反应速率值都取正值。
(4)由于一个化学反应里各物质之间化学计量数不一定相同,所以,在同一个化学反应里,不同物质表示化学反应速率不一定相同。
但是,各物质的化学反应速率之比等于它们的化学计量数之比。
如在化学反应2SO 2+O 22SO 3中,v (SO 2)∶v (O 2)∶v (SO 3)=2∶1∶2。
(5)固体或纯液体(注意:不是溶液)的物质的量浓度可视为不变的常数,因此,一般不用固体或纯液体表示化学反应速率。
例如:2Na +2H 2O===2NaOH +H 2↑,则一般不用Na 或水表示化学反应速率。
知识点二、化学反应速率的测定1.测定的原理: 利用化学反应中任何一种化学物质的 浓度(或质量) 相关的性质进行测定。
2.测定方法 (1)根据颜色变化:在溶液中,当反应物或产物本身有较明显的颜色时,可利用颜色深浅和显色物质浓 间的正比关系来跟踪反应的过程和测量反应速率。
(2)根据释放出气体的体积:通过测量释放出相同体积气体所需时间来测量反应速率。

选修四第二章化学反应速率和化学平衡章节知识网络反应的可逆不可逆 化学平衡状态特点 影响因素及平衡移动原理一、化学反应速率1. 化学反应速率(V)⑴ 定义:用来衡量化学反应的快慢程度⑵ 表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表 示 ⑶ 计算公式:v=A c/ At (v:平均速率,△ c :浓度变化,△ t:时 间)单位:mol/ (l s )、mol/(l min)、mol/(l h) ⑷对化学反应速率的理解,应注意A:化学反应速率都是正值;B:化学反应速率通常是指在某一段时间内的平均反应速率,不同时 刻的化学反应速率是不相同的;C:表示化学反应速率时,应标明是哪种物质;对于固体或气体反应 中的液体物质,反应在其表面进行,压强的变化对浓度几乎无影响, 是不变的,因此一般不用固体、纯液体表示化学反应速率;D:对于同一化学反应,用各种物质表示的化学反应速率之比等于它 们在化学方程式中的化学计量数之比。
(5)影响因素:① 决定因素(内因):反应物本身的性质(主要因素)② 条件因素(外因):反应所处的外界条件(浓度、压强、温度、 催化剂及其他条件)定景表示 方法浓度、压强影响化学反应速率的因素催化剂化学反应速率本课程重心外界条件对化学反应速率影响的变化规律外因对化学反应速率影响的变化规律※注意:惰性气体对于速率的影响:(该处知识为易错点,请注意)①恒温恒容时:充入惰性气体—总压增大,但是各分压不变,各物质浓度不变—反应速率不变②恒温恒压时:充入惰性气体—体积增大—各反应物浓度减小—反应速率减慢2有效碰撞、活化能:能够发生化学反应的分子的碰撞,把能够发生有效碰撞的分子叫活化分子。
活化分子具有比普通分子更高的能量,多出的那部分能量叫活化能。
注:浓度、压强、温度、催化剂影响反应速率的实质是改变了单位体积内活化分子的数目。
单位体积内活化分子的数目增加,反应速率增大,反之减少。
二、化学平衡(_) 1.定义:化学平衡状态:一定条件下,当一个可逆反应进行到正反应速率和逆反应速率相等时,反应混合物中各组分的浓度保持不变,达到表面上静止的一种平衡”,这就是这个反应所能达到的限度即化学平衡状态。
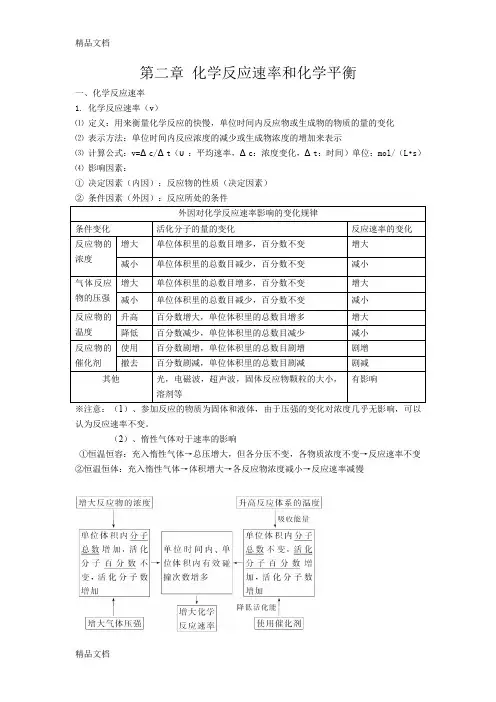
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L•s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1.定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据②各物质的质量或各物质质②在单位时间内消耗了n m olB同时消耗了p molC,则一定时,但(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。

高中化学选修4第二章《化学反应速率和化学平衡》知识点一、外界条件对化学反应速率的影响规律影响化学反应速率的因素包括内因和外因。
内因是指反应物本身的性质;外因包括浓度、温度、压强、催化剂、反应物颗粒大小等。
这些外界条件对化学反应速率影响的规律和原理如下:1.浓度(1)浓度增大,单位体积内活化分子数增多(活化分子百分数不变),有效碰撞的几率增加,化学反应速率增大。
(2)浓度改变,可使气体间或溶液中的化学反应速率发生改变。
固体或纯液体的浓度可视为常数,它们的物质的量的变化不会引起反应速率的变化,但固体颗粒的大小会导致接触面积的变化,故影响化学反应速率。
2.压强改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。
对于有气体参加的反应体系,有以下几种情况:3.温度(1)温度升高,活化分子百分数提高,分子间的碰撞频率提高,化学反应速率增大。
(2)温度升高,吸热反应和放热反应的速率都增大。
实验测得,温度每升高10 ℃,化学反应速率通常增大为原来的2~4倍。
4.催化剂(1) 催化剂对反应过程的影响通常可用下图表示(加入催化剂,B点降低) 。
催化剂能改变反应路径、降低活化能、增大活化分子百分数、加快反应速率,但不影响反应的ΔH。
(2)催化剂只有在适宜的温度下活性最大,反应速率才达到最大。
(3)对于可逆反应,催化剂能够同等程度地改变正、逆反应速率,对化学平衡状态无影响,生产过程中使用催化剂主要是为了提高生产效率。
特别提示在分析多个因素(如浓度、温度、反应物颗粒大小、催化剂、压强等)对反应速率的影响规律时,逐一改变一个因素而保证其他因素相同,通过实验分析得出该因素影响反应速率的结论,这种方法叫变量控制法。
二、化学平衡状态的特征及其判断方法1.化学平衡状态具有的“五大特征”(1)逆:指化学平衡状态只适用于可逆反应,同一可逆反应,在同一条件下,无论反应从正反应方向开始还是从逆反应方向开始,或同时从正、逆反应方向开始,以一定的配比投入反应物或生成物,则可以达到相同的平衡状态。
化学选修四第二章知识点归纳第二章是关于化学的反应速率和化学平衡的知识点。
主要内容包括反应速率,反应速率与浓度的关系,影响反应速率的因素,化学平衡,平衡常数和Le Chatelier原理。
一、反应速率1.反应速率定义:单位时间内反应物的消耗量或生成物的产生量。
2.反应速率的表达式:根据化学方程式中反应物和生成物的系数来表示。
3.反应速率与浓度的关系:反应速率与反应物的浓度成正比。
二、影响反应速率的因素1.温度:温度升高,反应速率增加。
2.浓度:浓度增加,反应速率增加。
3.催化剂:催化剂可以提高反应速率,但催化剂本身并不参与反应。
三、化学平衡1.化学平衡定义:当反应物与生成物的浓度或压强保持不变时达到的状态。
2.平衡时反应物与生成物的浓度:在平衡时,反应物与生成物的浓度或压强的比值始终保持不变。
3.平衡常数:根据平衡时反应物与生成物浓度的比值,定义反应的平衡常数。
4.平衡常数与反应速率:平衡常数越大,反应速率越快。
四、Le Chatelier原理1. Le Chatelier原理的表述:当系统处于平衡时,如果受到外界条件的改变,系统会倾向于通过一些方式恢复平衡。
2.外界条件的改变对平衡的影响:-温度变化:温度升高,平衡移向吸热反应方向;温度降低,平衡移向放热反应方向。
-反应物浓度变化:增加反应物浓度,平衡移向生成物方向;减少反应物浓度,平衡移向反应物方向。
-生成物浓度变化:增加生成物浓度,平衡移向反应物方向;减少生成物浓度,平衡移向生成物方向。
-压强变化:增加压强,平衡移向分子数量较少的一方;减少压强,平衡移向分子数量较多的一方。
综上所述,第二章主要介绍了化学反应速率和化学平衡的相关知识。
了解反应速率的定义和表达式,了解反应速率与浓度的关系和影响反应速率的因素,以及了解化学平衡的定义、平衡常数和Le Chatelier原理对平衡的影响。
这些知识对于理解和掌握化学反应和平衡的性质和规律具有重要意义。
第二章化学反映速度和化学平稳一、化学反映速度(1)化学反映速度的概念化学反映速度是用来衡量化学反映进行的快慢程度的物理量。
(2)化学反映速度的表示方式关于反映体系体积不变的化学反映,通经常使用单位时刻内反映物或生成物的物质的量浓度的转变值表示。
某一物质A的化学反映速度的表达式为:式中——某物质A的浓度转变,经常使用单位为mol·L-1。
——某段时刻距离,经常使用单位为s,min,h。
υ——物质A的反映速度,经常使用单位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化学反映速度的计算规律①同一反映中不同物质的化学反映速度间的关系同一时刻内,用不同的物质表示的同一反映的反映速度数值之比等于化学方程式中各物质的化学计量数之比。
②化学反映速度的计算规律同一化学反映,用不同物质的浓度转变表示的化学反映速度之比等于反映方程式中相应的物质的化学计量数之比,这是有关化学反映速度的计算或换算的依据。
(4)化学反映速度的特点①反映速度不取负值,用任何一种物质的转变来表示反映速度都不取负值。
②同一化学反映选用不同物质表示反映速度时,可能有不同的速度数值,但速度之比等于化学方程式中各物质的化学计量数之比。
③化学反映速度是指时刻内的“平均”反映速度。
小贴士:①化学反映速度通常指的是某物质在某一段时刻内化学反映的平均速度,而不是在某一时刻的瞬时速度。
②由于在反映中纯固体和纯液体的浓度是恒定不变的,因此关于有纯液体或纯固体参加的反映一样不用纯液体或纯固体来表示化学反映速度。
其化学反映速度与其表面积大小有关,而与其物质的量的多少无关。
一般是通过增大该物质的表面积(如粉碎成细小颗粒、充分搅拌、振荡等)来加速反映速度。
③关于同一化学反映,在相同的反映时刻内,用不同的物质来表示其反映速度,其数值可能不同,但这些不同的数值表示的都是同一个反映的速度。
因此,表示化学反映的速度时,必需指明是用反映体系中的哪一种物质做标准。
第二章《化学反应速率和化学平衡》知识点总结一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件2.※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响①恒温恒容时:充入惰性气体→各物质浓度不变→反应速率不变②恒温恒压时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢练习1:锌和稀硫酸反应,向反应混合溶液中加入下列物质,判断正确的是()A.加入醋酸钠固体,反应速率加快B.加入硫酸氢钠固体,反应速率加快C.加入水,产生氢气的体积减小D.加入少量硫酸铜,产生的氢气量不变练习2:在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+n D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
计算:(1)5 min末A的物质的量浓度为____________________________________________。
(2)前5 min内用B表示的化学反应速率v(B)为_________________________________。
(3)化学方程式中n值为_____________________________________________________。
(4)此反应在四种不同情况下的反应速率分别为①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1③v(C)=4.5 mol·L-1·min-1 ④v(D)=8 mol·L-1·min-1其中反应速率最快的是______________(填编号)。
第二章化学反应速率和化学平衡一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L•s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条件※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变。
(2)、惰性气体对于速率的影响①恒温恒容:充入惰性气体→总压增大,但各分压不变,各物质浓度不变→反应速率不变②恒温恒体:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1.定义:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应);等(同一物质的正逆反应速率相等);动(动态平衡)定(各物质的浓度与质量分数恒定);变(条件改变,平衡发生变化)3、判断平衡的依据判断可逆反应达到平衡状态的方法和依据②各物质的质量或各物质质②在单位时间内消耗了n m olB同时消耗了p molC,则一定时,但(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡不移动(3)在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,V正减小,V逆也减小,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着吸热反应方向移动,温度降低会使化学平衡向着放热反应方向移动。
3、压强对化学平衡移动的影响影响规律:其他条件不变时,增大压强,会使平衡向着体积缩小方向移动;减小压强,会使平衡向着体积增大方向移动。
注意:(1)改变压强不能使无气态物质存在的化学平衡发生移动(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似4.催化剂对化学平衡的影响:由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。
但是使用催化剂可以影响可逆反应达到平衡所需的_时间_。
5.勒夏特列原理(平衡移动原理):如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。
三、化学平衡常数(一)定义:在一定温度下,当一个反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数比值。
符号:K(二)使用化学平衡常数K应注意的问题:1、表达式中各物质的浓度是变化的浓度,不是起始浓度也不是物质的量。
2、K只与温度(T)关,与反应物或生成物的浓度无关。
3、反应物或生产物中有固体或纯液体存在时,由于其浓度是固定不变的,可以看做是“1”而不代入公式。
4、稀溶液中进行的反应,如有水参加,水的浓度不必写在平衡关系式中。
(三)化学平衡常数K的应用:1、化学平衡常数值的大小是可逆反应进行程度的标志。
K值越大,说明平衡时生成物的浓度越大,它的正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越高。
反之,则相反。
2、可以利用K值做标准,判断正在进行的可逆反应是否平衡及不平衡时向何方进行建立平衡。
(Qc:浓度积)Qc〈K:反应向正反应方向进行;Qc=K:反应处于平衡状态;Qc〉K:反应向逆反应方向进行3、利用K值可判断反应的热效应若温度升高,K值增大,则正反应为吸热反应若温度升高,K值减小,则正反应为放热反应*四、等效平衡1、概念:在一定条件下(定温、定容或定温、定压),只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的百分含量均相同,这样的化学平衡互称为等效平衡。
2、分类(1)定温,定容条件下的等效平衡第一类:对于反应前后气体分子数改变的可逆反应:必须要保证化学计量数之比与原来相同;同时必须保证平衡式左右两边同一边的物质的量与原来相同。
第二类:对于反应前后气体分子数不变的可逆反应:只要反应物的物质的量的比例与原来相同即可视为二者等效。
(2)定温,定压的等效平衡只要保证可逆反应化学计量数之比相同即可视为等效平衡。
五、化学反应进行的方向1、反应熵变与反应方向:(1)熵:物质的一个状态函数,用来描述体系的混乱度,符号为S. 单位:J•••mol-1•K-1(2)体系趋向于有序转变为无序,导致体系的熵增加,这叫做熵增加原理,也是反应方向判断的依据。
.(3)同一物质,在气态时熵值最大,液态时次之,固态时最小。
即S(g)〉S(l)〉S(s)2、反应方向判断依据在温度、压强一定的条件下,化学反应的判读依据为:ΔH-TΔS〈0 反应能自发进行ΔH-TΔS=0 反应达到平衡状态ΔH-TΔS〉0 反应不能自发进行注意:(1)ΔH为负,ΔS为正时,任何温度反应都能自发进行(2)ΔH为正,ΔS为负时,任何温度反应都不能自发进行知识赠送以下资料英语万能作文(模板型)Along with the advance of the society more and more problems are brought to our attention, one of which is that....随着社会的不断发展,出现了越来越多的问题,其中之一便是____________。
As to whether it is a blessing or a curse, however, people take different attitudes.然而,对于此类问题,人们持不同的看法。
(Hold different attitudes 持不同的看;Come up with different attitudes 有不同的看法) As society develops, people are attaching much importance to....随着社会的发展,人们开始关注............People are attaching more and more importance to the interview during job hunting求职的过程中,人们慢慢意识到面试的重要性。
As to whether it is worthwhile ....., there is a long-running controversial debate. It is quite natural that people from different backgrounds may have divergent attitudes towards it.关于是否值得___________的问题,一直以来争论不休。
当然,不同的人对此可能持不同的观点。
In the process of modern urban development, we often find ourselves in a dilemma.在都市的发展中,我们往往会陷入困境。
Recently the phenomenon has aroused wide concern, some people are in alarm that....最近,这种现象引起了人们的广泛关注,有人开始担心______________。
The human race has entered a completely new stage in its history, with the increasingly rapid economic globalization and urbanization, more problems are brought to our attention.人类进入了一个历史的崭新的阶段,经济全球化、都市化的速度不断加快,随之给我们带来了很多问题。
...... plays such an important role that it undeniably becomes the biggest concern of the present world, there comes a question, is it ablessing or a curse?"_______显得非常重要而成为当今世界所关注的最大的问题,这是无可厚非的。
不过,问题是:"我们该如何抉择?"Now we are entering a new era, full of opportunities and challenges, 现在我们正在进入一个充满机会和挑战的新时代。
People from different backgrounds would put different interpretations on the same case.不同行业的人对同一种问题的解释不尽相同。
The controversial issue is often brought into public focus. People from different backgrounds hold different attitudes towards the issue.这中极具争议性的话题往往很受社会的关注。
不同的人对此问题的看法也不尽相同。
When asked ..., some people think..... while some prefer...说到______,有人认为________,而另一些人则认为__________。
Just as the saying goes: "so many people, so many minds". It is quite understandable that views on this issue vary from person to person.俗话说,""。
不同的人对此有不同的看法是可以理解的。
To this issue, different people come up with various attitudes.对于这个问题,不同的人持不同的观点。
There is a good side and a bad side to everything, it goes without saying that...万事万物都有其两面性,所以,勿庸置疑,____________。