2020年高考专题复习:《盖斯定律》
- 格式:pptx
- 大小:329.13 KB
- 文档页数:16

《盖斯定律》知识清单一、盖斯定律的定义盖斯定律是指在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,而与变化途径无关。
换句话说,不管化学反应是一步完成还是分几步完成,其反应热是相同的。
为了更好地理解这一定义,我们可以想象一个从 A 地到 B 地的旅程。
无论您是选择直接的路线到达 B 地,还是经过了一些迂回的道路最终到达 B 地,两地之间的距离(就好比反应的热效应)是不会改变的。
二、盖斯定律的原理盖斯定律的原理基于能量守恒定律。
在化学反应中,能量的转化和守恒是始终不变的。
当反应物转化为生成物时,所释放或吸收的能量是一定的,不会因为反应的步骤不同而有所改变。
例如,碳燃烧生成二氧化碳,可以一步完成(直接燃烧生成二氧化碳),也可以分两步进行(先燃烧生成一氧化碳,一氧化碳再燃烧生成二氧化碳),但总的能量变化是相同的。
三、盖斯定律的应用1、计算难以直接测量的反应热有些化学反应的反应热很难直接通过实验测量得到,但我们可以通过盖斯定律,利用已知反应的热效应来计算。
比如,要计算反应 C(s) + 1/2O₂(g) = CO(g) 的反应热,我们可能无法直接测量,但如果我们知道反应 C(s) + O₂(g) = CO₂(g) 和反应CO(g) + 1/2O₂(g) = CO₂(g) 的反应热,就可以通过盖斯定律来计算出目标反应的反应热。
2、设计合理的反应途径在化工生产中,为了提高反应的效率、降低成本等,我们可以根据盖斯定律来设计合理的反应途径。
例如,在合成氨的工业生产中,通过对反应步骤和条件的优化,以达到提高产率、节约能源的目的。
3、比较不同反应的热效应通过盖斯定律,我们可以将不同的反应转化为具有相同终态和始态的反应,从而比较它们的热效应大小。
四、盖斯定律的计算方法1、虚拟路径法假设一个反应可以通过多种途径完成,我们可以虚拟出一条与已知反应相关的路径,然后根据盖斯定律进行计算。
例如,已知反应 A + B = C 的反应热为ΔH₁,反应 C = D 的反应热为ΔH₂,要计算反应 A + B = D 的反应热,可以将两个反应相加,得到 A + B = C +(C = D) = D,反应热为ΔH₁+ΔH₂。

2020届高三化学二轮复习盖斯定律专题复习(知识精讲与训练)知识梳理1.定律内容一定条件下,一个反应不管是一步完成,还是分几步完成,反应的总热效应相同,即反应热的大小与反应途径无关,只与反应的始态和终态有关。
2.常用关系式3.答题模板——叠加法步骤1“倒”为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。
这样,就不用再做减法运算了,实践证明,方程式相减时往往容易出错。
步骤2“乘”为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要相乘。
步骤3“加”上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。
强化训练1.[2019·全国卷Ⅱ,27(1)]环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
回答下列问题:已知:((g)===(g)+H2(g)ΔH1=100.3(kJ·mol-1①H 2(g)+I 2(g)===2HI(g) ΔH 2=-11.0(kJ·mol -1② 对于反应:((g)+I 2(g)===(g)+2HI(g)③ΔH 3=________kJ·mol -1。
答案 89.3解析 将题给三个热化学方程式依次编号为①、②、③,根据盖斯定律,由反应①+反应②得反应③,则ΔH 3=ΔH 1+ΔH 2=(100.3-11.0)kJ·mol -1=89.3(kJ·mol -1。
2.[2019·全国卷Ⅲ,28(2)]Deacon 直接氧化法可按下列催化过程进行:CuCl 2(s)===CuCl(s)+12Cl 2(g) ΔH 1=83(kJ·mol -1 CuCl(s)+12O 2(g)===CuO(s)+12Cl 2(g)((ΔH 2=-20(kJ·mol -1 CuO(s)+2HCl(g)===CuCl 2(s)+H 2O(g)((ΔH 3=-121(kJ·mol -1则4HCl(g)+O 2(g)===2Cl 2(g)+2H 2O(g)的ΔH =________kJ·mol -1。




2020届高考化学专题复习———第十一辑反应热及热化学方程式的正误判断及盖斯定律1.判断热化学方程式的正误时,要注意以下几点(1)看各物质的聚集状态是否正确:常用s、l、g、aq分别表示固体、液体、气体、溶液。
(2)看ΔH的符号是否正确:放热反应,ΔH为“-”;吸热反应,ΔH为“+”。
(3)看ΔH的单位是否正确:ΔH的单位为kJ·mol-1,能量的单位为kJ,二者不能混淆。
(4)看ΔH的数值与化学计量数是否对应:化学计量数加倍,则ΔH也要加倍。
(5)看反应是否可逆:可逆反应不能进行到底,不能根据反应的能量变化计算得到ΔH。
(6)看有无特殊条件的限制:表示燃烧热的热化学方程式中,可燃物的物质的量必须为1 mol,生成物必须为稳定的氧化物;表示中和热的热化学方程式中,生成的水必须为液态且为1 mol,当反应的溶液为强酸、强碱的稀溶液时,ΔH=-57.3 kJ·mol-1。
2.反应热计算的“三方法”(1)根据“两”公式计算反应热①ΔH=E(生成物的总能量)-E(反应物的总能量);②ΔH=E(反应物的键能之和)-E(生成物的键能之和)。
(2)根据热化学方程式计算反应热焓变与反应物的物质的量成正比。
(3)根据盖斯定律计算反应热若一个热化学方程式可由另外几个热化学方程式相加减而得到,则该反应的焓变可通过这几个化学反应的焓变加减而得到。
表示方法:,ΔH=ΔH1+ΔH2。
例1下列有关热化学方程式书写正确的是()N2(g)+3H2(g)2NH3(g)ΔH=-20a kJ·mol-1[解题思路]解答本题的关键是加强对各种概念的理解,如中和热和燃烧热,要弄清它们研究的对象和使用要求。
解析中和热是指稀溶液中强酸和强碱发生中和反应生成1 mol液态水时的反应热,A错误;燃烧热为25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,其中水应为液态,碳的稳定化合物为CO2,C、D错误。


高考化学经典试题总复习盖斯定律及其在热化学方程式中的应用一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/molH 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O(l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。

配套课时作业时间:45分钟满分:100分一、选择题(每题7分,共77分)1.已知反应:①H 2(g)+12O 2(g)===H 2O(g)ΔH 1②12N 2(g)+O 2(g)===NO 2(g)ΔH 2③12N 2(g)+32H 2(g)===NH 3(g)ΔH 3则反应2NH 3(g)+72O 2(g)===2NO 2(g)+3H 2O(g)的ΔH 为()A.2ΔH 1+2ΔH 2-2ΔH 3B.ΔH 1+ΔH 2-ΔH 3C.3ΔH 1+2ΔH 2-2ΔH 3D.3ΔH 1+2ΔH 2+2ΔH 3答案C解析根据盖斯定律,由①×3+②×2-③×2可得2NH 3(g)+72O 2(g)===2NO 2(g)+3H 2O(g)则有ΔH=3ΔH 1+2ΔH 2-2ΔH 3,C 项正确。
2.已知:NH 3·H 2O(aq)与H 2SO 4(aq)反应生成1mol 正盐的ΔH=-24.2kJ·mol -1,强酸、强碱稀溶液反应的中和热为ΔH=-57.3kJ·mol -1,则NH 3·H 2O 在水溶液中电离的ΔH 等于()A.-69.4kJ·mol -1B.-45.2kJ·mol -1C.+69.4kJ·mol -1D.+45.2kJ·mol -1答案D解析由题给条件可先写出NH 3·H 2O(aq)+H +(aq)===NH +4(aq)+H 2O(l)ΔH=-12.1kJ·mol -1①,H+(aq)+OH -(aq)===H 2O(l)ΔH =-57.3kJ·mol-1②,根据盖斯定律,由①-②即可得到NH 3·H 2O(aq)NH +4(aq)+OH -(aq)ΔH=+45.2kJ·mol -1,D 正确。
3.(2018·滕州二中月考)由金红石TiO 2制取单质Ti,涉及的步骤为TiO 2―→TiCl 4――→Mg800℃,Ar Ti。
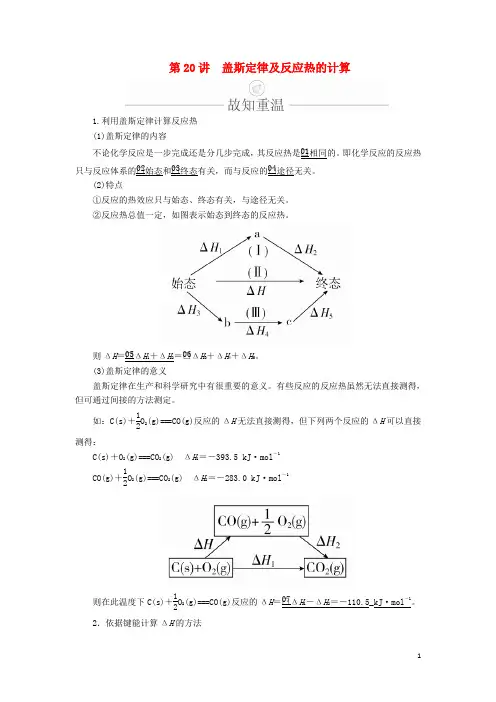
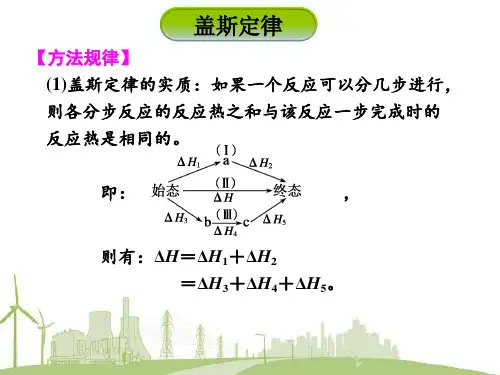
第20讲 盖斯定律及反应热的计算1.利用盖斯定律计算反应热 (1)盖斯定律的内容不论化学反应是一步完成还是分几步完成,其反应热是□01相同的。
即化学反应的反应热只与反应体系的□02始态和□03终态有关,而与反应的□04途径无关。
(2)特点①反应的热效应只与始态、终态有关,与途径无关。
②反应热总值一定,如图表示始态到终态的反应热。
则ΔH =□05ΔH 1+ΔH 2=□06ΔH 3+ΔH 4+ΔH 5。
(3)盖斯定律的意义盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。
如:C(s)+12O 2(g)===CO(g)反应的ΔH 无法直接测得,但下列两个反应的ΔH 可以直接测得:C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ·mol -1CO(g)+12O 2(g)===CO 2(g) ΔH 2=-283.0 kJ·mol -1则在此温度下C(s)+12O 2(g)===CO(g)反应的ΔH =□07ΔH 1-ΔH 2=-110.5_kJ·mol -1。
2.依据键能计算ΔH 的方法(1)计算公式:ΔH =□08反应物的键能总和-□09生成物的键能总和。
(2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的数目。
如:1 mol NH 3中含有□103 mol N —H 键。
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)C(石墨,s)===C(金刚石,s) ΔH >0,说明石墨比金刚石稳定。
(√) 错因:_______________________________________________ (2)已知:500 ℃、30 MPa 下,N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.4 kJ·mol -1;将1.5 mol H 2和过量的N 2在此条件下充分反应,放出热量46.2 kJ 。
盖斯定律的应用——反应热的比较、计算及热化学方程式的书写反应热是中学化学的重要内容,在近几年的高考中都有所涉及,特别是运用盖斯定律进行有关反应焓变的比较、计算以及热化学方程式的书写更是考查的重点和热点,该题型能够很好地考查学生综合分析问题的能力,命题角度灵活,但形式比较稳定,大都是与其他化学反应原理相互融合,往往都是以一定的工业生产为背景,在几个已知热化学方程式的基础上运用盖斯定律进行反应焓变的比较、计算以及热化学方程式的书写,在复习备考中应充分理解盖斯定律的本质,掌握解题的技能进行突破。
1.盖斯定律(1)内容对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都一样。
即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)意义间接计算某些反应的反应热。
2.ΔH的比较要点(1)比较ΔH的大小时需考虑正负号,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
(2)反应物和生成物的状态物质的气、液、固三态的变化与反应热的关系(3)参加反应物质的量:当反应物和生成物的状态相同时,参加反应物质的量越多,放热反应的ΔH越小,吸热反应的ΔH越大。
(4)反应的程度:参加反应物质的量和状态相同时,反应的程度越大,热量变化越大。
3.利用盖斯定律进行反应热计算的方法(1)运用盖斯定律的技巧——“三调一加”一调:根据目标热化学方程式,调整已知热化学方程式中反应物和生成物的左右位置,改写已知的热化学方程式。
二调:根据改写的热化学方程式调整相应ΔH的符号。
三调:调整中间物质的化学计量数。
一加:将调整好的热化学方程式及其ΔH相加。
(2)运用盖斯定律的三个注意事项①热化学方程式乘以某一个数时,反应热的数值必须也乘上该数。
②热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
③将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但数值不变。
(3)运用盖斯定律的三个模板AΔH1ΔH2B1.(2018·全国卷Ⅰ,28(2)①)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
第2节 盖斯定律及其应用[考试说明] 理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
[命题规律] 盖斯定律的应用是高考的常考考点,主要是盖斯定律应用于未知反应反应热的计算和未知反应的热化学方程式的书写,以填空题型出现。
知识梳理1.盖斯定律(1)内容:对于一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的。
即:化学反应的反应热只与反应体系的□01始态和终态有关,而与□02反应的途径无关。
如:(2)意义:间接计算某些反应的反应热。
已知在25 ℃、101 kPa 时:①C(s)+O 2(g)===CO 2(g) ΔH =-393.5 kJ·mol -1, ②2C(s)+O 2(g)===2CO(g) ΔH =-221 kJ·mol -1, 则CO(g)+12O 2(g)===CO 2(g)的ΔH 为□06-283_kJ·mol -1。
2.利用盖斯定律书写热化学方程式的步骤应用盖斯定律常用以下两种方法 (1)热化学方程式相加或相减,如由 ①C(s)+O 2(g)===CO 2(g) ΔH 1; ②C(s)+12O 2(g)===CO(g) ΔH 2;由(①-②)×2可得2CO(g)+O 2(g)===2CO 2(g) ΔH =2(ΔH 1-ΔH 2)(2)合理设计反应途径,如甲,顺时针方向和逆时针方向变化反应热代数和相等则ΔH =ΔH 1+ΔH 2。
题组训练题组一 利用盖斯定律书写热化学方程式1.(1)在微生物作用的条件下,NH +4经过两步反应被氧化成NO -3。
两步反应的能量变化如图1所示:1 mol NH+4(aq)全部氧化成NO-3(aq)的热化学方程式是____________________________________________。
(2)纳米级的Cu2O可作为太阳光分解水的催化剂。
火法还原CuO可制得Cu2O。
已知:1 g C(s)燃烧全部生成CO时放出热量9.2 kJ;Cu2O(s)与O2(g)反应的能量变化如图2所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式________________________________________________。
【高中化学】盖斯定律化学反应及其能量变化复习一. 教学内容:盖斯定律反应及其能量变化二. 教学目标1. 了解反应的途径、反应体系。
2. 从能量守恒定律角度理解盖斯定律。
3. 复习回顾反应热及其相关。
三. 教学重点、难点难点:反应热的有关计算四. 知识分析(一)盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
应用盖斯定律可以间接地计算出反应热。
说明:1. 化学反应不管是一步完成或分几步完成,其反应热是相同的。
如果一个反应可以分几步完成,则各步反应的反应热之和与该反应一步完成时的反应热是相同的。
(二)化学反应及其能量变化复习:说明:1. 反应热:在化学反应过程中所释放或吸收的能量都可以用热量(或换成相应的热量)来表示,叫反应热,又称“焓变”,符号用△H表示,单位一般采用kJ/mol当△H为“+”或△H>0时,为吸热反应。
2. 中和热和燃烧热:燃烧热:在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。
一般情况下,完全燃烧时,一般情况C生成CO2;H生成水;S生成SO2。
中和热、燃烧热的单位一般用kJ/mol表示。
3. 热化学方程式:能表示参加反应的物质的量和反应热的关系的化学方程式。
书写热化学方程式时要注意以下几点:状态、物质的量、反应热的单位及符号、条件等。
4. 反应热和中和热的测定:中和热的测定时同样要注意保温、隔热,要用强酸与强碱的稀溶液在室温下进行,测量温度时一定要读出最高点时的温度,计算时要将测量的热量换算成生成1mol水时所放出的能量。
5. 反应热的计算:燃烧热的计算:一定量的可燃物燃烧放出的总热量=燃烧热×可燃物的物质的量。
【典型例题例1. 按照盖斯定律,结合下列反应方程式,回答问题。
已知:(2)NH3(g)+H2O(l)=NH3?H2O(aq)△H=-35.1kJ?mol-1(4)NH3(aq)+ HCl(aq)= NH4Cl(aq)△H=-52.3kJ?mol-1则第(5)个方程式中的反应热是解析:根据盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。