硫脲的理化特性
- 格式:docx
- 大小:28.15 KB
- 文档页数:2

硫脲的分子量硫脲(Thiourea)是一种有机化合物,其分子式为CH4N2S,分子量为 76.12 g/mol。
它是一种白色结晶固体,可溶于水和大多数有机溶剂中。
硫脲具有许多重要的应用,包括作为化学试剂、催化剂和农药等。
本文将从不同的角度介绍硫脲的分子量及其相关特性。
1. 硫脲的化学结构硫脲的化学结构中包含了一个硫原子和两个氮原子。
硫原子与两个氮原子相连,形成了一个类似于尿素的结构。
硫脲的分子式为CH4N2S,其中C表示碳原子,H表示氢原子,N表示氮原子,S表示硫原子。
2. 硫脲的物理性质硫脲是一种白色结晶固体,具有特殊的臭味。
其熔点为170-180℃,沸点为172-175℃。
硫脲可溶于水和大多数有机溶剂,如醇类、醚类和酮类等。
在水中的溶解度随温度的升高而增加。
3. 硫脲的化学性质硫脲是一种相对稳定的化合物,但在一些条件下也会发生化学反应。
例如,硫脲可以与酸反应生成硫脲酸,与碱反应生成硫脲酸盐。
硫脲还可以与许多化合物发生取代反应,形成不同的衍生物。
4. 硫脲的应用领域硫脲具有许多重要的应用。
首先,硫脲广泛用作化学试剂,例如用于测定金属离子、有机物的分析等。
其次,硫脲还可以作为一种催化剂,参与多种有机反应,如氧化、还原和羟基化反应等。
此外,硫脲还被用作农药的原料,具有抗菌、杀虫等作用。
5. 硫脲的生产和用途硫脲的生产主要通过硫氰酸铵和氨水的反应得到。
硫脲的用途非常广泛,不仅在化学实验室中被广泛使用,还广泛应用于农业、医药、染料、橡胶等领域。
例如,在农业中,硫脲可以用作杀虫剂,对一些害虫具有较好的杀灭效果。
在医药领域,硫脲可以用于合成一些药物,如降压药和抗肿瘤药物等。
总结:硫脲是一种重要的有机化合物,具有丰富的应用价值。
它的分子量为76.12 g/mol,化学结构中含有硫原子和两个氮原子。
硫脲是一种白色结晶固体,可溶于水和大多数有机溶剂。
它具有特殊的物理性质和化学性质,可以用作化学试剂、催化剂和农药等。

硫脲1. 化学品及企业标识化学品中文名称:硫脲化学品英文名称:thiourea中文名称2:硫代尿素英文名称2:thiocarbamide主要用途:用于有机合成,也用作药品、橡胶添加物、镀金材料等。
2. 危险性概述2.1 危险性类别:有毒品。
2.2侵入途径:吸入、食入、经皮吸收。
2.3 健康危害:一次作用时毒性小,反复作用时可抑制甲状腺和造血器官的机能。
可引起变态反应。
可经皮肤吸收。
本品粉尘对眼和上呼吸道有刺激性,吸入后引起咳嗽、胸部不适。
口服刺激胃肠道。
慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、血压下降、脉搏变慢、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎、皲裂等。
2.4环境危害:对水生生物有毒作用。
2.5燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物。
3. 成分/组成信息纯品■混合物□主要成分CAS RN 含量(%)硫脲62-56-6 99.04. 急救措施4.1 皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
如有不适感,就医。
4.2眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
如有不适感,就医。
4.3吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
4.4食入:饮足量温水,催吐。
就医。
5. 消防措施5.1 危险特性:遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
5.2有害燃烧产物:氮氧化物、氧化硫。
5.3灭火方法:用水、雾状水、泡沫、二氧化碳、砂土灭火。
5.4灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
6. 泄漏应急措施应急处理:隔离泄漏污染区,限制出入。
消除所有点火源。
建议应急处理人员戴防尘口罩,穿防毒服。
穿上适当的防护服前严禁接触破裂的容器和泄漏物。

危化品M S D S-硫脲硫脲1. 化学品及企业标识化学品中文名称:硫脲化学品英文名称:thiourea中文名称2:硫代尿素英文名称2:thiocarbamide主要用途:用于有机合成,也用作药品、橡胶添加物、镀金材料等。
2. 危险性概述2.1 危险性类别:有毒品。
2.2侵入途径:吸入、食入、经皮吸收。
2.3 健康危害:一次作用时毒性小,反复作用时可抑制甲状腺和造血器官的机能。
可引起变态反应。
可经皮肤吸收。
本品粉尘对眼和上呼吸道有刺激性,吸入后引起咳嗽、胸部不适。
口服刺激胃肠道。
慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、血压下降、脉搏变慢、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎、皲裂等。
2.4环境危害:对水生生物有毒作用。
2.5燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物。
3. 成分/组成信息纯品■混合物□主要成分 CAS RN 含量(%)硫脲 62-56-6 99.04. 急救措施4.1 皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
如有不适感,就医。
4.2眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
如有不适感,就医。
4.3吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
4.4食入:饮足量温水,催吐。
就医。
5. 消防措施5.1 危险特性:遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
5.2有害燃烧产物:氮氧化物、氧化硫。
5.3灭火方法:用水、雾状水、泡沫、二氧化碳、砂土灭火。
5.4灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
6. 泄漏应急措施应急处理:隔离泄漏污染区,限制出入。
消除所有点火源。
建议应急处理人员戴防尘口罩,穿防毒服。

硫脲在酪氨酸酶催化中的抑制动力学是一项重要的研究课题,它涉及到酶催化机制、化学反应动力学等多个领域的知识。
本文将系统地介绍硫脲对酪氨酸酶催化的抑制作用,并深入探讨其动力学特性,以期为相关研究提供参考和借鉴。
一、硫脲的化学结构和性质硫脲是一种有机化合物,化学结构为(NH2)2CS,其分子中含有硫、氮和碳元素。
硫脲具有白色结晶粉末状,易溶于水,能够形成银盐沉淀,具有较强的还原性和亲电性。
在生物体内,硫脲被广泛应用于医药、农业等领域,常用作抗甲状腺药物、医学显影剂、化肥等。
二、酪氨酸酶的催化机制酪氨酸酶是一种重要的酶类蛋白,广泛存在于生物体内,能够催化酪氨酸的化学反应。
其催化机制主要包括底物结合、活化能降低、反应速率增加等步骤。
在催化过程中,酶与底物结合形成酶-底物复合物,通过降低反应活化能,促进反应的进行,并在反应结束后释放产物。
三、硫脲对酪氨酸酶的抑制作用1. 竞争性抑制硫脲能够与酪氨酸酶的活性中心结合,从而与底物竞争结合,影响酶的正常催化活性。
竞争性抑制的特点是与底物结合位点相似,而不改变酶的构象。
2. 非竞争性抑制硫脲以一种不同于底物的方式结合于酶的其他位点,造成酶的构象或活性中心的改变,从而影响催化活性。
非竞争性抑制不受底物浓度的影响,通常与酶的构象变化有关。
3. 抑制常数(Ki)的确定抑制常数(Ki)是衡量抑制物对酶抑制程度的一个重要参数,一般通过测定在不同浓度的抑制物条件下酶活性的变化,利用双倒数法或直线化法求得。
四、硫脲对酪氨酸酶催化动力学的影响1. 变温下的酶抑制动力学通过对变温条件下酶抑制动力学特性的研究,可以揭示硫脲抑制作用的温度依赖性,进一步探讨抑制机制。
2. pH值对酶抑制动力学的影响pH值是影响酶催化活性的重要因素,硫脲的抑制作用也受pH值的影响。
通过研究不同pH值条件下酶的抑制动力学,可以揭示硫脲抑制作用的pH依赖性特点。
3. 亲合力测定及动力学参数计算通过亲合力测定及动力学参数的计算,可以具体了解硫脲与酶的结合特性,进一步分析抑制机制及动力学特性。

硫脲1. 化学品及企业标识化学品中文名称:硫脲化学品英文名称:thiourea中文名称2:硫代尿素英文名称2:thiocarbamide主要用途:用于有机合成,也用作药品、橡胶添加物、镀金材料等。
2. 危险性概述2.1 危险性类别:有毒品。
2.2侵入途径:吸入、食入、经皮吸收。
2.3 健康危害:一次作用时毒性小,反复作用时可抑制甲状腺和造血器官的机能。
可引起变态反应。
可经皮肤吸收。
本品粉尘对眼和上呼吸道有刺激性,吸入后引起咳嗽、胸部不适。
口服刺激胃肠道。
慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、血压下降、脉搏变慢、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎、皲裂等。
2.4环境危害:对水生生物有毒作用。
2.5燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物。
3. 成分/组成信息纯品■混合物□主要成分CAS RN 含量(%)硫脲62-56-6 99.04. 急救措施4.1 皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
如有不适感,就医。
4.2眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
如有不适感,就医。
4.3吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
4.4食入:饮足量温水,催吐。
就医。
5. 消防措施5.1 危险特性:遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
5.2有害燃烧产物:氮氧化物、氧化硫。
5.3灭火方法:用水、雾状水、泡沫、二氧化碳、砂土灭火。
5.4灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
6. 泄漏应急措施应急处理:隔离泄漏污染区,限制出入。
消除所有点火源。
建议应急处理人员戴防尘口罩,穿防毒服。
穿上适当的防护服前严禁接触破裂的容器和泄漏物。
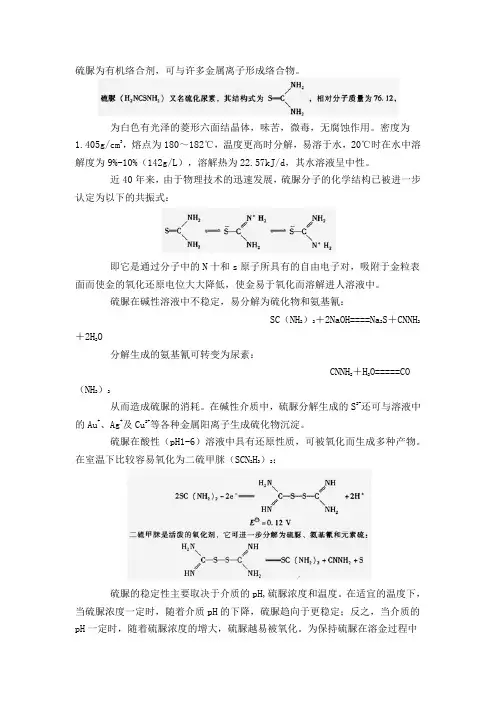
硫脲为有机络合剂,可与许多金属离子形成络合物。
为白色有光泽的菱形六面结晶体,味苦,微毒,无腐蚀作用。
密度为1.405g/cm3,熔点为180~182℃,温度更高时分解,易溶于水,20℃时在水中溶解度为9%-10%(142g/L),溶解热为22.57kJ/d,其水溶液呈中性。
近40年来,由于物理技术的迅速发展,硫脲分子的化学结构已被进一步认定为以下的共振式:即它是通过分子中的N十和s原子所具有的自由电子对,吸附于金粒表面而使金的氧化还原电位大大降低,使金易于氧化而溶解进人溶液中。
硫脲在碱性溶液中不稳定,易分解为硫化物和氨基氰:SC(NH2)2+2NaOH====Na2S+CNNH2+2H2O分解生成的氨基氰可转变为尿素:CNNH2+H2O=====CO(NH2)2从而造成硫脲的消耗。
在碱性介质中,硫脲分解生成的S2-还可与溶液中的Au+、Ag+及Cu2+等各种金属阳离子生成硫化物沉淀。
硫脲在酸性(pH1-6)溶液中具有还原性质,可被氧化而生成多种产物。
在室温下比较容易氧化为二硫甲脒(SCN2H3)2:硫脲的稳定性主要取决于介质的pH,硫脲浓度和温度。
在适宜的温度下,当硫脲浓度一定时,随着介质pH的下降,硫脲趋向于更稳定;反之,当介质的pH一定时,随着硫脲浓度的增大,硫脲越易被氧化。
为保持硫脲在溶金过程中的稳定性,提金作业宜采用低pH的硫脲溶液。
也只有降低溶液的pH,才能适当地提高溶液中的硫脲浓度。
298K硫脲的主要热力学数据如表1。
温度的提高虽能加快硫脲溶金的初始速度,但它会严重影响硫脲的稳定性,使得溶金才度随时间的延长而不断下降,甚至无效。
在多数文献中,选定的硫脲溶金介质温度不高了25℃,虽然它不一定是最佳的选择,但试验证明,随着介质(不论是酸性、中性或碱性)温度的升高硫脲的氧化速度会加快。
当硫脲在酸性或碱性溶液中,加热至60℃时,均会发生水解而生成氨、二氧化碳和液态H2S:SC(NH2)2+2H2O====CO2+2NH3+H2SH2S还可进一步分解成S。

硫脲的分子式
硫脲的化学式为CH4N2S,是一种无色结晶体,易溶于水和酒精。
它是一种重要的有机合成中间体,广泛应用于医药、染料、农药等领域。
1.在医药领域,硫脲被广泛用于制造多种药品,例如抗肿瘤药、抗生素和降血糖药。
此外,硫脲还可以用作胃泌素释放肤拮抗剂,可用于治疗肥胖症。
2.在化工领域,硫脲是一种重要的化工原料,用于制造多种化学产品,例如橡胶加工助剂、尿素形成催化剂和颜料材料。
3. 硫脲还可以用于其他领域,例如水处理、纸浆和纤维素工业、染料和荧光剂制造等在作用机制方面,硫脲可以抑制肝细胞内的氧化应激反应,从而减轻肝脏损伤,还可以用于调节血糖、血压等生理指标,改善患者的症状。
在作用机制方面,硫脉可以抑制肝细胞内的氧化应激反应,从而减轻肝脏损伤,还可以用于调节血糖、血压等生理指标,改善患者的症状。
随着科学技术的不断发展,硫服的应用前景将会更加广阔。

硫脲1。
化学品及企业标识化学品中文名称:硫脲化学品英文名称:thiourea中文名称2:硫代尿素英文名称2:thiocarbamide主要用途:用于有机合成,也用作药品、橡胶添加物、镀金材料等。
2。
危险性概述2。
1 危险性类别:有毒品。
2.2侵入途径:吸入、食入、经皮吸收.2。
3 健康危害:一次作用时毒性小,反复作用时可抑制甲状腺和造血器官的机能。
可引起变态反应.可经皮肤吸收。
本品粉尘对眼和上呼吸道有刺激性,吸入后引起咳嗽、胸部不适.口服刺激胃肠道.慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、血压下降、脉搏变慢、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎、皲裂等。
2。
4环境危害:对水生生物有毒作用。
2.5燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物.3。
成分/组成信息纯品■混合物□主要成分CAS RN 含量(%)硫脲62-56-6 99.04. 急救措施4。
1 皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
如有不适感,就医。
4.2眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
如有不适感,就医。
4.3吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术.就医.4.4食入:饮足量温水,催吐。
就医。
5. 消防措施5。
1 危险特性:遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
5.2有害燃烧产物:氮氧化物、氧化硫。
5.3灭火方法:用水、雾状水、泡沫、二氧化碳、砂土灭火。
5。
4灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火.尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束.6。
泄漏应急措施应急处理:隔离泄漏污染区,限制出入。
消除所有点火源。
建议应急处理人员戴防尘口罩,穿防毒服。
穿上适当的防护服前严禁接触破裂的容器和泄漏物.尽可能切断泄漏源。
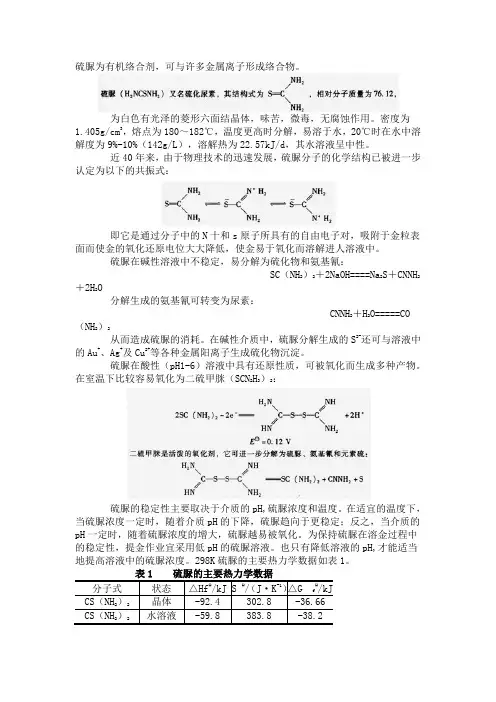
硫脲为有机络合剂,可与许多金属离子形成络合物。
为白色有光泽的菱形六面结晶体,味苦,微毒,无腐蚀作用。
密度为1.405g/cm3,熔点为180~182℃,温度更高时分解,易溶于水,20℃时在水中溶解度为9%-10%(142g/L),溶解热为22.57kJ/d,其水溶液呈中性。
近40年来,由于物理技术的迅速发展,硫脲分子的化学结构已被进一步认定为以下的共振式:即它是通过分子中的N十和s原子所具有的自由电子对,吸附于金粒表面而使金的氧化还原电位大大降低,使金易于氧化而溶解进人溶液中。
硫脲在碱性溶液中不稳定,易分解为硫化物和氨基氰:SC(NH2)2+2NaOH====Na2S+CNNH2+2H2O分解生成的氨基氰可转变为尿素:CNNH2+H2O=====CO(NH2)2从而造成硫脲的消耗。
在碱性介质中,硫脲分解生成的S2-还可与溶液中的Au+、Ag+及Cu2+等各种金属阳离子生成硫化物沉淀。
硫脲在酸性(pH1-6)溶液中具有还原性质,可被氧化而生成多种产物。
在室温下比较容易氧化为二硫甲脒(SCN2H3)2:硫脲的稳定性主要取决于介质的pH,硫脲浓度和温度。
在适宜的温度下,当硫脲浓度一定时,随着介质pH的下降,硫脲趋向于更稳定;反之,当介质的pH一定时,随着硫脲浓度的增大,硫脲越易被氧化。
为保持硫脲在溶金过程中的稳定性,提金作业宜采用低pH的硫脲溶液。
也只有降低溶液的pH,才能适当地提高溶液中的硫脲浓度。
298K硫脲的主要热力学数据如表1。
温度的提高虽能加快硫脲溶金的初始速度,但它会严重影响硫脲的稳定性,使得溶金才度随时间的延长而不断下降,甚至无效。
在多数文献中,选定的硫脲溶金介质温度不高了25℃,虽然它不一定是最佳的选择,但试验证明,随着介质(不论是酸性、中性或碱性)温度的升高硫脲的氧化速度会加快。
当硫脲在酸性或碱性溶液中,加热至60℃时,均会发生水解而生成氨、二氧化碳和液态H2S:SC(NH2)2+2H2O====CO2+2NH3+H2SH2S还可进一步分解成S。

硫脲分子式硫脲分子式CAS号87-43-1。
纯度99%。
无色或微带淡黄色,有刺激性气味的液体。
易溶于水,微溶于乙醇。
溶于盐酸、氨水。
可与硝酸银反应生成一种有机弱酸的银白色沉淀。
硫脲用途十分广泛,它是合成树脂、农药、染料、橡胶等的原料,也可用作防毒面具中吸收剂,还可以用来制备其他一些衍生物如一些缩合反应的催化剂、偶氮染料、医药等的中间体、也用于制造烟火、火柴、杀虫剂和触媒等。
硫脲分类硫脲根据其结构不同可分为:取代硫脲包括双硫脲、三硫脲、二甲基硫脲等,此类产品属国家管制产品;水杨酰胺类衍生物是合成抗疟药阿的平、扑疟母等的重要中间体。
【产品性状】硫脲白色针状结晶或粉末,具有特殊气味,易潮解。
【中文名称】硫脲【中文别名】脲;三氮苯磺酸钠;甲酰脲【英文名称】 Ketone【英文别名】 Triethylenesulfonate;Ketesalt;Toline salt【 CAS号】 87-43-1【分子式】 C9H8N3O3S【分子量】 189.19【 EINECS号】 209-921-4【化学性质】硫脲为白色针状结晶或粉末,有特殊气味,易潮解。
熔点50~53 ℃,沸点235 ℃,折光率1.497,比重1.67,水溶性90%。
硫脲在一般条件下稳定,低温时逐渐分解,可加热至150~170 ℃脱水成脲醛树脂,在强碱作用下进一步水解得到酚醛树脂和二氧化碳。
工业上将硫脲和其他含活泼氢的有机化合物混合加热,得到固体树脂或固体硫脲。
硫脲主要用于硝基纤维素、醋酸纤维素、聚酰亚胺、聚砜、聚丙烯腈、不饱和聚酯树脂等的合成原料,是醋酸纤维素、脲醛树脂的改性剂,是各种农药、杀虫剂、染料、涂料的原料,还用于防毒面具的生产中。
用途编辑1、合成树脂方面:用作环氧树脂、氯化橡胶、不饱和聚酯树脂等的合成原料。
2、农药方面:用于农药有机硫杀虫剂的合成。
3、橡胶方面:用于氯丁橡胶的生产。
4、印染助剂方面:可用作印染助剂、不饱和聚酯树脂、环氧树脂、增塑剂、表面活性剂、颜料及油漆、涂料的中间体。

硫脲,化学名称为硫代尿素,英文名为Thiourea,化学式为CH4N2S,是一种白色结晶或粉末状的有机化合物,具有微弱的特殊气味。
它在常温下相对稳定,可溶于水、醇和醚等多种溶剂中。
硫脲(Thiourea)的熔点和沸点分别是:
熔点:170至172°C
沸点:335至340°C
请注意,这些数值是在标准大气压下测定的。
在不同的压力条件下,熔点和沸点可能会有所变化。
下面是关于硫脲的主要性质和用途包括:
1.化学性质:硫脲可以与重金属离子形成稳定的络合物,因此
在化学分析中有一定的应用;它还具有还原性,能参与氧化
还原反应。
2.工业用途:硫脲广泛应用于化工、制药、染料等行业,如用
于制造农药(如杀虫剂、除草剂)、橡胶助剂、照相材料、
皮革鞣制剂等;另外,硫脲还是某些药物和精细化学品的重
要中间体。
3.实验室用途:在实验室中,硫脲可用于合成其他含硫化合
物,例如磺酰胺类药物和其他有机硫化物。
4.环保领域:硫脲可用作重金属离子废水处理中的螯合剂,帮
助去除废水中的铜、镍、铅等重金属离子。
5.农业领域:作为肥料添加剂,硫脲可以提高作物对氮肥的吸
收利用率,并有助于改善土壤结构。
硫脲1. 化学品及企业标识化学品中文名称:硫脲化学品英文名称:thiourea中文名称2:硫代尿素英文名称2:thiocarbamide主要用途:用于有机合成,也用作药品、橡胶添加物、镀金材料等。
2. 危险性概述危险性类别:有毒品。
侵入途径:吸入、食入、经皮吸收。
健康危害:一次作用时毒性小,反复作用时可抑制甲状腺和造血器官的机能。
可引起变态反应。
可经皮肤吸收。
本品粉尘对眼和上呼吸道有刺激性,吸入后引起咳嗽、胸部不适。
口服刺激胃肠道。
慢性影响:长期接触出现头痛、嗜睡、无力、面色苍白、面部虚肿、基础代谢降低、血压下降、脉搏变慢、白细胞减少等。
对皮肤有损害,出现皮肤瘙痒、手掌出汗、皮炎、皲裂等。
环境危害:对水生生物有毒作用。
燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物。
3. 成分/组成信息纯品■混合物□主要成分 CAS RN 含量(%)硫脲 62-56-64. 急救措施皮肤接触:脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
如有不适感,就医。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
如有不适感,就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
食入:饮足量温水,催吐。
就医。
5. 消防措施危险特性:遇明火、高热可燃。
受热分解,放出氮、硫的氧化物等毒性气体。
与氧化剂能发生强烈反应。
有害燃烧产物:氮氧化物、氧化硫。
灭火方法:用水、雾状水、泡沫、二氧化碳、砂土灭火。
灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
6. 泄漏应急措施应急处理:隔离泄漏污染区,限制出入。
消除所有点火源。
建议应急处理人员戴防尘口罩,穿防毒服。
穿上适当的防护服前严禁接触破裂的容器和泄漏物。
尽可能切断泄漏源。
用塑料布覆盖泄漏物,减少飞散。
勿使水进入包装容器内。
用洁净的铲子收集泄漏物,置于干净、干燥、盖子较松的容器中,将容器移离泄漏区。
表- 硫脲的理化性质及危险特性表
稳固,避免碰撞、摩擦、倾倒等情况发生。
运输车辆应装备相应的消防器材和急救设备。
运输过程中应避免与氧化剂、酸类、食用化学品等混装混运。
禁止与热源、火种等接触。
运输过程中如发生泄漏,应立即采取应急处理措施。
硫脲是一种白色光亮苦味晶体,分子式为CH4N2S,分子量为76.12.它可以溶于冷水和乙醇,微溶于乙醚。
硫脲的燃烧
性能较好,但容易受热分解,放出氮、硫的氧化物等毒性气体,具有一定的爆炸危险性。
硫脲的危害主要表现在健康方面,长期接触会对人体造成一定的损害,如出现头痛、嗜睡、无力、面色苍白等症状。
在使用硫脲时,需要注意其危险特性和禁忌物。
硫脲遇明火、高热可燃,与氧化剂能发生强烈反应,应远离火源、热源和氧化剂等物品。
在储存和运输时,应注意防火、防潮、防晒,避免碰撞、摩擦、倾倒等情况发生。
在急救和泄漏处置时,应采取相应的措施,如用肥皂水和清水冲洗皮肤、提起眼睑用流动清水或生理盐水冲洗、迅速脱离现场至空气新鲜处等。
硫脲分解成氢氧根离子
硫脲是一种有机化合物,化学式为CH4N2S。
它是一种白色晶体,具
有吸湿性,并且在空气中稳定。
然而,硫脲在一定条件下可以被分解
成氢氧根离子和二硫化碳。
硫脲分解的反应式可以表示为:CH4N2S + 2OH⁻ → CO2 + H2S + NH3 + S。
该反应是一个化学分解反应,在该反应中,硫脲分子被氢氧根离子攻击,导致分子中的硫-硫键断裂,从而产生二硫化碳和氨。
硫脲的分解产生的二硫化碳在常温常压下是一种无色有毒气体,具有刺激性气味。
氢气硫在这个反应中也被产生,它是一种有毒气体,具有难闻的臭鸡
蛋气味。
硫脲分解的条件包括高温、弱碱性、还原性物质和催化剂。
例如,溶
解硫脲的氢氧化钾溶液可以加速分解的速度。
另外,硫脲也可以通过
酸催化反应来分解,产生硫磺。
硫脲分解反应在工业上有一定的应用。
例如,它可以用于生产高纯度
的硫磺。
此外,硫脲分解反应还可以用于检测银离子、汞离子和银汞
离子等物质,因为它们可以使硫脲在溶液中分解产生沉淀。
总之,硫脲是一种有机化合物,可以在一定条件下分解成氢氧根离子和其他物质。
它的分解反应具有一定的工业应用价值和实验室检测价值。