大连理工大学化工热力学总结
- 格式:ppt
- 大小:7.20 MB
- 文档页数:7


化工热力学知识要点1、化工热力学的研究方法:宏观研究方法 微观研究方法。
2、热力学体系:孤立体系(无物质无能量) 封闭体系(无物质 有能量) 敞开体系(有物质 有能量)。
3、体系 环境:在热力学分析中,将研究中涉及的一部分物质(或空间)从其余物质(或空间)中划分出来。
其划分出来部分称为体系,其余部分称为环境。
4、状态函数:描述体系所处状态的宏观物理量成为热力学变量(状态函数)。
常用的状态函数有压力、温度、比容、内能、焓、熵、自由焓等。
5、循环:体系经过一系列的状态变化过程后,最后由回到最初状态,则整个的变化称为循环。
分为正向循环和逆向循环。
6、临界点:气化线的另一个端点是临界点C,它表示气液两相能共存的最高压力和温度,即临界压力cp 和临界温度cT 。
7、临界点的数学表达式:临界等温线在临界点上的斜率和曲率都等于零。
数学上表示为0=⎪⎭⎫⎝⎛∂∂=cTT V p 022=⎪⎪⎭⎫ ⎝⎛∂∂=cTT V p8、直线直径定律:当以饱和液体和饱和蒸气密度的算术平均值对温度作图时,得一近似的直线。
9、纯物质的p-V-T 图:P 510、理想气体状态方程:RT pV =式中,p 为气体压力;V 为气体摩尔体积;T 为绝对温度;R 为通用气体常数 8.314J/(mol ·K)11、范德华方程(van der Waals 方程):2V ab V RT p --= 其中cc pT R a 642722=;cp RTb 8=。
12、R-K 方程: )(5.0b V V T ab V RT p +--= 其中ccp T R a /42748.05.22=;cc p RT b /08664.0=。
13、维里方程(Virial 方程):++++==321V DV C V B RT pV Z (2-26) 或者 ++++==32'''1p D p C p B RTpVZ式中, 、、、)'()'()'(D D C C B B 分别称为第二、第三、第四、 Virial 系数。
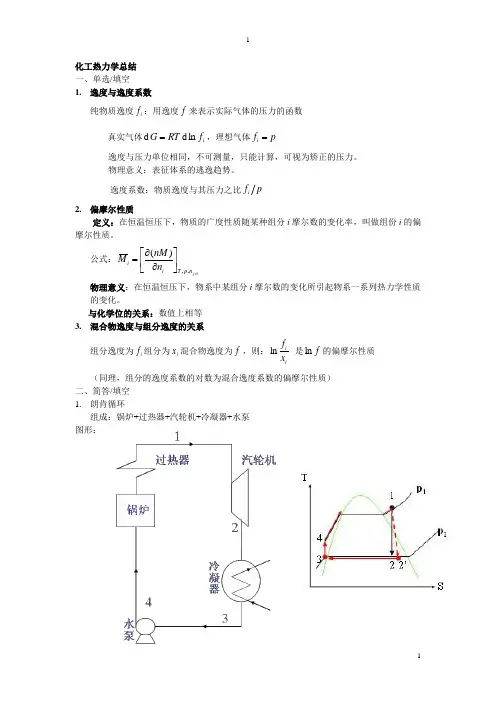
化工热力学总结一、单选/填空1. 逸度与逸度系数纯物质逸度i f :用逸度f 来表示实际气体的压力的函数真实气体i f RT G ln d d =,理想气体p f i =逸度与压力单位相同,不可测量,只能计算,可视为矫正的压力。
物理意义:表征体系的逃逸趋势。
逸度系数:物质逸度与其压力之比p f i2. 偏摩尔性质定义:在恒温恒压下,物质的广度性质随某种组分i 摩尔数的变化率,叫做组份i 的偏摩尔性质。
公式:ij n p T i i n nM M ≠⎥⎦⎤⎢⎣⎡∂∂=,,)( 物理意义:在恒温恒压下,物系中某组分i 摩尔数的变化所引起物系一系列热力学性质的变化。
与化学位的关系:数值上相等3. 混合物逸度与组分逸度的关系组分逸度为i f 组分为i x 混合物逸度为f ,则:ii x f ln 是f ln 的偏摩尔性质 (同理,组分的逸度系数的对数为混合逸度系数的偏摩尔性质)二、简答/填空1. 朗肯循环组成:锅炉+过热器+汽轮机+冷凝器+水泵图形:过程:1-2:汽轮机中工质做等熵膨胀2-3:蒸汽在冷凝器中等压等温冷凝3-4:饱和水在水泵中做可逆绝热压缩4-1:水在锅炉中等压升温和等压汽化 不足之处:可逆程度低、热效率不高,不能完全转换;改进办法:1)提高过热器出口蒸汽压力与温度。
2)降低排汽压力。
3)改进热力循环方式,如采用回热循环,热电循环等2、卡诺循环过程:1→2 11,T p 水蒸汽在汽轮机内作等熵膨胀,变成湿蒸汽(乏汽)2,同时对外作输出轴功S W2→3 乏汽在冷凝器内等压、等温冷凝,放出汽化潜热,放出的热量3→4 冷凝水在水泵中等熵压缩,升压至1p 进至锅炉4→1 水在锅炉中吸收热量,变化到状态1,完成一个循环。
不足:(1)湿蒸汽对汽轮机和水泵有浸蚀作用,汽轮机带水量不得超过10%,水泵不能带入蒸汽进泵;(2)绝热可逆过程实际上难以实现。
3、相平衡三大判据1)体系自由焓(吉布斯自由能)为0 即0d =G2)各组分在各相中化学位相等3)各组分在各相中分逸度相等4、活度系数法定义:根据溶液热力学理论,将液相中组分的逸度于组分的活度系数相联系 基本式:P164()N i RT p p V p x py i i ii i i i i ,,2,1,)(exp ˆS L S S V=⎥⎦⎤⎢⎣⎡-=ϕγϕ 举例:已知体系压力p 与液相组成i x ,求泡点温度与汽相组成y6、状态方程法定义:是以各组分逸度系数与气液两相均实用的状态方程和混合规则相联系基本式:()N i x y i i i i ,,2,1 ˆˆLV =⋅=⋅ϕϕ 举例:已知有N 个组分的混合物,压力为p ,液相组成为i x ,求平衡温度与汽相组成i y7、节流膨胀特点:节流前后流体焓不变作用:改变流体的温度(其熵增加)理想流体节流后温度不变节流膨胀与绝热膨胀的比较:降温程度:做外功的绝热膨胀比节流大,且可回收功降温条件:节流膨胀需要条件,对于氢等需预冷才能获得冷效应。



第一章1.化工热力学的作用地位:化工热力学是将热力学原理应用于化学工程技术领域。
它的主要任务是以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,研究各种物理和化学变化过程达到平衡的理论极限、条件和状态。
化工热力学是化学工程学的重要组成部分,是化工过程研究、开发与设计的理论基础。
2.热力学第零定律:当两个物体分别与第三个物体处于热平衡时,则这两个物体彼此之间也必定处于热平衡。
这是经验的叙述,称热平衡定律,又称热力学第零定律。
热力学第一定律即能量守恒定律:在任何过程中能量不能创造也不能消灭,只能按照严格的当量从一种形式转变为另一种形式。
热力学第二定律:任何体系都是自动地趋向平衡状态,一切自动过程都是不可逆的3.相律定义:'2R R K F--+-=π式中F 称为自由度,也就是独立的强度性质的数目,π、R 和'R 分别是相数、独立的化学反应数和其它的强度性质的限制数。
4.热力学基本方程 对于均相系统,热力学基本方程一共有四个,它们是:∑∑==++-=Ki ii L l l l dn dY X pdV TdS dU 11μ,∑∑==+++=Ki i i Ll l l dn dY X Vdp TdS dH 11μ∑∑==++--=Ki i i Ll l l dn dY X pdV SdT dA 11μ,∑∑==+++-=Ki i i Ll l l dn dY X Vdp SdT dG 11μ),,,(),,,(),,,(),,,(i l i l i l i l n Y P T G TS H G n Y V T A TS U A n Y P S H PV U H n Y V S U U =-==-==+==这四个基本方程可由热力学第一和第二定律导得。
推导前需要一个有关状态或平衡态的基本假定:对于一个均相系统,如果不考虑除压力以外的其它广义力,为了确定平衡态,除了系统中每一种物质的数量外,还需确定两个独立的状态函数。

化工热力学总结(1)写出多相系统的热力学方程;(2)二组分溶液,若已知一组分的逸度和组分含量,如何求另一组分的逸度? (3)低压下,由气液相平衡关系测得{P ,y ,x ,T },如何由提供的这些数据算出活度系数。
(4)GE> 0,属于正负偏差溶液?为什么?(5)真实溶液在反应器中,经过绝热变化后,系统熵变∆S= - 13000 J ,判断此过程的可能性。
(6)二组分溶液,其超额Gibbs 自由能满足:GE/RT=150-45x1-5x13,求各组分的活度系数r1, r2Gibbs 函数(G 函数) 应用反映真实气体与理想气体性质之差,称之为剩余G 函数。
与逸度或逸度系数的关系:反映真实溶液和理想溶液性质之差,称为过量Gibbs 函数。
与活度或活度系数的关系为:实验数据的热力学一致性检验 相平衡和化学平衡 有效能的综合利用:理想功与有效能也是一种Gibbs 函数。
理想功: 有效能: 第二章 流体的 P-V-T 关系2.1 纯物质的P-V-T 关系 2.2 气体的状态方程 2.3 对比态原理及其应用2.4 真实气体混合物的P-V-T 关系 2.5 液体的P-V-T 性质 理想气体方程TSH G -=RTTS H RT G RR R pf -===ϕln )ln(0ˆ(/)ln()ln ii i j iE f i f x i T p n nG RT n γ≠⎡⎤∂==⎢⎥∂⎣⎦、、0G T p ∆=、恒定id 00()W H T S G T p T =-∆+∆=∆,,X 00000()()(,,)E H H T S S G T p T p =--+-=∆,PV RTZ PVRT===11 在较低压力和较高温度下可用理想气体方程进行计算。
2 为真实气体状态方程计算提供初始值。
3 判断真实气体状态方程的极限情况的正确程度,当 或者 时,任何的状态方程都还原为理想气体方程。
立方型状态方程立方型状态方程可以展开成为 V 的三次方形式。


![化工热力学各章总结[1]](https://uimg.taocdn.com/d55e3a0cbb68a98271fefaac.webp)

第2章流体的P-V-T 关系1.掌握状态方程式和用三参数对应态原理计算PVT 性质的方法。
2.了解偏心因子的概念,掌握有关图表及计算方法。
1. 状态方程:在题意要求时使用该法。
① 范德华方程:常用于公式证明和推导中。
② R —K 方程: ③ 维里方程:2. 普遍化法:使用条件:在不清楚用何种状态方程的情况下使用。
三参数法:① 普遍化压缩因子法② 普遍化第二维里系数法3、Redlich-Kwong (RK )方程3、Soave (SRK )方程4、Peng-Robinson (PR )方程()22a 0.45724c r cR T T P α=0.0778c cRT b P =§2-5高次型状态方程5、virial 方程 virial 方程分为密度型:和压力型:第3章 纯物质的热力学性质1、热力学性质间的关系dU TdS pdV =-H=U+PV d H T d S V d =+A=U-TS d A S d Tp d V =--G=H-TS d G S d TV d p =-+ Maxwell 关系式S V T P V S ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ S P T V P S ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ V T P S T V ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭ P TV S T P ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ 转换公式: 1Z X YX Y Z Y Z X ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪⎪∂∂∂⎝⎭⎝⎭⎝⎭3.2计算H ∆和S ∆的方法1.状态方程法: P P V d H C d T V T d PT ⎡⎤∂⎛⎫=+- ⎪⎢⎥∂⎝⎭⎣⎦ P PC V d S d T d PT T ∂⎛⎫=- ⎪∂⎝⎭ 2.剩余性质法:①普遍化压缩因子图()()1R R RTC C C H H H RT RT RT ω=+ ()()1R R RTS S SRRRω=+②普遍化的第二维里系数方法0101R T r r r C r r H dB dB P B T B T RT dT dT ω⎡⎤⎛⎫=-+-⎢⎥ ⎪⎝⎭⎣⎦ 01R T r r r S dB dB P R dT dT ω⎛⎫=-+ ⎪⎝⎭0 1.60.4220.083r B T =-14.20.1720.139r B T =-导出:0 2.60.675r r dB dT T = 15.20.772r rdB dT T = 第6章 化工过程能量分析热力学第一定律一、功 Wp dVδ=-外不可逆过程: 2112W P dV =-⎰外体可逆过程: 21V rev V W p dV =-⎰体体规定:体系吸热为正,放热为负;对外做功为负,接受功为正。