中考总复习:燃料及其利用(提高) 知识讲解
- 格式:docx
- 大小:178.41 KB
- 文档页数:10

第七单元燃料及其利用
一、燃烧和灭火
1.燃烧:通常的燃烧是指可燃物跟氧气发生的一种发光、放热的剧烈的氧化反应,属于化学变化。
2.燃烧的条件:可燃物、氧气(或空气)、达到可燃物燃烧的最低温度(也叫着火点)。
【燃烧必须同时满足三个条件】
3.灭火的方法原理:【只要满足其中一条就可以灭火】
① 清除可燃物或使可燃物与其他物品隔离;
② 隔绝氧气(或空气)
;
③ 降低可燃物的温度,使其
降低到着火点以下。
二、燃料
的合理利用与开发
1.化石燃料:煤、石油、天然气(均为混合物,并且均为不可再生能源)称为化石燃料。
2.大量使用化石燃料或化石燃料燃烧不充分都会造成空气污染,如煤燃烧排放的污染物SO2、NO2可导致酸雨。
3.新能源:太阳能、核能、风能、地热能、生物质能、潮汐能、
可燃冰和氢气等。
三、最友好、最环保清洁、最高效新能源——
氢气
1.氢气只一种无色、无味、密度小于空气(密度最小的气体),难于水的气体。
氢气具有可燃性和还原性,可用来作燃料和冶炼金属等。
2.制取方法:通常可用锌片与稀硫酸或稀盐酸反应来制取,采用固液混合常温下制气体装置作发生装置。
由于氢气密度小于空气且难溶于水,所以可采用向下排空气法或排水集气法来收集。
四、防治空气污染的具体措施:
1.开发使用新能源;
2.减少化石燃料的使用;
2.使燃料充分燃烧(如增大与空气的接触面积);
3.汽车尾气、工业废气经处理达标再排放;
4.大力植树造林、种草等。
1。


化学燃料及其利用是九年级化学内容中的一个重要知识点,下面是九年级化学燃料及其利用的知识点总结,包括什么是燃料、常见的燃料种类、燃烧反应及其特点、燃料的效能、燃料和环境的关系以及节约能源和绿色能源等方面。
一、什么是燃料燃料是指直接或间接用于产生热能或动力的物质。
燃料主要为化学物质,它们能够在适当的条件下与氧气反应产生热能。
常见的燃料有化石燃料、木炭、天然气等。
二、常见的燃料种类2.木炭:木炭是由木材等植物有机物经过热分解得到的固体燃料。
木炭燃烧时释放的热量高,但燃烧产物中会有很多固体颗粒物。
3.液体燃料:液体燃料主要指石油和汽油,它们被广泛用于交通运输和工业生产等领域,但燃烧产生的尾气对环境有污染。
4.天然气:天然气是一种主要由甲烷组成的气态燃料,它燃烧时产生的污染物相对较少,因此被认为是较为清洁的燃料。
三、燃烧反应及其特点燃烧是指物质与氧气发生化学反应,放出焓变为负的化学反应。
燃烧反应一般包括燃料和氧气的反应,产物主要有二氧化碳、水和能量(热能和光能)。
燃烧反应具有自燃性、连续性、放热性和产物不稳定性等特点。
四、燃料的效能燃料的效能指用于产生能量的燃料利用效果的好坏。
常用的衡量燃料效能的指标包括燃烧的热效率和排放的污染物。
炉具和发动机等的效能主要取决于其热损失的多少,减少热损失可以提高燃料的效能。
五、燃料和环境的关系燃料的燃烧过程中会产生大量的污染物,包括二氧化碳、二氧化硫、氮氧化物和颗粒物等。
这些污染物对环境和人类健康都有一定的危害。
因此,燃料和环境的关系十分密切,我们应该选择清洁和高效的燃料,减少污染物的排放。
六、节约能源和绿色能源近年来,随着全球能源危机的日益突出和环境保护意识的提高,节约能源和绿色能源成为了研究的热点。
节约能源主要包括提高能源利用效率、合理使用能源和开发新能源等。
绿色能源是指对环境友好、可持续利用的能源,如太阳能、风能和生物能等。
总的来说,九年级化学燃料及其利用的知识点包括了什么是燃料、常见的燃料种类、燃烧反应及其特点、燃料的效能、燃料和环境的关系以及节约能源和绿色能源等方面。

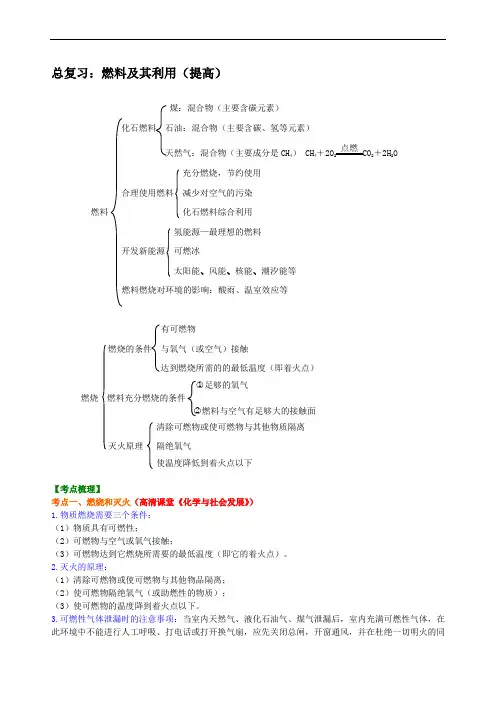
总复习:燃料及其利用(提高)煤:混合物(主要含碳元素)化石燃料石油:混合物(主要含碳、氢等元素)天然气:混合物(主要成分是CH4)CH4+2O2点燃CO2+2H2O充分燃烧,节约使用合理使用燃料减少对空气的污染燃料化石燃料综合利用氢能源—最理想的燃料开发新能源可燃冰太阳能、风能、核能、潮汐能等燃料燃烧对环境的影响:酸雨、温室效应等有可燃物燃烧的条件与氧气(或空气)接触达到燃烧所需的的最低温度(即着火点)○1足够的氧气燃烧燃料充分燃烧的条件○2燃料与空气有足够大的接触面清除可燃物或使可燃物与其他物质隔离灭火原理隔绝氧气使温度降低到着火点以下【考点梳理】考点一、燃烧和灭火(高清课堂《化学与社会发展》)1.物质燃烧需要三个条件:(1)物质具有可燃性;(2)可燃物与空气或氧气接触;(3)可燃物达到它燃烧所需要的最低温度(即它的着火点)。
2.灭火的原理:(1)清除可燃物或使可燃物与其他物品隔离;(2)使可燃物隔绝氧气(或助燃性的物质);(3)使可燃物的温度降到着火点以下。
3.可燃性气体泄漏时的注意事项:当室内天然气、液化石油气、煤气泄漏后,室内充满可燃性气体,在此环境中不能进行人工呼吸、打电话或打开换气扇,应先关闭总闸,开窗通风,并在杜绝一切明火的同时查找泄漏的原因。
4.火灾自救策略:(1)迅速找到安全通道;(2)发生火灾时上层空气中氧气少,毒气浓度大,所以要匍匐前进;(3)房间发生火灾时不能随便开门开窗,开门开窗会增加氧气量,使火势更加凶猛;(4)火灾时会产生大量烟尘,使人窒息而死,因此最好用湿布捂住口鼻;(5)若在山林中遇到火灾时,应逆风而跑,因为顺着风更易被烧伤和发生危险。
【要点诠释】1.着火点是物质本身的固有属性,一般不随外界条件的改变而改变。
因此不能说用降低着火点的方法来灭火,而只能是降温到着火点以下。
2.燃烧的本质是氧化反应。
燃烧一般伴随着发光、发热等现象,但有发光、发热现象的不一定是燃烧,如灯泡通电发光、发热。

《燃料的合理利用与开发》知识全解课标要求(一)知识与技能1.了解化学反应中的能量变化;2.了解煤、石油、天然气等化石燃料的组成和用途;知道甲烷的物理性质和化学性质;3.了解化石燃料燃烧对环境的影响;4.认识使用和开发清洁能源的重要性。
(二)过程与方法1.通过学生思考、阅读和讨论,培养学生的认知能力;2.通过一些探究活动,进一步认识与体验科学探究的过程。
(三)情感态度与价值观1.了解化石燃料的不可再生性,认识合理开采和节约使用化石燃料的重要性;2.了解使用化石燃料对环境的影响,懂得选择对环境污染较小的燃料;3.树立保护环境的意识,体会化学与社会发展的关系。
知识结构44222C S N C H S N CH CH +2O CO +2H O ⎧⎨⎩⎧⎨⎩⎧⎨⎩⎧⎧⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎩点燃放热化学反应中的能量变化吸热组成元素:(少量、)煤及其综合利用煤的干馏:煤焦油、焦炭、煤气组成元素:(少量、)石油及其综合利用石油的分馏:汽油、煤油、柴油物理性质:无色无味的气体,密度比空气小,极难溶于水化石燃料主要成分:甲烷()天然气能源燃料化学性质:可燃性,用途化石燃料燃2225222222SO NO C H OH +3O 2CO +3H O 2H +O 2H O ⎧⎪⎪⎪⎧⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎨⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎧⎪⎪⎪⎨⎪⎪⎪⎩⎩⎪⎪⎪⎪⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎩⎪⎪⎪⎩点燃点燃酸雨:、烧对环境的影响汽车尾气乙醇:新型燃料氢气:(来源广、热值高、无污染)新能源的开发和利用:太阳能、核能、风能、地热能、潮汐能重难点突破本课题的重点是:1.化学变化中能量的变化;2.煤、石油、天然气三大化石燃料;3.培养学生的能量观和节能环保的意识。
本课题突破重点的方法主要是通过探究实验利用生石灰煮鸡蛋等等趣味实验探究,引发学生思考原因,分析化学反应中存在放热和吸热现象,得出化学反应中存在能量变化。

千里之行,始于足下。
...九年级化学上册第七单元燃料及其利用知识点总结全面整理九年级化学上册第七单元涉及燃料及其利用,以下是该单元的主要知识点总结:1. 燃料的定义:燃料是用来产生热能或者做功的物质。
2. 燃烧的定义:燃烧是物质与空气中的氧气发生反应产生热、光、声等现象的化学变化。
3. 燃烧所需的条件:燃料、氧气和足够的温度。
4. 燃烧的三要素:燃料、氧气和着火温度。
5. 燃料的分类:- 有机燃料:如煤、石油、天然气等,它们是从化石中提取的,主要成分为碳和氢。
- 无机燃料:如氢气、氧气、臭氧等。
6. 燃料的利用途径:- 燃烧发电:利用燃料的热能产生蒸汽,蒸汽驱动汽轮机发电。
- 飞机、汽车等交通工具的运行。
- 工业生产:生产钢铁、化肥等。
- 生活用途:取暖、烹饪等。
7. 燃烧产物:燃料燃烧后会产生水蒸汽、二氧化碳、氮气、一氧化碳、硫化物等。
第1页/共2页锲而不舍,金石可镂。
8. 燃料的利与害:- 利:燃料可以提供能量和动力,满足人们的生活需求。
- 害:燃料的燃烧会产生大量的二氧化碳等温室气体,导致地球气候变暖;同时,燃料的燃烧排放的污染物会对环境和人类健康造成危害。
9. 节约能源的意义和方法:- 意义:节约能源可以减少对自然资源的消耗,减少环境污染的产生,保护生态环境。
- 方法:科学使用能源,开展节能宣传,推广节能技术,促进清洁能源的开发利用等。
10. 温室效应与全球变暖:- 温室效应:大气中的温室气体(如二氧化碳、甲烷、氟利昂等)能够吸收地球表面向外散发的热量,形成类似温室的作用,使地球温度上升。
- 全球变暖:由于温室效应加剧,地球的气候变得越来越热,导致冰川融化、海平面上升、气候变化等问题。
以上是九年级化学上册第七单元燃料及其利用的知识点总结。
除了了解这些知识点,还需要通过实践经验、实验观察等方式来加深对燃料及其利用的理解。

人教版九年级化学上册燃料及其利用知识点汇总
1.燃烧的条件(控制变量法):可燃物氧气(或空气)温度达到可燃物的着火点
缺一不可
2.探究燃烧条件实验,烧杯中热水的作用:隔绝氧气,提供热量使温度达到可燃物的着火点
3.探究燃烧的条件:酒精灯放置的位置:两者之间这样做的目的是:受热温度相同
4.乒乓球碎片先燃烧,滤纸碎片后燃烧
5.充分燃烧的条件:①燃烧时要有足够的空气②燃料与空气要有足够大的接触面积
6.灭火的原理:清除可燃物隔绝氧气(或空气)使温度降低到可燃物的着火点以下
例如:灯帽盖灭酒精灯油锅着火锅盖盖灭酒精灯着火湿抹布盖灭灭火原理都是隔绝氧气(或空气)
森林着火前方树木砍掉(设置隔离带)关闭燃气灶阀门灭火原理都是清除可燃物
高层建筑物着火用高压水枪灭火用嘴吹灭蜡烛灭火原理都是使温度降低到可燃物的着火点以下
7.例如:人要实,火要虚,这里面的虚就是燃料与空气要有足够大的接触面积
将煤球变为蜂窝煤这一变化目的是:燃料与空气要有足够大的接触面积
7.三大化石燃料:煤石油天然气均属于可再生能源,为混合物煤的干馏是化学变化石油的分馏是物理变化
8.粉尘爆炸实验:鼓入大量空气的目的是:使面粉充满金属罐,增大与氧气的接触面积。
8. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O
9. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O。

(人教版)中考化学考点第七单元燃料及其利用
考点1 燃烧及燃烧的条件
⒈通常的燃烧是指可燃物跟氧气发生的一种发光、发热的剧烈的氧化反响。
燃烧需要同时满足三个条件:⑴可燃物;⑵与氧气(或空气)接触;⑶温度到达可燃物的着火点。
⒉着火点:到达燃烧所需的最低温度,着火点是物质本身的固有属性,因此不能说用降低着火点的方法来灭火,而只能是降温到着火点以下。
考点2 灭火的原理和方法
⒈灭火的原理:(破坏燃烧的条件,三者破坏其一就可灭火,也可同时都破坏)
⑴去除可燃物或使可燃物跟其他物品隔离;⑵隔绝氧气(或空气)⑶使温度降低到着火点以下
⒉几种常用灭火器的适用范围
⑴泡沫灭火器:用来扑灭木材、棉花等燃烧而引起的失火。
⑵干粉灭火器:除用来扑灭一般火灾外,还可用来扑灭油、气等燃烧引起的失火。
⑶二氧化碳灭火器:用来扑灭图书档案、贵重设备、精密仪器等处的失火。
考点3 易燃物和易爆物的平安知识
⒈可燃物与氧气接触面积越大,燃烧越剧烈爆炸越危险。
⒉一切可燃性的气体或粉尘,在空气中到达爆炸极限遇到明火就易发生爆炸,家用煤气一旦泄露,千万不要开动电器开关,以免发生爆炸。


《燃料及其利用》考点解读一、中考命题预测本单元的知识和现代社会生活联系密切,所占分值有不断增大的趋势,命题趋向有:(1)联系生产、生活实际,研究燃烧的条件、灭火原理及防火措施,考查解决实际问题的能力;(2)依据课本知识进行迁移,考查对某些防火、防爆安全措施的理解程度;(3)各种燃料(煤、石油、天然气、甲烷、酒精、氢气)的使用前景以及由此带来的各种环境问题等内容。
上述内容都是本单元的主要考查点,其考查热点是运用这些知识分析解决生产、生活中的一些实际问题,特别是与生产、环境有关的问题。
其中合理开发与节约使用资源、新能源的开发与环境保护将是开放性试卷及研究性学习命题的热点,考查题型主要是选择题、填空题及简答题。
二、中考高频考点解读考点一:考查安全标识例1(10·广东)2010年5月起,广州市的液化石油气瓶要统一加贴新标识。
新标识上要含有以下选项中的( )解读本题考查常用危险化学品的安全标识,液化石油气易汽化,属于易燃气体。
答案A点评明确可燃物的状态是解题的关键。
考点二:考查燃烧的条件例2(10·新疆)根据如图所示的实验现象,下列判断正确的是( )A.现象①③说明白磷的着火点高于红磷的着火点B.现象①②说明可燃物燃烧温度一定要达到着火点C.现象②③说明白磷与红磷的着火点均高于80℃D.现象①②③说明可燃物燃烧需要氧气,同时温度要达到着火点解读本题考查燃烧的条件。
铜片上的白磷燃烧而红磷不燃烧,说明白磷的着火点低于红磷的着火点,A错误;铜片上的白磷燃烧而水中的白磷不燃烧,说明可燃物燃烧必须与氧气接触,B错误;在80℃铜片上的白磷燃烧,说明白磷的着火点低于80℃,红磷不燃烧,说明红磷的着火点高于80℃,C错误;现象①②比较说明可燃物燃烧需要氧气,现象①③比较说明可燃物燃烧温度必须达到着火点,D正确。
答案D点评可燃物燃烧必须同时具备两个条件:一是要与氧气接触,二是温度要达到着火点。
考点三:考查灭火的方法例3(10·重庆綦江)下列灭火方法与隔绝氧气无关的是( )A.森林大火时设置一条隔离带B.用CO2灭火器灭火C.用锅盖盖灭着火的油锅D.用灯帽盖灭酒精灯解读本题考查常见的灭火方法。
【九年级】九年级化学复习课燃料及其利用第一轮主题:燃料及其利用一、目标解读:1.了解可燃物的燃烧情况及灭火原理和方法2、认识煤、石油、天然气等化石燃料及其对环境的影响3.了解新燃料的使用和开发,以及能源和化学反应中的能源变化二、要点回顾:(一)燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃气体(2)氧气(或空气)(3)的温度达到燃点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔离氧气(或空气)(3)将温度降至燃点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积燃料充分燃烧的两个条件:(1)充足的空气(2)燃料和空气之间有足够的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
(二)、燃料和能源1、三大化石燃料:煤、石油、天然气(混合物、均为不可再生能源)(1)煤炭:“工业食品”(主要是碳);煤燃烧排放的污染物:so2、no2(引起酸雨)、co、烟尘等(2)石油:“工业的血液”(主要含碳和氢);汽车尾气中污染物:co、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是一种气体化石燃料(主要成分:甲烷),是一种清洁能源。
2、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式:ch4(最简单的有机物,相对分子质量最小的有机物)物理性质:无色无味气体,密度低于空气,极难溶于水。
化学性质:可燃性ch4+2o2点燃co2+2h2o(发出蓝色火焰)(2)乙醇(俗称乙醇,化学式:C2H5OH)化学性质:可燃性c2h5oh+3o2点燃2co2+3h2o工业酒精通常含有有毒的甲醇CH3OH,因此工业酒精不能用于制备葡萄酒!乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生3、化学反应中的能量变化(1)放热反应:如所有燃烧(2)吸热反应:如一般条件为“高温”的反应4.新能源:氢能、太阳能、核能、风能、地热能、潮汐能氢气是最理想的燃料:(1)优点:来源广,热值高,无污染。
中考化学复习专题十四:燃料及其利用【复习目标】1、掌握燃烧的条件,通过实验探究,理解燃烧的条件;明白促进燃烧的方法;2、认识灭火的原理;掌握灭火的常用措施;3、认识爆炸的类型,以及发生的条件、防范爆炸的措施。
4、知道化石燃料是人类重要的自然资源,了解化石燃料的不可再生性,认识合理开采、节约使用化石燃料的重要性;了解石油炼制出的几种重要产品及其用途。
5、了解化石燃料燃烧对环境的影响,树立环保意识;认识使用和开发清洁燃料及各种新能源的重要性。
【命题解读】1、燃烧与灭火:本考点常以选择题和填空与简答题的形式进行考查,考查的命题点有:灭火原理、灭火措施的判断等。
常结合日常生活中发生的火灾或近年来重大火灾事件等,以文字的形式呈现。
2、化石燃料的利用:该考点在中考中常以选择题、填空与简答题的形式考查,考查的命题点有:传统化石燃料的相关内容及其对环境的影响。
常结合环境及能源问题等,以文字形式出现。
【考点梳理】考点1:燃烧3、促进燃烧的方法:①增大氧气的浓度;②增大可燃物氧气不充足2C+O22CO;(CO中毒:与血红蛋白结合,失去运氧能力)考点2:灭火灭火的原理:破坏燃烧所需的条件,只要破坏其中一个燃烧条件,就可灭火。
灭火的方法:①隔绝氧气(如沙土覆盖);②移走可燃物(如关闭煤气阀门);③降低温度到着火点以下(如用水灭火)。
考点3:爆炸1、分类:①物理爆炸:如气球吹爆、爆胎、锅炉爆炸等;②化学爆炸:燃放鞭炮、甲烷爆炸等。
2、化学爆炸的条件:①可燃性气体或粉尘在空气中的含量达到爆炸极限;②遇明火燃烧;③气体体积在有限的空间内急剧膨胀。
3、一些与燃烧和爆炸有关的图标考点4:燃料与能源3、氢气是最清洁的燃料,但由于氢气的制取成本高和贮存困难,作为燃料暂时还不能广泛使用。
优点:(1)燃烧效率高;(2)燃烧产物是水,无污染;(3)资源丰富。
4、新能源:(1)种类:如氢能、风能、核能、太阳能、地热能和潮汐能等。
(2)开发新能源的作用:解决化石能源枯竭,减少环境污染。
第七单元燃料及其利用课题 1燃烧和灭火一、燃烧可燃物与空气中的氧气发生的一种发光、放热的剧烈的氧化反应,叫做燃烧。
二、燃烧的条件1.要使可燃物燃烧,需要同时满足两个条件:⑴可燃物要与氧气充分接触;⑵ 要是可燃物的温度达到着火点。
2.灭火的方法:⑴将可燃物与氧气 ( 或空气 ) 隔绝;⑵ 将可燃物的温度降至着火点以下;⑶清除可燃物或隔离可燃物。
三、燃烧的现象1.可燃物的性质不同,燃烧的现象也不同。
2.可燃物与氧气 ( 或空气 ) 的接触面积越大,燃烧越剧烈。
3.氧气的浓度越大,燃烧越剧烈。
四、爆炸易燃物在有限的空间内急剧地燃烧,就会在短时间内聚积大量的热,使气体体积迅速膨胀,引起爆炸。
爆炸的条件:易燃物、有限的空间、明火、达到爆炸极限。
五、缓慢氧化与自燃1.缓慢氧化:进行得很慢,很难被察觉的氧化反应。
2.自燃:易燃物由缓慢氧化而引起自发燃烧的现象,叫做自燃。
六、燃烧、爆炸、缓慢氧化、自燃之间的联系与区别联系:都属于氧化反应,都放热。
区别:条件不同,放出的热量、反应的剧烈程度不同,能否到达着火点、反应的向下不同。
七、常用灭火器1.泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
原理: Na 2 CO3+2HCl=2NaCl+H2O+CO 2 ↑2.干粉灭火器:扑灭油、气等燃烧引起的失火。
3.液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等的失火。
课题 2燃料和热量一、化石燃料煤、石油、天然气等是由古老生物的遗骸经一系列复杂变化而形成的,它们都是化石燃料。
化石燃料是不可再生能源。
工业的“粮食”指煤,工业的“血液”指石油。
1.煤、石油、天然气的主要成分和组成煤:主要含有 C,也含有 S、N 、 O 、H 等。
石油:主要含有C、H,也含有 S、O 、N 等。
天然气:主要成分是甲烷(CH4)。
2.煤和石油是混合物。
3.煤干馏后的产物有焦炭、煤焦油、焦炉气等。
煤的干馏是化学变化。
4.将石油加热炼制,根据石油中各成分的沸点不同来分离,可得到的产品有溶剂油、汽油、航空煤油、煤油、柴油、润滑油、石蜡、沥青等。
中考总复习:燃料及其利用(提高)
【考纲要求】
1.掌握燃烧的条件和灭火的原理;知道一些防火、防爆的安全知识和灭火方法。
3.了解化石燃料燃烧对环境的影响;知道开发各种新能源和使用清洁燃料的重要性。
【知识网络】
煤:混合物(主要含碳元素)
化石燃料石油:混合物(主要含碳、氢等元素)
天然气:混合物(主要成分是CH4)CH4+2O2点燃
CO2+2H2O
充分燃烧,节约使用
合理使用燃料减少对空气的污染
燃料化石燃料综合利用
氢能源—最理想的燃料
开发新能源可燃冰
太阳能、风能、核能、潮汐能等
燃料燃烧对环境的影响:酸雨、温室效应等
有可燃物
燃烧的条件与氧气(或空气)接触
达到燃烧所需的的最低温度(即着火点)
○1足够的氧气
燃烧燃料充分燃烧的条件
○2燃料与空气有足够大的接触面
清除可燃物或使可燃物与其他物质隔离
灭火原理隔绝氧气
使温度降低到着火点以下
【考点梳理】
考点一、燃烧和灭火
1.物质燃烧需要三个条件:
(1)物质具有可燃性;
(2)可燃物与空气或氧气接触;
(3)可燃物达到它燃烧所需要的最低温度(即它的着火点)。
2.灭火的原理:
(1)清除可燃物或使可燃物与其他物品隔离;
(2)使可燃物隔绝氧气(或助燃性的物质);
(3)使可燃物的温度降到着火点以下。
3.可燃性气体泄漏时的注意事项:当室内天然气、液化石油气、煤气泄漏后,室内充满可燃性气体,在此环境中不能进行人工呼吸、打电话或打开换气扇,应先关闭总闸,开窗通风,并在杜绝一切明火的同时查找泄漏的原因。
4.火灾自救策略:
(1)迅速找到安全通道;
(2)发生火灾时上层空气中氧气少,毒气浓度大,所以要匍匐前进;
(3)房间发生火灾时不能随便开门开窗,开门开窗会增加氧气量,使火势更加凶猛;
(4)火灾时会产生大量烟尘,使人窒息而死,因此最好用湿布捂住口鼻;
(5)若在山林中遇到火灾时,应逆风而跑,因为顺着风更易被烧伤和发生危险。
【要点诠释】
1.着火点是物质本身的固有属性,一般不随外界条件的改变而改变。
因此不能说用降低着火点的方法
来灭火,而只能是降温到着火点以下。
2.燃烧的本质是氧化反应。
燃烧一般伴随着发光、发热等现象,但有发光、发热现象的不一定是燃烧,如灯泡通电发光、发热。
3.物质燃烧要求三个条件同时具备,缺一不可。
实现灭火,只要破坏燃烧的一个条件即可。
4.并不是所有燃烧都可以用水和二氧化碳来灭火。
有的物质能在二氧化碳中燃烧,如镁;有的物质与水作用能燃烧,如钠和钾等,这样的物质的燃烧就不能用二氧化碳和水灭火。
考点二、易燃物和易爆物的安全知识
1.易燃物和易爆物:
(1)易燃物:是指那些易燃的气体和液体,容易燃烧、自燃或遇火就能燃烧的固体以及一些可以引起其他物质燃烧的物质等。
如硫、磷、酒精、液化石油气、面粉等。
易爆物:指的是受热或受到撞击时容易发生爆炸的物质。
如黑火药、硝酸铵等。
(2)安全意识:在生产、运输、使用和贮存易燃易爆物时要注意采取一些防范措施。
记忆口诀为:易燃爆物要注意,轻拿轻放防撞击;分开放置避暴晒,标志名称要看清;常通风并灭烟火,消防设施要保证;常检查来不轻心,消除隐患为第一。
2.爆炸:
可燃物在有限的空间内急速地燃烧,就会在短时间内聚集大量的热,使气体体积急速膨胀而引起爆炸。
可燃性气体或粉尘跟氧气(或空气)混合,由于可燃物与氧气接触的表面积很大,遇到明火就有发生爆炸的危险。
因此,加油站、面粉厂、煤矿矿井等处要严禁烟火。
【要点诠释】
1.由于可燃性气体与空气混合达到爆炸极限时将发生爆炸,因此,在点燃可燃性气体之前,务必检验气体纯度。
2.爆炸都非常剧烈,但从原理上来看,引起爆炸的原因有物理因素,也有化学因素。
生活中的轮胎爆炸、气球爆炸、锅炉爆炸等仅仅是由物理变化引起的,而火药爆炸、汽油等燃料引起的爆炸是发生化学变化的结果。
可见,爆炸所发生的变化不一定是化学变化。
3.可燃性气体泄漏时的注意事项:当室内天然气、液化石油气、煤气泄漏后,室内充满可燃性气体,在此环境中不能进行人工呼吸、打电话或打开换气扇,应先关闭总闸,开窗通风,并在杜绝一切明火的同时查找泄漏的原因。
考点三、燃料、热量和环境
1.化石燃料:主要有煤、石油和天然气。
(1)化石燃料通过燃烧以热能的形式给人们提供能量。
(2)化石燃料燃烧过程是化石燃料中的化学能转化为热能的过程。
(3)化石燃料燃烧的主要产物是二氧化碳和水。
2.使燃料充分燃烧通常考虑两点:一是燃烧时要有足够多的空气(或氧气);二是燃料和空气(或氧气)要有足够大的接触面积。
如果空气(或氧气)不足或跟燃料接触面积太小,燃料就会不完全燃烧,不仅使产生的热量减少,浪费燃料,而且还会产生大量的一氧化碳等有害气体污染空气。
3.化石燃料燃烧主要污染类型:。