化工原理第六章
- 格式:ppt
- 大小:1.46 MB
- 文档页数:85




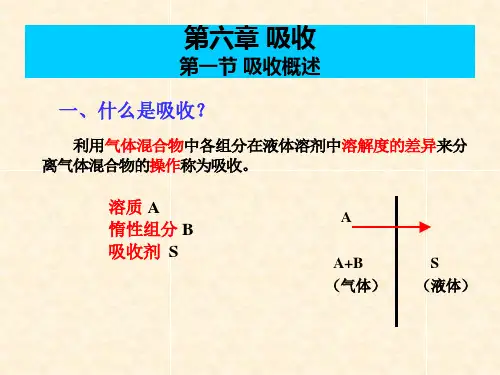
蒸馏⏹双组分溶液的气液相平衡拉乌尔定律由溶剂与溶质组成的稀溶液,在一定温度下汽液两相达到平衡时p A=p A o x Ap A:溶剂在汽相中的蒸气分压,kPap A∗:同温度下纯溶剂A的饱和蒸气压,kPax A:溶剂A在液相中的组成(摩尔分数)对于组分Bp B=p B∗x B=p B∗(1−x A)理想溶液的t−y−x关系式➢温度(泡点) — 液相组成关系式x=p−p B∗p A∗−p B∗x:液相中易挥发组分的摩尔分数p:总压,kPap A∗、p B∗:溶液温度t时,纯组分A、B的饱和蒸气压,kPa ➢恒压下t−y−x关系式y=p A∗x p若已知汽液相平衡温度t下的液相组成x,用上式就可求出与x平衡的汽相组成y ➢温度(露点) — 汽相组成关系式将上面两式合并y=p A∗p×p−p B∗p A∗−p B∗双组分理想溶液的汽液两相达到平衡时,总压p、温度t、汽相组成y及液相组成x的4个变量中,只要决定了两个变量的数值,其他两个变量的数值就被决定了。
相对挥发度与理想溶液的y−x关系式挥发度v挥发度是用来表示物质挥发能力大小的物理量,前面已提到纯组分液体的饱和蒸气压能反映其挥发能力。
理想溶液中各组分的挥发能力因不受其他组分存在的影响,仍可用各组分纯态时的饱和蒸气压表示,即挥发度v等于饱和蒸气压p∘v A=p A ov B=p B o相对挥发度α溶液中两组分挥发度之比称为相对挥发度αa=v Av B=p A op B o对于理想溶液,在操作温度范围内,取最低温度的α值与最高温度的α值之几何平均值理想溶液的汽液相平衡方程式非理想溶液汽液相平衡非理想溶液中各组分的蒸气分压不服从拉乌尔定律,他们对拉乌尔定律发生的偏差有正偏差与负偏差两大类。
实际溶液中,正偏差的溶液比负偏差者多蒸馏与精馏原理简单蒸馏与平衡蒸馏简单蒸馏:只适用于混合液中各组分的挥发度相差较大,而分离要求不高的情况,或者作为初步加工,粗略分离多组分混合液平衡蒸馏:为稳定连续过程,生产能力大。






《化工原理》第六章知识要点1、 物质在相间转移的过程称为 过程或分离过程。
2、 化工生产中常见的传质过程有 、 、 及 等单元操作。
3、 蒸馏是分离 的单元操作。
蒸馏是利用液体混合物中各组分 ,或 的不同使各组分得到分离。
4、蒸馏操作按操作方式可分为 、 、恒沸精馏、萃取精馏、水蒸气蒸馏等多种方法。
按操作压力蒸馏可分为 、 及蒸馏。
按被分离的混合物中所含组分数目可分为 及,按操作是否连续又可分为连续蒸馏和间歇蒸馏。
5、平均摩尔质量求法:=均M 。
6、理想溶液的条件为组分A 、B 分子间作用力AB α,与纯组分A 的分子间作用力AA α,或纯组分B 之间的作用力BB α相等。
例如苯-甲苯,甲醇-乙醇、丙烷-丁烷等可视为理想溶液。
我们所讨论的是两个完全互溶的挥发性组分所组成的理想溶液。
7、理想溶液符合拉乌尔定律,表达式为P A = ;P B = ;蒸汽是理想气体服从道尔顿分压定律。
8、在下图中标出液相区、气相区、气液相混合区,气相线、液相线。
C 点混合物的液相和气相两的关系符合杠杆规则: 。
混合物的沸点只能是一个范围,指出C 混合物的沸点范围。
9、掌握气液相平衡线图(y-x )因为气相中易挥发组分y 的浓度总是大于液相的浓度,故平衡线位于对角线上方,平衡线偏离对角线愈远,表示该溶液愈易 。
10、挥发度是表示某种溶液容易挥发的程度,对于纯液体,通常用其当时温度下的 来表示。
随温度的升高而挥发度 。
11、理想溶液的相对挥发度等于同温度下两纯组分的 之比。
12、气液两相达到平衡时的关系,称为气液平衡关系,写出三个气液平衡方程, 、 、。
13、由气液平衡方程可以看出,相对挥发度α〉1,则x y >。
α值越大,表示平衡时y 比x 大的愈多,故愈有利于分离。
若1=α,则x y =即表示平衡时气相组成等于液相组成,此时不能用简单蒸馏分离。
相对挥发度的大小,可以用来判断某种混合液能否用普通蒸馏方法分开及其可被分离的 程度。
化工原理第六章精馏第六章精馏一、精馏过程的数学描述在化工生产中,常根据混合液中各组分挥发度的不同,以精馏实现均相混合液的分离,二元连续精馏的基本流程如图6-1所示。
精馏过程的实质是伴有传热的传质过程,传质推动力取决于相互接触汽液两相偏离平衡的程度。
因此精馏过程的严格分析除了要应用相平衡、物料衡算两关系外,还需结合热量衡算及传质速率方程。
为了避开后两关系使分析得以简化,在工程上常引入似下两个概念:(1)理论板,(2)恒摩尔流,前者将影响板上传质速率的全部因素包括在塔板效率中;后者则是对热量衡算的简化。
于是精馏过程的数学描述可归结为全塔物料衡算、逐板组成变化两关系。
以图6-1的流程分离理想溶液;其已知量、未知量之间的关系可用图6-2表示。
图6-2表明,描述二元连续精馏的基本方程为 )(1W F D W D F x x R q N N f x Wx Dx Fx W D F ,,,,,,α=+=+= 由于三式中共涉及11个基本变量)(1R q N N x x x W D F W D F ,,,,,,,,,,α,因此其自由度为8,即须给定其中8个独立变量,才能确定另外3个变量。
二、精馏操作型问题的特点及基本类型精馏操作型问题的特点是:精馏塔已经给定(设塔板效率已知)。
即N 、N 1(或进料位置,通常不一定是最佳进料位置)为巳知量,其主要类型如下。
(1)对现有的精馏塔,在给定精馏条件下,核算其可能达到的分离程度。
如:已知N 、N 1、α、F 、x F 、q 、R 及W ,求D 、x D 、x W 。
(2)对运行中的精馏塔,当某一操作条件改变时,分析分离效果的变化,是否能获得合格的产品及为此需采取的措施;还会产生什么其他的影响。
如:(6-1)①已知N、N1、α、F、x F、q、R不变,若V'减少时,分析D、x D、x W的变化趋势;②已知N、N1、α、F、x F、q、V'不变,若x F下降,能否采取什么措施使x F不降低?通常对类型2,操作条件的变化将引起塔内液,汽流量的改变,并影响塔板效率,若这一影响甚小而能忽略,便可把操作中精馏塔的理论板数视为不变。
第六章蒸馏一、填空题1、蒸馏是用来分离均相液体混合物的单元操作。
2、含乙醇12%(质量百分数)的水溶液,其乙醇的摩尔分率为。
答案:5.07%3、蒸馏操作是借助于液体混合物中各组分的差异而达到分离的目的。
答案:挥发度4、进料板将精馏塔分为和。
答案:精馏段、提馏段5、理想溶液的气液相平衡关系遵循。
答案:拉乌尔定律6、当一定组成的液体混合物在恒这一总压下,加热到某一温度,液体出现第一个气泡,此温度称为该液体在指定总压下的。
答案:泡点温度,简称泡点7、在一定总压下准却气体混合物,当冷却到某一温度,产生第一个液滴,则此温度称为混合物在指定总压下的。
答案:露点温度,简称露点8、理想溶液中各组分的挥发度等于其。
答案:饱和蒸气压9、相对挥发度的大小反映了溶液用蒸馏分离的。
答案:难易程度10、精馏与简单精馏的区别在于。
答案:回流11、在精馏操作中,回流比的操作上限是。
答案:全回流12、在精馏操作中,回流比的操作下限是。
答案:最小回流比13、在工业生产中,塔顶液相回流常采用的方法有、、。
答案:泡点回流、冷液回流、塔顶采用分凝器产生液相回流14、是衡量实际塔板分离效果的标准,实际并不存在。
答案:理论板15、理想溶液是指。
答案:相同分子间作用力与相异分子间作用力相等的溶液。
16、表示物质挥发能力大小的物理量是。
答案:挥发度17、表示进料热状况对理论板数的影响的物理量为。
答案:进料热状况参数18、q值越大,达到分离要求所需的理论板数。
答案:越少19、精馏塔中温度由下而上沿塔高的变化趋势为。
答案:逐渐降低20、当分离要求一定,回流比一定时,在五种进料状况中,进料的q值最大,此时,提馏段操作线与平衡线之间的距离,分离所需的总理论板数。
答案:冷液,最远,最少。
二、选择题1、理想溶液的特点是:相同分子间的作用力()不同分子间作用力。
A:大于 B:等于 C:小于 D:不能确定答案: B2、实验表明,当由两个完全互溶的挥发性组分所组成的理想溶液,其气液平衡关系服从()A:亨利定律 B:费克定律C:拉乌尔定律 D:牛顿粘性定律答案:C 3、双组分理想溶液的t-x-y图中,下方曲线称为()A:饱和蒸气线 B:饱和液体线 C:饱和蒸气压线 D:露点线答案 B 4、关于理论板理列说法错误的是()A:理论板可作为衡量实际塔板分离效率的依据和标准。