(五四制)初中化学 配套练习册 一课一练 九年级下册_61
- 格式:pdf
- 大小:233.01 KB
- 文档页数:2

课题1 金属材料1.铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的()A.导电性B.延展性C.导热性D.抗腐蚀性2.下列关于金属的物理性质,不是铜、铝、铁所共有的是()A.常温下都是固体B.都具有银白色金属光泽C.都是电、热的导体D.都具有延展性3.单质金的性质有:①美丽的光泽;②较好的导电性;③很好的延展性;④很强的耐腐蚀性。
金常被人们加工成饰品是利用金具有的哪些性质()A.①② B.①②④C.①③④ D.①②③④4.目前,南宁市正在进行地铁建设,修建地铁广泛使用金属材料,下列不属于合金的是()A.锰钢B.生铁C.硬铝D.合成材料5.下列关于“合金”的叙述:①合金中至少含有两种金属;②合金中各元素以化合物的形式存在;③合金中一定含有金属;④合金一定是混合物;⑤合金具有金属特征,其中正确的是()A.①B.①②③C.③④D.③④⑤6.下列有关合金说法错误的是()A.钢是一种化合物B.黄铜的硬度比纯铜的硬度大C.生铁是一种铁的合金D.焊锡的熔点比纯锡的熔点低7.下列说法正确的是()A.铝是人类最早利用的金属材料B.铜是目前世界上年产量最高的金属C.大多数金属元素在自然界中以单质形式存在D.日常使用的金属材料大多数是合金8.下列有关金属的说法中,错误的是()A .铜质插头是利用铜的导电性B .钨制灯丝是利用钨的熔点低C .铝制成铝箔是利用铝的延展性D .用铁锅炒菜时利用铁的导热性9.古人曾将铅锻打成细细的铅条,作为笔来写字,这也是“铅笔”名字的由来。
铅条能像铅笔一样写字,这一现象与铅的下列性质有关的是( )A .硬度小B .熔点低C .密度大D .能导电10.不锈钢是人们常用的一种合金钢,有耐腐蚀的重要特性,被广泛应用于制造医疗器械、炊具、装饰材料等。
不锈钢中添加的主要合金元素是( )A .硅B .碳C .铬和镍D .钨11.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
请回答:(1)地壳中含量最高的金属元素是 ; (2)根据图中金属应用实例推断,试说出金属具有的两点物理性质: 、 。

第四节酸碱中和反应一、单选题(共9题,共18分)1.下列数据是一些食物的近似pH,其中呈碱性的是()pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0食物 A.苹果汁 B.葡萄汁 C.牛奶 D.鸡蛋清A.A2.下列应用与中和反应原理无关的是()A.用浓硫酸干燥湿润的氧气B.用熟石灰改良酸性土壤C.服用含氢氧化铝的药物治疗胃酸过多D.用氢氧化钠溶液洗涤石油产品中的残留硫酸3.常温下,一些食物的近似pH如表,其中显碱性的是()食物柠檬汁菠萝汁牛奶鸡蛋清pH 2.1﹣2.8 3.3﹣5.2 6.3﹣6.6 7.6﹣8.0A.柠檬汁B.菠萝汁B.C.牛奶 D.鸡蛋清4.下列应用符合中和反应原理的是()A.用浓H2SO4干燥O2B.用熟石灰改良酸性土壤C.用灼烧的方法区别棉花和羊毛D.用纸盒代替铝制易拉罐盛装饮料5.下列数据为常见水果的近似pH,其中呈碱性的水果是()A.菠萝pH=5.1B.草莓pH=3.1C.苹果pH=4.7D.柿子pH=8.36.实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。
下列有关该实验事实的说法正确的是()A.该实验是将氢氧化钠溶液滴入盐酸中B.B点表示此时液体为纯净物C.A点时的溶液能使酚酞试液变红D.C点时,溶液中的溶质只有氯化氢7.常温下,一些食物的近似pH如表,其中显碱性的是()食物柠檬汁菠萝汁牛奶鸡蛋清pH 2.1﹣2.8 3.3﹣5.2 6.3﹣6.6 7.6﹣8.0A.柠檬汁B.B.C.牛奶 D.鸡蛋清8.盐酸和氢氧化钠溶液混合时,下列有关反应叙述不正确的是()A.等质量等质量分数的氢氧化钠和稀盐酸混合,溶液的pH值一定不等于7B.a克M%氢氧化钠溶液和b克N%稀盐酸恰好完全反应,则a不一定大于bC.氢氧化钠和稀盐酸能发生反应的实质是氢离子和氢氧根离子结合生成了水分子D.氢氧化钠和稀盐酸能发生反应的实质是钠离子和氯离子结合生成了氯化钠二、填空题(共4题;共13分)9.在盛有氢氧化钠溶液的烧杯里滴入几滴酚酞溶液,溶液呈________色,pH________ ;再用________慢慢滴加稀硫酸,同时用________不断搅拌,直到溶液________时,pH________ ,证明酸、碱正好完全反应,这个反应称为________反应。

活动与探究
现欲研究硝酸铵、
变化。
1.请设计具体的实验方案,
2.请将你所设计的方案与以下方案进行比较,
对你的方案进行评价。
(1)取3个烧杯,
水,用温度计测量水的温度。
(2)分别将一药匙硝酸铵、
图6-4 物质溶解时的温度变化
取用时要小心)
物质溶解时的温度变化
温度的变化(与水相比)结论把小烧杯中的溶液倒入指定的容器内。
拓展视野
在生产、生活中常用冰做冷却剂,
一些医疗和研究单位常需要更低的温度,
冷冻混合物。
表
低温度。
表6-4
冷冻混合物的组成
观察与思考
1.在5个烧杯中分别加入一定量的水、酸和稀氢氧化钠溶液,
时,观察实验现象。
在上述实验中,。


部编版人教初中化学九年级下册《全册一课一练基础闯关测试卷(含参考答案与解析)》前言:该试题(卷)由多位一线国家特级教师针对当前最新的热点、考点、重点、难点、知识点,精心编辑而成,以高质量的试题(卷)助力考生查缺补漏,在原有基础上更进一步。
(最新精品测试卷)金属材料一课一练·基础闯关知识点金属材料的发展及应用1.在生产和生活中,使用最多的金属材料是( )A.铁B.铝C.铜D.锌【解析】选A。
生产和生活中,使用最多的金属材料是铁。
2.(2017·宜昌质检)下列各组物质中不属于金属材料的是( )A.铜B.生铁C.硅钢D.金刚石【解析】选D。
金属材料包括纯金属及其合金。
铜是金属单质,属于金属材料;生铁与硅钢是合金,属于金属材料;金刚石是碳单质,不属于金属材料。
3.下列金属的导电性能最好的是( )A.CuB.AlC.FeD.Ag【解析】选D。
在四种金属中导电性能最好的金属是银。
4.人类历史上大量使用铝、钛、铁、铜四种金属的时间先后顺序是( )A.铜、铁、铝、钛B.铁、铝、铜、钛C.铜、铁、钛、铝D.铁、铜、铝、钛【解析】选A。
人类利用最早的金属制品是青铜器,然后进入铁器时代,人类使用铝制品仅有100多年的历史,钛和钛合金是人类在近年来才发现和利用的重要金属材料。
5.(2016·北京中考)铜能被加工成厚度仅为7微米的超薄铜箔,说明铜具有良好的( )A.导电性B.延展性C.导热性D.抗腐蚀性【解析】选B。
铜能够制成超薄铜箔,是因为铜具有良好的延展性。
6.(2017·阜康月考)物质的性质决定物质的用途,下列金属制品的用途与其性质不存在决定关系的是( )【解析】选A。
金属制成电线是因为其导电性;金属做成刀具主要是因为其硬度大;铜做成镜子应该是能映出人影,故应用其金属光泽;金属做成炊具是利用其导热性。
7.下列关于“金属之最”的说法中,正确的是( )A.硬度最大的金属是铁B.目前,世界年产量最高的金属是铝C.导电性最好的金属是钨D.熔点最低的金属是汞【解析】选D。

第三节溶液的酸碱性一、单选题(共10题;共20分)1.常温下,下列物质的水溶液pH<7的是()A.CO2B.KOHC.NH3•H2OD.KCl2.下列数据是一些食物的近似pH,其中呈碱性的是()3.下列为常见水果的pH,酸性最强的是()A.柿子pH=8.5B.菠萝pH=5.1C.苹果pH=4.1D.杨梅pH=2.54.紫甘蓝汁性质稳定,其颜色随pH改变而发生如下变化:A.紫甘蓝汁可用作酸碱指示剂B.将紫甘蓝汁加入到不同碱性溶液中,可能显示出多种颜色C.与石蕊相比,紫甘蓝汁可更准确测定溶液的酸碱度大小D.向滴有紫甘蓝汁的氢氧化钠溶液中加入盐酸,若溶液变色则说明一定恰好完全反应5.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。
各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:A.研磨花瓣过程中加入酒精是为了溶解其中的色素B.25℃时,遇到pH=10的溶液,玫瑰花汁会变成粉红色C.可用雏菊花汁来区别H2SO4和K2SO4溶液D.上述三种花汁都能用作酸碱指示剂6.下图表示的是身边一些物质在常温下的近似pH,有关这些物质的比较和判断正确的是()A.柠檬的酸性比橘子弱B.橘子汁显碱性C.草木灰水的碱性最强D.萝卜显中性7.某同学测得一些物质的pH如图所示,其中显碱性的是()A.苹果汁B.汽水C.酱油D.洗发水8.一些食物近似pH如下表:食物番茄牛奶鸡蛋清苹果汁pH 4.0~4.4 6.3~6.6 7.6~8.0 2.9~3.3A.胃酸过多的人应少食苹果B.番茄汁属于酸性食品C.牛奶和鸡蛋清均为碱性食品D.苹果汁酸性比牛奶强9.pH如下表所示,其中显酸性的是()番茄汁糖水牙膏肥皂水pH 4 7 9 10A.番茄汁B.糖水C.牙膏D.肥皂水10.下列溶液或悬浊液中滴加无色酚酞试液一定变成淡红色的是()A.稀盐酸B.食盐水C.氢氧化钠溶液D.浓肥皂水二、填空题(共4题;共8分)11.根据如表中的信息填空:(1(2)鸡蛋清呈________性。


人教版九年级化学下册一课一练专项练习第八单元金属和金属材料课题1金属材料第1课时几种重要的金属一、金属材料1.金属材料包括__________和它们的__________。
2.(1)金属材料的开发和使用时间:__________(商朝)→__________(春秋)→__________(战国)→__________(一百多年前)(2)目前金属年产量居前三位的分别是__________、铝、铜。
二、金属的物理性质1.共性:常温下,大多数金属都是________,有________,具有优良的________性、________性和________性。
注意:金属光泽只有在金属成块时才能表现出来,金属粉末一般都呈暗灰色。
2.特性(1)大多数金属呈银白色,但铜呈________色,金呈________色。
(2)常温下,绝大多数金属是________体,而________却是液体。
3.金属之最地壳中含量最高的金属元素——铝;目前世界年产量最高的金属——铁;硬度最高的金属——铬;熔点最低的金属——汞;熔点最高的金属——钨;导电、导热性最好的金属——银;密度最大的金属——锇;密度最小的金属——锂;延展性最好的金属——金;人体中含量最高的金属元素——钙。
三、物质性质与用途的关系1.物质的__________在很大程度上决定了物质的用途,但这不是唯一的决定因素。
2.在考虑物质用途时还需要考虑____________、资源、是否____________、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
同时,物质的用途也体现了物质的__________。
第2课时合金一、概念在金属中加热熔合某些____________或____________,得到的具有____________特征的________。
注意:在一种金属表面镀其他金属后,形成的不是合金,因为它们并未熔合。
二、合金的性能合金与组成它们的纯金属相比,一般具有__________、__________、__________等优点,因此日常生活中使用的金属材料大多是__________。

10 某中学的同学自制成一种黄色的花汁ꎬ加入到不同试剂中ꎬ观察到的现象如下:
试剂
稀盐酸食盐水蒸馏水草木灰水石灰水颜色红黄黄绿绿
小强同学依据上表信息进行如下实验ꎬ请回答:
(1)用该花汁去检验附近小化工厂排放废水的酸碱性ꎬ显浅红色ꎬ则此废水显何性?(2)用该花汁测知家中花盆土壤显酸性ꎬ打算加入上表中的什么物质来改良?(3)一段时间后ꎬ家中花盆里的花长得瘦弱叶黄ꎬ准备给它施肥ꎬ施哪类化肥适宜?
11
(1)写出下列步骤中的化学方程式:步骤Ⅰ:
㊀ꎻ步骤Ⅱ:
㊀ꎮ
(2)写出在步骤Ⅲ中所得蓝色晶体的名称㊀㊀㊀㊀㊀㊀㊀ꎮ(3)上述方案中可能造成空气污染的步骤是㊀ꎮ。
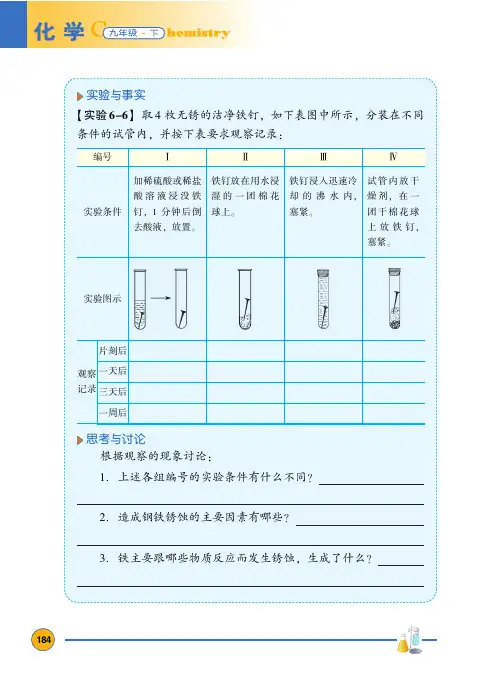
思考与讨论
根据观察的现象讨论上述各组编号的实验条件有什么不同造成钢铁锈蚀的主要因素有哪些铁主要跟哪些物质反应而发生锈蚀生成了什么
Ә金属保护
自然界可提供给人类的金属资源是有限的ꎬ可惜这有限的金属资源却因锈蚀而被消耗掉一部分ꎮ为了社会的可持续发展ꎬ我们应当自觉地保护金属资源ꎮ
那么ꎬ应当从哪些方面去保护金属资源呢?
从资源的采掘与开发方面:有计划㊁合理地开采资源ꎬ严禁不顾国家整体利益非法乱采金属矿产ꎻ积极进行金属代用品的开发研究ꎬ利用具有
特殊性能的塑料去替代金属材料ꎻ
加强废旧金属的回收和再利用等ꎮ
从保护金属材料和制品方面:保护金属材料和制品ꎬ特别是钢铁制品的一个重要措施ꎬ就是防止锈蚀ꎮ防锈的方法主要是用保护层使金属隔绝空气和水分ꎬ可在钢铁制件上涂油㊁喷漆㊁搪瓷ꎬ或镀上一层耐腐蚀的金属ꎬ如锌㊁铜㊁镍和铬等ꎮ
①㊀铁锈主要成分的化学式应为Fe2O3 xH2Oꎬ为简便起见ꎬ初中化学以Fe2O3表示ꎮ。
最新最全人教版九年级化学下一课一练全册精品8金属和金属材料8.1金属材料知识图谱状态:常温下是固体(Hg 除外)色泽:有金属光泽导电性:良好导热性:良好延展性:良好密度:较大熔点:较高与O 2反应(如Mg、Al、Fe 能在氧气中燃烧)与酸反应(条件:活泼金属)①置换反应:A +BC ===B +AC ②金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au与盐溶液反应(条件:强者才能置换弱者)如:Fe +CuSO 4===Cu +FeSO 4用途:(与性质联系)1、定义:在金属中加热熔合某些金属或非金属,就可制得具有金属特征的合金。
生铁:2%—4.3%钢:0.03%—2%3、其它合金:4、性能:比纯金属优越原料:铁矿石CO 化学方程式:3CO +Fe 2O 3======2Fe +3CO 2①CO——早出晚归;酒精灯——迟到早退②最后放一盏酒精灯的作用——除尾气中的CO,防止使人中毒和污染大气有关不纯物质的计算生锈条件:同时与O 2和H 2O 接触物性化性纯金属2、铁合金(含C 量不同)合金金属铁的腐蚀和防护高温金属的利用和保护赤铁矿(Fe 2O 3)磁铁矿(Fe 3O 4)注意事项铁的冶炼:(CO 还原)铁锈化学式:Fe 2O 3·xH 2O 铁的保护措施:金属资源保护措施:(4个)金属回收的好处(2个)1.几种重要的金属(1)最常用的几种金属是铁、铝、铜以及它们的合金。
(2)我国劳动人民在夏、商时期就开始使用青铜器,春秋战国时期开始冶铁和冶钢,西汉时期发明了“湿法冶铜”技术。
(其化学方程式为44CuSO Fe Cu FeSO +=+)2.金属的物理性质(1)金属的共性:金属在常温下除了汞是液体之外,其余都是固体;有金属光泽;大多数是电和热的良导体;有延展性;密度较大;熔点较高。
(2)金属的特性:金属除具有上述共性以外,还有各自的特性。