青浦区2017学年高三年级第二次学业质量调研测试高三化学(二模)
- 格式:docx
- 大小:121.82 KB
- 文档页数:9

青浦区2016学年高三年级第二次学业质量调研测试化学试卷Q2017.4 相对原子质量:H-1 C-12 O-16 S-32一、选择题(本题共40分,每小题2分,每题只有一个正确选项。
)1. 海水中含量最多的卤素是()A. 氟B. 氯C. 溴D. 碘2. 下列一定属于纯净物的是()A. 不锈钢B. 铝热剂C. 液氨D. 漂粉精3. 将两种互不相溶的液体分离的方法是()A. 分液B. 结晶C. 纸层析D. 过滤4. 既能和盐酸反应,又能和氢氧化钠溶液反应的物质是()A. FeB. Fe2O3C. AlD. AlCl35. 有关HF和HCl判断正确的是()A. 键长:HF HClB. 键能:HF HClC. 稳定性:HCl HFD. 共用电子对偏移程度:HCl HF6. 可用来鉴别乙醇、乙醛的试剂是()A. 银氨溶液B. 乙酸溶液C. 氯化铁溶液D. 氢氧化钠溶液7. 下列化工生产涉及的变化主要是物理变化的是()A. 煤的干馏B. 石油的分馏C. 石油的裂化D. 石油的裂解8. 按照有机物的命名规则,下列命名正确的是()A. 1,2-二甲基戊烷B. 2-乙基丁烷C. 3-乙基己烷D. 3,4-二甲基戊烷9. 能说明二氧化硫具有还原性的事实是()A. 使品红溶液褪色B. 使溴水褪色C. 与氢硫酸反应D. 与烧碱反应10. 一定条件下,通过单质间化合可得到的是()A. FeCl3B. SO3C. Al(OH)3D. HClO11. 下列物质的工业生产原理不涉及氧化还原反应的是( )A. 烧碱B. 纯碱C. 硫酸D. 液溴12. 研究电化学腐蚀及防护的装置如右图所示。
下列有关说法正确的是( ) A. 锌片发生氧化反应作阴极 B. 电子从铁片经过导线流向锌片C. 铁片上电极反应为:O 2+2H 2O+4e →4OH -D. 该装置用于防护铁的方法叫作外加电流阴极保护法13. 在密闭容器中,反应2X(g)Y(g)3Z(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( ) A. 正()v 减小,逆()v 增大 B. 正()v 增大,逆()v 减小C. 正()v 、逆()v 都减小D. 正()v 、逆()v 都增大14. 布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( ) A. 布洛芬的分子式为C 13H 18O 2 B. 布洛芬与苯乙酸是同系物C. 1mol 布洛芬最多能与3mol 氢气发生加成反应D. 布洛芬在苯环上发生取代反应,其一氯代物有4种15. 配制一定物质的量浓度的NaOH 溶液时,下列因素会导致溶液浓度偏高的是( ) A. 溶解时有少量液体溅出 B. 洗涤液未全部转移到容量瓶中C. 容量瓶使用前未干燥D. 定容时液面未到刻度线16. 下列离子在溶液中能大量共存的是( ) A. H +、AlO 2-、CO 32- B. K +、Ba 2+、SO 42-C. NH 4+、OH -、NO 3-D. Fe 3+、NO 3-、Cl -17. 右图是H 2(g)与I 2(g)反应生成HI(g)的能量示意图,由图可知( )A. 该反应是吸热反应B. 1mol HI(g)分解吸收的热量为QC. 反应物总能量高于生成物总能量D. 1mol H 2和1mol I 2反应放出的热量为Q18. 25℃时,将100mL 质量分数为50%(密度1.4g/mL )的硫酸稀释成1000mL ,下列说法正确的是( ) A. 纯硫酸的摩尔质量为98B. 上述1000mL 稀硫酸中含溶质140gCH CH 3COOHCH 2CH CH 3CH 3C. 上述稀释过程所需要的蒸馏水为900mLD. 质量分数为50%的硫酸物质的量浓度为7.14mol/L19. 溶质都为1mol 的NaHCO 3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是( ) A. 2233CO Ba BaCO B. 2323HCO OH H O CO C. 2323HCO Ba OH H OBaCOD. 2233232HCO Ba 2OHBaCO 2H OCO20. 工业上常用NaHSO 3处理含227Cr O 的废液,反应的离子方程式为:232273425HCr O 3HSO 2Cr 3SO 4H O 。

2017上海各区二模化学习题答案详解6一、2017年上海市嘉定区二模卷答案详解44 Na2OH+H2SO4==Na2SO4+H2OA 对Na2OH+CuSO4== Na2SO4+Cu(OH)2↓B 错误BaCl2+ H2SO4==BaSO4↓+2HCl, BaCl2+ Na2SO4== BaSO4↓+2NaCl H2SO4和Na2SO4都能与BaCl2反应生成白色沉淀C 对氢前金属与酸反应生成氢气D 对酚酞遇碱变红45 氢氧化钠变质的方程式2NaOH+CO2==Na2CO3+H2O1)对Na2CO3+2HCl==2NaCl+CO2↑,CO2+Ca(OH)2==CaCO3↓+H2O 能检验是否变质2)错Na2CO3+Ca(OH)2== CaCO3↓+2NaOH, 滤液中存在反应后生成的NaOH,加酚酞只能显示滤液呈碱性,不能说明样品里是否含有NaOH,有可能存在完全变质的情况,而这种方法不能确定成分。
3)错Na2CO3+2HCl==2NaCl+CO2↑+H2O,NaOH+HCl==NaCl+H2O 因为氢氧化钠固体能吸收水和CO2气体,导致反应后的CO2质量测量不准确,无法测定纯度。
4)对,Na2CO3+Ca(OH)2== CaCO3↓+2NaOH,反应后得到NaOH,故滤掉固体得到纯净的NaOH。
答案 D(14)46 A 错,锌与足量盐酸反应完之后质量应该为零,图中不为0B 错误,Cu+2AgNO3==Cu(NO3)2+2Ag, 1mol的铜质量为63.5克,生成2mol的银质量为216克,因此固体质量是逐渐增加的,与图相反。
C正确Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑2mol稀盐酸,需要24克镁,65克锌,镁的活性强,产生氢气的速度更快。
D 错误,2KClO3=MnO2=2KCl+3O2↑反应时氯酸钾不断消耗,固体质量不断减少,而锰元素的质量不变,所以质量分数反而慢慢变大。


青浦区2017学年高三年级第二次学业质量调研测试物理试卷(时间60分钟,满分100分)2018.04全卷包括三大题,第一大题为单项选择题,第二大题为填空题,第三大题综合题。
一、单项选择题(共40分,1到8题每小题3分,9到12题每小题4分)1.下列物理量中,属于标量的是()A.电流强度B.电场强度C.磁感应强度D.引力场强度(即重力加速度)2.下列四种电磁波中,最容易表现衍射现象的是()A.红外线B.紫外线C.无线电波D.γ射线3.下列论述中,能够揭示原子核有复杂结构的是()A.卢瑟福通过α粒子散射实验建立原子核式结构模型B.汤姆孙发现了电子C.贝克勒尔发现天然放射性现象D.伦琴发现X射线4.某单色光照射某金属时不能产生光电效应,下列措施中可能使该金属产生光电效应的是()A.延长光照时间B.增大光的强度C.换用频率较低的光照射D.换用波长较短的光照射5.一个物体静止在斜面上时,正确表示斜面对物体作用力F方向的是图中的()6.如图所示,O是水面上一波源,实线和虚线分别表示某时刻的波峰和波谷,A是挡板,B是小孔。
若不考虑波的反射因素,则经过足够长的时间后,水面上的波将分布于()A.整个区域B.阴影Ⅰ以外区域C.阴影Ⅱ以外区域D.阴影II和III以外的区域7.如图所示,一定质量的理想气体由状态A变化到状态B,则A、B 两个状态的密度相比()A.气体密度减小B.气体密度不变C.气体密度增大D.气体密度先增大后减小ⅠⅡⅢABOPT 0AB8.如图甲所示直线是一条电场线,A 、B 是该线上的两点。
一正电荷由A 点以一定初速度沿电场线从A 运动到B ,运动过程中的v -t 图线如图乙所示,则下列说法中正确的是( )A .该电场是非匀强电场B .A 、B 两点的电势相比一定是φA <φBC .A 、B 两点的场强大小相比一定是E A <E BD .该电荷在两点的电势能大小相比一定是E pA >E pB 9.雨滴从高空静止下落,受到的空气阻力随雨滴速度的增大而增大,则下落过程中雨滴的速度随时间变化的规律是( )10.如图所示的电路,电池内阻不计,当R 2的滑动触头P 由a 端向b 端滑动过程中,电流表示数A 和电压表示数V 将( )A . V 不变, A 变大B . V 不变, A 变小C . V 变小, A 变大D . V 变小, A 变小11.在同一平面上有a 、b 、c 三根等间距平行放置的长直导线,依次载有电流强度大小为1A 、2A 和3A 的电流,各电流的方向如图所示,则导线b 所受的合力方向是( )A .水平向左B .水平向右C .垂直纸面向外D .垂直纸面向里12.如图所示,A 是一均匀小球,B 是个1/4圆弧形滑块,最初A 、B 相切于小球的最低点,一切摩擦均不计。
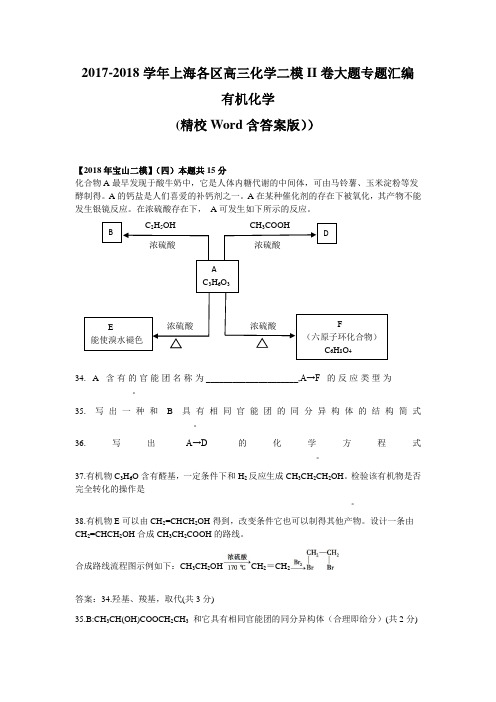
B DAC3H6O3E能使溴水褪色F(六原子环化合物)C6H8O42017-2018学年上海各区高三化学二模II卷大题专题汇编有机化学(精校Word含答案版))【2018年宝山二模】(四)本题共15分化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。
A的钙盐是人们喜爱的补钙剂之一。
A在某种催化剂的存在下被氧化,其产物不能发生银镜反应。
在浓硫酸存在下,A可发生如下所示的反应。
C2H5OH CH3COOH浓硫酸浓硫酸浓硫酸浓硫酸34. A含有的官能团名称为_____________________,A→F的反应类型为____-_____________。
35. 写出一种和B具有相同官能团的同分异构体的结构简式___________________________。
36.写出A→D的化学方程式_______________________________________________________。
37.有机物C3H6O含有醛基,一定条件下和H2反应生成CH3CH2CH2OH。
检验该有机物是否完全转化的操作是_______________________________________________________________。
38.有机物E可以由CH2=CHCH2OH得到,改变条件它也可以制得其他产物。
设计一条由CH2=CHCH2OH合成CH3CH2COOH的路线。
合成路线流程图示例如下:CH3CH2OH CH2=CH2答案:34.羟基、羧基,取代(共3分)35.B:CH3CH(OH)COOCH2CH3和它具有相同官能团的同分异构体(合理即给分)(共2分)浓硫酸36. CH3CH(OH)COOH+CH3COOH →CH3CH(COOH)OOCCH3+H2O (共3分)37.取样,加入新制氢氧化铜,煮沸,观察是否有砖红色沉淀生成,若有砖红色沉淀生成,则未全部转化;若没有砖红色沉淀生成,则已全部转化。

2017年高三二模汇编-选择部分有机选择1. (17年浦东新区二模)实验室制备乙酸乙酯和乙酸丁酯采用的相同措施是()A .水浴加热B .冷凝回流C .用浓硫酸做脱水剂和催化剂D .乙酸过量【难度】★ 【答案】C2. (17年长宁、金山二模)6.下列化工生产涉及的变化主要是物理变化的是 ()A .煤的干馏B .石油的分馏C .石油的裂化D .石油的裂解【难度】★ 【答案】B3. (17年长宁、金山二模)7.按照有机物的命名规则,下列命名正确的是 ()A .1,2-二甲基戊烷B .2-乙基丁烷C .3-乙基己烷D .3,4-二甲基戊烷【难度】★ 【答案】C4. (17年长宁、金山、青浦、宝山二模)14.布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是()A .布洛芬的分子式为C 13H 18O 2B .布洛芬与苯乙酸是同系物C .1mol 布洛芬最多能与3mol 氢气发生加成反应D .布洛芬在苯环上发生取代反应,其一氯代物有4种 【难度】★★ 【答案】D5. (17年杨浦二模)6.烷烃命名中常使用三套数字,甲、乙、丙……,1、2、3……,一、二、三……。
其中“一、二、三……”是说明 ( )A .碳原子数B .烷基位置编号C .氢原子数D .同种烷基数目【难度】★ 【答案】D6. (17年杨浦二模)16.在加热条件下,乙醇转化为有机物R 的过程如图所示,其中错误的是()A .R 的化学式为C 2H 4OCH CH 3COOHCH 2CH CH 3CH3B.乙醇发生了还原反应C.反应过程中固体有红黑交替变化的现象D.乙二醇(HO-CH2-CH2-OH)也能发生类似反应【难度】★★【答案】B7.(17年徐汇二模)2.我国油气资源匮乏而煤储量相对丰富。
将煤转化为水煤气(CO、H2),不可能产生的效果是()A.得到相对清洁的能源B.提高了能源利用率C.增加了单位质量煤的热值D.便于管道输送【难度】★【答案】C8.(17年徐汇二模)3.以下化石能源的加工方式能大量得到乙烯的是()A.石油裂解B.石油裂C.石油分馏D.煤焦油分馏【难度】★【答案】A9.(17年徐汇二模)5.右图是一种有机物的模型,该模型代表的有机物可能是()A.饱和一元醇B.羟基酸C.羧酸酯D.饱和一元醛【难度】★【答案】B10.(17年徐汇二模)9.黄酒酿造过程中有部分乙醇最终转化为具有芳香气味的物质,该过程中发生的反应有()A.还原反应B.氧化反应C.加成反应D.聚合反应【难度】★【答案】B11.(17年松江二模)乙醇转化为乙醛,发生的反应为()A.取代反应B.加成反应C.消除反应D.氧化反应【难度】★【答案】D12.(17年松江二模)催化加氢可生成3-甲基戊烷的是()【难度】★【答案】C13.(17年松江二模)莽草酸结构简式如图,有关说法正确的是()A.分子中含有2种官能团B.1mol莽草酸与Na反应最多生成4mol氢气C.可与乙醇、乙酸反应,且反应类型相同D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同【难度】★★【答案】C14.(17年青浦二模)8.按照有机物的命名规则,下列命名正确的是()A.1,2-二甲基戊烷B.2-乙基丁烷C.3-乙基己烷D.3,4-二甲基戊烷【难度】★【答案】C15.(17年普陀二模)分子式为C n H2n+1Cl(n>1)的卤代烃不能发生消去反应,n的最小值是()A.3 B.4 C.5 D.6【难度】★【答案】C16.(17年普陀二模)14.山梨酸(CH3-CH=CH-CH=CH-COOH)是一种高效安全的防腐保鲜剂。
2017上海各区二模化学习题答案详解2一、2017年上海市黄浦区区二模卷答案详解44 A 错,CO2+2NaOH== Na2C03+H2O(本题NaOH足量,微量是生成NaHCO3),没有明显现象,所以不能检测。
B 对,水里气泡的多少反应了氧气流速的快慢C 错,氢氧化钙能除去CO2,不是CO。
D 错,酚酞试剂遇酸不变色,在中性溶液中也不变色,所以不能证明。
45 2NaOH+H2SO4== Na2SO4+2H2O2 1X a2/X=1/a X=2a 与图一致,所以是A.另:看图应该是物质的量,所以BD错。
烧杯中除了反应生成的水,还有溶液中的溶剂水,溶剂质量不可知,无从判断水的物质的量,所以C也错。
答案A46 A 错,除了酸碱中和反应生成盐和水,酸+碱性氧化物→盐+水例如3H2SO4+Fe2O3=Fe2(SO4)3+3H2O 。
B 错,置换反应:单质+化合物==新单质+新化合物,若C、D分别为单质和化合物,则该反应不一定是置换反应,如一氧化碳还原氧化铁3CO+Fe2O3==2Fe+3CO2C 错,例如Fe+2AgNO3==Fe(NO3)2+2Ag 1mol的铁质量是27克,能与硝酸银反应置换2mol的Ag,质量为216克,正好相反a<cD 对,金属与盐酸反应,生成氢气和盐,氢气的质量远远小于金属,根据质量守恒,反应后的盐溶液质量一定增加。
49 1) C2)碳酸钙,钠盐都可溶,氯化盐仅氯化银不可溶,硫酸铜也可溶,只有碳酸钙不可溶;硫酸钠与氯化钡反应生成硫酸钡是白色沉淀(Na2SO4+BaCl2==BaSO4↓+2NaCl),但BaSO4不能与稀盐酸反应(酸的通性里,除了碳酸盐,能与酸反应的盐必须可溶,BaSO4不溶,且反应无法产生↓↑和水),沉淀不会消失变成无色溶液I,因此不存在Na2SO4。
3) 2NaOH+CO2==Na2CO3+H2O ,BaCl2+Na2CO3==BaCO3↓+2NaCl4) 硫酸铜溶液是蓝色,不符合题意,故不存在,答案:碳酸钙、氢氧化钠、氯化钡2)步骤I 金属活动性Zn>Fe>Cu , 过量铁能置换出所有的铜Fe+CuSO4==FeSO4+Cu 所以,滤渣里含有C溶质为FeSO4、ZnSO43)步骤II是铁与硫酸反应产生氢气直到气泡完全消失,反应结束。
2- +河南省郑州、平顶山、濮阳市 2017 届高三第二次质量预测(二模)理科综合试题化学试卷可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Cu-64第 I 卷—、选择题:本大题共 13 小题,每小题 6 分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学渗透在生活、生产中的各个方面。
下列有关说法正确的是( )A .碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群B .化石燃料不完全燃烧会产生C O 造成污染,完全燃烧不会造成大气污染C .利用铁比铜金属性强的性质,常用 F eCl 溶液腐蚀 Cu 来刻制印刷电路板3D .中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性2.傅克反应是合成芳香族化合物的一种重要方法。
有机物 a 和苯通过傅克反应合成 b 的过程表示如下(无机 小分子产物略去):下列说法中不正确的是( )A .该反应是取代反应B .若 R 为 CH 时,a 的电子式为3C .若 R 为 C H 时,b 的结构可能有 4 种49D .若 R 为 C H O 时,1 mol b 最多可与 5 mol H 加成42 23.X 、Y 、Z 是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为 15;X 、Y 、Z 三种元素的常见单质在适当条件下可发生右下图转化关系,其中 R 为 10 电子分子,是一种常见的无 机溶剂。
下列说法中不正确的是( )A .X 元素位于周期表中第 16 列B .X 、Y 、Z 元素两两之间均能形成原子个数比为 1:1 的化合物C .X 、Y 、Z 元素形成的单质均具有强还原性D .R 的沸点高于 M 的沸点4 .已知 K CrO 溶液中存在平衡:227Cr O (橙色) H O 2 7 22CrO 42- (黄色)+2H + 保持温度不变,用K Cr O 溶液进行下列实验:22 7得原溶液中 n Mg 2+ :n Al 3+ :n NH 4+ = 10:: (结合实验,下列说法正确的是( )A .①中溶液变黄,③中溶液橙色加深B .上述可逆反应的平衡常数:①<③C . K Cr O 溶液的氧化性在酸性条件下更强227D .若向④中加入 70% H SO 溶液至过量,溶液变为橙色245.下列关于甲、乙、丙、丁四个图像的说法中,不正确的是()A .若图甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能B .图乙表示在含 Mg 2+、A13+、NH +、Cl - 的溶液中,加入一定浓度 NaOH 溶液时生成沉淀的图像,由图可() ( ) ()2 3C .图丙表示 MOH 和ROH 两种一元碱的溶液分别加水稀释时的 pH 变化,由图可得碱性: R OH>MOHD .图丁表示某温度时, BaSO 在水中的沉淀溶解平衡曲线,则加入 Na SO 可以使溶液由 a 点变到 b 点42 46.太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用。
青浦区2017学年高三年级第二次学业质量调研测试化学学科试卷(时间60分钟,满分100分)Q2018.04考生注意:1.本考试设试卷和答题纸两部分,所有答题必须涂或写在答题纸上;做在试卷上一律不得分。
2.答题前,考生务必在答题纸上用钢笔或圆珠笔在答题纸正面清楚地填写姓名、准考证号。
3.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH3COOH CH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H2O HS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A .苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B .乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键C .乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同D .乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L -1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH -C.石墨上有Cl 2 放出D. 铁棒上有H 2放出 9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液 10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 4 12.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚 13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH CH 2=CH 2↑+H 2OB.工业合成盐酸:H 2 + Cl 2 2HClC. 工业获取氯化钠:2Na + Cl 2 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O 14.右图是可逆反应A+2B2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是 A .正反应是放热反应 B .A 、B 一定都是气体C .D 一定不是气体 D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H+ + CO3- → H2O+CO2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。
2017上海各区二模化学习题答案详解1一、2017年上海市闵行区二模卷答案详解41 A错,锌和铁都是氢前金属,都能与酸反应产生氢气,无法比较2者活动性强弱。
应该用一种金属与含另一种金属的盐的置换反应来证明。
B 错,H2O2溶液是浓度不同,不能比,变量只能有1个C 错,溶质、溶剂都不同,不能比D 正确,浓盐酸有挥发性,能使石蕊试剂变红42 NaOH变质CO2+NaOH==Na2CO3+H2OA 正确,CO2不能Na2CO3反应,无法证明B 错Na2CO3+Ca(OH)2==CaCO3↓+2NaOH,有白色沉淀C 错Na2CO3+BaCl2==BaCO3↓+NaCl,有白色沉淀D 错CaCO3+2HCl==CaCl2+H2O+CO2↑有气泡产生44 除去杂质的要点:⑴选择的试剂不能与需要提纯的物质反应⑵试剂与杂质反应的产物可以是需要提纯的物质,也可以是新物质(必须是↑↓H2O),不能是可溶性的新物质A错,铁丝在含氧量太少的氮气中无法燃烧,不能除去O2B错,H2O+CaO==Ca(OH)2,选择的试剂与需要提纯的物质反应了C正确,Cu(NO3)2不与Cu反应,Cu+2AgNO3== Cu (NO3)2+2Ag,铜能置换硝酸银中的银,生成物恰好是Cu (NO3)2D错,KNO3不能与CuSO4反应(无↑↓H2O产生),CuSO4+2KOH ==K2SO4+Cu(OH)2↓Cu(OH)2↓可过滤,但引入了新的杂质K2SO445 CaCO3=煅烧= CaO+CO2↑1 1 1100g/100g/mol=1mol m Cao=1*(40+16)=56g<78g所以有部分CaCO3未完全分解成CaO,CO2,这部分CaCO3与稀盐酸反应生成了CO2 CaCO3=煅烧= CaO+CO2↑CaCO3+2HCl==CaCl2+H2O+CO2↑X X Y Y设Xmol的CaCO3分解,生成Xmol CO2;Y mol的CaCO3与酸反应生成Ymol CO2 X+Y=1mol 所以共生成1 mol CO2 答案:DA 正确,Zn (NO3)2,Cu (NO3)2不与稀盐酸反应,NaCl+AgNO3==AgCl↓+NaNO3,所以是上表5的情况,固体是AgB 正确,溶液甲是蓝色,说明含有,Cu (NO3)2,上表345都符合,一定有Ag,3有CuC正确,固体乙有Ag Cu Zn,是上表1,溶液是Zn (NO3)2D错误,氢前金属与稀盐酸反应生成氢气,说明固体乙一定含Zn,符合上表1情况,此时溶液甲中只有Zn (NO3)2,不符合47①根据物质分类,甲橱放非金属单质,所以放甲橱。
青浦区2017学年高三年级第二次学业质量调研测试化学学科试卷Q2018.04相对原子质量:H-1 C-12 N-14 O-16 Na-23一、选择题(本题共40分,每小题2分,每题只有一个正确选项)。
1.下列物质属于混合物的是A. 冰醋酸B. 石油裂解气C. 硫磺D.酒精2.干冰气化时,发生变化的是A. 分子间作用力B. 分子内共价键C. 分子的大小D. 分子的化学性质3.为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须A.除去铁锈B. 用盐酸清洗C. 彻底干燥D. 加点铁粉4.下列烷烃命名错误的是A.2─甲基戊烷B.3─乙基戊烷C.3,4─二甲基戊烷D.3─甲基己烷5.下列物质溶于水时会破坏水的电离平衡,且属于电解质的是A.氯气B.二氧化碳C.氯化钾D.醋酸钠6.下列变化过程中Q>0的是A.CH 3COOH CH3COO-+ H+ + QB. CaCO3(s)→ CaO(s)+ CO2(g)+ QC.S2- + H 2O HS- + OH- + QD.S(g)→S(l)+ Q7.下列有关有机物结构、性质的分析正确的是A .苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色B .乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键C .乙醇、乙酸均能与 Na 反应放出 H 2 ,二者分子中官能团相同D .乙醇在铜催化作用下,能发生还原反应生成乙醛8.铁棒与石墨用导线连接后,浸入0.01mol·L -1的食盐溶液中(如右图所示),下列说法正确的是A.铁棒是阴极B. 石墨附近产生OH -C.石墨上有Cl 2 放出D. 铁棒上有H 2放出9.下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是A .观察颜色B .加热C .加水D .加紫色石蕊试液10.标准状况下的1mol N 2和1mol 13C 2H 2,下列叙述错误的是A. 质量相等B. 体积相等C. 质子数相等D.共用电子对数目相等11.下列变化不能通过一步反应直接完成的是A.Na→Na 2O 2B.C→CO 2C.S→SO 3 D .Fe→Fe 3O 412.测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的A. 蒸发皿B.研钵C. 干燥器D.坩埚13.与实际化工生产功能相符合的化学方程式是A. 工业制取乙烯: C 2H 5OH 170−−−→浓硫酸℃CH 2=CH 2↑+H 2O B. 工业合成盐酸:H 2 + Cl 2 −−−→光照 2HClC. 工业获取氯化钠:2Na + Cl 2 −−−→点燃 2NaClD. 工业制漂粉精:2Ca(OH)2+2Cl 2 → Ca(ClO)2+CaCl 2+2H 2O14.右图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A .正反应是放热反应B .A 、B 一定都是气体C .D 一定不是气体D .C 可能是气体15.下列物质之间进行反应时,可用离子方程式2H + + CO 3- → H 2O+CO 2 ↑表示的是A. 碳酸钠溶液中加入足量醋酸溶液B.碳酸钡和稀硝酸反应C. 碳酸氢钠溶液中加入少量稀硫酸D.在盐酸溶液中滴入少量碳酸钾溶液16.将二氧化硫气体通入KIO 3淀粉溶液,溶液先变蓝后褪色。
此过程中二氧化硫表现出A. 酸性B. 还原性C. 氧化性D. 漂白性17.常温下,若HA 溶液和NaOH 溶液混合后pH=7,下列说法错误的是A .反应后HA 溶液可能有剩余B .HA 溶液和NaOH 溶液的体积可能相等C .溶液中c(Na +)>c( A —)D .HA 溶液的c (H +)和NaOH 溶液的c (OH -)可能不相等18.根据相关化学原理,下列判断正确的是:A .若R和M 的电子层结构相同,则原子序数: M > R B .若R 和M 的电子层结构相同,则离子半径:M >RC .若X 是原子晶体,Y 是分子晶体,则熔点:Y >XD .若A 2+2D —→2A -+D 2,则氧化性:D —>A --2+-2++-219.下列各组离子,能在同种溶液中大量共存的是A、NH4+、Na+、OH-、SO42-B、NH4+、Mg2+NO3- Cl-C、Ba2+OH-Cl-SO42-D、Fe2 + H+ Cl- NO3-20.在0.1 mol/L Na2CO3溶液中,微粒间浓度关系正确的是A.[Na+] + [H+]=[OH—] + [HCO3—] + [CO32—]B.[Na+]>[CO32—]>[HCO3—]>[OH—]C.[Na+]=2[CO32—] + 2[HCO3—] + 2[H2CO3]D.[Na+]>[HCO3—]>[CO32—]>[OH—]二、综合题(一)本题共16分研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
7N2 + 12 H2O处理NO2。
I. 利用反应:6NO2 + 8NHII. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)3(g)+NO(g) −Q(Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g)CH3OH(g) 。
21.硫离子最外层电子的电子排布式为__________________,氨气分子的电子式为___________,氨气分子属于___________分子(填“极性”或者“非极性”)。
22.C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是()a、最高价氧化物对应水化物的酸性b、气态氢化物的沸点c、单质与氢气反应的难易程度d、其两两组合形成的化合物中元素的化合价23. 对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_______________。
24. 对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________a. 体系压强保持不变b. NO2浓度保持不变c. NO2和SO3的体积比保持不变d. 混合气体的平均相对分子质量保持不变25. 请写出II中反应的平衡常数表达式K=_____________________________________如果II中反应的平衡常数K值变大,该反应___________a.一定向正反应方向移动b. 平衡移动时,正反应速率先减小后增大c.一定向逆反应方向移动d. 平衡移动时,逆反应速率先增大后减小压强的关系如右图示。
实际生产条件控制在250℃、1.3×104kPa左右,简述选择此压强的理由:___________________________________________________________________。
(二)本题共14分海洋是资源的宝库,含有丰富的化学元素。
27.在电解饱和食盐水的实验中,阳极产物的检验方法是_________________________________________________________________________________________________________。
28. 目前从海水中提溴(Br 2)大致有以下步骤。
(1)向浓缩的海水中通入Cl2,将海水中的Br-氧化为Br2。
(2)用热空气将Br 2从上述溶液中吹出,并由浓Na 2 CO 3 溶液吸收,转变为NaBr、NaBrO 3和CO2。
吸收1 moL Br 2需消耗Na 2 CO 3 ________moL。
(3)再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
____Br— +____ BrO3— +____H +→____ Br2 +____H 2 O29.碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是:________________________________________________________。
30.同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为˃。
NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-) (填变大或变小),请用平衡理论解释发生这种变化的原因。
(三)本题共15分联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:31.两种方法的沉淀池中均发生的反应化学方程式为______________________________。
32.X是,Y是(填化学式)。
33.Z中除了溶解的氨气、食盐外,其它溶质还有;排出液中的溶质除了氢氧化钙外,还有。
34.根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是。
a.常温时氯化铵的溶解度比氯化钠小b.通入氨气能增大NH4+的浓度,使氯化铵更多析出c.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出35.为检验产品碳酸钠中是否含有氯化钠,请设计实验方案。
36.联碱法中,每当通入NH 3 22.4L (已折合成标准状况下)时可以得到纯碱50.0g ,则NH 3的利用率为 。
(结果精确到0.01)(四)本题共15分有机物E 是医药合成中间体。
其合成路线如下:37. 的官能团名称为_____________。
E 的分子式为 。
38. B→D 的过程中,B 分子的羧基全部酯化,写出该反应方程式:。
39.D→E 的反应历程如下:写出反应Ⅱ、Ⅲ的反应类型:Ⅱ 、Ⅲ40.写出满足下列条件的A 的所有同分异构体的结构简式 。
a .能与新制氢氧化铜悬浊液反应产生砖红色沉淀b .常温下能与Na 2CO 3反应并释放出气体41.请写出以CH 2=CH 2为主要原料(无机试剂任用)制备OHC —CHO (乙二醛)的合成路线流程图(须注明反应条件)。
(合成路线常用的表示方式为:A −−−−→反应试剂反应条件B……−−−−→反应试剂反应条件目标产物)参考答案一、选择题(一)本题共16分21. 3s23p6(1分);(1分);极性(1分)22. O>N>C (1分);D (2分)23.0.015mol/(L·min) (3分)24.b c (2分)25 .[SO3][NO]/[NO2] [SO2] (1分);a(2分)26.在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
(2分)(二)本题共14分27.湿润的淀粉碘化钾试纸变蓝(2分)28.1mol (2分);5 1 6 3 3 (2分)29.单质碘在四氯化碳中的溶解度大于在水中的溶解度;四氯化碳与水互不相容,存在较大的密度差;碘与四氯化碳不反应(2分)。