层状双氢氧化物即时合成处理含Cr_废水
- 格式:pdf
- 大小:130.21 KB
- 文档页数:5

含铬废水处理方案一、背景介绍含铬废水是指工业生产过程中产生的含有铬离子的废水。
铬是一种常见的重金属元素,其存在于许多工业领域的废水中,如电镀、皮革加工、纺织印染等行业。
高浓度的铬离子对环境和人体健康都具有严重的危害性,因此,对含铬废水进行有效处理是十分必要的。
二、目标本方案的目标是设计一种高效、经济、环保的含铬废水处理方案,以实现废水中铬离子的去除,达到国家相关标准要求,确保废水排放符合环保要求。
三、处理工艺本方案采用以下处理工艺来处理含铬废水:1. 预处理首先,对含铬废水进行预处理,包括沉淀、调节pH值等步骤,以去除废水中的悬浮物和调节废水的酸碱度,为后续处理工艺创造良好的条件。
2. 化学沉淀法采用化学沉淀法是一种常见的处理含铬废水的方法。
通过添加适量的沉淀剂,如氢氧化钙、氢氧化铁等,使废水中的铬离子与沉淀剂发生反应生成不溶性的沉淀物,从而实现铬离子的去除。
3. 离子交换法离子交换法是一种有效的去除废水中重金属离子的方法。
通过将废水通过含有离子交换树脂的柱子,离子交换树脂上的功能基团与废水中的铬离子发生吸附反应,从而将铬离子从废水中去除。
4. 膜分离法膜分离法是一种基于膜的物质分离技术,可以有效去除废水中的有机物、重金属等。
通过选择合适的膜材料和膜分离工艺,将废水中的铬离子从其他溶质中分离出来,达到去除的目的。
5. 活性炭吸附法活性炭吸附法是一种常用的废水处理方法,适合于去除废水中的有机物和重金属离子。
通过将废水与活性炭接触,活性炭表面的孔隙吸附废水中的铬离子,从而实现去除的效果。
四、处理效果及控制要求1. 处理效果要求:a. 废水中铬离子的去除率达到90%以上。
b. 处理后的废水中铬离子浓度不超过国家相关标准要求。
2. 控制要求:a. 废水处理过程中,严格控制废水的pH值,避免对处理设备和环境造成伤害。
b. 废水处理过程中,监测废水中的悬浮物、有机物等指标,确保处理效果稳定可靠。
c. 废水处理过程中,定期清洗和更换处理设备,保证设备的正常运行和处理效果。


层状双氢氧化物基复合材料的制备及其电化学性能的研究The Construction of Layered Double Hydroxides-Based Hybrid Materials for Electrochemical ApplicationAbstractTwo-dimensional (2D) materials have attracted increasing interest in electrochemical energy storage andconversion. As typical 2D materials, layered double hydroxides (LDHs) display large potential in this areadue to the facile adjustableof their composition, structure and morphology. Various preparationstrategies, including in situ growth, electrodeposition and layer-by-layer (LBL) assembly, have beendeveloped to directly modify electrodes by using LDHs materials. Moreover, several composite materialsbased on LDHs and conductive matrices have also been rationally designed and employed in supercapacitors, batteries and electrocatalysis with largely enhanced performances.This paper focus on the construction of LDHs-based composites and its application in electrocatalytic hydrolysis and electrochemical energy storage carried out in a series of trial and research.The controllable synthesis of LDHs-based composites was realized by the method of multi-step hydrothermal process and liquid phase self-assembly. As a result, the electrochemical performance was enhanced.The main contents of this paper are as following:(1) Study on the construction of NiFe LDH@NiCo2O4 compositesHerein, for the first time, we demonstrate NiFe-LDH ultrathin sheets with several atomic layers grown on nickel cobalt oxide (NiCo2O4) nanowire arrays as an efficient bifunctionalcatalyst toward both HER and OER reaction. Nickel (Ni) foam was used as the electrode scaffold support because of its earth abundance and porous three-dimensional structure.NiCo2O4, a typical OER electrocatalyst with high conductivity, was deposited on the Ni foam in the form of rhombus/hexagonal plates interconnected into perpendicular nanowire array morphology, efficientlyfacilitating electron transfer and electrolyte permeation. The electrical conductivity in NiCo2O4 has been believed to originate from the层状双氢氧化物基复合材料的制备及其电化学性能的研究presence of Ni3+ and the electron transfer between Ni2+ and Ni3+. Importantly, the surface of NiCo2O4was a Ni-rich layer, which served as the seed for the following hierarchical growth of NiFe-LDH, ensuring close contact and strong coupling at the interface.(2) Study on the properties of electrocatalytic water splitting of NiFe LDH@NiCo2O4 compositesHerein, the NiFe-LDH sheets were ultrathin of only several atomic layers, combined with its strong coupling with NiCo2O4 and the unique hierarchical structure, enabled the hybrid electrode a remarkable overall water splitting performance of only 1.60 V to achieve 10 mA cm-2 current in single alkaline KOH eletrolyte.Key words: Layered double hydroxides (LDHs),Electrocatalysis, Overall water splitting, Hydrogen evolution reaction, Oxygen evolution reaction,Heterostructure.Written by: Zhiqiang WangSupervised by: Prof. Fengxia GengProf. Xingwang Wang目录第一章文献综述 (1)1.1 引言 (1)1.2 LDHs及其复合材料的制备 (2)1.2.1 LDHs的基本结构 (2)1.2.2 LDHs的制备方法 (2)1.3 LDHs及其复合材料的应用 (3)1.3.1电催化水解中的应用 (3)1.3.2超级电容器中的应用 (10)1.4论文的选题思路、意义和主要工作 (15)1.4.1选题思路和意义 (15)1.4.2主要工作 (16)参考文献 (16)第二章超薄NiFe LDH纳米片与NiCo2O4纳米线杂化结构的构筑 (16)2.1 引言 (24)2.2 实验部分 (26)2.2.1 实验试剂 (26)2.2.2 仪器 (26)2.2.3 实验步骤 (27)2.3 结果与讨论 (28)2.3.1 SEM分析 (28)2.3.2 XRD和BET分析 (30)2.3.3 TEM分析 (32)2.3.4 EDS和Mapping分析 (33)2.3.5 XPS分析 (35)2.4 小结 (37)参考文献 (37)第三章NiFe LDH@NiCo2O4杂化结构的电催化全解水性能研究 (41)3.1 引言 (41)3.2 实验部分 (41)3.2.1 电化学测试 (41)3.3 结果与讨论 (42)3.3.1析氧反应分析 (42)3.3.2析氢反应分析 (44)3.3.3 全解水分析 (45)3.3.4 CV和EIS分析 (46)3.3.5电催化性能比较 (47)3.3.6 电催化性能的机理探究 (50)3.4 小结 (53)参考文献 (53)第四章结论和展望 (53)4.1 全文总结 (60)4.2 展望 (60)在读期间已发表或录用的论文 (62)致谢 (63)第一章文献综述1.1 引言能源在当今社会的发展中发挥着重要的作用,但近年来由传统能源煤、石油、天然气等资源的日益消耗,以及化石燃料等的大量使用所带来的生活环境的污染,以及温室气体的增加导致的海平面上升、酸雨的形成,使人类面临生存环境的恶化,不可再生能源的枯竭等多重威胁1-4。

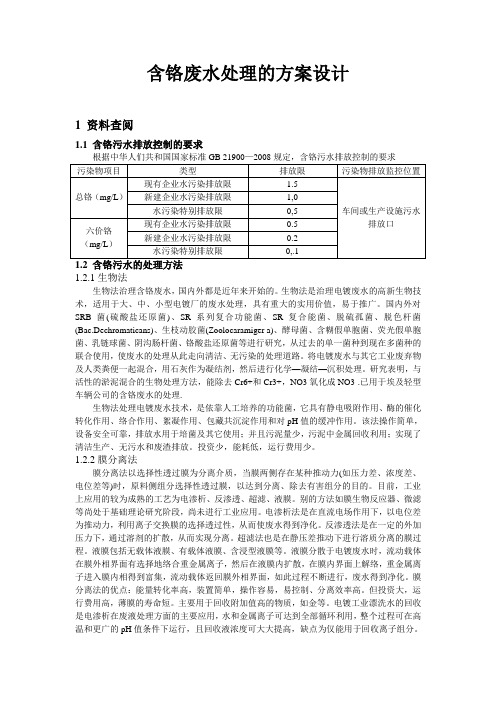
含铬废水处理的方案设计1 资料查阅1.1 含铬污水排放控制的要求根据中华人们共和国国家标准GB 21900—2008规定,含铬污水排放控制的要求1.2.1生物法生物法治理含铬废水,国内外都是近年来开始的。
生物法是治理电镀废水的高新生物技术,适用于大、中、小型电镀厂的废水处理,具有重大的实用价值,易于推广。
国内外对SRB菌(硫酸盐还原菌)、SR系列复合功能菌、SR复合能菌、脱硫孤菌、脱色杆菌(Bac.Dechromaticans)、生枝动胶菌(Zoolocaramiger a)、酵母菌、含糊假单胞菌、荧光假单胞菌、乳链球菌、阴沟肠杆菌、铬酸盐还原菌等进行研究,从过去的单一菌种到现在多菌种的联合使用,使废水的处理从此走向清洁、无污染的处理道路。
将电镀废水与其它工业废弃物及人类粪便一起混合,用石灰作为凝结剂,然后进行化学—凝结—沉积处理。
研究表明,与活性的淤泥混合的生物处理方法,能除去Cr6+和Cr3+,NO3氧化成NO3-.已用于埃及轻型车辆公司的含铬废水的处理.生物法处理电镀废水技术,是依靠人工培养的功能菌,它具有静电吸附作用、酶的催化转化作用、络合作用、絮凝作用、包藏共沉淀作用和对pH值的缓冲作用。
该法操作简单,设备安全可靠,排放水用于培菌及其它使用;并且污泥量少,污泥中金属回收利用;实现了清洁生产、无污水和废渣排放。
投资少,能耗低,运行费用少。
1.2.2膜分离法膜分离法以选择性透过膜为分离介质,当膜两侧存在某种推动力(如压力差、浓度差、电位差等)时,原料侧组分选择性透过膜,以达到分离、除去有害组分的目的。
目前,工业上应用的较为成熟的工艺为电渗析、反渗透、超滤、液膜。
别的方法如膜生物反应器、微滤等尚处于基础理论研究阶段,尚未进行工业应用。
电渗析法是在直流电场作用下,以电位差为推动力,利用离子交换膜的选择透过性,从而使废水得到净化。
反渗透法是在一定的外加压力下,通过溶剂的扩散,从而实现分离。
超滤法也是在静压差推动下进行溶质分离的膜过程。

含铬废水的处理方法-CAL-FENGHAI.-(YICAI)-Company One1含铬废水的处理方法(焦翠华山东师范大学济南 250358)摘要:简述了含铬废水的来源、性质及其危害,对含铅废水处理的工艺方法包括吸附法、苹取法及液膜法等物理方法。
药剂还原法和沉淀法、铁屑铁粉及铁氧体处理等化学方法和生物法进行了比较分析,考察了上述方法的优缺点,介绍了含铬废水的处理研究新动向并对其应用前景作出了展望。
并对它们的原理、工艺流程、优缺点等进行了详细评述。
关键词:含铬废水;处理方法1 含铬废水的来源、性质及危害铬及其化台物在工业上应用广泛,冶金、化工、矿物工程、电镀、制铬、颜料、制药、轻工纺织、铬盐及铬化物的生产等一系列行业,都会产生大量的含铬废水。
铬的化合物以二价(如CrO)、三价(如Cr2O3)和六价(如CrO3)的形式存在,但以三价和六价的化合物最为常见。
其毒性则以六价铬最强,约为三价铬的一百倍,三价铬次之,而二价铬和铬本身毒性很小或无毒性。
铬化物可以通过消化道、呼吸道、皮肤和粘膜侵人人体,主要积聚在肝、肾、内分泌系统和肺部。
毒理作用是影响体内物质氧化、还原和水解过程,与核酸、核蛋白结合影响组织中的磷含量。
铬化合物具有致癌作用。
水中的铬可在鱼的骨骼中积累,此时Cr3+比Cr6+的毒性还大。
浓度为3.0 mg/ L即对淡水鱼有致死作用;浓度为/L,便可使一些水生生物致死,使水体的自净作用受到抑制[1]。
若用含铬的污水灌溉农田,铬便在植物体内积聚,土壤中有机质的消化作用受到抑制,造成农业减产。
因此,各国对排放的废水、渔业水域水质、农田灌溉水质、地面水以及饮用水的铬含量,均有严格规定。
我国已把六价铬规定为实施总量控制的指标之一,并规定工业排放的废水中六价铬最高浓度为0.5 mg/L,总铬的最高浓度为1.5 mg/L,且不得用稀释法代替必要的处理;生活饮用水中铬含量不得超过/L[2]。
2 化学法药剂还原沉淀法还原沉淀法是目前应用较为广泛的含铬废水处理方法。
一、实验目的1. 了解含铬废水的成分和危害。
2. 掌握化学还原沉淀法处理含铬废水的原理和步骤。
3. 分析实验过程中各因素对铬离子去除率的影响。
4. 评估化学还原沉淀法在含铬废水处理中的实际应用效果。
二、实验原理含铬废水中的铬主要以Cr(VI)和Cr(III)的形式存在,其中Cr(VI)的毒性较大。
化学还原沉淀法是通过加入还原剂将Cr(VI)还原为Cr(III),然后与钙、镁等金属离子形成沉淀,从而实现铬的去除。
本实验采用硫酸亚铁作为还原剂,氢氧化钠作为沉淀剂。
三、实验材料与仪器1. 材料:含铬废水(Cr(VI)浓度约为50 mg/L)、硫酸亚铁、氢氧化钠、丙酮、无水亚硫酸钠等。
2. 仪器:烧杯、玻璃棒、pH计、分光光度计、电子天平等。
四、实验步骤1. 样品处理:取100 ml含铬废水于250 ml烧杯中,在不断搅拌下滴加3mol·L-1H2SO4调整至pH约等于1。
2. 还原反应:向上述溶液中加入10%的FeSO4溶液,直至溶液颜色由浅黄变为深绿色。
3. 沉淀反应:向上述溶液中加入适量的氢氧化钠溶液,调节pH至7-8,观察沉淀的形成。
4. 过滤与洗涤:将形成的沉淀用滤纸过滤,并用蒸馏水洗涤3次。
5. 分析测定:取少量滤液,用分光光度计测定铬离子的浓度,计算去除率。
五、实验结果与分析1. 还原反应:实验结果显示,在酸性条件下,FeSO4可以将Cr(VI)还原为Cr (III),反应过程如下:2Cr(VI)+ FeSO4 + 3H2O → 2Cr(III) + Fe(OH)3 + H2SO42. 沉淀反应:在碱性条件下,Cr(III)与钙、镁等金属离子形成沉淀,反应过程如下:Cr(III) + 3OH- → Cr(OH)3↓3. 去除率:实验结果显示,化学还原沉淀法对含铬废水的铬离子去除率较高,去除率可达90%以上。
六、讨论与结论1. 本实验采用化学还原沉淀法处理含铬废水,结果表明该方法具有操作简便、去除率高等优点,适用于含铬废水的处理。
层状双金属氢氧化物的制备及其应用层状双金属氢氧化物,简称LDHs,是一种具有多层结构和正电性的金属氢氧化物。
LDHs的制备方法非常简单,通常使用双金属离子和碱性氢氧化物混合反应,经过水热处理后就可以制备得到。
LDHs具有很强的吸附性能和催化性能,在环境保护、医药和化学工业等领域都有广泛的应用。
一、LDHs的制备方法LDHs的制备方法主要包括共沉淀法、水热法、溶胶凝胶法等。
其中,水热法是最常用的方法,因为这种方法可以得到高比表面积的LDHs,并且可以根据不同的要求调整LDHs的结构和性能。
水热法的具体操作方法是:首先将含有双金属离子的溶液与碱性氢氧化物混合,然后加入一定量的表面活性剂,混合均匀后,用高压釜进行水热处理。
经过水热处理后,LDHs会自组装形成多层结构,并且表面活性剂会在LDHs的表面形成特殊的结构,增加LDHs的比表面积和吸附性能。
二、LDHs的应用1.环境保护领域LDHs具有较强的吸附性能,可以吸附各种有害物质,如重金属离子、有机物等。
因此,在环境污染治理、水处理和废物处理等领域,LDHs可以发挥极大的作用。
例如,LDHs可以用于处理含有重金属的废水,吸附其离子使其减少到安全的水平。
此外,LDHs还可以用于处理含有有机污染物的废水,对于苯、甲苯、二甲苯等化学品具有很强的吸附能力。
2.医药领域LDHs可以作为一种廉价、低毒、高活性的药物载体,用于传递和释放药物。
传统的药物载体大多数是聚合物或脂质体,但这些载体在药物传递和释放过程中存在一些问题,如低药物包载量、不稳定性等。
相比较而言,LDHs载体更加稳定、可控,并具有更好的生物相容性。
例如,一种包含化疗药物的LDHs含有较低的细胞毒性,可以在体内缓慢地释放药物并降低副作用。
3.化学工业领域LDHs具有优良的催化性能,可以用于各种催化反应,如氧化反应、还原反应、加氢反应等。
因此,LDHs在化学合成、有机合成、化学分析等领域中有广泛的应用。
层状双氢氧化物合成现状
层状双氢氧化物(Layered Double Hydroxides,LDHs)是一类重要的无机功能材料,由阳离子层和阴离子层交替排列构成。
LDHs具有良好的离子交换性能、催化性能、吸附性能等,被广泛地应用于锂离子
电池、废水处理、催化反应等领域。
目前,LDHs的合成方法主要包括化学共沉淀法、水热法、溶剂热法、水溶胶凝法等。
其中,化学共沉淀法是最常用的方法之一,通过控制
反应条件和添加剂,可以得到具有不同结构和性能的LDHs。
水热合成法是一种较新的合成方法,可以在较低的温度下合成具有高比表面积、高晶格度、高结晶度的LDHs。
除了传统的合成方法,近年来还出现了一些新的合成方法,如转化法、电化学合成法、光化学合成法等。
转化法是在碳酸钙的基础上制备LDHs,可以杜绝含氧离子存在的可能性,得到更纯净的LDHs。
电化
学合成法是在电解质溶液中进行,通过改变电场、电流密度和电解液
中的成分,可以得到具有不同性质和结构的LDHs。
光化学合成法是通过光化学反应合成LDHs,可以在无需高温、高压下制备具有优异性能的LDHs。
总的来说,各种LDHs的合成方法各有优缺点,选择合适的合成方法
取决于具体的应用需求。
在未来,随着对LDHs研究的不断深入,相信会有更多的合成方法被开发出来,为其在各个领域中的应用提供更多可能性。
温馨小提示:本文主要介绍的是关于电置换介导合成层状双氢氧化物的文章,文章是由本店铺通过查阅资料,经过精心整理撰写而成。
文章的内容不一定符合大家的期望需求,还请各位根据自己的需求进行下载。
本文档下载后可以根据自己的实际情况进行任意改写,从而已达到各位的需求。
愿本篇电置换介导合成层状双氢氧化物能真实确切的帮助各位。
本店铺将会继续努力、改进、创新,给大家提供更加优质符合大家需求的文档。
感谢支持!(Thank you for downloading and checking it out!)阅读本篇文章之前,本店铺提供大纲预览服务,我们可以先预览文章的大纲部分,快速了解本篇的主体内容,然后根据您的需求进行文档的查看与下载。
电置换介导合成层状双氢氧化物(大纲)一、引言1.1背景介绍1.2层状双氢氧化物的应用前景1.3电置换合成方法的提出1.4研究目的和意义二、实验材料与方法2.1实验材料2.1.1原料与试剂2.1.2仪器与设备2.2电置换介导合成方法2.2.1合成原理2.2.2合成过程2.2.3合成条件优化三、结果与讨论3.1层状双氢氧化物的结构表征3.1.1X射线衍射(XRD)分析3.1.2扫描电子显微镜(SEM)分析3.1.3傅里叶变换红外光谱(FT-IR)分析3.2电置换介导合成过程分析3.2.1电流密度与时间的关系3.2.2电置换过程中电位变化3.2.3电置换过程中溶液pH值变化3.3合成条件对层状双氢氧化物性能的影响3.3.1电流密度对层状双氢氧化物性能的影响3.3.2合成时间对层状双氢氧化物性能的影响3.3.3介电常数对层状双氢氧化物性能的影响四、结论与展望4.1结论4.2不足与展望一、引言1.1背景介绍:层状双氢氧化物(Layered Double Hydroxides,LDHs)是一类具有层状结构的阴离子型黏土矿物。
随着科学技术的不断发展,LDHs因其独特的性质,如可调节的层间距、较大的比表面积、良好的离子交换性能等,引起了研究者的广泛关注。
层状双氢氧化物即时合成处理含Cr(Ⅵ)废水陈天虎1,冯有亮1,XU Hui 2fang 2,彭书传1,黄川徽1,唐述培1(1.合肥工业大学资源与环境学院,合肥 230009;2.Department of Earth and Planetary Sciences ,University of New Mexico ,NM 87131,USA )摘要:利用LDH 合成原理,提出了即时合成层状双氢氧化物去除Cr (Ⅵ)的新方法.其基本原理是,在废水处理中由于Mg 2+、Al 3+水解共沉淀形成LDH ,Cr (Ⅵ)阴离子优先进入LDH 结构层间平衡结构电荷,从而使Cr (Ⅵ)阴离子以LDH 沉淀的形式被去除.这一原理已为模拟废水实验和沉淀物结构分析证实.研究结果表明,影响处理效果的因素是Mg/Al 比值、p H 值以及Cr(Ⅵ)浓度,当p H 值为815~9、Mg/Al 为1∶1~2∶1时Cr 去除率最高,Mg 、Al 利用率也比较高,出水水质满足工业排放要求,从而显示这种废水处理技术具有非常好的效果.关键词:层状双氢氧化物(LDH );六价铬;X 2射线衍射(XRD );废水处理中图分类号:X78111 文献标识码:A 文章编号:025023301(2004)022*******收稿日期:2003205216;修订日期:2003207201基金项目:国家自然科学基金资助项目(40072017);合肥工业大学科研开发基金项目(030702F )作者简介:陈天虎(1962~),男,博士,教授,主要从事环境矿物学和环境材料研究.本文技术成果已申请国家发明专利.T reatment of W aste w ater Containing Cr(Ⅵ)by LD H Synthesizing in SituCHEN Tian 2hu 1,FEN G Y ou 2liang 1,XU Hui 2fang 2,PEN G Shu 2chuan 1,HUAN G Chuan 2hui 1,TAN G Shu 2pei 1(1.College of Resources and Environmental Engineering ,Hefei University of Technology ,Hefei 230009,China ;2.Department of Earth and Planetary Sciences ,University of New Mexico ,NM 87131,USA )Abstract :The objective of this work was to investigate the efficiency and factors impacting of removal Cr (Ⅵ)from wastewater by lay 2er double hydroxide synthesizing in situ.Principle of the method may be described as follow :Mg 2+and Al 3+hydrolysis and formsMg/Al 2LDH by adding Mg 2+,Al 3+and NaOH into wastewater containing Cr (Ⅵ),Cr (Ⅵ)anions are selectively intercalated into interlayer of LDH to balance positive structural charge.While Mg 2+and Al 3+co 2precipitates and forms LDH ,the Cr (Ⅵ)in wastew 2ater is removal by settle of LDH synthesizing in situ ,which are confirmed by analysis of X 2ray diffraction on settle and chemical anal 2ysis on aqueous.The results indicate that factors of impacting on efficiency of removal Cr (Ⅵ)include in amount of adding Mg 2+and Al 3+,Mg/Al ratio ,p H and concentration of Cr (Ⅵ)in wastewater.The maximal removal efficiency of Cr (Ⅵ)can be reached when p H values are between 8.5and 9,and Mg/Al ratios are between 1∶1and 2∶1,meanwhile ,Mg and Al added can be taken good use of.This technology has present extraordinary efficiency of wastewater treatment.K ey w ords :layer double hydroxide (LDH );Cr (Ⅵ);X 2ray diffraction (XRD );wastewater treatment Cr (Ⅵ)主要来源于电镀、制革、采矿、铬盐化工等工业排出的废水.Cr (Ⅵ)是一种毒性较大的致畸、致突变剂[1~3],目前常用的处理六价铬的方法为亚铁还原法和离子交换法[4].虽然近来涌现了许多新的方法,如光催化法[5]、微生物法[6]、硫化物及H 2S 还原法[7,8]等,但是经济有效的含Cr (Ⅵ)废水处理方法和技术仍值得进一步研究.层状双氢氧化物,也称水滑石、阴离子粘土.其基本结构式为:M 2+x M 3+y(OH )2x +3y 2nz (A n -)z 1m H 2O ,M 2+和M 3+分别代表二价和三价阳离子,A n -代表n 价阴离子.LDH 具有类似水镁石的层状结构,在水镁石的结构单元层中,二价阳离子部分被三价阳离子替代,产生结构正电荷,从而需要引入阴离子进入结构单元层间平衡结构正电荷.与一般粘土矿物类似,处于结构层间的阴离子与结构正电荷属于远程静电平衡,作用力较弱,其中的阴离子可以被其它的阴离子交换,因而LDH 具有优异的阴离子交换性能[9~11].目前已经利用LDH 作为先驱物制造尖晶石结构的过渡金属催化剂.把LDH 作为水处理吸附剂也已开展了较多的研究,显示出非常广阔的应用前景,特别是作吸附剂处理含磷酸根、砷酸根、硒酸根、铬酸根等含氧阴离子显示出很好地效果[12~23].目前存在的问题主要是研究者制备的LDH 多是用化学试剂在较严格的实验条件下完成,生产量小,成本高,很难在实际废水处理中应用.因而,尽管LDH 的发现、研究已经有几十年的历史,合成技术研究也已形成较多的成果,但把LDH 作为水处理吸附剂应用,尚存在技术经济的问题[24].本文利用LDH 合成原理,在废水处理过程中即时合成LDH ,并达到利用LDH 处理去除废水中污第25卷第2期2004年3月环 境 科 学ENV IRONM EN TAL SCIENCEVol.25,No.2Mar.,2004染物的目的.这种方法省去了LDH 合成生产中复杂的固液分离和干燥操作,使LDH 合成与废水处理2个分立的工业过程在一个系统中完成.本文报道即时合成LDH 处理含Cr (Ⅵ)废水模拟实验研究初步成果.1 实验方法含Cr (Ⅵ)废水用重铬酸钾和蒸馏水配制,Mg 2+和Al 3+以氯化物形式加入,用于水解形成Mg/Al 2LDH ,用10%NaOH 溶液调节p H 值,所用试剂均为市售分析纯试剂,溶液中阴离子除了含铬阴离子外,主要是Cl -,这样可以避免其它阴离子的干扰,模拟废水处理实验流程见图1.按照实验设计,首先配制表1所列浓度的含铬溶液,将一定重量的氯化镁、氯化铝固体加入到含铬液中,并使固体溶解.在快速搅拌下,缓慢滴加10%NaOH 溶液调节p H 值,使之达到表1所要求的终点p H 值.为了提高LDH 结晶度,便于固体结构分析,在加热并保温50℃条件下继续搅拌2h ,离心分离,上清液收集用于Mg 、Al 、Cr 分析.固体洗涤多次,直至无氯离子,最后将固体在100℃干燥24h ,用于X 2射线衍射分析和Mg 、Al 、Cr 含量分析.图1 即时合成LD H 处理含Cr(Ⅵ)废水实验图Fig.1 Diagram of treatment procedures of Cr (Ⅵ)wastewater by synthesizing LDH in situ 表1 正交实验设计及实验结果Table 1 Orthogonal experiments and results序号Mg2+/Al3+Cr (Ⅵ)浓度/mg ・L -1p H 值Cr 6+去除率/%处理出水残余浓度/mg ・L -1Mg 2+Al 3+Cr 6+沉淀2LDHW Mg /W Al利用率/%Mg 2+Al 3+12∶1108.598.3028.15 1.2260.167 1.82790.6299.1822∶1209.096.90 1.968.5460.618 2.10699.3594.3032∶1309.592.560.98015.77 2.233 2.22899.6789.4942∶1401089.870.0015.87 4.051 2.23610089.4251∶1109.097.6936.720.0110.2310.75575.5299.9961∶1208.598.5380.780.0110.1460.46246.1599.9971∶1301090.120.0012.810.988 1.09310091.4681∶1409.590.450.0012.270.955 1.08910091.8293∶1109.584.7629.370.204 1.524 2.80893.4799.86103∶1201066.0214.200.075 6.796 2.90796.8499.95113∶1308.598.00279.10.0050.600 1.14037.9899.99123∶1409.080.53244.80.0227.790 1.36845.6099.98134∶1101080.8163.650.257 1.920 3.58289.3999.83144∶1209.583.95161.60.041 3.210 2.92473.0799.97154∶1309.083.57298.70.028 4.930 2.00950.2299.98164∶1408.590.67465.10.0173.7300.89922.4899.99Ⅰ377.6361.6385.5Ⅱ376.8345.4358.7Ⅲ329.3364.3351.7Ⅳ339351.5326.8极差R48.4218.8558.68 Cr (Ⅵ)分析采用二苯碳酰二肼分光光度法[25];Mg 2+分析采用ED TA 标准液络合滴定[26];Al 3+分析采用十六烷基溴化铵2铬天青S 分光光度法[27];X 2射线分析使用D/MAX 2RB 型X 2射线衍射仪,铜靶,电压40kV,电流100mA,扫描速度4°/min,分析在合肥工业大学理化中心完成.2 结果与讨论211 正交实验根据成分不同,可以把LDH分为很多不同的种类.但是原料易得,成本最低,在废水处理中最有应用前景的是Mg/Al2LDH.Mg/Al2LDH制备方法是向一定Mg/Al比值的Mg2+和Al3+混合盐溶液中滴加碱液,导致Mg2+和Al3+同时水解共沉淀,从而形成Mg/Al2LDH.决定Mg/Al2LDH合成和离子交换性质的因素主要是Mg/Al比和共沉淀终点p H 值[24].为了同时考察初始溶液Cr(Ⅵ)浓度对去除效果的影响,在即时合成LDH处理含Cr(Ⅵ)废水的模拟实验中,以Mg/Al比、Cr(Ⅵ)浓度和p H值为影响因子,每个影响因子取4个水平,以Cr(Ⅵ)去除率作为评价指标做正交实验设计.其中在配水实验中投加Al3+浓度保持不变(150mg/L),通过调节Mg2+的加入量来改变初始溶液中Mg/Al比.正交实验结果见表1,Cr(Ⅵ)去除率从66%~98153%,表明即时合成LDH方法处理含铬废水具有明显的效果,并且处理效果受到p H值、Mg2+/ Al3+和Cr(Ⅵ)浓度的影响.从极差R可以看出,p H 值对处理效果的影响最大(极差R=58168),其次是Mg2+/Al3+比值(极差R=48142),最后是Cr (Ⅵ)浓度(极差R=18185).当控制p H值为815和Mg/Al比值小于2∶1时,处理出水含Cr(Ⅵ)小于015mg/L,满足工业排水要求.说明在严格控制p H 值的条件下,添加镁、铝化合物,保持适当的Mg/Al 比值,通过即时合成LDH技术可以较好地处理含Cr(Ⅵ)废水.2.2 Mg/Al2LDH固体产物结构表征和机理即时合成LDH处理含Cr(Ⅵ)废水沉淀固体干燥后得到黄色粉末,呈现铬酸盐特有的颜色,说明水溶液中Cr(Ⅵ)以CrO2-4形式进入沉淀固体物的结构中.该沉淀固体X2射线衍射分析结果见图2,出现LDH特有的序列衍射峰,其特征表明在p H值为815~10范围内,固体产物基本是LDH物相,没有出现水镁石和水铝石的结晶相或其它物相.该沉淀固体浸泡在1mol・L-1Na2CO3溶液中,释放出Cr (Ⅵ)离子,固体洗涤后产物变为白色,Cr(Ⅵ)可以被碳酸根离子交换而释放出来,表明Cr(Ⅵ)不仅以CrO2-4形式进入沉淀固体物,而且是以可交换离子的形式进入LDH层间,平衡结构正电荷,废水中Cr (Ⅵ)是以LDH沉淀的形式去除的.即时合成水滑石X射线衍射图谱与美国Alco公司所产的Mg/Al2 LDH X射线衍射图谱相比,衍射峰稍微向高角度方向偏移,说明即时合成的LDH层间距稍大,这也与CrO2-4进入结构层是一致的[22].与Alco公司产品相比,即时合成LDH衍射峰明显宽化,衍射强度较低,表明即时合成的LDH结晶度较低,这与透射电镜观察结果是一致的[24].上述结构分析结果证明,不仅在废水处理过程中即时合成了LDH,而且废水中Cr(Ⅵ)是通过即时合成LDH的方式去除的,证明了本文提出的净化机理.(A:为美国Alco公司LDH产品;B:p H=10;C:p H=9.5;D:p H=9;E:p H=815)(A:product from Alco Corporation of America;B:p H=10;C:p H=915;D:p H=9;E:p H=815)图2 在不同pH值下即时合成LD H处理含铬废水沉淀固体X2射线衍射图谱Fig.2 XRD pattern of LDH synthesized in situ at different p H213 p H值和初始Mg/Al比值影响Cr(Ⅵ)去除效率的机理即时合成LDH处理含Cr(Ⅵ)废水的化学反应原理可以用以下反应方程表示:x Mg2++y Al3++(2x+3y-2z)OH-+z CrO2-4Mg x Al y(OH)2x+3y-2z(CrO4)zLDH 从上面反应方程式可以看出,结晶形成LDH 时,结合进入晶体中的CrO2-4离子的数量取决于结晶LDH中Mg/Al比值和结构中羟基数量.铝含量越高,产生的结构电荷越多,需要的平衡阴离子数量越多.结构中羟基越多,能够结合进入LDH的CrO2-4越少.LDH中羟基的数量与水的p H值有关, p H值越高,进入结构中的羟基越多,能够结合进入LDH的CrO2-4越少,Cr(Ⅵ)去除效率越低.上述分析表明,Mg/Al比值和p H值越低对Cr(Ⅵ)去除越有利.但是Mg/Al 比值和p H 值都有一个下限,p H值过低,Mg 2+不能水解,LDH 不能形成,Mg/Al 比值过低也不利于LDH 的形成[9].上述根据反应方程和LDH 晶体化学式进行的理论推测已为实验证实.从表1可以看出,在各种条件下,加入的铝离子在合成LDH 过程中沉淀去除率总体都比较高,为89149%~99198%;加入的镁离子沉淀去除率变化范围比较大,为22148%~100%,原因是处理出水p H 值和初始Mg/Al 比值不同,镁、铝离子水解程度不同.当p H 值偏高时,有利于Mg 2+的水解,而不利于Al 3+的水解;当p H 值偏低时,有利于铝离子水解,而不利于镁离子的水解.沉淀物中Mg/Al 比值为01462~31582,有很大的变化范围,明显受到p H 值和初始Mg/Al 比值影响(见表1).图3反映了p H 值对沉淀物Mg/Al 比值的影响,在相同的初始Mg/Al 比值条件下,随着p H 值不同,形成的LDH Mg/Al 比值不同.从图4可以看出,当其它条件不变时,随着p H值的增加,Cr (Ⅵ)去除率减少,这种趋势正好与固体Mg/Al 比值-p H 值关系(图3)相反.说明p H 值对Cr (Ⅵ)去除率的影响,原因是p H 值影响LDH 的成分,从而影响到Cr (Ⅵ)进入LDH 结构.图3 pH 与合成LD H 2Mg/Al 关系(初始Mg/Al 比值为2∶1)Fig.3 p H vs Mg/Al ratio in LDH synthesized(initial Mg/Al ratios are all 2∶1)214 工艺特点工业合成LDH 需要固液分离、洗涤、干燥、包装等过程,由于人工合成的LDH 颗粒细小,因而固液分离含水率高而且困难,干燥能耗高,使人工合成LDH 成本较高,制约了LDH 在废水处理中的应用.而且,把超细粉状LDH 均匀加入废水中也需要严密控制的方法,才不致造成粉尘污染.本文研究的即时合成LDH 处理废水技术,直接在水处理过程中合成LDH ,去除废水中的阴离子,使本来需要在2个工厂或系统中完成的过程在一个水处理系统实现,因而,减少了中间环节,将大大降低处理成本.图4 pH 2Cr(Ⅵ)去除率关系(初始Mg/Al 比值为2∶1)Fig.4 p H vs chromium removal efficiency(initial Mg/Al ratios are all 2∶1)3 结论(1)水质和固体结构分析研究结果表明,可以通过在废水处理过程中即时合成LDH 的方法来去除废水中Cr (Ⅵ)离子,这种方法省去了LDH 工业合成过程,在一定程度上可以推动LDH 在废水处理中的应用.(2)在p H 值为815~9、Mg/Al 为1∶1~2∶1时,Cr 去除率最高,Mg 、Al 利用率也比较高,出水水质满足工业排放要求.参考文献:[1] Pattison DI ,Davies MJ ,Levina A ,Dixon N E ,Lay PA 1Chromium (Ⅵ)reduction by catechol (amine )s results in DNA cleavage in vitro :Relevance to chromium genotoxicity [J ].Chemical Research in Toxicology ,2001,14(5):500~510.[2] Tiravanti G ,Domenico P ,Mario S ,Roberto P.Cr (Ⅲ)recov 2ery and separation from spent tannery baths by carboxylic ion ex 2change resins.New Developments in Ion Exchange [A ].In :Abe M ,suzuki T ,K odansha T (Eds.),Proceedings of the In 2ternational Conference in Ion Exchange.Tokyo ,Japan :1991,383~388.[3] Knott M.Toxic tannery sludge made as safe as houses[J ].NewScientist ,1996,149(20):17~22.[4] Buerge I J ,Hug S J.K inetics and p H dependence of chromium(Ⅵ)reduction by iron (Ⅱ)[J ].Environmental Science and Technology ,1997,31(5):1426~1432.[5] Testa JJ ,Grela MA ,Litter MI.Experimental evidence in favorof an initial one 2electron 2transfer process in the heterogeneous photocatalytic reduction of chromium (VI )over TiO 2[J ].Lang 2muir ,2001,17(12):3515~3517.[6] Chirwa EMN ,Wang YT.Hexavalent chromium reduction byBacill us sp.in a packed 2bed bioreactor[J ].Environmental Sci 2ence and Technology ,1997,31(5):1446~1451.[7] Patterson RR ,Fendorf S ,Fendorf M.Reduction of hexavalentchromium by amorphous iron sulfide[J ].Environmental Science and Technology ,1997,31(7):2039~2044.[8] K im C ,Zhou QH ,Deng BL ,Thornton EC ,Xu HF.Chromium(Ⅵ)reduction by hydrogen sulfide in aqueous media:stoichiom2etry and kinetics[J].Environmental Science and Technology,2001,35(11):2219~2225.[9] Miyata S.The syntheses of hydrotalcite2like compounds andtheir structures and physico2chemical properties———I:the sys2tems Mg2+2Al3+2NO-3,Mg2+2Al3+2Cl-,Mg2+2Al3+2ClO-4,Ni2+2Al3+2Cl-and Zn2+2Al3+2Cl-[J].Clays and Clay Miner2als,1975,23(5):396~375.[10] Miyata S.Anion2exchange properties of hydrotalcite2like com2pounds[J].Clays and Clay Minerals,1983,31(4):305~311.[11] Miyata S.Physico2chemical properties of synthetic hydrotalcitesin relation to composition[J].Clays and Clay Minerals,1980,28(1):50~56.[12] Villa M2V,Sanchez Martin M2J,Sanchez Camazano M.Hydro2talcites and organic2hydrotalcites as sorbents for removing pesti2 cides from water[J].Journal of Environmental Science andHealth Part B———Pesticides Food Contaminants and AgricultureWastes,1999,34(3):509~525.[13] Onkal E2G,Wibulswas R,White D2A.Humic acid uptake fromaqueous media using hydrotalcites and modified montmorillonite[J].Environmental Technology,2000,21(2):167~175. [14] Inacio J,Taviot2Gueho C,Forano C,et al.Adsorption of MC2PA pesticide by Mg2Al layered double hydroxides[J].AppliedClay Science,2001,18(526):255~264.[15] Parker L2M,Milestone N2B,Newman R2H.The use of hydro2talcite as an anion absorben[J].Industrial and EngineeringChemistry Research,1995,34(4):1196~1202.[16] Fetter G,Ramos E,Olguin M T,et al.Sorption of131I2by hy2drotalcites.Journal of Radioanalytical and Nuclear Chemistry,21(122):63~66.[17] Ulibarri M2A,Pavlovic I,Barriga C,et al.Adsorption of an2ionic species on hydrotalcite2like compounds:effect of interlayeranion and crystallinity[J].Applied Clay Science,2001,18(122):17~27.[18] Serrano J,Bertin V,Bulbulian S.Mo299sorption by thermallytreated hydrotalcites[J].Langmuir,2000,16(7):3355~3360.[19] K ovanda F,K ovacsova E,K olousek D.Removal of anions fromsolution by calcined hydrotalcite and regeneration of used sorbentin repeated calcination2rehydration2anion exchange processes[J].Collection of Czechoslovak Chemical Communications,1999,64(9):1517~1528.[20] Lazaridis N2K,Matis K2A,Webb M.Flotation of metal2loadedclay anion exchangers[J].Part I:the case of chromates.Chemosphere,2001,42(4):373~378.[21] Lehmann M,Z ouboulis A2I,Matis K2A.Removal of metal ionsfrom dilute aqueous solutions:a comparative study of inorganicsorbent materials[J].Chemosphere,1999,39(6):881~892.[22] Y ou Y2W,Vance G2F,Zhao H2T.Selenium adsorption on Mg2Al and Zn2Al layered double hydroxides[J].Applied Clay Sci2ence,2001,20(122):13~25.[23] Y ou Y2W,Zhao H2T,Vance G2F.Removal of arsenite fromaqueous solutions by anionic clays[J].Environmental Technolo2gy,2001,22(12):1447~1457.[24] 陈天虎,徐惠芳,鲁安怀,等.凹凸棒石粘土酸活化废水合成LDH:制备方法和表征[J].矿物学报,2003,23(3):199~203.[25] 魏复盛.水和废水监测分析方法(第三版)[M].北京:中国环境科学出版社,1998.[26] 陈伟光,杨奇,胡国云.十六烷基溴化铵存在下铬天青S分光光度法测定饮用水中铝[J].环境与健康杂志,2000,15(4):243~235.[27] 浙江大学分析化学教研组.分析化学实验(第二版)[M].北京:高等教育出版社,1989.。