九年级化学化学计算
- 格式:pdf
- 大小:856.91 KB
- 文档页数:9
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。

初中化学常用的计算公式,必须记!!九年级上册:相对原子质量= 某元素一个原子的质量/一个碳原子质量的1/12设某化合物的化学式为AmBn1、计算它的相对分子质量=(A的相对原子质量×m)+(B的相对原子质量×n)2、计算A元素与B元素的质量比=(A的相对原子质量×m):(B的相对原子质量×n)3、计算A元素的质量分数=(A的相对原子质量×m)/AmBn的相对分子质量×100﹪4、计算化合物中A元素的质量化合物中A元素的质量=化合物的质量×A元素的质量分数九年级下册混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量×100%=纯物质的质量/(纯净物的质量+杂质的质量)×100﹪=1—杂质的质量分数1、物质的密度(p)=物质的质量(m)÷物质的体积(V)2、物质的质量(m)=物质的密度(p)×物质的体积(V)3、物质的体积(V)=物质的质量(m)÷物质的密度(p)有关溶质质量分数的计算:1、溶质的质量分数=溶质质量/溶液质量×100% =溶质质量/(溶质质量+溶剂质量) ×100%2、溶液中溶质的质量=溶液的质量×溶液中溶质的质量分数=(溶液的体积×溶液的密度)×溶液中的溶质的质量分数=(溶质的质量+溶剂的质量)×溶液中溶质的质量分数3、溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度=溶质的质量÷溶液中溶质的质量分数有关溶液稀释的计算(抓住稀释前、后溶质的质量不变;;浓:指溶质质量分数大的溶液;稀:指溶质质量分数小的溶液)浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数=(浓溶液的质量+增加的溶剂的质量) ×稀溶液中溶质的质量分数有关求反应后溶液的质量或反应后溶液中溶质的质量分数的计算1、反应后溶液的质量=反应前各物质的质量总和—生成气体的质量—生成沉淀的质量2、反应后溶液中溶质的质量分数=反应后溶质的质量/反应后溶液的质量×100﹪利用化学方程式简单计算的步骤:设、写、列、解、答。

九年级化学上册化学方程式质量分数的计算1、利用化学方程式计算的依据是化学方程式表示的各物质之间的质量比是固定不变的。
各物质的质量比等于各物质的相对分子质量与其化学计量数乘积之比。
2、利用化学方程式计算的基本步骤(1)设:根据题意设未知量。
(2)写:正确书写反应的化学方程式。
(3)找:找出已知量与未知量的质量关系。
①根据化学方程式求出相关物质的化学计量数与相对分子质量的乘积,标在其化学式下面;②把题中已知量和待求未知量标在相应物质的化学计量数与相对分子质量的乘积的下面。
(4)列:列出比例式,求解。
(5)答:简明地写出答案。
【例一】过氧化钙(CaO2)是一种化学增氧剂,其反应原理是2CaO2 + 2H2O = 2Ca(OH)2 + O2↑请回答:2.88g过氧化钙放入足量水中,完全反应后,生成氧气的质量是多少?【解析】设2.88gCaO2完全反应生成O2的质量为x()++↑2CaO2H O =2Ca OH O2222144322.88g x144 2.88g=32xx=0.64g答:完全反应可生成0.64g氧气。
【例二】在合成氨工业中,常用碳酸钾溶液吸收产生的二氧化碳得到碳酸氢钾,反应的化学方程式为:K2CO3+CO2+H2O=2KHCO3。
现向碳酸钾溶液中通入二氧化碳,完全反应后得到溶质质量分数为10%的溶液50 g。
(1)把该50 g溶液稀释成溶质质量分数为4%的溶液,需加水的质量是75g。
(2)碳酸钾溶液中所含溶质的质量是多少?3.45g。
【解析】溶液稀释前后溶质质量不变。
(1)设需加水的质量是x()⨯⨯50g10%=50g+x4%x=75g故把该50 g溶液稀释成溶质质量分数为4%的溶液,需加水的质量是75g。
(2)碳酸氢钾的质量为50 gx10%=5g设碳酸钾溶液中所含溶质的质量是xK CO+CO+H O=2KHCO23223138200x5g138200=x 5gx=3.45g故碳酸钾溶液中所含溶质的质量是3.45g 。


计算题考点一、有关化学式的计算【考点扫描】1、计算相对分子质量相对分子质量等于化学式中各原子的相对原子质量的代数和。
2、计算化合物中各元素的质量比化合物中各元素的质量比就是化学式中各原子的相对原子质量代数和的比值。
3、计算化合物中某元素的质量分数某元素质量分数=%100⨯⨯物质的相对分子质量原子的个数元素的相对原子质量4、某元素质量与物质质量之间的换算某元素质量=某元素的质量分数×物质的质量★有关化学式计算的考点归纳1、历年中考的热门考点归纳如下:以CO(NH 2)2为例①计算物质的相对分子质量:12+16+(14+1×2)×2=60②化合物中的各原子的个数比:C :H :O :N=1:4:1:2★★此处C 、H 、O 、N 切忌对应顺序颠倒③各元素的质量比:C :H :O :N=(12×1):(1×4):(16×1):(14×2)=3:1:4:7④计算物质中某元素的质量分数:N%=60214⨯×100%≈46.7%.⑤某元素质量与物质质量之间的换算、某物质在混合物中的百分比2、得分的关键如下:①注意计算的准确性②单位的换算③计算结果的精确度(看清题目是否要求保留几位小数)【例题精讲】1科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C 3H 5ON ).请你完成下列问题:(1)丙烯酰胺(C 3H 5ON )的相对分子质量为;(2)丙烯酰胺中碳元素和氧元素的质量比为;(3)氢元素的质量分数为。
【解析】(1)丙烯酰胺的相对分子质量是12×3+1×5+16+14=71.故填:71;(2)丙烯酰胺中碳元素、氧元素的质量比=(12×3):16=9:4.故填:9:4;(3)丙烯酰胺(C3H5ON)中氢元素的质量分数=≈7%.故填:7%.2如图为某分子的结构模型,请回答下列问题:(1)这种分子的化学式为;该物质是白酒的主要成分,化学名称为。

九年级化学计算题
题目:现有一定质量的锌粉加入到盛有200g稀硫酸的烧杯中,恰好完全反应,反应后烧杯内物质总质量为209.8g。
求:(1)生成氢气的质量;(2)稀硫酸中溶质的质量分数。
解析:
1. 计算氢气质量
- 根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量。
反应前锌粉和稀硫酸的总质量,反应后是烧杯内剩余物质和氢气的总质量。
- 设生成氢气的质量为公式。
- 反应前锌粉和公式稀硫酸的总质量,反应后烧杯内物质总质量为公式,则公式,因为锌与稀硫酸反应公式
,所以公式。
- 生成氢气的质量公式,由于锌粉的质量在计算氢气质量时不需要单独求出,根据质量守恒定律,公式
,所以公式。
2. 计算稀硫酸中溶质的质量分数
- 设稀硫酸中溶质公式的质量为公式。
- 根据化学方程式公式,可得公式
(公式的相对分子质量为公式,公式的相对分子质量为公式)。
- 解得公式。
- 稀硫酸中溶质的质量分数公式。

初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。

九上化学计算题50道1. 一氧化碳和氧气在焰燃烧器内反应生成二氧化碳和水,如果燃烧了500 mL的一氧化碳,需要多少氧气才能完全燃烧?2. 在反应中,硫酸和氢氧化钠生成硫酸钠和水。
如果你有100 g硫酸和150 g氢氧化钠,请问你最多能生成多少钙铁矿?3. 如果你有100 mL的4 M HCl,你需要加多少水才能得到2 M HCl?4. 在反应中,氢气和氧气生成水。
如果你有20 g氢气和80 g氧气,请问你最多能生成多少水?5. 如果你有5 g氢气和10 g氧气,你可以生成多少水?6. 如果你有100 mL的0.1 M NaOH溶液,你可以用它来中和多少硫酸?7. 在反应中,氮气和氢气生成氨。
如果你有50 g氢气,你需要多少氮气才能生成最多的氨?8. 如果你有100 mL的2 M HNO3,你可以中和多少钠氢碳酸?9. 在反应中,碳酸钠和盐酸生成氯化钠、二氧化碳和水。
如果你有10g碳酸钠和20 mL 1 M盐酸溶液,请问你最多能生成多少氯化钠?10. 如果你有10 g氨气和20 g氯气,他们可以产生多少氯化铵?11. 在反应中,五氧化二磷和水生成磷酸。
如果你有50 g五氧化二磷,你需要多少水才能产生最多的磷酸?12. 如果你有100 mL的1 M NaCl溶液,你可以用它来沉淀多少AgCl?13. 在反应中,硫酸和铝金属生成氢气和铝硫酸。
如果你有20 g铝金属和60 mL1 M硫酸溶液,请问你最多能反应出多少氢气?14. 如果你有10 g氮气和20 g氧气,他们可以产生多少硝酸?15. 在反应中,硫酸和氢氧化钾生成钾硫酸和水。
如果你有100 g硫酸和150 g氢氧化钾,请问你最多能生成多少钾硫酸?16. 如果你有100 mL的0.1 M NaOH溶液,你可以用它来中和多少盐酸?17. 在反应中,氧气和硫化氢生成二氧化硫和水。
如果你有50 g氧气,你需要多少硫化氢才能产生最多的二氧化硫?18. 如果你有10 g氮气和20 g氢气,他们可以产生多少氨?19. 在反应中,氢气和盐酸生成氯化氢。

化学计算公式大全总结初中一、有关化学式的计算。
1. 相对分子质量(Mr)- 定义:化学式中各原子的相对原子质量的总和。
- 计算公式:- 对于单质,如O_2,Mr = 16×2 = 32;- 对于化合物,如H_2O,Mr=(1×2 + 16)=18。
2. 元素质量比。
- 计算公式:在化合物AxBy中,A、B元素的质量比=(A元素的相对原子质量× x):(B元素的相对原子质量× y)。
- 例如,在CO_2中,碳、氧元素的质量比=(12×1):(16×2)=12:32 = 3:8。
3. 元素的质量分数。
- 计算公式:ω(A)=(A元素的相对原子质量×原子个数)/(相对分子质量)×100%- 例如,在NH_4NO_3中,氮元素的质量分数ω(N)=(14×2)/(14×2 +1×4+16×3)×100%=(28)/(80)×100% = 35%二、有关化学方程式的计算。
1. 根据化学方程式计算的依据。
- 化学方程式中各物质之间的质量比等于相对分子质量(或相对原子质量)与化学计量数的乘积之比。
- 例如:2H_2+O_2{点燃}{===}2H_2O,H_2、O_2、H_2O的质量比为(2×2):32:(2×18)=4:32:36 = 1:8:9。
2. 计算步骤(以加热分解15.8g高锰酸钾制取氧气为例)- 设未知量:设可制取氧气的质量为x。
- 写出反应的化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2 + O_2↑。
- 找出相关物质的相对分子质量和已知量、未知量:- KMnO_4的相对分子质量=39 + 55+16×4 = 158,O_2的相对分子质量=32。
- 已知KMnO_4的质量为15.8g。
- 列比例式求解:- 根据化学方程式中KMnO_4与O_2的质量比(2×158):32,可列出比例式(2×158)/(32)=(15.8g)/(x),解得x = 1.6g。

九年级化学化学计算题题20套(带答案)含解析一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
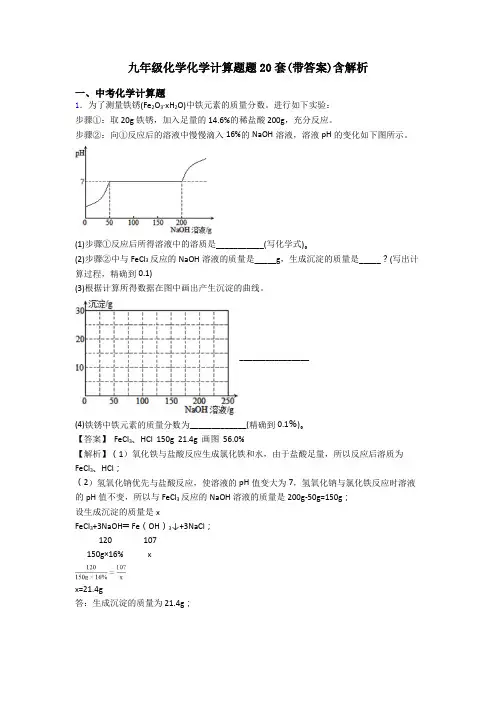
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
求:(1)铜锌合金中,Zn的质量分数是________。
(2)所用稀硫酸溶液中溶质的质量分数是__________?【答案】65% 19.6%【解析】试题分析:(1)铜锌合金与稀硫酸反应,其中只有锌与硫酸反应,故固体减少的量即为锌的质量=10g-3.5g=6.5g,则Zn%=6.5g/10g×100%=65%(2)解:设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑65 986.5g 50gx65/98=6.5g/50gxx=19.6%答:锌的质量是65%;所用稀硫酸中溶质的质量分数为19.6%考点:合金、化学方程式计算3.某炼铝工厂想测定铝土矿中A12O3的含量,将矿石粉碎(其中杂质不溶于水,不与酸反应,且不含铝元素),进行如下实验,第一步反应的物质质量关系如坐标图所示:(1)上述实验过程中发生反应的化学方程式是_____;(2)根据已知条件列出求解第一步实验铝土矿中参加反应的A12O 3质量(x)的比例式_____ (3)铝土矿样品中A12O 3的含量_____;(4)坐标图中B 点所示溶液中溶质的化学式是_____;(5)在第二步实验结束后所得溶液中溶质的质量分数是_____(6)用1700t 此铝土矿冶炼得到540t 的铝,则在冶炼中,铝土矿的利用率是_____。
初中化学计算题及答案
计算题1:
题目:已知一瓶酒精溶液体积为200毫升,浓度为60%,求其中含有酒精的质量是多少?
解答:首先需要知道酒精溶液的浓度是指溶液中酒精的质量与溶液的总质量的比值,以百分比表示。
浓度等于酒精的质量除以溶液的体积。
所以,酒精的质量 = 浓度 * 溶液的体积。
= 60% * 200毫升
= 0.6 * 200毫升
= 120毫升
故其中含有酒精的质量为120毫升。
计算题2:
题目:已知一块铁块的体积为200立方厘米,密度为7.8克/立方厘米,求该铁块的质量是多少?
解答:密度是物质的质量与单位体积的比值,以克/立方厘米表示。
所以,质量等于密度乘以体积。
所以,铁块的质量 = 密度 * 体积
= 7.8克/立方厘米 * 200立方厘米
= 1560克
故该铁块的质量为1560克。
25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
初中化学计算题及答案一、摩尔质量计算1. 计算氯化铜(II)的摩尔质量氯化铜(II)的化学式为CuCl2,分子量为63.55 + 2 × 35.45 = 134.45 g/mol。
因此,氯化铜(II)的摩尔质量为134.45 g/mol。
2. 计算亚硝酸铜(II)五水合物的摩尔质量亚硝酸铜(II)五水合物的化学式为Cu(NO2)2·5H2O,分子量为63.55 + 2 × 14.01 + 2 × 16.00 + 5 × 18.02 = 241.60 g/mol。
因此,亚硝酸铜(II)五水合物的摩尔质量为 241.60g/mol。
二、反应式计算1. 计算制备一克氧化锌需要多少克氢氧化钠反应式为:Zn(OH)2 + 2 NaOH → Na2ZnO2 + 2 H2O根据反应式,摩尔比为 1:2:1:2,因此反应需要 2 摩尔的氢氧化钠与 1 摩尔的氧化锌反应生成 1 摩尔的 Na2ZnO2。
氧化锌的摩尔质量为 81.39 g/mol,因此制备 1 克氧化锌需要 1 / 81.39 = 0.0123 摩尔的氧化锌。
根据摩尔比,2 摩尔的氢氧化钠与 1 摩尔的氧化锌反应生成 1 摩尔的 Na2ZnO2,因此需要 2 × 0.0123 = 0.0246 摩尔的氢氧化钠。
氢氧化钠的摩尔质量为 40.00 g/mol,因此制备 0.0246 摩尔的氢氧化钠需要0.0246 × 40.00 = 0.98 克氢氧化钠。
因此,制备一克氧化锌需要 0.98 克氢氧化钠。
2. 计算制备 10 克硫酸铜(II)需要多少克铜反应式为:Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O根据反应式,摩尔比为 1:2:1:1,因此反应需要 1 摩尔的铜与 2 摩尔的硫酸反应生成 1 摩尔的硫酸铜和 1 摩尔的二氧化硫。
硫酸铜(II)的摩尔质量为 159.61 g/mol,因此制备 10克硫酸铜(II)需要 10 / 159.61 = 0.0627 摩尔的硫酸铜(II)。
(一)根据化学式计算一、基础知识1.化学式:用元素符号来表示物质组成的式子.2.化学式(分子式)表示的含义:(1)表示该物质的一个分子.(2)表示构成一个分子的各种原子的原子个数.(3)表示一种物质及组成该物质的各种元素.3.常用的计算关系式(以化合物A m B n为例):(1)相对分子质量=A的相对原子质量×m+B的相对原子质量×n(2)A的质量分数(3)A、B元素的质量比(4)A元素的质量=化合物质量×A的质量分数(5)在混合物中,某物质的质量分数(纯度)(杂质不含该元素时)4.两种物质的质量比等于相对分子质量×分子个数之比.5.两种元素的原子个数比等于它们的质量比除以相对原子质量之比.一·例题解析例1、为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐。
碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。
1000g碘盐中约含0.02g碘。
(相对原子质量:K-39 I-127 O-16)(1)__________g碘酸钾中含有0.02g碘。
(保留小数点后3位)(2)成人每天约需1.5×10-4g碘,假设这些碘是从碘盐中摄取的,成人每天需要食用碘盐解析:碘盐中碘元素的质量=碘盐中碘酸钾的质量×碘酸钾中碘元素的质量分数(1)碘酸钾中碘元素的质量分数为:×100%=59.3%需碘酸钾的质量为:0.02g/59.3%=0.034g(2)需要食用碘盐的质量为:1.5×10-4g/x=0.02g/1000g x=7.5g答案:(1)0.034(2)7.5例2、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。
营养学家指出每天铝的安全摄入量为每千克体重0.7mg。
请回答下列问题:(1)传统食品加工过程中,一般在1kg面粉中加入1g明矾(已知:明矾的化学式为KAl(SO4)2·12H2O,其相对分子质量是474;1g = 1000mg)。
(化学)初三化学化学计算题常见题型及答题技巧及练习题(含答案)(化学)初三化学化学计算题常见题型及答题技巧及练习题(含答案)⼀、中考化学计算题1.化学兴趣⼩组的同学⽤⼀瓶含有少量氯化钠和氯化钙的固体混合物进⾏下列实验:取样品14 g,放⼊烧杯中,加⼊96 g碳酸钠溶液恰好完全反应后过滤,称得滤液的总质量为100 g。
(1)根据质量守恒定律,可知⽣成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是___________?(3)所得滤液中溶质的质量分数是__________?【答案】10 g 2.9 g 14.6%【解析】(1) 、根据质量守恒定律可知,反应前物质质量总和=反应后物质质量总和,即反应前所有混合物的总质量=滤液的总质量+⽣成沉淀的质量;(2)、根据化学⽅程式中各物质之间的质量⽐,利⽤碳酸钙沉淀的质量,列出⽐例式,即可计算出固体混合物中氯化钙的质量。
(3) 、根据题意,反应完全后过滤,所得滤液为氯化钠溶液,滤液中的溶质NaCl包括混合物中原有的NaCl和反应⽣成的NaCl;根据上述⽅程式可以求出⽣成NaCl的质量,⽽混合物中原有的NaCl的质量=混合物总质量-氯化钙的质量,据此可以计算出滤液中溶质的质量,然后根据溶质质量分数= 溶质质量溶液质量×100%计算即可。
解:(1) 、根据质量守恒定律,⽣成沉淀的质量=14g+96g-100g=10g;(2)、设固体混合物中含氯化钙的质量为x,反应后⽣成氯化钠的质量为y。
Na2CO3+CaCl2=CaCO3↓+2NaCl111 100 117x 10g y111100117=10x g y=解得,x=11.1g y=11.7g(3) 、原混合物中含氯化钠的质量=14g-11.1g=2.9g则所得滤液中溶质的质量分数=2.911.7100g gg+×100%=14.6%答:(2)、原固体混合物中氯化钙的质量为11.1g;(3) 、所得滤液中溶质的质量分数为14.6%。
九年级上册化学计算题一、有关化学式的计算。
1. 计算硝酸铵(NH_4NO_3)中氮元素的质量分数。
- 解析:- 根据化学式求出硝酸铵的相对分子质量,NH_4NO_3中,N的相对原子质量为14,H的相对原子质量为1,O的相对原子质量为16。
- 硝酸铵的相对分子质量M = 14×2 + 1×4+16×3=80。
- 硝酸铵中氮元素的质量分数ω(N)=(14×2)/(80)×100% = 35%。
2. 多少克氧化铁(Fe_2O_3)中含铁元素56g?- 解析:- 首先求出氧化铁中铁元素的质量分数。
- 在Fe_2O_3中,Fe的相对原子质量为56,O的相对原子质量为16。
- 氧化铁的相对分子质量M = 56×2+16×3 = 160。
- 铁元素的质量分数ω(Fe)=(56×2)/(160)×100% = 70%。
- 设质量为x的氧化铁中含铁元素56g,则x×70% = 56g,解得x = 80g。
3. 某铁的氧化物中铁元素与氧元素的质量比为7:3,求该氧化物的化学式。
- 解析:- 设该铁的氧化物的化学式为Fe_xO_y。
- 已知铁元素与氧元素的质量比为7:3,铁的相对原子质量为56,氧的相对原子质量为16。
- 则(56x)/(16y)=(7)/(3),通过计算可得(x)/(y)=(2)/(3),所以该氧化物的化学式为Fe_2O_3。
4. 已知某化合物的化学式为H_nRO_2n - 1,其相对分子质量为M,求R的相对原子质量。
- 解析:- 根据相对分子质量的定义,相对分子质量等于各原子相对原子质量之和。
- 在H_nRO_2n - 1中,H的相对原子质量为1,O的相对原子质量为16。
- 则M = n×1+R+(2n - 1)×16=n + R+32n-16=R + 33n-16。
- 所以R = M - 33n + 16。