人教高一化学第五章 化工生产中的重要非金属元素 单元测试
- 格式:doc
- 大小:716.50 KB
- 文档页数:22

第五章《化工生产中的重要非金属元素》测试题一、单选题(共12题) 1.下列说法正确的是A .FeS 2在沸腾炉中与O 2反应主要生成SO 3B .Na 加入到CuCl 2溶液中可得CuC .NaOH 在空气中变质最终生成Na 2CO 3D .H 2O 2溶液中加入少量MnO 2粉末生成H 2和O 2 2.下列各组离子在指定操作下一定能大量共存的是 A .加入M g 产生2H 的溶液:4N H +、3N O -、N a +B .通入2S O 后的溶液:3F e+、2B a+、C l -C .加入22N aO后的溶液:23S O -、2S-、K +D .加入少量4C u S O 的溶液:4N H +、H +、C l -3.下列说法正确的是A .“液氯”因其具有强氧化性不能用钢瓶运输B .氧化镁具有较高的熔点,常被用于耐高温材料C .在医疗上,纯碱可用于治疗胃酸过多,但不能用于胃穿孔病人D .硅是一种重要的半导体材料,常被用于制造光导纤维4.3K C lO 和2M n O (催化剂)的混合物加热分解,现要对反应完全后所得的混合物进行分离,为此有下列方法可供选择:(a)干燥(b)过滤(c)溶解(d)水洗(e)盐酸洗涤(f)高温灼烧(g)蒸发结晶(h)高温加碳还原.其中正确的组合是 A .(c)(b)(d)(a)(e)B .(c)(b)(g)(h)C .(c)(b)(d)(e)(f)D .(c)(b)(d)(a)(g)5.如图所示为“双色双喷泉”实验装置。
图中烧瓶内分别充了氨气和氯化氢,烧杯内盛放滴有石蕊试液的蒸馏水。
下列说法错误的是二、非选择题(共10题)13.硫酸在下列用途或反应中各表现的性质是:A.强酸性B.高沸点难挥发性C.吸水性D.脱水性 E.强氧化性(1)干燥H2、SO2等气体_______;(2)实验室用食盐与浓硫酸反应制备氯化氢气体_______;(3)胆矾中加入浓硫酸,久置变为白色粉末_______;(4)蔗糖中加入浓硫酸,形成“黑色发糕”_______;(5)浓硫酸与木炭共热_______。

一、选择题1.新教材实验,如图所示,在注射器里吸入20mLNO(标况),然后吸入5mL水。
若再吸入30mL空气(标况,O2占15计算),夹住弹簧夹,让内外大气压相同,观察。
下列叙述不正确的是A.可观察到注射器内气体由无色变成红棕色,最后变成无色B.可观察到注射器的活塞缓缓向右移动C.最终剩余气体体积约为36mLD.所得硝酸溶液的浓度约为0.07mol/L2.新教材中,浓硝酸和稀硝酸与铜反应的实验,用NaOH来吸收尾气,如图所示,下列叙述正确的是A.铜丝与浓硝酸反应只能产生NO2气体B.铜丝与浓硝酸可看到红棕色的气体和绿色溶液的生成C.铜丝与稀硝酸反应产生无色气体,但能被NaOH溶液吸收D.铜丝与少量的稀硝酸结束后,再加稀硫酸,伸入铜丝也不能产生气体3.下列说法正确的是A.等物质的量Cl2和SO2同时通入品红溶液,褪色更快B.标准状况下,1 mol Na2O2和22.4LSO2反应生成Na2SO4,转移电子数目为N A C.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质D.在Na2O2中阴阳离子所含的电子数目相等4.将3.84g铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO、NO2混合气体2.24L(标准状况下),则所消耗酸的物质的量是A.0.1mol B.0.11mol C.0.16mol D.0.22mol5.为检验溶液里的某种离子,进行下列实验,其中结论正确的是A.溶液中加AgNO3溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含Cl-B.溶液中加入BaCl2溶液有白色沉淀,再加入稀盐酸沉淀不溶解,则溶液中含SO24C.溶液中加入NaOH溶液,加热,产生使湿润红色石蕊试纸变蓝的气体,溶液中一定NH4+D.溶液中加入稀HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含CO23-6.下列叙述Ⅰ和叙述Ⅱ均正确并有因果关系的是选项叙述Ⅰ叙述ⅡA常温下,碳可与浓硝酸剧烈反应浓硝酸具有强氧化性B SiO2可与氢氟酸反应,又可与氢氧化钠溶液反应SiO2是两性氧化物C新制的氯水使蓝色石蕊试纸变白氯水具有漂白性D SO2可使滴加酚酞的NaOH溶液褪色SO2具有漂白性A.A B.B C.C D.D7.下列有关实验操作、现象和解释或结论都正确的是选项实验操作现象解释或结论A 过量的Fe粉中加入少量稀HNO3充分反应后,滴入KSCN溶液溶液呈红色稀HNO3将 Fe氧化为Fe2+B将充满氨气的烧瓶倒置于水中水迅速充满烧瓶氨气极易溶于水C用玻璃棒蘸取浓氨水点在蓝色石蕊试纸上试纸变红色浓氨水呈碱性D取适量浓HNO3加热有红棕色气体产生HNO3有强氧化性A.A B.B C.C D.D8.用如图装置探究Cl2和NO2在NaOH溶液中的反应。

一、选择题1.如图是氮氧化物(NO x)储存还原的工作原理:NO x的储存过程与还原过程在不同时刻是交替进行的。
下列有关说法不正确的是A.“还原”过程中,Ba(NO3)2转化为BaOB.在储存还原过程中,Pt作催化剂C.在储存还原过程中,参加反应的NO和O2的物质的量之比为2∶1D.若还原性气体为H2,则参加反应的H2与生成的N2的物质的量之比是5∶12.下列说法正确的是A.等物质的量Cl2和SO2同时通入品红溶液,褪色更快B.标准状况下,1 mol Na2O2和22.4LSO2反应生成Na2SO4,转移电子数目为N AC.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质D.在Na2O2中阴阳离子所含的电子数目相等3.下列离子在指定溶液中能大量共存的是A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO24-B.1.0 mol·L-1的FeCl2溶液:NO3-、Na+、K+、ClO-C.使酚酞变红的溶液中:Na+、Cl-、SO24-、Fe3+D.酸性溶液中:NO3-、SO24-、Fe3+、Mg2+4.用下列装置进行相应实验,能达到实验目的的是A B C D验证浓H2SO4的脱水性、强氧制备少量O2,其优证明非金属性强弱:N配制100 mL一定物化性点是能随时控制反应的发生和停止>C>Si质的量浓度的硫酸溶液A.A B.B C.C D.D5.无色的混合气体甲,可能含NO、CO2、NO2、NH3、O2、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为A.NH3、NO、O2B.NH3、NO、CO2C.NH3、NO2、CO2D.NO、CO2、N2 6.运输化学药品浓硫酸的车辆,应该张贴的标志为( )A.B.C.D.7.对于某些离子的检验及结论一定正确的是A.向某溶液中滴加紫色石蕊试液,溶液变红,原溶液一定是酸。

新高中化学第五章化工生产中的重要非金属元素练习题一、选择题1.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,将产生的气体和6.72L(标准状况下)氧气混合通入水中,恰好全部被水吸收.向反应后的溶液中加入足量4mol/L﹣1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是A.63.8 g B.53.6 g C.46.8 g D.43.2 g【答案】C【解析】试题分析:Mg、Cu与稀硝酸发生反应变为Mg2+、Cu2+,硝酸得到电子被还原变为NO,在反应过程中金属失去电子的物质的量与硝酸得到电子的物质的量相等,NO与氧气反应又转化为硝酸,则转移的电子就是氧气得到的电子,氧气是6.72L÷22.4L/mol=0.3mol,则电子转移的物质的量是n(e-)=0.3mol×4=1.2mol。
当向反应后的溶液中加入过量的NaOH溶液时,金属形成Mg(OH)2、Cu(OH)2沉淀,结合的OH-的物质的量与金属单质失去电子的物质的量相等。
因此形成沉淀的质量就是金属质量与氢氧根离子的质量和,m(OH-)=nM=1.2mol×17g/mol=20.4g,所以沉淀的质量是26.4g+20.4g=46.8g,答案选C。
【考点定位】本题主要是考查守恒方法在氧化还原反应的计算中的应用的知识。
【名师点晴】许多有关化学反应的计算,如果能够巧妙地运用守恒规律可以达到快速解题的目的,常见的守恒关系有:①反应前后元素种类和某种原子总数不变的原子守恒;②电解质溶液中的电荷守恒;③氧化还原反应中得失电子数守恒、原电池或电解池中两极通过的电子总数相等;④从守恒思想出发还可延伸出多步反应中的关系式,运用关系式法等计算技巧巧妙解题。
2.下列说法正确的是( )A.晶体硅常用于制造光导纤维B.碳酸钠常用于治疗胃酸过多C.明矾常用于自来水的消毒杀菌D.高压钠灯常用于道路和广场照明【答案】D【详解】A.二氧化硅用于制造光导纤维,晶体硅可用于制造晶体管及太阳能电池,A错误;B.碳酸氢钠常用于治疗胃酸过多,而碳酸钠溶液碱性强,对人会产生一定的腐蚀作用,因此不能用于治疗胃酸过多,B错误;C.明矾具有净水作用但无强氧化性,因此常用于自来水的净化,但不能对水进行消毒杀菌,C错误;D.高压钠灯发出的黄光穿透力强,因此常用于道路和广场照明,D正确;故合理选项是D。
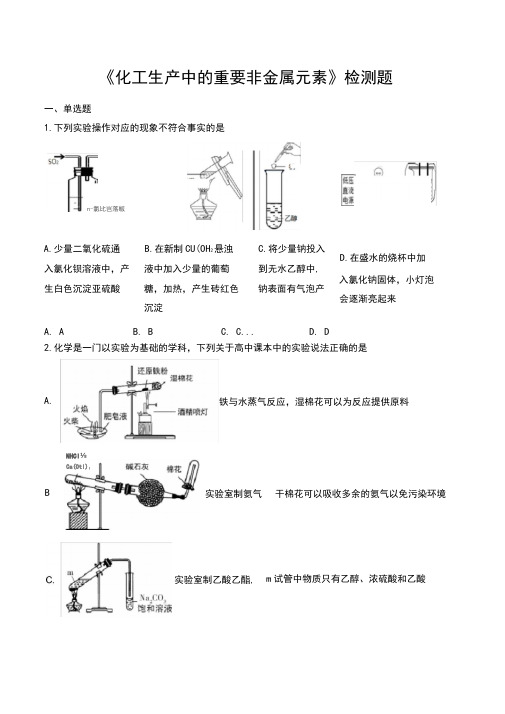
《化工生产中的重要非金属元素》检测题一、单选题1.下列实验操作对应的现象不符合事实的是2.化学是一门以实验为基础的学科,下列关于高中课本中的实验说法正确的是A.少量二氧化硫通B.在新制CU(OH 2悬浊C.将少量钠投入入氯化钡溶液中,产 液中加入少量的葡萄 到无水乙醇中, D.在盛水的烧杯中加生白色沉淀亚硫酸糖,加热,产生砖红色 沉淀钠表面有气泡产入氯化钠固体,小灯泡 会逐渐亮起来A. AB. BC. C...D. D铁与水蒸气反应,湿棉花可以为反应提供原料干棉花可以吸收多余的氨气以免污染环境m 试管中物质只有乙醇、浓硫酸和乙酸n -氯比岂落皈A.BNHCl ⅛Ca(Otl)I实验室制氨气 实验室制乙酸乙酯,K√AgCI)>K sp (Agl)>K SP (Ag 2S)3.下列有关物质检验的实验结论正确的是A. AB. BC. CD. D4.向四支试管中分别加入少量不同的无色溶液并进行如下操作,其中结论正确的是A. AB. BC. CD. D5. CaCO 是一种化工原料,可以通过反应生成一系列物质,如图所示D.足■的 卜κ∣fS ⅛βf- gs 需液沉淀溶解转化实验,不能用来说明^AgfW J ⅛⅛巻反应瀧會物下列说法正确的是()A.C∣2和SO?均可以漂白有色物质,且漂白的原理相同咼温B.由SiO2+Na2CO3 Na2SiO3+CO2 可知H2CO3的酸性强于H2SQ3C工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应6.化学与生产、生活及环境密切相关,下列有关说法不正确..的是A.二氧化硫有毒,严禁将其添加到任何食品和饮料中B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗C《本草经集注》中记载了区分硝石(KNQ)和朴消(Na z SQ)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”D用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的7.生活中处处有化学,下列说法正确的是A.煎炸食物的花生油和牛油都是可皂化的饱和高级脂肪酸甘油酯B.晶体硅可作光伏电池材料,其性质稳定,不与酸、碱发生反应C雾霾天气会危害人类的健康,“雾”和“霾”的分散质微粒不同D“绿色化学”的核心是应用化学原理对环境污染进行治理8.某溶液中可能有下列离子大量存在:NH+、Ba2+、K、Mg+、OH、SQ2-,加入过量NaOH并加热,产生有刺激性气味的气体。

人教高一化学第五章化工生产中的重要非金属元素知识点总结含答案解析一、选择题1.某稀硫酸和稀硝酸混合溶液100 mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示。
下列说法错误的是()A.H2SO4浓度为4 mol/LB.溶液中最终溶质为FeSO4C.原混合酸中NO3-浓度为0.2 mol/LD.AB段反应为:Fe+2Fe3+=3Fe2+【答案】C【分析】由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.最终消耗Fe为22.4g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe),由硫酸根守恒n(H2SO4)=n( FeSO4),根据OA段离子方程式计算原混合酸中NO3-物质的量,再根据c=nV计算c(H2SO4)、c(NO3-)。
【详解】A、反应消耗22.4g铁,也就是22.4g÷56g/mol=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是4mol/L,A正确;B、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,B正确;C、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n (NO3-)=n(Fe)=0.2mol,NO3-浓度为2mol/L,C错误;D、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,D正确。
答案选C。
【点晴】该题难度较大,解答的关键是根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用。
在做此类题目时,应当先分析反应的过程,即先发生的是哪一步反应,后发生的是哪一步。
第五章化工生产中的重要非金属元素一、单选题1.碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。
实验室中利用下列流程制备La2(CO3)•xH2O。
下列说法正确的是A.镧(57La)为第VIIA族元素B.“洗气”环节用Na2CO3除去CO2中的HCl杂质C.“制备”环节应先通入CO2,再通入NH3D.生成产品的反应为:2LaCl3+6NH3+3CO2+(x+3)H2O=La2(CO3)3•xH2O↓+6NH4Cl 2.化学与生产、生活密切相关。
下列有关说法错误的是A.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法B.中国天眼FAST用到的高性能镜片材料碳化硅是一种新型的有机高分子材料C.从石墨中剥离出的石墨烯薄片能导电,石墨不是电解质D.NaClO溶液中含有HClO,流感季节,可用一定浓度NaClO溶液对环境消毒3.室温下,1体积的水能溶解约40体积的SO2。
用试管收集SO2后进行如下实验。
对实验现象的分析正确的是A.试管内液面上升,证明SO2与水发生了反应B.试管中剩余少量气体,是因为SO2的溶解已达饱和C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3、H2SO3⇌H++HSO3-、HSO3-⇌H++SO32-D.取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发4.下列说法不正确...的是A.胆矾和石灰乳混合可制得一种常用农药“波尔多液”B.金属钠不能保存在石蜡中,以免两者相互反应产生氢气发生爆炸C.碳纳米点是一种直径小于10 nm的材料,不是胶体D.燃料的脱硫、NO x的催化转化都是减少酸雨产生的措施5.下列气体中极易溶于水的是A.O2B.H2C.NH3D.NO6.下列转化不可以一步实现的是A.SiO2→H2SiO3B.Cu→CuSO4C.SO3→Na2SO4D.N2O5→N27.类推的思维方式在化学学习与研究中经常采用。
第五章《化工生产中的重要非金属元素》测试题一、单选题(共12题)1.价-类二维图是学习元素化合物知识的重要方法,某同学绘制某常见元素的价-类二维图如图所示。
下列推断合理的是A .f 与e 的水溶液混合后溶液变浑浊B .图中按箭头所示的转化均可一步实现C .标况下,1mol b 和c 的混合物体积为22.4LD .可用盐酸酸化的氯化钡检验e 是否变质2.下列离子方程式书写正确的是A .向4CuSO 溶液中通入2H S 气体:22Cu S CuS +-+=↓B .将FeO 固体放入稀硝酸中:22FeO 2H Fe H O +++=+C .4NaHSO 溶液与2Ba(OH)溶液反应至溶液呈中性:224422H SO Ba2OH BaSO 2H O +-+-+++=↓+ D .用氨水吸收烟气中的二氧化硫:2232SO 2OH SO H O --+=+ 3.将盛有22mLNO 2和O 2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL 无色气体,则原混合气体中O 2的体积和剩余的2mL 气体可能分别是A .1.2mL ,NOB .2.4mL ,O 2C .3.2mL ,NOD .4mL ,O 2 4.下列试剂需保存于棕色试剂瓶中的是( )A .浓硫酸B .浓盐酸C .氢氧化钠D .硝酸 5.化学与社会、生产、生活和科技都密切相关。
下列有关说法不正确的是 A .“天宫二号”使用的碳纤维,是一种新型无机高分子材料B .2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。
利用此类光学显微镜可以观察活细胞内蛋白质等大分子 C .“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 D .福尔马林可浸制标本,因其可使蛋白质变性6.将一定量的2SO 通入2BaCl 溶液中,再加入适量22H O 溶液,一定会大量增加的是 A .H + B .24SO - C .2Ba + D .Cl -7.能鉴别CO 2和SO 2的试剂是A .氯化钙溶液B .澄清石灰水C .紫色石蕊试液D .溴水 8.下列说法不正确的是A .定容时,因不慎使液面高于容量瓶的刻度线,需重新配制B .焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验C .将紫色石蕊试液滴入稀盐酸中,可以看到溶液由无色变红色D .提纯含有少量硝酸钡杂质的硝酸钾溶液,加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸9.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。
一、选择题1.如图是氮氧化物(NO x)储存还原的工作原理:NO x的储存过程与还原过程在不同时刻是交替进行的。
下列有关说法不正确的是A.“还原”过程中,Ba(NO3)2转化为BaOB.在储存还原过程中,Pt作催化剂C.在储存还原过程中,参加反应的NO和O2的物质的量之比为2∶1D.若还原性气体为H2,则参加反应的H2与生成的N2的物质的量之比是5∶12.新教材实验,如图所示,在注射器里吸入20mLNO(标况),然后吸入5mL水。
若再吸入30mL空气(标况,O2占15计算),夹住弹簧夹,让内外大气压相同,观察。
下列叙述不正确的是A.可观察到注射器内气体由无色变成红棕色,最后变成无色B.可观察到注射器的活塞缓缓向右移动C.最终剩余气体体积约为36mLD.所得硝酸溶液的浓度约为0.07mol/L3.可用于检验SO24的试剂是A.稀硝酸B.NaOH C.BaCl2D.KNO34.固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。
某化学兴趣小组为确定该固体粉末的成分,取X进行连续实验,实验过程及现象如图:下列说法正确的是A.气体乙和气体丙都为纯净物B.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有NaHCO3、Na2CO3C .溶液丁中一定含有H +、Fe 2+,可能含有Fe 3+D .溶液甲中一定含有AlO 2-,可能含有CO 23-5.运输化学药品浓硫酸的车辆,应该张贴的标志为( )A .B .C .D .6.下列各组物质,不满足组内任意两种物质在一定条件下均能发生反应的是( )甲乙 丙A()()32Fe NO aq()32NH H O aq ⋅ ()3HNO aqB NaOH(aq) ()3NaHCO aq ()24H SO aqC ()2SiO s C(s)()2H O gD()2Cl g ()3FeBr aqNaI(aq)A .AB .BC .CD .D 7.下列化合物能由两种单质直接化合生成的是 A .FeCl 2B .NO 2C .CuSD .SO 28.下列有关实验描述正确的是A .在某溶液中加入稀盐酸,产生无色无味的气体,该气体能使澄清石灰水变混浊,证明其中含有CO 2-3B .要证明某烧碱溶液中可能含有Cl -,应先加稀盐酸酸化,再滴加AgNO 3溶液,若有白色沉淀生成,证明其中含有Cl -C .焰色反应时,观察到火焰呈黄色,可以推测肯定含钠元素,可能含钾元素D .在某溶液中加入BaCl 2溶液,产生白色沉淀,加盐酸,沉淀不溶解,证明其中含有SO 2-49.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升经过多次重复后,试管内完全被充满,原来试管中盛装的气体是A .可能是N 2和NO 2的混合气体B .可能是NO 2一种气体C .一定是NO 与NO 2的混合气体D .一定是NO 2气体10.某废催化剂主要成分有SiO 2、ZnO 、ZnS 和CuS 。
单元素养评价(五)(第五章)(90分钟100分)【合格性考试】(60分钟70分)一、选择题(本题包括14小题,每小题3分,共42分)1.(2019·全国卷Ⅰ)陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是( )A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点【解析】选A。
氧化铁是红色的,俗称铁红,所以瓷器的青色不来自氧化铁。
2.(2019·泰州高一检测)下列物质中不能用化合反应的方法制得的是( ) ①SiO2②H2SiO3③Na2O2④Al(OH)3⑤FeCl3⑥CaSiO3A.①③⑤B.②④⑥C.②⑤D.②④【解析】选D。
①Si+O2SiO2;③2Na+O2Na2O2;⑤2Fe+3Cl22FeCl3;⑥CaO+SiO2CaSiO3;②无法通过化合反应来制备;④一般用铝盐和氨水反应来制备,但不属于化合反应。
3.氮、氧、硫、氯是四种重要的非金属元素,下列有关说法中正确的是( )A.NO在加热条件下才能与空气中的氧气反应B.氮、硫的最高价氧化物对应水化物的溶液均具有很强的氧化性C.Cl2不与硫化钠溶液反应D.四种元素的单质中化学性质最稳定的是N2,其次是硫【解析】选D。
NO在常温下即可与空气中的O2反应,A错误;稀硫酸的氧化性较弱,B 错误;Cl2与硫化钠溶液反应生成S和NaCl,C错误。
4.由下列实验事实得出的结论正确的是( )A.由SiO2不能与水反应生成H2SiO3可知,SiO2不是酸性氧化物B.由SiO2+2C Si+2CO↑,可知碳的非金属性大于硅C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3D.SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物【解析】选C。
人教高一化学第五章化工生产中的重要非金属元素单元测试一、选择题1.下列实验操作、现象和结论均正确的是()A.A B.B C.C D.D【答案】A【解析】试题分析:A、氯气和碘离子反应生成碘单质和氯离子,氯气的氧化性比碘单质强,碘遇到淀粉显蓝色,故正确;B、铜和硝酸反应不是置换反应,故错误;C、溶液中可能是硫酸根离子,或亚硫酸根离子,故错误;D、铝常温下在浓硝酸中钝化,故错误。
考点:氧化性的比较,硝酸的性质,硫酸根离子的检验2.下列离子的检验方法及对应结论正确的是( )A.A B.B C.C D.D【答案】B【详解】A.氢氧化铝和氢氧化镁均为白色沉淀,取样,滴加氢氧化钠溶液,观察到有白色沉淀,不能证明有镁离子,可能有铝离子,故A错误;B .铁离子与硫氰根离子反应生成红色的硫氰化铁,取样,滴加硫氰化钾溶液,观察到溶液变红,证明有铁离子,故B 正确;C .氯化银、碳酸钡、亚硫酸钡和硫酸钡均为白色沉淀,取样,滴加氯化钡溶液,观察到白色沉淀,不能证明有硫酸根离子,可能有银离子或碳酸根离子或亚硫酸根离子,故C 错误;D .取样,用铂丝进行焰色反应,透过蓝色钴玻璃观察到紫色火焰,证明有钾离子,故D 错误; 故选B 。
3.下列各组物质中,满足如图物质一步转化关系的选项是X Y Z A Na NaOH NaHCO 3 B Cu CuSO 4 Cu(OH)2 C Al 2O 3 AlO 2- Al(OH)3 DSiSiO 2H 2SiO 3A .AB .BC .CD .D【答案】C 【详解】A .钠能与水反应生成氢氧化钠,氢氧化钠溶液能与过量二氧化碳反应生成碳酸氢钠,但碳酸氢钠不能直接生成金属钠,故A 错误;B .铜能与浓硫酸共热反应生成硫酸铜,硫酸铜溶液与氢氧化钠溶液反应能生成氢氧化铜,但氢氧化铜不能直接生成金属铜,故B 错误;C .氧化铝能与强碱溶液反应生成偏铝酸根,偏铝酸根在溶液中与二氧化碳反应能生成氢氧化铝沉淀,氢氧化铝沉淀受热分解能生成氧化铝,故C 正确;D .硅在高温下能与氧气反应生成二氧化硅,二氧化硅不溶于水,不能与水反应生成硅酸,故D 错误; 故选C 。
4.向下列溶液中通入足量相应气体后,各离子组还能大量存在的是 A .二氧化碳:K +、Na +、2-3CO 、Cl -B .氨气:Mg 2+、Al 3+、Na +、-3NOC .氯化氢:Ca 2+、Fe 3+、-3NO 、Cl - D .氯气:Na +、Ba 2+、-3HCO 、-3HSO【答案】C 【详解】A .CO 2、2-3CO 、H 2O 会发生反应产生3HCO -,不能大量共存,A 不符合题意; B .NH 3·H 2O 与Mg 2+、Al 3+会发生反应产生Mg(OH)2、Al(OH)3沉淀,不能大量共存,B 不符合题意;C .HCl 溶于水电离产生H +、Cl -,与选项离子之间不能发生任何反应,可以大量共存,C 符合题意;D .氯气溶于水,反应产生HCl 、HClO ,HCl 与-3HCO 会反应产生H 2O 、CO 2;HClO 与-3HSO 会发生氧化还原反应,也不能大量共存,D 不符合题意;故合理选项是C 。
5.现今手机等电子产品产业蓬勃发展,推动了高纯硅的生产与应用。
工业上用“西门子法”。
以硅石(SiO 2) 为原料制备冶金级高纯硅的工艺流程如下图所示。
下列说法不正确的是已知:SiHCl 3室温下为易挥发、易水解的无色液体。
A .“还原”过程需要在高温条件下,该反应的主要还原产物为Si B .为最大程度节约成本,上述 生产工艺中能循环使用的物质只有H 2C .为防止SiHCl 3水解而损失、氢气爆炸,“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行D .“氧化”过程反应的化学方程式为Si+3HC1200-300C︒SiHCl 3+H 2【答案】B 【分析】二氧化硅和金属镁在高温下反应生成氧化镁和硅,加入稀硫酸除去氧化镁,过滤得到硅,通入氯化氢在200~300℃下反应生成SiHCl 3,与最后与氢气反应生成Si 。
【详解】A .二氧化硅和金属镁在高温下反应生成氧化镁和硅,还原产物为硅,镁和硅反应可生成Mg 2Si ,故A 正确;B .流程中H 2、HCl 既是反应物也是生成物,则可循环使用,故B 错误;C .“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行,可防止SiHCl 3水解而损失、氢气爆炸,故C 正确;D .由流程可知,通入氯化氢在200~300℃下反应生成SiHCl 3,反应的化学方程式为Si+3HCl 200-300CSiHCl3+H2,故D正确;故选B。
6.下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是()a b cA Al AlCl3Al(OH)3B NO NO2HNO3C Si SiO2H2SiO3D S SO2H2SO4A.A B.B C.C D.D【答案】B【详解】试题分析:A项:用Al(OH)3无法一步生成Al,故错。
B项:可以。
如2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故正确。
C项:SiO2无法一步生成H2SiO3,H2SiO3无法一步生成Si,故错。
D项:H2SO4无法一步生成FeS2,故错。
故选B。
考点:无机推断点评:本题考查的是无机推断的知识,要求学生对课本中的化学反应要熟悉掌握,识记化学方程式的书写。
7.将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2mol,则NaOH的浓度为A.2mol/L B.1.8mol/L C.2.4 mol/L D.3.6 mol/L【答案】A【详解】试题分析:n(Cu)=51.2g÷64g/mol=0.8mol,由于Cu是+2价的金属,所以Cu失去电子的物质的量是n(e-)=0.8mol×2=1.6mol;Cu失去电子的物质的量与硝酸变为氮的氧化物(含NO、N2O4、NO2)得到电子的物质的量相等。
由于这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,在NaNO3中N元素的化合价是+5价,与硝酸中N的化合价相同,所以产生NaNO2得到电子的物质的量就是Cu失去电子的物质的量。
n(NaNO2)×2=1.6mol,n(NaNO2)=0.8mol.根据元素守恒可知n(NaOH)= n(NaNO2)+ n(NaNO3)= 0.8mol+0.2mol=1mol,所以c(NaOH)=1mol÷0.5L=2mol/L,选项是A。
8.在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀。
则下列说法不正确的是A.原合金中含0.1mol Fe、0.15mol CuB.25.4g沉淀为Cu(OH)2和Fe(OH)3的混合物C.气体X中含0.3 mol NO、0.1 mol NO2D.气体X中含0.3 mol NO2、0.1 mol NO【答案】C【解析】试题分析:铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成Cu(NO3)2和Fe(NO3)3,再向所得溶液中加入足量的NaOH溶液,生成Cu(OH)2和Fe(OH)3的混合物,设合金中有xmol Fe、ymol Cu,,所以x=0.1mol,y=0.15mol;根据得失电子守恒,0.1mol Fe、0.15mol Cu共失去0.6mol电子,所以生成的气体不可能是0.3 mol NO、0.1 mol NO2,故C错误。
考点:本题考查化学计算。
9.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是已知类推A将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+B向稀硫酸加入NaOH溶液至中性:H++OH-=H2O 向H2SO4溶液加入Ba(OH)2溶液至中性:H++OH-=H2OC向氯化铝溶液中加入足量NaOH溶液:Al3++4OH-=AlO2-+2H2O 向氯化铝溶液中加入足量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+D向Ca(OH)2溶液中通入过量CO2:CO2+OH-=HCO3-向Ca(OH)2溶液中通入过量SO2:SO2+OH-=HSO3-A.A B.B C.C D.D【答案】D【详解】A、钠与硫酸铜溶液反应,钠会优先与水反应,生成氢氧化钠,氢氧化钠再与硫酸铜反应生成氢氧化铜,A错误;B、硫酸与氢氧化钡除了生成水还生成硫酸钡沉淀,B错误;C、氢氧化铝溶于强碱,不溶于弱碱,C错误;D、CO2和SO2均为酸性氧化物,与碱反应时类似,D正确;答案选D。
10.某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是A.Zn和浓H2SO4B.Cu和浓HNO3C.Na2O2和NH4Cl浓溶液D.C和浓HNO3【答案】C【解析】试题分析:A.Zn和浓H2SO4,开始发生反应:Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O。
当随着反应的进行,溶液变稀后,会发生反应:Zn+ H2SO4(稀)=ZnSO4+H2↑。
最后得到的气体为SO2与H2的混合气体。
SO2的相对分子质量为64,H2的相对分子质量为2.因此混合气体的平均相对分子质量可能为45.正确。
B.C和浓HNO3。
发生反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O。
CO2与4NO2的相对分子质量分别是44、46.所以混合气体平均相对分子质量可能为45.正确。
C.Na2O2和溶液中的水发生反应:2Na2O2+2H2O=4NaOH+O2↑。
产生的NaOH与溶液中的溶质NH4Cl发生反应:NaOH+NH4Cl NaCl++H2O+ NH3↑。
得到的气体中含有O2与NH3的相对分子质量都比45小,所以不可能平均为45.错误。
D.Cu和浓HNO3,开始发生反应:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O。
当溶液变为稀硝酸时,发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。
NO2、NO的相对分子质量分别是46、28,因此混合气体的平均相对分子质量可能为45.正确。