第九章化学动力学基本原理
- 格式:doc
- 大小:213.00 KB
- 文档页数:5

§9.3 简单级数反应的动力学规律凡是反应速率只与反应物浓度有关,而且反应级数,无论是、、…或n都只是零或正整数的反应,统称为“简单级数反应”。
简单反应都是简单级数反应,但简单级数反应不一定就是简单反应,前已述及的HI气相合成反应就是一例。
具有相同级数的简单级数反应的速率遵循某些简单规律,本节将分析这类反应速率公式的微分形式、积分形式及其特征。
(1)一级反应反应速率与反应物浓度的一次方成正比的反应称为一级反应。
其速率公式可表示为(9.7)式中c为t时刻的反应物浓度。
将上式改写成的形式,积分可得(9.8)B为积分常数,其值可由t = 0时反应物起始浓度c0确定:B = ln c0。
故一级反应速率公式积分形式可表示为(9.9)或(9.10)或(9.11)使用这些公式可求算速率常数k1的数值,只要知道了k1和c0的值,即可求算任意t时刻反应物的浓度。
从(9.8)式可看出,以lnc对t作图应得一直线,其斜率即为k1。
如图9.2所示。
反应物浓度由c0消耗到c=c0/2所需的反应时间,称为反应的半衰期,以t1/2表示。
由(9.9)式可知,一级反应的t1/2表示式为(9.12)可以看出,一级反应的半衰期与反应物起始浓度c0无关。
许多分子的重排反应和热分解反应属一级反应。
还有些反应例如蔗糖水解实际上是二级反应,但由于水溶液中反应物之一H2O大大过量,其浓度在整个反应过程中可视为常数,故表观上表现为一级反应,这类反应称为“准一级反应”。
例题1 30℃时N2O5在CCl4中的分解反应为一级反应,由于N2O4和NO2均溶于CCl4中,只有O2能逸出,用量气管测定不同时刻逸出O2的体积有下列数据:t / s 0 2400 4800 7200 9600 12000 14400 16800 19200V(O2) / cm3 0 15.65 27.65 37.70 45.85 52.67 58.30 63.00 66.8584.85求算此反应的速率常数k1和半衰期t1/2。


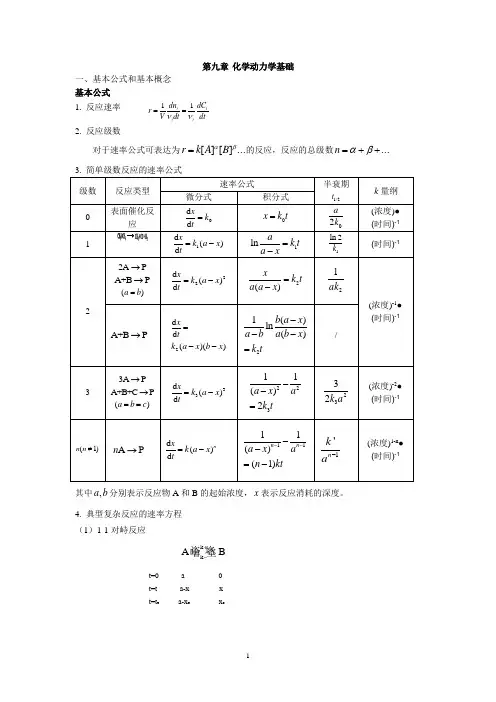
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。


第九章化学动力学基本原理一、填空题1、设物质A 可发生两个平行的一级反应:(a )C B A Ea ka +−−→−,(b )E D A Ebkb +−−→−, 式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是 ,升高温度对 更有利。
2、硝酸异丙烷在水溶液中被碱中和,其反应速率常数可表示为lgk=11.899-3163/T ,该反应的表观活化能为 。
3、今将某物质A 放入一反应器内,反应了3600s ,消耗掉75%,设反应分别为一级,二级,零级反应。
则反应进行了7200s 时,对于各级反应,A 物质的剩余量分别为 、 和 。
4、某化合物的分解反应是一级反应,设反应的活化能E=14.43×104J ·mol -1,已知557K 时该反应的速率常数k=3.3×10-2s -1,现要控制反应在10min 内转化率达到90%,则应控制该反应的温度为 。
5、比较两相同类型的反应I 和II ,发现活化能E I >E II ,速率常数k I >k II ,其原因在于 。
6、在T ,V 恒定时,反应A(g)+B(g)→D(g)t=0时,P A,0=800kPa ,t 1=30s 时,P A,1=400kPa ,t 2=60s 时P A,2=200kPa ,t 3=90s 时,P A,3=100kPa 时此反应的半衰期t 1/2= ,反应级数n= ,反应的速率常数k= 。
.7、阿累尼乌斯活化能是 。
.8、气相有效分子碰撞理论的基本观点是 。
.9、根据活化络合物理论,液相分子重排反应的活化能E a 和活化焓△r H m 之间的关系是 。
.10、由经验规则“温度每增加10K ,反应速率增加二倍”可知,在T 1=298K 时和T 2=308K 时符合这规律的活化能值E a = 。



第九章 化学动力学基本原理一、填空题1、设物质A 可发生两个平行的一级反应:(a )C B A Ea ka +−−→−, (b )E D A Ebkb +−−→−, 式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是 ,升高温度对 更有利。
2、硝酸异丙烷在水溶液中被碱中和,其反应速率常数可表示为lgk=11.899-3163/T ,该反应的表观活化能为 。
3、今将某物质A 放入一反应器内,反应了3600s ,消耗掉75%,设反应分别为一级,二级,零级反应。
则反应进行了7200s 时,对于各级反应,A 物质的剩余量分别为 、 和 。
4、某化合物的分解反应是一级反应,设反应的活化能E=14.43×104J ·mol -1,已知557K 时该反应的速率常数k=3.3×10-2s -1,现要控制反应在10min 内转化率达到90%,则应控制该反应的温度为 。
5、比较两相同类型的反应I 和II ,发现活化能E I >E II ,速率常数k I >k II ,其原因在于 。
6、在T ,V 恒定时,反应A(g)+B(g)→D(g) t=0时,P A,0=800kPa ,t 1=30s 时,P A,1=400kPa ,t 2=60s 时P A,2=200kPa ,t 3=90s 时,P A,3=100kPa 时此反应的半衰期t 1/2= ,反应级数n= ,反应的速率常数k= 。
.7、阿累尼乌斯活化能是 。
.8、气相有效分子碰撞理论的基本观点是 。
.9、根据活化络合物理论,液相分子重排反应的活化能E a 和活化焓△r H m 之间的关系是 。
.10、由经验规则“温度每增加10K ,反应速率增加二倍”可知,在T 1=298K 时和T 2=308K 时符合这规律的活化能值E a = 。

化学动力学的基本原理与应用化学动力学是研究化学反应速率及其规律的学科。
化学反应速率的测定对于理解化学反应机理和反应条件选择具有重要的意义。
本文将从化学动力学的概念、速率定律、反应机理以及应用等方面介绍化学动力学的基本原理和应用。
一、化学动力学的概念化学动力学是研究化学反应速率及其规律的学科。
化学反应速率是指化学反应物质的转化速率。
化学反应的速率通常由反应物的摩尔浓度、反应温度、反应物质的状态(固态、液态和气态)等因素决定。
化学动力学的研究内容包括反应速率定律、反应机理和反应速率的测定等方面。
二、反应速率定律反应速率定律是化学动力学研究的核心内容,它表明了反应速率与各因素的关系。
一般来说,反应速率与反应物浓度的关系可以用速率定律来描述。
速率定律一般写作:v = k[A]^m[B]^n其中v表示反应速率,k为速率常数,[A]和[B]分别表示反应物A和B的摩尔浓度,m和n为反应物的反应次数。
速率常数k是一个与温度有关的定值。
速率定律的推导需要通过反应速率的实验测定来完成。
三、反应机理反应机理是指反应物因分子碰撞等原因而发生化学反应的过程。
反应机理的推导需要通过实验数据来判断。
如果我们对反应的过程和能量变化都非常了解,就可以找到反应的机理。
反应的机理不仅有助于更好地了解反应过程和反应的条件选择,而且还有助于预测和设计新的化学反应。
四、反应速率的测定反应速率的测定是化学动力学的核心内容之一。
通过实验测定,我们可以知道反应的速率常数和速率方程式。
常用的反应速率测定方法有观测投控法、吸收法、电流法等。
观测投控法:该法是通过观察相应指标的变化来确定反应速率。
例如,当酸状黄汞和碘化钾反应时,有色质氰酸根离子产生,颜色深浅可以反映出反应速率。
吸收法:该法是通过反应物或产物中的吸收光谱来测定反应速率。
例如,测定某药物的稳定性可以采用紫外吸收光谱来测定。
电流法:该法是通过对反应体系施加电压或电流来反映反应速率的相关信息。
第九章化学动力学基本原理化学动力学是研究化学反应速度和反应机理的学科。
了解反应速率和反应机理对于理解和控制化学反应过程至关重要。
本章将介绍化学动力学基本原理,包括反应速率的定义和测定、速率定律方程、反应级数和速率常数等概念。
1.反应速率反应速率指的是单位时间内反应物消失或生成物产生的物质量。
以一般的反应方程式表示为:aA+bB→cC+dD反应速率可以用消失反应物或生成物的物质量的减少或增加来表示。
根据反应物或生成物浓度随时间的变化关系,可以得到反应速率的数学表示。
2.速率定律方程速率定律方程描述了反应物浓度与反应速率之间的关系。
一般的速率定律方程可以表示为:v=k[A]^m[B]^n其中,v为反应速率,k为速率常数,[A]和[B]为反应物的浓度,m 和n分别为反应物A和B的反应级数。
3.反应级数反应级数指的是反应物在速率定律方程中的指数。
根据反应级数的不同,反应可以分为一级反应、二级反应和零级反应。
-一级反应:速率与一个反应物的浓度的一次幂成正比,二级反应:速率与一个反应物的浓度的二次幂成正比-零级反应:速率与一个反应物的浓度无关4.速率常数速率常数是衡量反应速率快慢的物理量,其数值与反应机理、反应温度等因素有关。
速率常数的大小与活化能有关,活化能越低,速率常数越大,反应速率越快。
5.反应速率的测定测定反应速率的方法有多种,包括观察物质变化、测量反应物浓度的变化、测量生成物浓度的变化等。
6.反应速率与温度的关系根据阿伦尼乌斯方程,反应速率与温度之间存在正比关系。
提高温度可以提高反应活性,增加反应速率。
并且,根据阿伦尼乌斯方程,温度每升高10摄氏度,反应速率大约增加一倍。
总结:化学动力学是研究化学反应速率和反应机理的学科。
了解反应速率和反应机理对于理解和控制化学反应过程至关重要。
本章介绍了化学动力学基本原理,包括反应速率的定义和测定、速率定律方程、反应级数和速率常数等概念。
另外,还介绍了反应速率与温度的关系,即温度越高,反应速率越快。
第九章 《化学动力学基本原理》第十章 《复合反应动力学》一、选择题1.在TK时,对于某一简单级数反应的半衰期与反应物起始浓度的关系,正确的是( )。
A. 对一级反应为反比;B. 对二级反应为正比;C. 对零级反应为正比;D. 无明确关系。
2.某反应的反应物消耗3/4所需时间是消耗1/2所需时间的二倍,则反应级数为( )。
A. 零级;B. 一级;C. 二级;D. 三级。
3.基元反应的反应级数( )反应分子数。
A. 总大于;B. 总小于;C. 总等于;D. 等于或小于。
4.某放射性同位素的半衰期为5天,则经15天后所剩的同位素的物质的量是原来同位素的物质的量的( )。
A. 1/3;B. 1/4;C. 1/8;D. 1/16。
5.某反应的速率常数k = 2×10-2 dm3· mol-1 · s-1,当反应物初始浓度为1.0 mol · dm-3时,反应的半衰期为( )。
A. 50 s ;B. 15 s ;C. 30 s ;D. 21.65 s 。
6.反应速率常数随温度变化的阿仑尼乌斯经验式适用于( )。
A. 基元反应; B. 基元反应和大部分非基元反应;C. 非基元反应;D. 所有化学反应。
7.反应物A进行由两个一级反应组成的平行反应: 步骤⑴的速率常数为k1,步骤⑵的速率常数为k2。
已知k1> k2,若两步骤的指前因子相近且与温度无关, 则( )。
A. 升温对⑴和⑵的影响相同;B. 升温对⑴有利;C. 升温对⑵有利;D. 降温对⑵有利。
8.某物质A与水反应,在水溶液中,若A起始浓度为1mol/kg,1h后,浓度为0.5 mol/kg,2h后, 浓度为0.25mol/kg, 则对A来说,此反应的级数为( )。
A. 零级;B. 一级;C. 二级;D. 三级。
9.在Tk时,某一反应的速率常数为0.0693min-1,反应物起始浓度0.1mol/L, 则半衰期为()。
§9.3 简单级数反应的动力学规律凡是反应速率只与反应物浓度有关,而且反应级数,无论是α、β、…或n 都只是零或正整数的反应,统称为“简单级数反应”。
简单反应都是简单级数反应,但简单级数反应不一定就是简单反应,前已述及的HI 气相合成反应就是一例。
具有相同级数的简单级数反应的速率遵循某些简单规律,本节将分析这类反应速率公式的微分形式、积分形式及其特征。
(1)一级反应反应速率与反应物浓度的一次方成正比的反应称为一级反应。
其速率公式可表示为1dc k c dt -= (9.7)式中c 为t 时刻的反应物浓度。
将上式改写成1dck dt c-=的形式,积分可得1ln c k t B =-+ (9.8)B 为积分常数,其值可由t = 0时反应物起始浓度c 0确定:B = ln c 0。
故一级反应速率公式积分形式可表示为01ln ck tc = (9.9)或11ln c k t c = (9.10) 或 10k tc c e -= (9.11)使用这些公式可求算速率常数k 1的数值,只要知道了k 1和c 0的值,即可求算任意t 时刻反应物的浓度。
从(9.8)式可看出,以ln c 对t 作图应得一直线,其斜率即为-k 1。
如图9.2所示。
反应物浓度由c 0消耗到c =c 0/2所需的反应时间,称为反应的半衰期,以t 1/2表示。
由(9.9)式可知,一级反应的t 1/2表示式为1/21110.6932ln 2t k k ==(9.12)可以看出,一级反应的半衰期与反应物起始浓度c 0无关。
许多分子的重排反应和热分解反应属一级反应。
还有些反应例如蔗糖水解)(O H C )(O H C O H O H C 612661262112212果糖葡萄糖+→+ 实际上是二级反应,但由于水溶液中反应物之一H 2O 大大过量,其浓度在整个反应过程中可视为常数,故表观上表现为一级反应,这类反应称为“准一级反应”。
例题1 30℃时N 2O 5在CCl 4中的分解反应N 2O 524O 22NO 212+为一级反应,由于N 2O 4和NO 2均溶于CCl 4中,只有O 2能逸出,用量气管测定不同时刻逸出O 2的体积有t / s 0 2400 4800 7200 9600 12000 14400 16800 19200 ∞ V (O 2) / cm 315.6527.6537.7045.8552.6758.3063.0066.8584.8511/2 解 从(9.10)式可看出,一级反应的特点是速率常数k 的数值与所用浓度单位无关,因此用任何一种与N 2O 5的浓度成正比的物理量来代替浓度都不会影响k 的数值。
所以可以用逸出O 2的体积来求算k 的值。
因为每产生一个O 2分子一定有两个N 2O 5分子分解,因此逸出O 2的体积与N 2O 5的浓度有一定的比例关系。
图9.2 一级反应的ln c 对t 图最后逸出O 2的总体积V ∞是指N 2O 5全部分解后的体积,故可用来表示N 2O 5的起始浓度c 0,设V 为t 时刻逸出O 2的体积,则V ∞-V 就代表尚未分解的N 2O 5的浓度c ,于是(9.10)式可写为11lnV k t V V ∞∞=-(V ∞V ) / cm 3 105k 1 /s -11 用(9.12)式求得31/210.69328.5010s t k ==⨯ (2) 二级反应反应速率与反应物浓度的二次方(或两种反应物浓度的乘积)成正比的反应称为二级反应,有两种类型: (i) 2A −→ 产物 (ii) A + B −→ 产物对第(ii)种类型的反应来说,如果设a 和b 分别代表反应物A 和B 的起始浓度;x 为t 时刻已反应掉的浓度,则其反应速率公式可写为2()()dxk a x b x dt =-- (9.13)当A 和B 的起始浓度相等即a = b 时,(9.13)式变为22()dxk a x dt =- (9.14)对第(i)种类型的反应来说,其速率公式形式与(9.14)式相似。
将(9.14)式积分可得21k t Ba x =+- (9.15)B 为积分常数。
当t =0时,x =0;因此,1B=a 。
故上式可改写为211()k t a x a-=-或21()x k t a a x =-(9.16) 由(9.15)式和(9.16)式可看出,二级反应有以下特性: 1. 当浓度单位用mol·dm -3,时间单位用s(秒)时,速率常数k 2的单位为dm 3·mol -1⋅s -1。
因此其数值不仅与所用的时间单位有关,还与所用浓度单位有关。
2.由(9.15)式可看出,以1a x -对t 作图应得一直线,其斜率即为k 2。
3.当反应恰好完成一半时,12x a =,将此代人(9.16)式可得1/221t k a=(9.17) 这说明二级反应的半哀期与反应物的起始浓度成反比。
例题2 乙醛的气相分解反应为二级反应CH 3CHOCH 4CO +在定容下反应时系统压力将增加。
在518℃时测量反应过程中不同时刻t 定容器皿内的总压力p ,得下列数据:解 首先要找出器皿中压力与反应物浓度的关系。
设起始压力为p 0,在t 时刻乙醛的压力降低x ,此时乙醛的分压应为p 0-x ,由于乙醛压力降低x 的同时,CH 4和CO 的压力各增加了x ,故器皿中总压力应为p = p 0-x+x+x = p 0+x因此, x = p - p 0由于气相中各物质的浓度与其分压成正比,将此代入(9.16)式即得)2()(10002p p p t p p x a a x t k -⋅-=-=利用题给数据可求出t / s 0 73 242 480 840 1440 (p - p 0) / kPa 0 7.2 17.85 25.85 32.5 37.85 (2p 0- p) /kPa — 41.2 30.55 22.55 15.9 10.55 k 2 / (kPa -1⋅s -1)—4.96⨯10-54.98⨯10-54.94⨯10-55.03⨯10-55.15⨯10-5k 22 当A 和B 的起始浓度不同,即 a ≠ b 时,则对(9.13)式积分,可得()21()ln ()b a x k ta b a b x -=-- (9.18)从(9.18)式可看出,以()ln ()b a x a b x --对t 作图应得一直线,由此直线的斜率可求出k 2。
由于A和B 的半衰期不同,因此很难说总反应的半衰期是多少。
二级反应是最常见的一种反应,特别是在溶液中进行的有机化学反应很多都是二级反应。
例题3 在15.8℃时,乙酸乙酯在水溶液中的皂化反应为CH 3COOC 2H 5OH +CH 3COO +C 2H 5OH该反应对酯及碱各为一级,总反应级数为2。
酯和碱的起始浓度a 和b 分别为0.01211及0.02578 mol ⋅dm -3。
在不同时刻t t / s 224 377 629 816 (b -x ) / mol·dm -30.022560.021010.019210.01821(1) 解 t / s 224 377 629 816 (b -x ) / mol ⋅dm -3 0.02256 0.02101 0.01921 0.01821 (a -x ) / mol ⋅dm -3 0.008890.007340.005540.00454ln[(a -x )/(b -x )]-0.9313 -1.0517 -1.2434 -1.3890由(9.182211ln ln()()b a xt k a b a k a b b x -=+---因此,以t 对xb x a --ln作图应得一直线,斜率是21()k a b -。
利用上表数据作图,斜率为- 1.30⨯103 sk 2 = [ 1.30 ⨯ 103 (0.02578 - 0.01211)]-1 mol -1⋅dm 3⋅s -1 = 5.64 ⨯ 10-2 mol -1⋅dm 3⋅s -1(2) 利用(9.18)式,将t = 3600 s 代入,解得xx = 0.01170 mol ⋅dm -3故反应一小时后酯的浓度为:a -x = 4.1⨯10-4 mol ⋅dm -3(3) 酯消耗掉一半时⎪⎭⎫ ⎝⎛-⋅-=22ln)(12a b a a b b a k t 将a 、b 、k 2的数据代入可求得t = 552 s(3) 三级反应和零级反应三级反应比较少见,到目前为止, 人们发现的气相三级反应只有五个, 都与NO 有关,是NO 与Cl 2、Br 2、O 2、H 2、D 2的反应。
溶液中三级反应比气相中的多。
在乙酸或硝基苯溶液中含有不饱和C=C 键的化合物的加成作用常是三级反应。
另外,水溶液中FeSO 4的氧化,Fe 3+和I -的作用等也是三级反应的例子。
零级反应是速率与反应物浓度无关的反应。
一些光化学反应及复相催化反应可表现为零级反应。
根据前述方法,读者可以自行推出三级与零级反应的速率公式及半衰期公式。
现仅将一些简单级数反应的速率公式及半衰期表示式列于表9.1,以兹查用。
习题2 某物质按一级反应进行分解。
已知反应完成40%需时50 min ,试求:(1)以s 为单位的速率常数;(2)完成80%反应所需时间。
[答案:(1)1.7⨯10-4 s -1; (2)9.45⨯103 s]习题3 镭Ra 蜕变产生氡Rn 及氦核He ,半衰期为1662 yr (年)。
试问(1) 24 h 内;(2) 10 yr 内,1.00 g 无水溴化镭蜕变所放出的氡气在标准状况下的体积为多少?[答案:(1)6.70⨯10-5 cm 3;(2) 0.245 cm 3]习题4 N 2O 5在25℃时分解反应的半衰期为5.70 h ,且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
[答案:18.9 h]习题5 高温时气态二甲醚的分解为一级反应:CH 3OCH 3CH 4CO H 2++迅速将二甲醚引入一个504℃的已抽成真空的瓶中,并在不同时刻t 测定瓶内压力p 总。
(1)[答案:(1)4.5⨯10-4 s -1;(2)1.6⨯103 s]习题6在0℃用铂溶胶催化H 2O 2分解为O 2 及H 2O 。
在不同时刻各取出5 cm 3样品用KMnO 4溶液滴定之,所消耗的KMnO 4溶液的体积x 数据如下:t / min 124 127 130 133 136 139 142 x / cm 310.609.408.257.006.055.254.50试求(1) [答案:(1)一级; (2)4.8⨯10-2 min ;(3)14.4 min] 习题7 一级反应C 6H 5N 2Cl 在水溶液中的分解按下式进行C 6H 5N 2Cl(aq) -−→ C 6H 5Cl(aq) + N 2(g)在反应过程中,用量气管测量所释放的N 2的体积。