四种基本反应类型与氧化还原反应)
- 格式:ppt
- 大小:1.26 MB
- 文档页数:3




最全氧化还原反应知识点总结一、氧化还原基本概念氧化还原反应是指在化学反应过程中,元素的化合价发生变化或电子发生转移的化学变化。
其中,元素化合价的升降是氧化还原反应的特征,而电子转移是其实质。
在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应,反之则称为还原反应。
氧化剂是指所含元素化合价升高的物质,而还原剂则是所含元素化合价降低的物质。
生成物中,所含元素化合价升高的被称为氧化产物,而所含元素化合价降低的则被称为还原产物。
二、氧化还原反应的四种基本类型氧化还原反应可以分为四种基本类型:氧化反应、还原反应、化合反应和分解反应。
其中,有单质参加的化合反应和有单质生成的分解反应也属于氧化还原反应。
三、氧化还原反应的有关计算在氧化还原反应中,电子转移可以使用双线桥法或单线桥法来表示。
双线桥法强调同一元素的原子或离子间的电子转移,而单线桥法则将箭头指向氧化剂,从失电子的元素出发指向得电子的元素。
四、氧化还原反应的类型氧化还原反应可以分为还原剂+氧化剂氧化产物+还原产物、部分氧化还原反应、自身氧化还原反应和归中反应四种类型。
其中,还原剂和氧化剂为不同物质参与的反应是最常见的类型。
而自身氧化还原反应可以发生在同一物质的不同元素之间或同一物质的同种元素之间。
归中反应则是一种非氧化还原反应,其特点是反应物中的两种物质合并生成一种新物质。
化学中,同一元素不同价态之间发生的氧化还原反应遵循以下变化规律:高价态和低价态会产生中间价态,中间价态可以相同也可以不同,但必须靠近,不能相互交叉。
例如,Cl2+ 2NaOH = NaCl + NaClO + H2O 就是一种歧化反应,发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应。
歧化反应的反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。
氧化性和还原性的强弱取决于得失电子的难易程度,与得失电子的数目多少无关。


4种基本反应类型一、合成反应合成反应是一种化学反应类型,其中两个或更多的反应物结合形成一个新的产物。
这种类型的反应通常涉及原子或分子之间的键的形成。
合成反应可以分为以下几种情况:1. 元素合成反应元素合成反应是指两个或多个元素结合形成一个化合物。
例如,氢气和氧气反应生成水。
这个反应可以用化学方程式表示为:2H₂ + O₂ → 2H₂O在这个反应中,两个氢原子和一个氧原子结合形成了两个水分子。
2. 化合物合成反应化合物合成反应是指两个或多个化合物反应生成一个新的化合物。
例如,氯化钠和硫酸反应生成氯化氢和硫酸钠。
这个反应可以用化学方程式表示为:NaCl + H₂SO₄ → HCl + Na₂SO₄在这个反应中,氯化钠和硫酸反应生成了氯化氢和硫酸钠。
二、分解反应分解反应是一种化学反应类型,其中一个化合物分解成两个或更多的反应物。
这种类型的反应通常涉及键的断裂。
分解反应可以分为以下几种情况:1. 热分解反应热分解反应是指一个化合物在高温下分解成两个或更多的反应物。
例如,碳酸钙在加热时分解成二氧化碳和氧化钙。
这个反应可以用化学方程式表示为:CaCO₃ → CO₂ + CaO在这个反应中,碳酸钙分解成了二氧化碳和氧化钙。
2. 电解分解反应电解分解反应是指一个化合物在电解过程中分解成两个或更多的反应物。
例如,水在电解过程中分解成氢气和氧气。
这个反应可以用化学方程式表示为:2H₂O → 2H₂ + O₂在这个反应中,水分解成了氢气和氧气。
三、置换反应置换反应是一种化学反应类型,其中一个元素或基团被另一个元素或基团取代。
置换反应可以分为以下几种情况:1. 单置换反应单置换反应是指一个元素或基团被一个元素或基团取代。
例如,氢气和溴气反应生成氢溴酸。
这个反应可以用化学方程式表示为:H₂ + Br₂ → 2HBr在这个反应中,氢气被溴气取代生成了氢溴酸。
2. 双置换反应双置换反应是指两个化合物中的两个元素或基团互相交换位置。



学科:奥化年级:初三不分版本期数:1320本周教学内容:化学反应基本类型和氧化还原反应知识【内容综述】 本期主要介绍化学反应的基本类型以及氧化还原反应的有关知识。
该内容的主要知识要点包括:(1)明确并学会判断四种基本反应类型,即:化合反应、分解反应、置换反应、复分解反应(2)从得失氧的角度理解氧化还原反应(3)判断某一反应是否发生氧化还原反应(4)判断发生氧化还原反应中那些物质被氧化、被还原、氧化剂、还原剂(5)明确四种基本反应类型与氧化还原反应间的关系。
由于化学反应的基本类型以及氧化还原反应知识是中学化学的重点和难点知识,也是考试中的热点知识,为此,本期主要从近几年的考试和竞赛试题中分析该内容的精髓。
【要点讲解】 一、四大基本反应类型的正确区分和理解 【例1】通过下列反应,一定有单质生成的是() A.化合反应 B.分解反应 C.置换反应 D.复分解反应 【解析】依题意知化合反应、复分解反应的产物一定是化合物,置换反应一定有单质生成,分解反应可能有单质,也可能有化合物生成。
故答案为C。
【例2】下列有关化学反应的基本类型的说法正确的是() A.反应物有多种的反应是化合反应 B.生成物有多种的反应是分解反应 C.两种化合物相互交换成分,生成另两种化合物的反应是复分解反应 D.生成物中一种是单质,另一种是化合物的反应就是置换反应 【解析】 本题主要考查四种基本反应类型及其有关知识。
化合反应的特点是反应物有多种,但生成物只有一种,即“多到一”,而A选项只强调反应物而未强调生成物,故不一定是化合反应;分解反应的特点是“一到多”,B选项只强调生成物,而未强调反应物的种类,故也不一定属于分解反应;置换反应的特点是单质和化合物反应生成另一种单质和化合物,而D选项只强调生成物的特点,例如实验室用氯酸钾分解制氧气的反应符合选项要求,但其属于分解反应。
故本题答案为C。
二、氧化还原反应知识的更深层次的理解和应用 【例3】下列有关氧化还原反应的叙述错误的是() A.失氧的物质被还原,得氧的物质被氧化 B.失氧的物质是还原剂,得氧的物质是氧化剂 C.氧化剂发生氧化反应,还原剂发生还原反应 D.氧化反应和还原反应必需同时发生 【解析】本题是考查氧化还原反应的有关知识。

氧化还原反应一、概念化合价升降的反应。
二、本质电子的转移(得失或偏移)。
三、四种反应类型1.化合反应:可以是氧化还原反应。
如H2O2+SO2=H2SO42。
分解反应:可以是氧化还原反应.如NH4NO3=(△)N2O+2H2O3。
置换反应:一定是氧化还原反应。
4。
氧化还原反应:同素异形体间的转化是化学变化但不是氧化还原反应。
如:3O2=(放电)2O3四、常见的氧化剂与还原剂1。
氧化剂:①活泼的非金属单质:F2、Cl2、Br2、I2、O2、O3等。
碘与铁生成的二价的碘化亚铁。
②高价态金属离子:Fe3+、Cu2+.③元素处于高价时的含氧酸:硝酸、浓硫酸。
④元素处于高价时盐:KClO3、KMnO4、K2Cr2O7。
⑤其他:银氨溶液、新制氢氧化铜、漂白粉、HClO、H2O2、MnO2等。
2.还原剂①金属单质:K、Na、Mg等。
②非金属单质:H2、C、Si、S等。
③低价态的化合物:CO、H2S、HI、Fe2+、NH3等.④其他:Fe2+、S2-、I—、Br-。
五、氧化剂的还原产物O2→H2O或OH—;Fe3+ →Fe2+;浓硫酸→SO2;浓硝酸→NO2;稀硝酸→NO;H2O2→H2O或OH-;K2Cr2O7(H+)→Cr3+;六、氧化性、还原性强弱的比较1.反应条件:热>冷;浓>稀;易>难;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OCu+2H2SO4(浓)=(△)CuSO4+2H2O+SO2↑Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu + 8HNO3(稀) =3Cu(NO3)2 + 4H2O + 2NO↑16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑4HCl(浓)+MnO2=(△)MnCl2+2H2O+Cl2↑4HCl(浓)+O2=(△、CuCl2催化剂)2H2O+2Cl2↑氧化性:KMnO4>MnO2>O22. 根据物质活动性顺序比较金属:K〉Ca>Na〉Mg〉Al>Mn〉Zn>Cr>Fe〉Ni>Sn〉Pb〉(H)〉Cu>Ag〉Pt>Au非金属:F〉Cl〉Br>I〉S;原子(或单质)氧化性逐渐减弱,对应阴离子还原性增强。
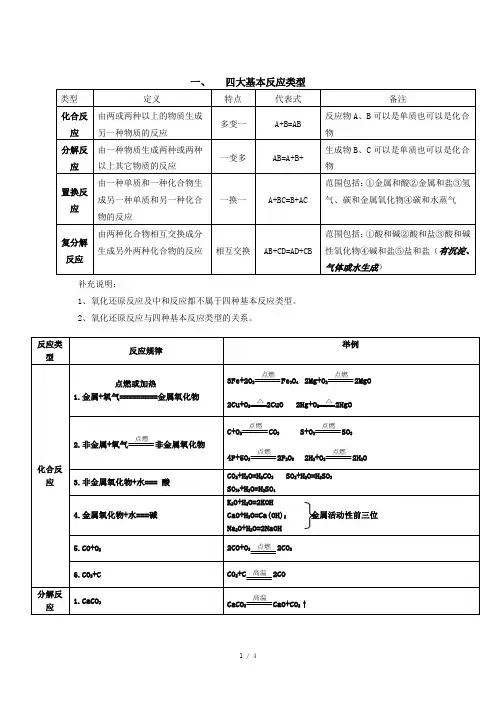
四大基本反应类型化合反应:指的是由两种或两种以上的物质生成一种新物质的反应(combination reaction)。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
分解反应:分解反应,是化学反应的常见类型之一,是化合反应的逆反应。
它是指一种化合物分解成二种或二种以上较简单的单质或化合物的反应。
置换反应:置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
复分解反应:复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质----沉淀、气体、水,使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。
可简记为AB+CD=AD+CB。
化合反应1.金属+氧气→金属氧化物很多金属都能跟氧气直接化合。
例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。
4Al+3O2 = 2Al2O32.非金属+氧气→非金属氧化物经点燃,许多非金属都能在氧气里燃烧,如:C+O2=点燃=CO23.金属+非金属→无氧酸盐许多金属能与非金属氯、硫等直接化合成无氧酸盐。
如:2Na+Cl2==点燃==2NaCl4.氢气+非金属→气态氢化物. 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。
如:2H2+O2=点燃=2H2O5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。
判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。
如:Na2O+H2O=2NaOH.对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。
如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。
四大基本反应类型与氧化还原反应的关系
四大基本反应类型都涉及到氧化还原反应。
1. 合成反应(Synthesis Reaction):由两种或两种以上原料经氧化还原反应合成新物质,一般原料物质发生氧化。
2. 分解反应(Decomposition Reaction):一种原料物质经氧化还原反应分解为两种或两种以上物质,一般原料物质发生还原。
3. 交换反应(Exchange Reaction):由两种不同的原料物质交换基团,经氧化还原反应得到新的物质,两种原料物质都发生氧化还原反应。
4. 水解反应(Hydrolysis Reaction):在水的作用下,原料物质通过氧化还原反应破坏键的过程,将原料物质分解成二价离子及水,一般原料物质发生还原反应。
化学基本反应类型
化学反应是指化学物质之间发生物质转化的过程,化学反应可分为物理变化和化学变化两种类型。
而化学变化又可以分为以下基本反应类型:
1. 合成反应:指两个或多个物质反应生成一个新物质的过程,也称为化合反应。
例如:2H2(g) + O2(g) →2H2O(l)。
2. 分解反应:指一个物质在一定条件下分解成两个或多个物质的过程。
例如:CaCO3(s) →CaO(s) + CO2(g)。
3. 单一置换反应:指一种元素置换另一种元素的反应,也称为单一置换反应。
例如:Fe(s) + CuSO4(aq) →Cu(s) + FeSO4(aq)。
4. 双重置换反应:指两个化合物中的阳离子和阴离子互相交换的反应,也称为双替换反应。
例如:AgNO3(aq) + NaCl(aq) →AgCl(s) + NaNO3(aq)。
5. 氧化还原反应:指在反应中发生电子转移的化学反应,其中一个物质被氧化,另一个物质被还原。
例如:2HCl(aq) + Zn(s) →ZnCl2(aq) + H2(g)。
以上是化学基本反应类型的简要介绍。
在实际应用中,化学反应类型的分类并不是非常严格,很多反应都可以同时归属于多种类型。