气体的状态参量
- 格式:ppt
- 大小:528.50 KB
- 文档页数:27

气体的状态参量气体是物态中最简单的一种,由于分子之间的距离比较大,因而分子间相互作用相对较弱,分子内能量占有主导地位,因此气体的性质比较特殊。
关于气体的状态参量,我们将在本文中进行详细介绍。
压力压力是气体状态参量中最基础的一个,表示气体分子对容器壁产生的作用力。
在理想气体状态方程中,压力与温度和容积成正比,与摩尔数成正比。
单位通常用帕斯卡(Pa)来表示。
温度温度是气体状态参量中最主要的一个,用于描述气体分子的平均能量、分子热运动的强度和分子间作用力的大小。
温度的单位通常用开尔文(K)来表示。
理想气体状态方程表明,其温度与压力成正比,与容积和摩尔数成反比。
容积容积是气体状态参量中表示气体所占空间大小的一个参数。
在理想气体状态方程中,容积与温度和压力成反比,与摩尔数成正比。
在实际气体中,容积还可以受到气体分子的相互作用力和压缩因素的影响。
摩尔数摩尔数表示单位体积或单位质量的气体分子数,是气体状态参量中的一个重要参数。
在理想气体状态方程中,摩尔数与温度、压力和容积成正比。
在实际气体中,摩尔数还受到气体分子的相互作用力和存在物质的影响。
内能内能是气体状态参量中描述物质内部粒子整体动能和分子间势能之和的一个参数。
在理想气体状态方程中,内能与温度成正比,与压力、容积和摩尔数正比例。
内能不仅仅受到温度的影响,同时也与气体的化学状态和分子内部结构等因素相关。
熵熵是气体状态参量中描述混乱度或无序度的一个参数。
在理想气体状态方程中,熵与温度成正比,与其他状态参量均无关。
熵的大小决定了热力学系统是否能实现一定的物理过程。
粘滞性粘滞性是气体状态参量中描述气体分子流动时与内部求相互作用力密切相关的一个参数。
在实际气体中,粘滞性可以通过剪切率和黏滞系数进行测量和描述。
热导率热导率是气体状态参量中描述气体传递热能的能力的一种参数。
在实际气体中,热导率可以通过热扩散系数和热传导系数进行测量和描述。
电导率电导率是气体状态参量中描述气体传导电流的能力的一种参数。

军校考试大纲《物理》考点—气体状态三个参量
关键词:军校考试张为臻军考培训军考大纲士兵军考
1、气体状态三个参量
由一定质量气体组成的系统的热学状态由系统的温度、压强和体积来描述。
状态也指各种物态,如物质的固态,液态和气态等。
热学中特有的状态参量有温度,内能,焓、熵等。
当物质在一定状态下,其状态参量具有一定的数值。
状态参量的数值,随外界作用的改变而变化。
例如,封闭在容器内的气体,在平衡状态中,气体的密度,压强和温度各处相同。
当对气体加热时,气体体积无大变化,但气体的压强却增加了,而且压强的增加和气体温度的升高有一定的对应数值。
准维教育军队考试网
2、三个参量的函数关系
当气体处于平衡态时可由三个量中任何两个变量来决定。
可写成下面的函数关系:F(P,t,V)=0。
式中三个变量中的任意两个可作为独立变量。
而状态方程正是反映其余一个为这两个独立变量的函数。
描写均匀流体的状态也只需两个自变量,但标志流体性质的变量不只限于上述的压强,体积和温度。
只要规定流体
状态的各变量中,任意选择两个作为变量,则状态的其他一切变量都是这两个自变量的函数。
对于均匀固体系统,除描写均匀流体所需的两个变量外,还需加上在各方向上的胁强或胁变作为变量才能作全面的描写。

13.1 气体的状态参量教学目的:1、理解什么是气体的状态及描述气体状态的参量(温度、体积、压强)的意义。
2、知道温度的物理意义,知道热力学温标及其单位。
知道热力学温度与摄氏温度的关系,会进行热力学温度跟摄氏温度之间的换算。
3、知道气体的体积及其单位。
4、知道气体的压强是怎样产生的,知道它的单位,会计算气体的压强,知道压强的不同单位,必要时会进行换算。
引入在力学中我们用质点所在的位置和在该位置的速度这两个物理量来确定质点的运动状态。
在热学里,我们研究的是组成物质的大量分子的集体状态。
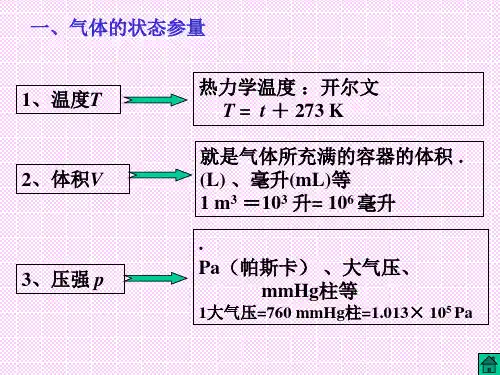
对一定质量的气体来说,这种集体状态用气体的体积V,压强P及温度T三个物理量来描述。
这三个量称气体的状态参量。
我们研究物理问题,要用一些物理量来描述研究对象,问题不同,所用物理量也不同。
如:研究质点运动规律时,常用到位移、速度、加速度来描述其运动状态,现在研究气体的热学性质,用什么物理量来描述呢?这就是我们这节课学习的内容。
一、气体的状态参量1.气体的状态:气体的各种性质的总和称为气体的状态,对于气体,它有各种性质,如几何性质、力学性质、热学性质等.这些性质的总和决定了气体所处的状态.2.气体的状态参量:描述气体性质的物理量叫做气体的状态参量.气体的热学性质用温度来描述,几何性质用体积来描述,力学性质用压强来描述.气体的温度、体积、压强是描述气体性质的三个状态参量.二、温度(描述气体的热学性质)1、对温度物理意义的认识宏观:温度是表示物体冷热程度的物理量。
微观:从分子动理论观点来看,温度是物体分子热运动的平均动能的标志。
温度越高,物体分子的热运动越剧烈,分子热运动的平均动能越大。
2、温标:温标即温度的数值表示法。
我们在初中学习过热力学温度和摄氏温度。
在国际单位制中,用热力学温标表示的温度叫做热力学温度。
它是国际单位制中七个基本量之一。
用符号“T”表示,单位是“开尔文”,简称“开”符号是“K”。
①摄氏温标:(它是把1个大气压下水的冰点定为零度,沸点定为100度,中间分为100等分,每一等分为1度)用符号t表示,单位为摄氏度,国际符号是o C。


⽓体的状态参量及⽓态⽅程⽓体的状态参量及⽓态⽅程[内容综述]1. 明确⽓体的状态是指⽓本的热⼒学平衡状态。
可以⽤压强P、体积V和温度T来描述⼀定质量的某种⽓体的热⼒学平衡状态。
2. 知道理想⽓体是⼀种物理模型,理想⽓体的状态变化遵守三个实验定律,并能由此导出理想⽓体的状态⽅程。
3. 知道⽤分⼦动理论的观点对理想⽓体模型及其状态参量作出微观解释。
[要点讲解]1. ⽓体的状态参量我们的研究对象是容器中的确定的⽓体,当它和外界不发⽣能量交换时,⽓体就处于平衡状态,但与⼒学中的平衡状态不同,⽓体的分⼦是在不停地运动着的。
称为热动平衡状态(以下简称平衡态)。
实验表明,处于平衡态的某⼀⽓体,只需压强P、体积V和温度T三个参量来描述,不同的平衡态对应⼀组不同的(P、V、T)值。
P、V、T这三个参量,只有两个是独⽴的。
因⽽对于⼀个确定的⽓体对象,两个不同的状态,只可能有⼀个参量取相同值。
即不可能保持两个参量不变⽽单独改变第三个参量来实现状态的变化。
如果假定P、V是独⽴的,则T是P、V的状态函数,可表⽰为T=f(P、V)此函数关系称为⽓体的状态⽅程。
其具体表达式要由实验来确定。
2.⽓体实验定律(1)玻意⽿定律实验表明,在温度不太低(与常温相⽐),压强不太⼤(与常压相⽐)的实验条件下,⼀定质量的⽓体温度保持不变时,它的压强与体积的乘积是⼀个常量。
即PV=C (1)常量C由温度决定。
(2)查理定律实验表明,⼀定质量的⽓体,体积不变时,它的压强跟热⼒学温度成正⽐。
即(2)(3)盖·吕萨克定律实验表明,⼀定质量的⽓体,压强保持不变时,它的体积跟热⼒学温度成正⽐。
即(3)3. 理想⽓体的状态⽅程严格遵守三个实验定律的⽓体称为理想⽓体。
对于⼀定质量的理想⽓体,当由状态1(参量为P1、V1、T1)变化到状态2(参量为P2、V2、T2)时,可由上述(1)、(2)、(3)三个⽅程中的任意两个(并设定中间态)推导出(4)上式称为理想⽓体的状态⽅程。



气体的状态参量
气体的状态参量是指帮助我们识别某一时刻或某一地点物质状态的特性。
气体的典型状态参量有压强、密度、比容、比体积、弹性系数、粘度、热容等。
压强(Pressure)即气体的外力,其特征就是能够驱动气体在容器内流动,在标准大气压下,1立方分米的气体的压强就是1千帕,而在室外,其大气压变化会影响压力的变化。
密度(Density)是指气体的质量与体积的比率,密度与气体的温度和压强有关,由伯努利方程可知,密度与温度成正比,与压力成反比。
比容(Specific Volume)指的是单位质量的气体能容纳的单位体积。
比容与温度的变化成正比,与压强的变化成反比。
比体积(Specific Weight)指的是单位质量气体的体积,一般情况下,它与比容按一定关系变化,它与压强成正比,与温度成反比。
弹性系数(Bulk Modulus)即气体的弹性力,它指气体在受到外力时,其体积会发生变化,但当外力结束时,气体会回复原始状态。
弹性系数与气体的压强、浓度,以及温度有关。
粘度(Viscosity)是指气体或液体移动时的阻力,粘度与温度有关,随着温度的上升,粘度降低,粘度当前也会与压强变化有关。
热容(Thermal Capacity)指的是气体的热容量,即气体内部的热量,其大小决定于气体的温度、压强和浓度。
一般来说,热容是一个非常大的量,在同一温度和压强下,不同浓度的热容量也不一样。
以上是常见的气体状态参量,可以完整地表示气体的状态,每一个状态参量都有特定的变化规律,特定的场合需要结合相应的环境条件进行计算才能得出准确的结果。
气体状态参量的重要性非常大,它们是我们了解气体特性的基础,为后续的气体处理工作奠定基础。


气体的等温变化【要点梳理】要点一、气体的状态参量用以描述气体宏观性质的物理量,叫状态参量,对于一定质量的某种气体来说,描述其宏观性质的物理量有温度、体积、压强三个.我们把温度、体积、压强三个物理量叫气体的状态参量. 1.体积(1)气体的体积就是指气体分子所能达到的空间. (2)单位:国际单位3m ,常用单位还有L m L 、. 331 L 10m3 1 dm ==-, 631 mL 10m3 1 cm ==-.要点诠释:气体分子可以自由移动,所以气体总要充满容器的整个空间,因此气体的体积就是容器的容积. 2.温度(1)温度是表示物体冷热程度的物理量.(2)温度的微观含义:温度是物体分子平均动能的标志,表示物体内部分子无规则运动的剧烈程度.(3)温度的两个单位:①摄氏温度:规定1标准大气压下,冰水混合物的温度为0℃,沸水的温度为100℃.表示符号为t .②热力学温度:规定273.15-℃为热力学温度的0K 。
热力学温度与摄氏温度单位等大.表示符号为T ,单位为开尔文,符号为K 。
热力学温度是国际单位制中七个基本物理量之一.0K 称为绝对零度,是低温的极限。
③热力学温度与摄氏温度的关系是:273.15 K T t =+,一般地表示为273K T t =+. 3.压强(3)微观解释①气体的压强是由气体中大量做无规则热运动的分子对器壁频繁持续的碰撞产生的,压强就是大量气体分子作用在器壁单位面积上的平均作用力. ②气体压强的决定因素气体分子的平均动能与分子的密集程度.分子平均动能越大,分子碰撞器壁对器壁产生的作用力就越大,气体的压强就越大;在分子平均动能一定时,气体分子越密集,每秒撞击器壁单位面积的分子数就越多,气体压强也就越大. ③理想气体压强公式 2/3p n ε=.式中/n N V =,是单位体积的分子数,表示分子分布的密集程度,ε是分子的平均动能. 【典型例题】类型一、气体的状态参量 例1(多选).甲、乙两个相同的密闭容器中分别装有等质量的同种气体,已知甲、乙两容器中气体的压强分别为p p 甲乙、,且p p 甲乙<,则( ).A .甲容器中气体的温度高于乙容器中气体的温度B .甲容器中气体的温度低于乙容器中气体的温度C .甲容器中气体分子的平均动能小于乙容器中气体分子的平均动能D .甲容器中气体分子的平均动能大于乙容器中气体分子的平均动能【思路点拨】由理想气体状态方程判断AB 对错;由温度是分子平均动能的标志判断CD 对错。
气体的三个状态参量知识点精解
描述气体状态用三个状态参量,只要这三个量确定了,则气体就处在一个确定的状态中。
气体的三个状态参量是:力学参量压强P,几何参量体积V,热学参量温度T或t。
1.压强P
(1)气体作用在器壁单位面积上的压力叫做气体的压强。
(2)气体压强的单位为帕斯卡,简称帕。
1帕=1牛/米2或1Pa=1N/m2。
常用单位有标准大气压和毫米汞柱。
1标准大气压=760毫米汞柱=1.013×105帕。
1毫米汞柱=133.3帕。
(3)气体的压强由单位体积内的分子数和分子的平均动能决定。
(4)如图3-1所示,用长为h的一小段水银柱把气体封闭在玻璃管中,大气压为P0,三种情况中被封闭气体的压强为:
P a=P0,P b=P0+P h,
P c=P0-P h。
上述三式,表示玻璃管放置不同时,被水银柱封闭气体的压强的计算方法。
2.体积V
气体的体积就是指气体所充满的容器的容积。
其单位有:米3,立方分米,立方厘米,升。
1升=10-3米3=1分米3。
3.温度T或t
这是三个参量中唯一的一个热学参量。
温度是表示物体冷热程度的物理量,是物体分子热运动的平均动能的标志。
【说明】上述三个状态参量是用来描述气体状态发生变化的三个物理量。
若P、V、T三个量不变化,就说气体处于一定的状态中。
若有两个或者三个同时改变,就说气体的状态改变了。
对一定质量的气体来说,只有一个量改变而其他
两个都不改变的情况,是不会发生的。