2020届二轮复习 电化学 专题卷(全国通用)
- 格式:doc
- 大小:934.00 KB
- 文档页数:13

专题突破电化学一、选择题(本题包括8个小题,每小题8分,共64分)1.(2019黑龙江大庆实验中学高三上学期开学考试)有关下列四个常用电化学装置的叙述正确的是()A.图Ⅰ所示电池中,MnO2的作用是催化剂B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag2.(2019四川成都高三一诊)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。
下列分析错误的是()A.防腐原理主要是避免发生反应:2Fe+O2+2H2O2Fe(OH)2B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池C.采用外加电流的阴极保护法时需外接镁、锌等作辅助阳极D.钢构件可采用不锈钢材料以减缓电化学腐蚀3.(2018山东烟台高三诊断性测试)下列装置一定能证明2Ag++2I-2Ag+I2能否自发进行的是()4.(2019天津武清区大良中学高三月考)燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。
下列说法正确的是()A.M极生成氮气且电极附近pH降低B.负极上每消耗1 mol N2H4,会有2 mol H+通过质子交换膜C.正极的电极反应式为O2+2H2O+4e-4OH-D.电极M是原电池的正极5.(2019广东佛山普通高中教学质量检测)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。
总反应为CO(NH2)2+H2O3H2↑+N2↑+CO2↑。
下列说法中错误的是()A.a为阳极,CO(NH2)2发生氧化反应B.b电极反应为2H2O+2e-H2↑+2OH-C.每转移6 mol电子,a电极产生1 mol N2D.电解一段时间,a极区溶液pH升高6.(2019湖南衡阳高三联考)“ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示,隔开两极的陶瓷管作钠离子导体。

浙江2020高考化学二轮通用:电化学基础练习题附答案专题:电化学基础一、选择题1、控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
下列判断不正确的是()A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流表读数为零时,反应达到化学平衡状态D.电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极解析:由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失电子变成I2被氧化,A、B正确;电流表读数为零时,Fe3+得电子速率等于I-失电子速率,反应达到平衡状态,C正确;在甲中溶入FeCl2固体,平衡2Fe3++2I-2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
答案:D2、高效能电池的研发制约电动汽车的推广。
有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH===4K2CO3+10H2O,有关此电池的推断中正确的是(C)A.负极反应为:14H2O+7O2+28e-===28OH-B.放电过程中KOH的物质的量浓度不变C.每消耗1 mol C2H6,则电路上转移的电子为14 molD.放电一段时间后,负极周围的pH升高解析:燃料作负极,氧气作正极,A选项错误;由总反应可知放电过程中消耗KOH,B选项错误;分析总反应,7个O2参加反应转移28个电子,C选项正确;负极电极反应式为C 2H 6+18OH --14e -===2CO 2-3+12H 2O ,D 选项错误。
3、用惰性电极电解一定浓度的CuSO 4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu 2(OH)2CO 3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。
则电解过程中转移电子的物质的量为( )A .0.4 mol B.0.5 mol C .0.6 mol D .0.8 mol解析:电解硫酸铜溶液时,开始发生反应:2CuSO 4+2H 2O=====电解2Cu +O 2↑+2H 2SO 4,后来发生反应:2H 2O=====电解2H 2↑+O 2↑。

绝密★启用前2020届全国高考化学二轮复习《电化学基础》测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分分卷I一、单选题(共10小题,每小题4.0分,共40分)1.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是()A.铜电极附近观察到黄绿色气体B.石墨电极附近溶液呈红色C.溶液中的Na+向石墨电极移动D.铜电极上发生还原反应2.如下图所示,其中甲池的总反应式:2CH3OH+3O2+4KOH===2K2CO3+6H2O。
下列说法正确的是()A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置B.甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O===CO32−+8H+C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体3.对于原电池的电极名称,叙述错误的是()A.发生氧化反应的一极为负极B.正极为电子流入的一极C.比较不活泼的金属为负极D.电流流出的一极为正极4.原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是()A. H2O+CaO===Ca(OH)2B. Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3·H2O+8H2OC. 2KClO32KCl+3O2↑D. CH4+2O2CO2+2H2O5.现有A、B、C、D四种金属片:①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是()A.在①中,金属片B发生还原反应B.在②中,金属片C作正极C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生D.上述四种金属的活动性由强到弱的顺序是A>B>C>D6.X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中,X溶解,Z极上有氢气放出;Y2+的氧化性强于Z2+,弱于M2+。

电解原理的应用1.金属镍有广泛的用途。
粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()A.阳极发生还原反应,其电极反应式:Ni2++2e﹣===NiB.电解过程中,阳极质量的减少与阴极质量的增加相等C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中只有Cu和Pt2.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是()A.a为正极,b为负极;NaClO和NaClB.a为负极,b为正极;NaClO和NaClC.a为阳极,b为阴极;HClO和NaClD.a为阴极,b为阳极;HClO和NaCl3.关于镀铜和电解精炼铜,下列说法中正确的是()A.都用粗铜作阳极、纯铜作阴极B.电解液的成分都保持不变C.阳极反应都只有Cu-2e-===Cu2+D.阴极反应都只有Cu2++2e-===Cu4.电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。
下列说法不正确的是() A.阳极反应为Fe-2e-===Fe2+B.电解过程中溶液pH不会变化C.过程中有Fe(OH)3沉淀生成D.电路中每转移12mol电子,最多有1mol Cr2O被还原5.下列图示中关于铜电极的连接错误的是()6.某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。
通电后,溶液中产生白色沉淀,且较长时间不变色。
下列说法中正确的是()A.电源中a为负极,b为正极B.电解池中的电解液不可以是NaCl溶液C.B电极发生的反应:2H++2e-===H2↑D.A、B两端都必须使用铁作电极7.下列有关说法正确的是()A.铅蓄电池的正极反应为PbO2+4H++2e-===Pb2++2H2OB.以CO和O 2构成的碱性燃料电池负极电极反应式为CO+4OH--2e-===CO+2H2O C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极D.工业上通过电解氯化钠溶液制备金属钠和氯气8.用石墨电极完成下列电解实验。

2020届人教高考化学:电化学二轮练及答案专题:电化学一、选择题1、LiFePO4电池具有稳定性高、安全、环境友好等优点,可用于电动汽车。
电池反应为FePO4+Li 放电充电LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。
下列有关LiFePO4电池的说法正确的是()A.放电时电池正极反应为FePO4+Li++e-===LiFePO4B.放电时电池内部Li+向负极移动C.充电过程中,电池正极材料的质量增加D.可加入硫酸以提高电解质的导电性解析:选A。
当其为原电池时,负极材料为石墨和锂,锂失去电子,正极得到电子,电极反应为FePO4+Li++e-===LiFePO4,故A正确;放电时阳离子向正极移动,故B错误;充电过程为电解池,阳极反应为LiFePO4-e-===FePO4+Li+,电池的正极材料质量减少,故C错误;因为锂可以和硫酸反应,则电解质中不能加入硫酸,故D错误。
2、现有的氨合成气,液体燃料合成气制备工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备氨合成气和液体燃料合成气的概念,并取得研究进展。
其工作原理如图所示,下列说法错误的是A.膜I侧相当于原电池的正极B.O2和H2O均发生还原反应C.膜II侧发生的反应为:CH4+O2--2e-=2H2+COD.膜II侧消耗CH4与膜I侧生成H2的物质的量之比为1:2【答案】D3、以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。
下列说法不正确的是A.x是二氧化碳,y是氧气B.太阳能电池是将光能转化为电能C.a极可用铁作电极,b极一定要用惰性电极D.b极的反应之一为2CO2+12e-+12H+==C2H4+4H2O【答案】C4、锂-碘电池应用于心脏起搏器,使用寿命超过10年,负极是锂,正极是聚2-乙烯吡(P2VP) 和I2复合物,工作原理2Li+ P2VP·nI2=2LiI+ P2VP·(n-1)I2,下列叙述错误的是A.该电池是电解质为非水体系的二次电池B.工作时Li+向正极移动C.正极反应式为P2VP·nI2+2Li++2e-=2LiI+ P2VP·(n-1)I2D.该电池具有全时间工作、体积小、质量小、寿命长等优点【答案】A【解析】金属锂能够与水反应,所以该电池是电解质为非水体系的一次电池,使用寿命超过10年,A错误;原电池工作时,阳离子(Li+)向正极移动,B 正确;原电池正极发生还原反应,P2VP·nI2在正极得电子,C正确;锂-碘电池应用于心脏起搏器,使用寿命超过10年,该电池具有全时间工作、体积小、质量小、寿命长等优点,D正确;正确选项A。

2020届高考化学二轮通用题:电化学基础练习附答案专题:电化学基础一、选择题1、如图是某同学设计的原电池装置,下列叙述中正确的是()A.电极Ⅰ上发生还原反应,作原电池的负极B.电极Ⅱ的电极反应式为Cu2++2e-===CuC.该原电池的总反应为2Fe3++Cu===Cu2++2Fe2+D.盐桥中装有含氯化钾的琼脂,其作用是传递电子解析:该原电池的总反应为2Fe3++Cu===Cu2++2Fe2+;电极Ⅰ上发生还原反应,作原电池的正极,电极反应式为2Fe3++2e-===2Fe2+,电极Ⅱ为原电池的负极,发生氧化反应,电极反应式为Cu-2e-===Cu2+;盐桥中装有含氯化钾的琼脂,其作用是传递离子。
答案:C2、利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。
该电池工作时,有关说法正确的是(A)A.铝罐将逐渐被腐蚀B.炭粒和炭棒上发生的反应为O2+4e-===2O2-C.炭棒应与玩具电池的负极相连D.该电池工作一段时间后炭棒和炭粒的质量会减轻解析:由废铝罐和碳棒,食盐水等材料制可用于驱动玩具的电池可知,A、铝做负极,铝罐将逐渐被腐蚀,正确;B、炭棒做正极,碳棒上发生的反应为O2+4e -+2H2O===4OH-,错误;C、碳棒应与玩具电池的正极相连,错误;D、该电池工作一段时间后碳棒质量不变,错误;选A。
3、电镀在工业上有着广泛的应用,可以镀锌、镀铜、镀金等。
如利用下图所示装置可以使铜牌摇身一变为银牌,即在铜牌表面电镀一层银。
下列有关说法中正确的是()A.通电后,Ag+向阳极移动B.银片与电源负极相连C.该电解池的阴极反应可表示为Ag++e-===AgD.当电镀一段时间后,将电源反接,铜牌可恢复如初解析:由电解原理可知,在电镀时,镀层金属作阳极,待镀金属制品作阴极。
要想在铜上镀银,说明银为阳极,与电源的正极相连,B项错误;在电解液中,Ag+向阴极移动,A项错误;阴极反应为Ag++e-===Ag,C项正确;将电源反接,则铜牌作阳极,由放电顺序可知,铜牌上的Cu、Ag均能溶解,铜牌不可能恢复如初,D项错误。

题型4 电化学新型化学能源1.用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。
下列说法错误的是( )A.金属锂作电池的负极B.电池正极反应为FeS2+4Li++4e-===Fe+2Li2SC.放电时,Li+向负极迁移D.电池总反应为FeS2+4Li===Fe+2Li2S解析:该电池中金属锂为负极,二硫化亚铁为正极,A项正确;电池正极上FeS2发生还原反应,且电解液中Li+向正极移动参与反应,电极反应式为FeS2+4Li++4e-===Fe+2Li2S,B项正确,C项错误;电池负极反应为Li-e-===Li+,则电池总反应为FeS2+4Li===Fe+2Li2S,D项正确。
答案:C2.(2018·福建三明质检)有一种钌(Ru)基配合物光敏染料敏化太阳能电池,其原理如图所示。
下列说法不正确的是( )A.电池工作时,能量的转化形式至少有3种B.放电时,I-和I-3的浓度均减小C.Y电极为电池的正极,发生的反应为I-3+2e-===3I-D.电池工作时,X电极上发生氧化反应解析:电池工作时,能量的转化形式至少有3种:太阳能转化为化学能,化学能转化为电能及热能,A项正确;放电时,正极电极反应式为I-3+2e-===3I-,I-浓度增大,I-3的浓度减小,B项错误;Y电极为电池的正极,电极反应式为I-3+2e-===3I-,C项正确;电池工作时,X电极为负极,发生氧化反应,D项正确。
答案:B3.某太阳能电池的工作原理如图所示。
下列说法正确的是( )A.光照时,b极的电极反应式为VO2+-e-+H2O===VO+2+2H+B.光照时,每转移2 mol电子,有2 mol H+由a极区经质子交换膜向b极区迁移C.夜间,a极的电极反应式为V3++e-===V2+D.硅太阳能电池供电原理与该电池相同解析:光照时,b极失去电子,发生氧化反应,b极为负极,电极反应式为VO2+-e-+H2O===VO+2+2H+,A正确;光照时,b极失去电子,为了维持电荷平衡,H+必须由b极区经质子交换膜向a极区迁移,B错误;夜间,电池放电,a极的电极反应式为V2+-e-===V3+,C错误;该电池工作时,发生了氧化还原反应,化学能转化为电能,而硅太阳能电池直接将光能转化成电能,二者供电原理不相同,D错误。

2020届高三化学二轮复习电化学基础选择题专题训练(有答案和详细解析)1.根据下图分析下列说法正确的是()A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大解析A项,Ⅰ中负极反应式为Zn-2e-===Zn2+,错误;B项,Ⅱ中正极反应式为2H++2e -===H2↑,错误;C项,阳离子向发生还原反应的一极移动,Ⅰ中阳离子向左侧移动,Ⅱ中阳离子向右侧移动,错误;D项Ⅰ中左侧发生O2+4e-+2H2O===4OH-,Ⅱ中右侧发生2H++2e-===H2↑,故pH均增大,正确。
答案D2.一定条件下,碳钢腐蚀与溶液pH的关系如下表:下列说法错误的是()A.当pH<4时,碳钢主要发生析氢腐蚀B.当pH>6时,碳钢主要发生吸氧腐蚀C.当pH>14时,正极反应为O2+4H++4e-===2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓解析C项正极反应为O2+4e-+2H2O===4OH-。
答案C3.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如下图所示,下列与此原理有关的说法错误的是()A.正极反应:SO2-4+5H2O+8e-===HS-+9OH-B.输送暖气的管道不易发生此类腐蚀C.这种情况下,Fe腐蚀的最终产物为Fe2O3·x H2OD.管道上刷富锌油漆可以延缓管道的腐蚀+5H2O+8e-===HS 解析原电池的正极发生还原反应,由图示可知发生的电极反应为SO2-4-+9OH-,A正确;硫酸盐还原菌是蛋白质,在高温下易变性,失去催化活性,则输送暖气的管道不易发生此类腐蚀,B正确;由图示可知,Fe腐蚀生成Fe2+且在HS-环境中不易生成Fe3+,C错误;管道上刷富锌油漆,形成ZnFe原电池,Fe为正极,可以延缓管道的腐蚀,D正确。
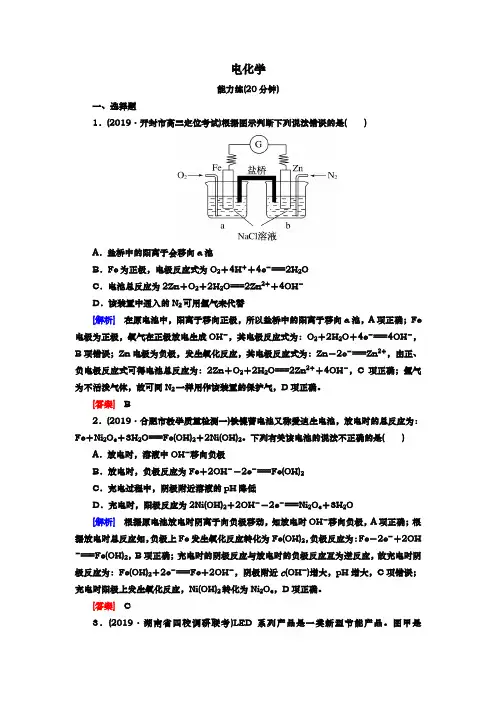
电化学能力练(20分钟)一、选择题1.(2019·开封市高三定位考试)根据图示判断下列说法错误的是( )A.盐桥中的阳离子会移向a池B.Fe为正极,电极反应式为O2+4H++4e-===2H2OC.电池总反应为2Zn+O2+2H2O===2Zn2++4OH-D.该装置中通入的N2可用氩气来代替[解析]在原电池中,阳离子移向正极,所以盐桥中的阳离子移向a池,A项正确;Fe 电极为正极,氧气在正极放电生成OH-,其电极反应式为:O2+2H2O+4e-===4OH-,B项错误;Zn电极为负极,发生氧化反应,其电极反应式为:Zn-2e-===Zn2+,由正、负电极反应式可得电池总反应为:2Zn+O2+2H2O===2Zn2++4OH-,C项正确;氩气为不活泼气体,故可同N2一样用作该装置的保护气,D项正确。
[答案] B2.(2019·合肥市教学质量检测一)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2。
下列有关该电池的说法不正确的是( ) A.放电时,溶液中OH-移向负极B.放电时,负极反应为Fe+2OH--2e-===Fe(OH)2C.充电过程中,阴极附近溶液的pH降低D.充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O[解析]根据原电池放电时阴离子向负极移动,知放电时OH-移向负极,A项正确;根据放电时总反应知,负极上Fe发生氧化反应转化为Fe(OH)2,负极反应为:Fe-2e-+2OH -===Fe(OH)2,B项正确;充电时的阴极反应与放电时的负极反应互为逆反应,故充电时阴极反应为:Fe(OH)2+2e-===Fe+2OH-,阴极附近c(OH-)增大,pH增大,C项错误;充电时阳极上发生氧化反应,Ni(OH)2转化为Ni2O3,D项正确。
[答案] C3.(2019·湖南省四校调研联考)LED系列产品是一类新型节能产品。

有机化学基础(测试时间:90分钟评价分值:100分)一、单项选择题(本大题共12小题,每小题3分,共36分)1.下列物质的主要成分,属于蛋白质的是( )A.火棉B.人造丝C.黏胶纤维D.真丝解析:火棉是酯类,而B、C两项都是人工处理过的纤维素,真丝(蚕丝)成分是蛋白质。
答案:D2.四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯。
下列关于四氯乙烯和聚四氟乙烯的叙述正确的是( )A.它们都属于纯净物 B.它们的分子中都不含氢原子C.它们都能使酸性高锰酸钾溶液褪色 D.它们都可由乙烯只发生加成反应得到解析:高聚物都是混合物,聚四氟乙烯是由四氟乙烯(F2C—CF2) 通过加聚反应而生成所以分子中都没有氢原子,且聚四氟乙烯中不存在双键。
答案:B3.有机物的正确命名为( )A.3,3二甲基2乙基戊烷 B.3,3二甲基4乙基戊烷C.3,3,4三甲基己烷 D.2,3,3三甲基己烷解析:选主链:最长的碳链含有8个C;编号:从左边编号支链编号之和比从右边编号小,故从左边编号;该有机物的名称为:3,3,4三甲基己烷,故C正确。
答案:C4.2008年奥运会将在北京举行,这届奥运会吉祥物五个福娃已经被做成各种玩具,有一种玩具的内充物为无毒的聚酯纤维。
下列说法正确的是( )A.聚酯纤维是高分子化合物,是一种纯净物B.聚酯纤维一定易溶于水C.聚酯纤维可能易着火D.由单体合成聚酯纤维的反应属加聚反应解析:本题以热点为素材,考查了社会生活与化学知识的关系。
从分子结构可以看出分子内存在是聚酯,生成聚酯的反应为缩聚反应。
答案:C5.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:下列叙述错误的是( )A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油解析:动植物油脂不是高分子化合物,C项错误。

2020(届)人教版高考化学:电化学二轮练题含答案专题:电化学一、选择题1、近日,中国科学院深圳先进技术研究院研发出一种高性能的钙离子电池:以溶有六氟磷酸钙Ca(PF6)2的碳酸酯类溶剂为电解液,放电时合金Ca7Sn6发生去合金化反应,阴离子(PF-6)从石墨烯中脱嵌,进入电解质溶液。
放电时其工作原理如图,下列说法错误的是(已知:比能量为单位质量的电极放出电能的大小)()A.电池放电时,化学能转化为电能和热能B.放电时,a电极的电极反应式为Ca7Sn6-14e-===7Ca2++6SnC.充电时,b电极接电源的正极D.与锂离子电池相比较钙离子电池具有材料储量丰富、比能量高的优点解析:选D。
电池放电时为原电池,化学能转化为电能和热能,A正确;根据图示可知,Ca2+向b电极移动,因此a电极为负极,发生氧化反应:Ca7Sn6-14e-===7Ca2++6Sn,B正确;充电时为电解池,b电极为原电池的正极,应该接电源的正极,C正确;由于提供1 mol e-时,钙的质量大于锂的质量,所以单位质量的电极放出电能,钙离子电池比能量比锂离子电池要低,D错误。
2、全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。
一种钢铁锈蚀原理示意图如右,下列说法不正确...的是A.缺氧区:Fe-2e-=== Fe2+B.富氧区:O2+ 2H2O + 4e-=== 4OH-C.Fe失去的电子通过电解质溶液传递给O2D.隔绝氧气或电解质溶液均可有效防止铁生锈【答案】C3、以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是A.原溶液中CuSO4和NaCl物质的量之比为1:1B.a表示阴极上产生的气体,前产生的为Cl2C.若t1时溶液的体积为1L,此时溶液的pH为13D.若原溶液体积为1L,则原溶液中SO42-的物质的量浓度为0.2mol/L【答案】A4、摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为LiCoO2+6C li1-x CoO2 +lixC6,结构如图所示。
电化学原理I.Zulema Borjas 等设计的一种微生物脱盐池的装置如下图,以下说法正确的选项是A.该装置可以在高温下工作B.X 、Y 依次为阳离子、阴离子交换膜C.负极反响为 CHCOG2HO-8e -I2COT +7H +D.该装置工作时,电能转化为化学能 2.某柔性屏 的柔性电池以碳纳米管作电极材料,以吸收ZnSO 溶液的有机高聚物作固态电解质,其电池总反响为_1__ O+ZnSO MnOOH+ 6 1 -ZnSqZn 〔OH 〞] 3 • x HO,电池结构如图1所不,图2是有机身聚物的 6结构片段F 列说法中,不正确的选项是 〔 〕A.碳纳米管具有导电性,可用作电极材料B.放电时,电池的正极反响为 MnO+e+H +—MnOOH1 ..??.. Mn(2+-慎水生物阪/ I cnicm 1有机帆 处理后整水T宏还窗由一riF 横育机废水 海水 |空气ffll*胸椎「揖野嶂一-艮---MnQ ;N 一置地米管钟堆C.充电时,Zn 2+移向Zn 膜oD.合成有机高聚物的单体是 Clh-CH-C- NH a3. 一种正投入生产的大型蓄电系统如下图.放电前 ,被交换膜隔于 的电解质为Na&和NaBr 3,放电后分别变为Na$和NaBr .以下表达 正确的选项是〔 〕A.放电时,负极的电极反响式为2s 2--2e--S 2-B.充电时,阳极的电极反响式为3Br --2e -—B r 3C.放电时,Na +经过离子交换膜,由b 池移向a 池D.充电时,M 接电源负极,N 接电源正极4 .乙醛酸〔HOOGCHO 是一种重要的有机合成中间体.在乙二酸〔HOOC- COOHfe 复原法合成乙醛酸的根底上化学工作者创新性地提 出双极室成对电解法装置模型及工作原理如下图.以下说法中错 误的是 〔IJ窝子文换履A.该离子交换膜应选择阳离子交换膜B.HCl 是制取乙醛酸反响的催化剂,并起导电作用C.该方法的总、反响为 OHC-CHO+HOO 〔CO 〔#2HOOCCHO吉乙琳酸N 的电解液 盐就 乙二tl IO ( EIO COOH Hl MM' F 含乙甚晶 的电解液 住窝子交忤晾CHO2H* IIO(■ H riD.乙二醛、乙二酸分别在阴、阳电极外表放电,故称为双极室成对电解法5 .钛被誉为第三金属,广泛用于航天航空等领域.硼化锐〔VB2〕-空气电池的放电反响为4VB+11Q—4BQ+2V2Q,以该电池为电源制备钛的装置如下图.以下说法正确的选项是〔〕Cu 空/f希II LJ IWKOH; KOHlaq〕1 1 叫J阴高孑交梅隆A.电解过程中,QH由阴离子交换膜右侧向左侧迁移B.Pt 极反响式为2VB+22QH22e--V2Q+2BQ+11HQC.电解过程中,铜极附近电解质溶液的pH减小D.假设石墨极只收集到4.48 L Cl 2气体,那么理论上制备4.8 g Ti6 .太阳能路灯蓄电池是磷酸铁锂电池,具工作原理如图.M电极材料是金属锂和碳的复合材料〔碳作为金属锂的载体〕,电解质为一种能传导Li +的高分子材料,隔膜只允许Li +通过,电池反响式为Li x C6+Li i-x 产电FePQ LiFePQ+6G以下说法正确的选项是〔〕A.放电时Li +从左边移向右边,P O 4-从右边移向左边B.放电时,正极反响式为Li 1-x FePO+x Li ++x e —LiFePQC.充电时M 极连接电源的负极,电极反响为6C+xe —C?? D.充电时电路中通过2.0 mol 电子,产生7.0 g Li7 .太阳能电池是以外表涂有钉〔Ru 〕基配合物的TiO 2光敏染料的透明 导电玻璃和镀Pt 导电玻璃为极板.其工作原理如下图F 列关于该电池表达正确的选项是〔 〕8 .电池工作的总反响为 Ru n +I3—Ru 1n +3I -C.当太阳光照射光敏染料时,光敏染料所在电极的电势低于镀 Pt 导 电玻璃电极D.电池工作时,为持续供电,需要定期补充有关电解质 8.2021年诺贝尔化学奖授予了在锂电池研究方面有突出奉献的三位 放电科学家.我国研究锂硫电池获得突破,电池的总反响是16Li+S 嬴 8Li 2S,充放电曲线如下图,以下说法不正确的选项是 〔 〕A.充电时,电能转化为化学能A.电池工作时电能由光能直接转化而来 ,不涉及化学能转化 踹配合i 髓B.放电时,锂离子向正极移动C.放电时,1 mol Li 2$转化为Li 2S4得到2 mol e -D.充电时,阳极总电极反响式是8S2--16e—S89 .城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀.原理如图所示,但假设电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护〞.以下有关说法不正确的选项是()A.该装置能够将电能转化为化学能B.管道右端腐蚀比左端快,右端电极反响式为Fe-2e--Fe2+C.如果没有外加电源,潮湿的土壤中的钢铁管道比拟容易发生吸氧腐蚀D.钢铁“阳极保护〞的实质是在阳极金属外表形成一层耐腐蚀的钝化膜10 .深埋在潮湿土壤中的铁管道,在硫酸盐复原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如下图,以下与此原理有关说法错误的选项是( )A.正极反响:S O4-+5HO+8e HS+90HB.输送暖气的管道不易发生此类腐蚀C.这种情况下,Fe 腐蚀的最终广物为Fe .- x H 2OD.管道上刷富锌油漆可以延缓管道的腐蚀11 .微生物燃料电池是指在微生物的作用下将化学能转化为电能的装 置.某微生物燃料电池的工作原理如下图,以下说法正确的选项是( )A.电子从b 流出,经外电路流向aB.HS 在硫氧化菌作用下转化为S O4-的反响是HS+4HO-8e — S O 4-+9H +C.如果将反响物直接燃烧,能量的利用率不会变化D.假设该电池电路中有0.4 mol 电子发生转移,那么有0.5 mol H +通过质 子交换膜12.中科院科学家设计出一套利用 SO 和太阳能综合制氢方案,其根本 工作原理如下图,以下说法错误的选项是 ()• • A.该电化学装置中,Pt 电极作正极B.BiVO 4电极上的反响式为 S O 2--2e -+2OH S O 4- +H 2O太阳光P L H O BtVOi湍“5寸JC.电子流向:Pt电极-导线-BiVQ电极-电解质溶液-Pt电极D.Pt电极的电势高于BiVO电极的电势13 .镁燃料电池具有比能量高、使用平安方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁 -次氯酸盐燃料电池的工作原理图,以下有关说法不正确的选项是()A.该燃料电池中镁为负极,发生氧化反响B.正极反响式为ClO-+H2O+2e—C1-+2OHC.放电过程中OF<向正极移动D.电池总反响式为Mg+ClOHUMg(OH) ; +Cl-14 .C-Na2MnO是科学家正在研发的新型钠离子电池中的一种,具充放电原理如下图.放电时的总反响式为x Na+NaMnO 列说法错误的选项是电源或、用电器,NT电*电解液A.放电时,左电极为负极,材料为金属钠Na2+x)MnQ 下Clff+HjOB.该电池可用NaMnO中性水溶液作为电解液C.充电时,右电极与电源正极相连,发生氧化反响D.充电时,阳极反响式为Na〔2+x〕Mn®x e―x Na++NaMnO1.C A.高温能使微生物蛋白质凝固变性,导致电池工作失效,所以该装置不能在高温下工作,A错误;B.原电池内电路中:阳离子移向正极、阴离子移向负极,从而到达脱盐目的,所以Y为阳离子交换膜、X 为阴离子交换膜,B错误;C.由题图可知,负极为有机废水中CH3CO跌电子发生氧化反响,电极反响为CHCOG2H2O-8e 2COT +7H+,C正确;D.该装置工作时为原电池,是将化学能转化为电能的装置,D错误.2.B A.该电池以碳纳米管作电极材料,可知碳纳米管具有导电性,故A正确;B.原电池正极发生复原反响,根据放电时的总反响式,放电时MnO# 电子发生复原反响,所以电池的正极反响为MnOe+HO MnOOH+OH 故B错误;C.充电时该装置为电解池,阳离子移向阴极,充电时Zn膜充当阴极,所以Zn2+移向Zn膜,故C正确;D.根据高聚物的结构单元,o该高聚物为加聚产物,合成有机高聚物的单体是NH.,故D 正确;选B.3c 放电时,负极反响为2N a$-2e-T N aS+2Na,A错误;充电时,阳极反响为3NaBr-2e-NaBr3+2Nd,B错误;在原电池中,阳离子移向正极,Na+经过离子交换膜,由b池移向a池,C正确;充电时,M接阳极反应为3NaBr-2e—NaBr+2Na,所以充电时,M接电源正极,N接电源负极,D错误.4.D 由图可知,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中D电极上HOOCCOOK电子生成HOOCCHO,Cfe极氯离子失电子生成氯气,氯气具有氧化性,能将醛基氧化为竣基,那么乙二醛与氯气反响生成乙醛酸.C为阳极,发生的反响为2cl--2e--C12 T,OHC-CHO+C+HMHOOCCHO+2C+2RD 为阴极,电极反响为HOOCCOOH+2+2H+ -HO O CCHO+ 2O,氢离子由阳极向阴极移动,所以应选择阳离子交换膜,A正确;由于阳极发生的反响为2cl--2e-T Cl2T ,OHC-CHO+C+H2O—HOOeCHO+2C+2H f,反响后HCl 并没改变,所以HCl 是制取乙醛酸反响的催化剂,并起导电作用,B正确;根据两电极反响,该方法的总反响为OHC-CHO+HOO<COOH2HOOCCHO, C正确;根据以上分析,乙二醛在阳极被氧化为HOOCCHO且乙二醛不在阳极外表放电;乙二酸在阴极得电子生成HOOCCHO, D错误.5.B 由装置图知,铜极为正极,电极反响式为O+4e+2HO-40H钳为负极,负极反响式为2VB-22e+22OH-V2Q+2BQ+11HO,负极反响消耗OHOH 由交换膜左侧向右侧迁移,A项错误,B项正确;铜极生成OH,迁移需要一定时间,铜极附近电解质溶液pH增大,C项错误;没有指明氯气是否处于“标准状况〞,不能根据摩尔体积22.4 L •mol-1 计算,D项错误.6.B A.M电极材料是金属锂和碳的复合材料〔碳作为金属锂的载体〕,含有Li单质.M电极为负极,放电时,阳离子向正极移动,Li +从左向右移动,隔膜只允许Li +通过,P O4-不能通过,A项错误;B.放电时,正极得到电子,Li 1-x FePO变成LiFePQ,根据电子守恒,Li 1- x FePO x Li++x e-|—LiFePQ,B项正确;C.放电时,M为负极,充电时M为阴极,连接电源的负极,生成Lix C6,电极反响为6C+x Li ++x e-T Li x C6,C 项错误;D.C是锂的载体,根据6C+〔Li ++x e—Li x C6,转移x mol e -得到x mol Li,那么转移2 mol e -,生成2 mol Li单质,为14 g,D项错误.7.C A.电池中存在13与I-的转化,发生化学变化,即存在化学能的转化,A错误BRuUl g-Rj+BI-反响中电荷不守恒,B错误;C.由图可知,电子从光敏染料流向镀Pt导电玻璃电极,那么光敏染料所在电极为负极,镀Pt导电玻璃电极为正极,所以光敏染料所在电极的电势低于镀Pt导电玻璃电3在正极上得电子被复原为极,C正确;D.由电池中发生的反响可知,I3I-,后又被氧化为I3, I3和I-相互转化,反响的实质是光敏有机物在激发态与基态的相互转化,所有化学物质都没有被损耗,不需要补充有关电解质,D错误.8c A.充电时,是电解池,是电能转化为化学能,故A正确;B.放电时,是原电池,在原电池中,阳离子向正极移动,因此锂离子向正极移动,故B正确;C.根据图示,放电时,1 mol Li 2$转化为Li2S4的反响为2Li 2S6+ 2Li I-3LizS,反响中2 mol Li2$得到2 mol e,即1 molLi 2$得到1 mol e ,故C错误;D.根据16Li+S疯8Li 2S,充电时,阳极总电极反响式是8g -16e- - $,故D正确;应选a9.B A项,该装置相当于电解池,能将电能转化为化学能,正确;B项, 左端是阳极,腐蚀得更快,错误;C项,如果没有外加电源,潮湿的土壤〔接近中性〕中的钢铁管道发生原电池反响,所以发生的是吸氧腐蚀, 正确;D项,根据题意,此种腐蚀较慢,所以“阳极保护〞实际上是在金属外表形成了一层致密的保护膜,正确.4-10 .C 原电池的正极发生复原反响,由图示可知发生的电极反响为S O+5H2O+8e HS+90H故A正确;硫酸盐复原菌是蛋白质,在高温下易变性,失去催化水平,那么输送暖气的管道不易发生此类腐蚀,故B 正确;由图示可知,Fe腐蚀的最终产物为FeO,故C错误;管道上刷富锌油漆,形成Zn-Fe原电池,Fe变为正极,可以延缓管道的腐蚀,故D 正确.11 .B b电极通入氧气,是正极,a电极是负极,电子从a流出,经外电路流向b,A错误;a电极是负极,发生失去电子的氧化反响,即HS在硫氧化菌作用下转化为S O2-,电极反响是HS+4H I O-8e—S O4-+9H+,B 正确;如果将反响物直接燃烧,会有局部化学能转化为光能,因此能量的利用率会变化,C错误;假设该电池电路中有0.4 mol电子发生转移, 根据电荷守恒可知有0.4 mol H +通过质子交换膜与0.1 mol氧气结合转化为水,D错误.12 .C Pt电极上发生复原反响,作正极,A项正确;BiVO4电极为负极,发生氧化反响,电极反响式为S O2--2e-+2OH S O4-+H2O,B项正确;电子从BiVQ电极〔负极〕经导线流向Pt电极〔正极〕,且不能进入溶液,C项错误;Pt电极〔正极〕电势高于BiVO电极〔负极〕,D项正确.13 .C A.镁失电子发生氧化反响而作负极,所以A选项是正确的;B. 正极上次氯酸根得电子发生复原反响,电极反响式为C1O-+HO+2L C1-+2OH所以B选项是正确的;C.放电过程中氢氧根离子向负极移动,所以C选项是错误的;D.镁在负极上失电子生成镁离子,次氯酸根离子在正极上得电子和水生成氯离子和氢氧根离子,所以电池反响式为Mg+ ClO+HO Mg〔OH〕; + Cl-,所以D选项是正确的.14.B A.放电时,钠离子流向右电极,说明左电极为负极,材料为金属钠,右电极为正极,故A正确;B.金属钠是活泼金属,易与水反响发生自损耗现象,所以该电池不可用NaMnO中性水溶液彳^为电解液,故B 错误;C.原电池中右电极为正极,充电时,右电极与电源正极相连,发生氧化反响,故C正确;D.充电时,阳极发生氧化反响,阳极反响式为Na2+x〕Mn@x e-x Na f+NaMnO 故D正确.。
2020届高考化学二轮通用题:电化学基础练习及答案专题:电化学基础一、选择题1、M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P 用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。
则这四种金属的还原性由强到弱的顺序是()A.P>M>N>E B.E>N>M>PC.P>N>M>E D.E>P>M>N解析:由①知,金属活动性:M>N;M、P用导线连接放入硫酸氢钠溶液中,M 表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N作负极,故金属活动性:N>E。
综合可知,金属活动性:P>M>N>E,A正确。
答案:A2、可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,其电池反应为Mg+2MnF3===2MnF2+MgF2。
下列有关说法不正确的是(C)A.镁为负极材料B.正极的电极反应式为MnF3+e-===MnF2+F-C.电子从镁极流出,经电解质流向正极D.每生成1 mol MnF2时转移1 mol电子解析:由电池反应知,镁作还原剂,发生氧化反应,镁极为负极,A项不符合题意;电池反应中,三氟化锰发生还原反应,B项不符合题意;电子由负极(镁极)流出经外电路流向正极,C项符合题意;锰元素由+3价降至+2价,D项不符合题意。
3、电解法精炼含有Fe、Zn、Ag等杂质的粗铜。
下列叙述正确的是() A.电解时以硫酸铜溶液作电解液,精铜作阳极B.粗铜与电源负极相连,发生氧化反应C.阴极上发生的反应是Cu2++2e-===CuD.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥解析:根据电解原理,粗铜作阳极,比铜活泼的Zn 、Fe 等杂质发生氧化反应,比Cu 不活泼的金属单质,如Ag 等在阳极底部沉积;精铜作阴极,只发生Cu 2++2e -===Cu 。
2020届高考二轮复习跟踪测试:电化学化学试卷试卷简介:1.本卷共100分,考试时刻100分钟2.试卷类型:二轮专题复习3.题目类型:选择题、填空题、运算题、4.难度比例:中等难度为主5.考察范畴:电化学6.将答案写在答题卡的相应位置一.选择题〔15小题,每题3分〕1.以下讲法不正确的选项是A.原电池中,负极上发生的反应是氧化反应B.原电池中,电流从负极流向正极C.铜锌原电池中放电时,溶液中的阴离子向负极移动,阳离子向正极移动D.碱性锰锌电池是一次电池,铅蓄电池是二次电池2.等质量的两份锌粉a和b,分不加入过量的稀硫酸中,a中同时加入少量CuSO4,以下图中表示其产生H2总体积(V)与时刻(t)的关系正确的选项是3.白铁皮〔镀锌〕发生析氢腐蚀时,假设有0.2mol电子发生转移,以下讲法正确的选项是A.有6.5g锌被腐蚀B.在标准状况下有22.4L氢气放出C.有2.8g铁被腐蚀D.在标准状况下有2.24L气体放出4.将Al片和Cu片用导线相连,一组插入浓硝酸中,一组插入稀氢氧化钠溶液中,分不形成原电池,那么在这两个原电池中,正极.负极分不为A.Al片.Cu片 B.Cu片.Al片C.Al片.Al片 D.Cu片.Cu片5.有A.B.C.D四种金属,当A.B组成原电池时,电子流淌方向A →B ;当A.D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+那么A.B.D.E金属性由强到弱的顺序为A.A﹥B﹥E﹥D B.A﹥B﹥D﹥EC.D﹥E﹥A﹥B D.D﹥A﹥B﹥E6.据报到,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。
其电池反应为:2Zn+O2=2ZnO原料为锌粒,电解液和空气。
以下表达正确的选项是A.锌为正极,空气进入负极反应B.负极反应为Zn-2e-=Zn2+C.正极发生氧化反应D.电解液确信不是强酸7.在一盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通电一段时刻后:A.溶液的PH值增大; B.Na+和CO32-的浓度减小;C.溶液的浓度增大; D.溶液的浓度不变,有晶体析出;8.将分不盛有熔融KCl.MgCl2.Al2O3〔熔有冰晶石〕的三个电解槽,在一定条件下通电一段时刻后,析出K.Mg.Al的物质的量之比是:A.1:2:3; B.3:2:1; C.6:3:1; D.6:3:2;9.用石墨做电极,电解以下溶液,通过一段时刻,溶液的pH下降的是A. NaCl B. NaOH C. H2SO4 D. CuSO410.在铁品上镀一定厚度的锌层,以下方案设计正确的选项是A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌作阴极,镀件作阳极,溶液中含有锌离子11.用酸性氢氧燃料电池电解苦卤水 (含Cl―.Br―.Na+.Mg2+)的装置如下图 (a.b为石墨电极)。
绝密★启用前2020年高考化学二轮专题复习测试《电化学基础》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题4.0分,共40分)1.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。
下列“水”电池在海水中放电时的有关说法不正确的是()A.负极反应式:Ag+Cl--e-===AgClB.正极反应式:5MnO2+2e-=== Mn5C.每生成1 mol Na2Mn5O10转移2 mol电子D. AgCl是还原产物2.燃料电池能有效提高能源利用率,具有广泛的应用前景。
下列物质均可用作燃料电池的燃料,其中最环保的是()A.甲醇B.天然气C.液化石油气D.氢气3.关于下列各装置图的叙述中不正确的是()A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液B.装置②的总反应是Cu+2Fe3+===Cu2++2Fe2+C.装置③中钢闸门应与外接电源的负极相连D.装置④中的铁钉几乎没被腐蚀4.下图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是()A. a为负极、b为正极B. a为阳极、b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变5.关于下图所示①、②两个装置的叙述,正确的是()A.装置名称:①是原电池,②是电解池B.硫酸浓度变化:①增大,②减小C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,②中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动6.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。
则电解过程中转移的电子的物质的量为()A. 0.4 molB. 0.5 molC. 0.6 molD. 0.8 mol7.某小组为研究电化学原理,设计如图装置。
2020届高考化学二轮复习常考题型大通关(全国卷)(11)电化学基础1、下列有关四个常用电化学装置的叙述中,正确的是( )A.图Ⅰ所示的电池中,是正极,电极反应式2MnO 2-2O e ==O 2H 2H 2H -↑++B.图II 所示电池放电过程中,当外电路通过1 mol 电子时,理论上负极板的质量增加96 gC.图111所示装置工作过程中,阳极质量减少M 等 于阴极的质量增加MD.图IV 所示电池中,不管KOH 溶液换成溶液还是溶液,电池的总反应式24H SO 24Na SO 不变2、我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制(装置如2H 图),总反应为。
()222222CO NH H O 3H N CO ↑↑↑通电+++下列说法中正确的是( )A.a 电极反应为()222222CO NH H O 6e N CO 6H -↑↑↑++++=B.b 电极为阳极,发生氧化反应C.电解一段时间b 极区溶液pH 升高D.废水中每通过6 mol 电子,a 电极产生2 mol 2N 3、电解合成 1 , 2-二氯乙烷的实验装置如下图所示。
下列说法中正确的是( )A.该装置工作时,化学能转变为电能B.能将还原为 l , 2-二氯乙烷2CuCl 24C HC.X 、Y 依次为阳离子交换膜、阴离子交换膜D.该装置总反应为222222CH =CH +2H O+2NaCl ===H +2NaOH+ClCH CH Cl电解4、伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间都夹放着几张盐水泡过的布。
如图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积时成。
下列说法正确的是( )A.该原电池正极的电极反应式为O 2+4e -+4H +2H 2OB.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag 2OC.当电路中转移0.2 mol 电子时,消耗锌板的总质量为52 gD.该伏打电堆工作时,在银板附近会有Cl 2放出5、三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为,23+42Li Ni Co Mn O z x y ++且x +y+z=1。
电化学能力练(20分钟)一、选择题1.(2019·开封市高三定位考试)根据图示判断下列说法错误的是()A.盐桥中的阳离子会移向a池B.Fe为正极,电极反应式为O2+4H++4e-===2H2OC.电池总反应为2Zn+O2+2H2O===2Zn2++4OH-D.该装置中通入的N2可用氩气来代替[解析]在原电池中,阳离子移向正极,所以盐桥中的阳离子移向a池,A项正确;Fe 电极为正极,氧气在正极放电生成OH-,其电极反应式为:O2+2H2O+4e-===4OH-,B 项错误;Zn电极为负极,发生氧化反应,其电极反应式为:Zn-2e-===Zn2+,由正、负电极反应式可得电池总反应为:2Zn+O2+2H2O===2Zn2++4OH-,C项正确;氩气为不活泼气体,故可同N2一样用作该装置的保护气,D项正确。
[答案] B2.(2019·合肥市教学质量检测一)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe +Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2。
下列有关该电池的说法不正确的是() A.放电时,溶液中OH-移向负极B.放电时,负极反应为Fe+2OH--2e-===Fe(OH)2C.充电过程中,阴极附近溶液的pH降低D.充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O[解析]根据原电池放电时阴离子向负极移动,知放电时OH-移向负极,A项正确;根据放电时总反应知,负极上Fe发生氧化反应转化为Fe(OH)2,负极反应为:Fe-2e-+2OH-===Fe(OH)2,B项正确;充电时的阴极反应与放电时的负极反应互为逆反应,故充电时阴极反应为:Fe(OH)2+2e-===Fe+2OH-,阴极附近c(OH-)增大,pH增大,C项错误;充电时阳极上发生氧化反应,Ni(OH)2转化为Ni2O3,D项正确。
[答案] C3.(2019·湖南省四校调研联考)LED系列产品是一类新型节能产品。
图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。
下列叙述错误的是()A.电池应选用阳离子交换膜,Na+向A极区移动B.电池A极区的电极反应式为:H2O2+2e-===2OH-C.每有1 mol NaBH4参加反应,转移电子数为4N AD.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连[解析]A极上H2O2转化为OH-,发生还原反应:H2O2+2e-===2OH-,则A极为正极,根据图示,Na+能透过离子交换膜进入A极区生成NaOH,则离子交换膜为阳离子交换膜,A项正确,B项正确;B极为负极,发生氧化反应:BH-4+8OH--8e-===BO-2+6H2O,每有1 mol NaBH4参加反应,转移电子数为8N A,C项错误;根据LED发光二极管中电荷移动情况知,导线a应与负极相连,导线b应与正极相连,故图乙中的导线a应与图甲中的B极相连,D项正确。
[答案] C4.(2019·郑州市质量预测二)如图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。
O2可以通过聚四氟乙烯膜与AlI3反应生成Al2O3和I2,通过电池电位计的变化可以测得O2的含量。
下列说法正确的是()A.正极反应为:3O2+12e-+4Al3+===2Al2O3B.协同总反应为:3O2+4AlI3+12Ag===2Al2O3+12AgIC.外电路通过0.01 mol电子时,消耗O2的体积为0.56 LD.给传感器充电时,Ag+向多孔石墨电极移动[解析]O2通过聚四氟乙烯膜与AlI3发生反应:4AlI3+3O2===2Al2O3+6I2,此时Ag 电极为负极,电极反应式为Ag-e-===Ag+,多孔石墨电极为正极,电极反应式为I2+2e-+2Ag+===2AgI,A项错误;原电池总反应为I2+2Ag===2AgI,协同总反应为4AlI3+3O2+12Ag===2Al2O3+12AgI,B项正确;外电路通过0.01 mol电子时,消耗0.0025 mol O2,其在标准状况下的体积为0.056 L,C项错误;给传感器充电时,多孔石墨电极作阳极,Ag 电极作阴极,Ag+向阴极移动,D项错误。
[答案] B5.(2019·黑龙江省重点中学第三次联考)H2S转化是环保和资源利用的研究课题。
将烧碱吸收H2S后的溶液加入如图装置,可以回收单质硫,甲为二甲醚(CH3OCH3)-空气燃料电池。
下列推断正确的是()A.Y极充入二甲醚B.电子移动方向:X→W→溶液→Z→YC.电解后,乙装置右池中c(NaOH)减小D.Z极反应式为S2--2e-===S[解析]据图分析甲为原电池,乙为电解池,电解池右侧有H2产生,则W极为阴极,Z极作阳极,连接的Y极为原电池的正极,发生还原反应,所以Y极应充入氧气,A项错误;电子不进入溶液,B项错误;乙装置右池中发生电极反应2H2O+2e-===H2↑+2OH-,氢氧化钠溶液浓度增大,C项错误;Z极电极反应为S2--2e-===S,D项正确。
[答案] D6.(2019·成都市摸底测试)下列有关电化学在生产、生活中的应用分析正确的是()A.图1:铁钉发生析氢腐蚀B.图2:可以在铁件上镀铜C.图3:溶液中c(Cu2+)保持不变D.图4:将输油管与电源负极相连可以防止腐蚀[解析]图1,电解质溶液若呈酸性,则铁钉发生析氢腐蚀,电解质溶液若呈碱性或中性,则铁钉发生吸氧腐蚀,A项错误;图2,在铁件上镀铜,铜片作阳极,应与电源正极相连,待镀铁件做阴极,应与电源负极相连,B项错误;图3,电解精炼铜时,阳极上锌先放电,铜后放电,而阴极上是Cu2+放电,故电解质溶液中c(Cu2+)减小,C项错误;图4采用外加电流的阴极保护法,将输油管与电源负极相连,输油管作阴极,可以防止腐蚀,D项正确。
[答案] D7.(2019·黄石调研)如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是()A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO2-3+8H+C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度D .甲池中消耗280 mL(标准状况下)O 2,此时丙池中理论上最多产生1.45 g 固体[解析] 由题意和题图知,甲池为原电池,乙、丙池均为电解池,故甲池是化学能转化为电能的装置,乙、丙池是电能转化为化学能的装置,A 项错误;结合甲池的总反应及甲池中的电解质溶液为KOH 溶液,可知通入CH 3OH 的电极反应式为CH 3OH -6e -+8OH-===CO 2-3+6H 2O ,B 项错误;乙池中石墨电极为阳极,Ag 电极为阴极,乙池的总反应为:2CuSO 4+2H 2O=====通电2Cu +O 2↑+2H 2SO 4,溶液中减少的是“2Cu +O 2↑”,因此加入CuO 能使CuSO 4溶液恢复到原浓度,C 项错误;甲池通入O 2的电极反应式为:O 2+4e -+2H 2O===4OH -,丙池的总反应为:MgCl 2+2H 2O=====通电Mg(OH)2↓+H 2↑+Cl 2↑(转移2e -),根据各电极上转移电子数目相同,可得关系式:O 2~2Mg(OH)2,则甲池中消耗280 mL(标准状况下)O 2时,丙池中产生Mg(OH)2固体的质量为0.280 L 22.4 L·mol-1×2×58 g·mol -1=1.45 g ,D 项正确。
[答案] D二、非选择题8.(2019·成都摸底测试)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。
(1)电解NO 制备NH 4NO 3原理如图1所示。
①阳极为________(填“X”或“Y”),Y 的电极反应式为_________。
②为使电解产物完全转化为NH 4NO 3,需要补充的物质A 的化学式为________。
(2)用图2装置进行模拟电解NO 2气体实验,可回收硝酸。
①电解时NO 2发生反应的电极反应式为________________。
②若有标准状况下2.24 L NO 2被吸收,通过阳离子交换膜(只允许阳离子通过)的H +为________mol 。
[解析] (1)①通过分析装置图1可知Y 极上NO 转化为NO -3,则该电极是阳极,失去电子发生氧化反应,电极反应式为NO +2H 2O -3e -===NO -3+4H +。
②X 电极反应式为NO +6H ++5e -===NH +4+H 2O ;生成一个NH +4需要得到5个电子,生成一个NO -3需要失去3个电子,根据转移电子相等知,生成的NH +4浓度小于NO -3浓度,要使NO -3完全转化为NH4NO3,应该加入NH3,所以加入的A为NH3。
(2)①通过分析装置图2知左室为电解池的阴极,电极反应式为2H2O+2e-===H2↑+2OH-,右室为电解池的阳极,NO2发生氧化反应生成硝酸,电极反应式为NO2+H2O-e-===NO-3+2H+。
②根据阴、阳两极的电极反应式知若有标准状况下2.24 LNO2被吸收,转移电子0.1 mol,阴极区生成的OH-为0.1 mol,为维持电荷守恒通过阳离子交换膜的H+为0.1 mol。
[答案](1)①Y NO+2H2O-3e-===NO-3+4H+②NH3(2)①NO2+H2O-e-===NO-3+2H+②0.1拔高练(25分钟)一、选择题1.(2019·长春市质量监测一)下列有关四个常用电化学装置的叙述,正确的是()A.图Ⅰ所示电池中,MnO2是催化剂B.图Ⅱ所示电池放电过程中,硫酸浓度保持不变C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度不断增大D.图Ⅳ所示电池工作过程中,外电路中电子由锌极流向氧化银极[解析]图Ⅰ所示电池中MnO2是氧化剂,作正极,得电子,发生还原反应,A项错误;图Ⅱ所示铅蓄电池放电过程的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,放电过程中消耗H2SO4,生成H2O,使硫酸浓度减小,B项错误;图Ⅲ电解精炼铜的过程中,阳极粗铜中比铜活泼的金属优先失去电子,之后是铜失电子,阴极上Cu2+得电子生成Cu,因此电解质溶液中Cu2+浓度减小,C项错误;图Ⅳ所示电池工作过程中,外电路中电子由锌极流向氧化银极,D项正确。
[答案] D2.(2019·武汉部分市级示范高中联考)在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO2-4与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。