药理学实验指导
- 格式:doc
- 大小:83.50 KB
- 文档页数:8

药学大实验实验指导药理学部分Revised at 2 pm on December 25, 2020.药学实验(药理学实验)实验五不同给药途径、给药剂量对药物作用的影响(一)不同给药途径对药物作用的影响实验目的观察不同给药途径对药物(硫酸镁)作用的影响,了解核酸镁不同给药途径产生不同作用的原因;掌握硫酸镁的作用以及小鼠灌胃、腹腔注射方法实验原理硫酸镁为一种容积性泻药(此外还有刺激性和润滑性泻药),口服在肠道难吸收,在肠内形成高渗压而阻止肠内水分的吸收,从而扩张肠道、刺激肠壁、促进肠道蠕动,产生泻下作用。
注射给药可使血中Mg2+增加,由于Ca2+和Mg2+化学结构相似,Ca2+和Mg2+间存在相互拮抗作用,Ca2+参与运动神经末梢Ach释放,而Mg2+拮抗Ca2+这种作用,结果使神经肌肉接头处Ach减少,骨骼肌紧张性降低,肌肉松弛。
同时对中枢神经及心血管系统产生抑制作用。
因此产生抗惊厥及降压效果。
本实验观察不同给药途径对硫酸镁作用性质的影响。
大多数药物需进入血液分布到作用部位才能发生作用。
药物自给药部位进入全身血液循环的过程为吸收(absorption),吸收速度的快慢及吸收数量的多少直接影响药物的起效时间及强度。
其中给药途径是决定药物起效时间及强度的重要因素之一。
给药途径不同,则药物吸收快慢亦不同,其吸收快慢顺序除静脉注射外是:腹腔注射>吸入>舌下>直肠>肌内注射>皮下注射>口服>皮肤。
给药途径不同,其吸收程度又不同,由此使药物作用强度不同。
药物经不同给药途径所致的吸收程度是:吸入、舌下、直肠、肌内注射较为完全,口服次之,皮下较差;皮肤表面吸收程度最差,一定要脂溶性特别高的药物才能通过此途径较好地吸收。
而胃肠道给药,影响因素较多,包括有首关消除的影响等,使药物吸收程度有所不同。
首关消除(first pass elimination):从胃肠道吸收入门静脉系统的药物在到达全身血循环前必先通过肝脏,如果肝脏对其代谢能力很强或由胆汁排泄的量大,则使进入全身血循环内的有效药物量明显减少,这种作用称为首关消除。

实验一药理学实验基本知识和技术实验目的:1、掌握基本操作,锻炼动手、动脑能力;2、更好地掌握药理学基本理论知识;3、培养科学思维。
实验内容:一、药理实验的基本目的与要求二、实验动物:1、动物的选择;2、动物的标记与捉拿、固定方法;3、动物的取血方法(尾尖、眼眶静脉丛、摘眼球、断头);4、动物的给药方法(灌胃、腹腔、皮下、尾静脉);5、动物的麻醉方法;6、动物的处死方法。
三、实验设计基本原则。
实验步骤:一、药理学实验的基本目的与要求药理学实验课在药理学教学中占有非常重要的地位。
药理学实验课的目的在于通过实验验证药理学的基本理论,加深理解与掌握药理学的基本知识和规律;也是了解获得药理学知识的科学途径。
同时,培养学生独立思考,独立工作,科学思维的能力;培养学生动手操作、分析问题和解决问题的能力;还应培养学生对科学工作的严肃的态度、严格的要求、严密的工作方法及实事求是的工作作风。
为了达到上述目的,要求做到下列事项:1. 实验前:预习实验内容并复习相关理论知识;2. 实验时:(1)实验分小组进行,实验前分工明确,实验时密切配合;(2)确定实验仪器、药品、动物与实验指导相符时,将实验器材妥善安排,正确装置、保管;(3)实验操作按步骤进行,仔细观察实验中出现的现象,实事求是地做好记录;(4)注意爱护动物、节约实验药品;(5)实验过程中保持实验室肃静、清洁。
3. 实验后:⑴各组同学将实验动物处死,实验台擦干净,将实验方盘送回准备室;⑵值日生搞好实验室卫生,将死亡动物送至指定场所;⑶整理实验结果,经分析思考作出结论,按要求写出实验报告,按时交给指导老师。
实验报告的书写1.题目2.目的3.原理4.材料:实验动物,器材,药品5.方法:用自己的语言简单扼要描述出来;6.结果:要求真实、清楚;7.讨论:将实验结果进行比较、分析;实验中有哪些不足之处;结果异常或失败的原因;8.结论:将实验结果进行归纳总结,应带有提示性质。

生理学实验一、蛙(蟾蜍)坐骨神经腓肠肌标本制备【实验目的】1. 掌握蛙类坐骨神经腓肠肌标本的制备方法。
2. 观察组织的兴奋性、刺激与反应律以及骨骼肌收缩的特点。
【实验原理】蛙和蟾蜍是两栖类动物,其生存环境较简单,离体组织或器官所要求的条件也较简单。
坐骨神经和腓肠肌属于可兴奋组织,把它们置于人工配制的林格液中,其兴奋性在几个小时内保持不变。
若给坐骨神经一个适宜的刺激,可在神经和肌肉上产生一个可传导的动作电位,肉眼可以看到一次肌肉的收缩和舒张,表明神经和肌肉兴奋了一次。
【实验材料】实验对象:蟾蜍或蛙。
实验器材:蛙板、玻璃分针、粗剪刀、眼科剪刀、尖镊子、培养皿、锌铜弓。
实验试剂:任氏液【实验方法】坐骨神经腓肠肌标本的制备可采用离体或在体的方法。
1 、离体坐骨神经腓肠肌标本制备( 1 )破坏脑脊髓:取蟾蜍 1 只,以左手示指压其头部前端使其尽量前俯,中指与示指夹住其前肢,拇指抵住其骶部,使整个躯干做最大屈曲,后肢悬空。
探针自枕骨大孔处垂直刺入,到达椎管,随即将探针改变方向刺入颅腔,向左右两侧不断搅动,彻底捣毁脑组织。
将探针退出至枕骨大孔处,转向后刺入椎管,捻动探针使其逐渐刺入整个椎管内,完全捣毁脊髓。
脑脊髓完全破坏的标志是:下颌呼吸运动消失,反射消失,四肢松软。
( 2 )去除头部和内脏:左手握住蟾蜍后肢,此时躯干上部及内脏即全部下垂。
右手持粗剪刀在骶髂关节前 1cm 处剪断脊柱,剪除全部躯干及内脏组织,注意勿损伤神经。
( 3 )去皮:用圆头镊子夹住脊柱,注意不要碰到神经,捏住皮肤边缘,逐步向下牵拉剥离皮肤。
全部皮肤剥除后,把标本置于盛有林格液的培养皿中。
( 4 )双手和用过的全部手术器械。
( 5 )分离两后肢:避开坐骨神经,用粗剪刀从背侧剪去骶骨,然后沿中线将脊柱剪成左右两半,再从耻骨联合中央剪开两腿,将已分离的下肢标本浸入盛有任氏液的培养皿中保存。
( 6 )完成坐骨神经腓肠肌标本。
① 游离坐骨神经:取出一下肢,用蛙钉固定于蛙板上。

药理学实验指导(供自学助考班用)实验一药理学实验基础知识与常用动物捉拿、给药【目的】1、学习药理学实验基础知识;2、掌握药理学实验常用动物捉拿、给药方法。
【器材】1ml、5ml、20ml注射器,大、小鼠灌胃针头,4号、6号注射针头,250ml烧杯、鼠笼(或铁丝笼),天平秤、砝码。
【药品】0.9%生理盐水。
【动物】小白鼠、大鼠、家兔。
【内容】一、实验动物的捉拿方法1、蛙和蟾蜍左手握持蛙或蟾蜍,食指和中指夹住左前肢,拇指压住右前肢;右手将双下肢拉直,左手无名指及小指将其压住而固定。
此法用于淋巴囊注射。
毁脑和毁脊髓则用左手食指和中指夹持蛙或蟾蜍的头部,拇指和无名指小指握持双下肢,右手持刺针进行操作。
2、小白鼠可采取双手法和单手法两种形式。
双手法:右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏住小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
单手法:小白鼠置于笼盖上,先用左手食指与拇指抓住鼠尾,手掌尺侧及小指夹住尾根部,然后用左手拇指与食指捏住颈部皮肤。
3、大白鼠大白鼠容易激怒咬人,捉持时左手应戴防护手套或用厚布盖住大鼠,先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与手掌握住背部和腹部。
不要用力过大,切勿捏其颈部,以免窒息致死。
4、家兔用左手抓住颈背部皮肤(抓的面积越大,其吃重点越分散)。
将兔提起,以左手托住其臀部,使兔呈坐位。
二、实验动物的给药途径与方法1、小白鼠给药途径与方法灌胃(ig):左手固定小鼠,右手持灌胃器,灌胃针头自口角进入口腔,紧贴上腭插入食道。
如遇阻力,将灌胃针头抽回重插,以防损伤。
常用灌胃量为0.1~0.2ml/10g。
皮下注射(ih):可用腹部、背部、腹股沟的皮下,此处皮肤比较松弛,也可由助手协助。
注药量一般为0.1~0.2ml/10g。
肌肉注射(im):一人抓住小鼠头部皮肤和尾巴,另一人持连4号针头的注射器,将针头刺入后腿外侧肌肉。

中药药理学实验指导中药教学部姚干编重庆邮电学院生物信息学院2005年02月10日前言我国中医中药历史悠久,理论体系完整,在历代临床实践中积累了丰富的药效学经验。
中药和方剂是祖国医学的精华,其药理作用需要不断地加以研究与探索。
中药药理学是采用现代科学技术方法来研究中药的组方、成分、作用机理及用途的一门前沿科学,而中药药理实验和中药药理学是不可分割的一门学科的两个组成部分,缺一不可。
中药药理实验以中医药理论为指导,以中药功效为主线,运用现代药理学实验方法进行单味中药与经典方剂的研究,对继承、发扬祖国医药学这一伟大宝库的历史使命和实现中药现代化,有着非常重要的作用。
本实验指导是以中药专业培养计划为依据,按照《中药药理学》实验课程(本科)教学大纲的要求编撰而成的,主要供我院中药专业本科学生实验教学使用。
本实验指导首先对中药药理实验的基础知识与基本技术进行了简要介绍,选择的实验项目力求内容经典、实用,既与理论课有密切联系,又有实验课的独特体系;既有整体动物实验,又有器官水平实验;既有定性实验,又有定量实验;既有验证性实验,又有设计性实验。
从而使学生初步具备对客观事物进行观察、比较、分析、综合和解决问题的能力,并验证、巩固和加深理解基本理论,从而初步掌握中药药理学实验的基本方法。
目录中药药理学实验须知 3 中药药理实验的基础知识与基本技术 5 实验一生大黄、制大黄对小鼠排便时间和数量的影响17实验二生大黄、制大黄对小鼠小肠运动的影响17实验三秦艽对蛋清致大鼠后跖肿胀的影响18实验四青皮对家兔离体肠平滑肌的影响19实验五金铃子对小鼠的镇痛作用20实验六人参对小鼠耐常压缺氧的作用20实验七人参对小鼠游泳时间的影响21中药药理学实验须知一、中药药理学实验课的目的和要求㈠目的中药药理学实验课的目的在于通过实验,使学生掌握中药药理学实验的基本方法,了解获得中药药理学知识的科学途径,验证中药药理学中的重要理论,更牢固地掌握中药药理学的基本概念和基本知识。

药理实验指导教案一、实验目的通过药理实验,了解药物的作用机制、药力学参数以及药物相互作用等相关知识,培养学生科学实验的能力。
二、实验材料与设备1. 实验药物:如阿司匹林、盐酸吗啡等。
2. 药理实验动物:如小鼠、大鼠等。
3. 实验器材:如注射器、实验仪器等。
4. 实验材料:如生理盐水、缓冲液等。
三、实验内容及步骤1. 实验前准备(1)准备好实验动物,确保健康状况良好。
(2)配制药物溶液,根据药物剂量和实验要求进行稀释。
(3)准备实验器材和材料。
2. 药效学实验(1)组织实验动物,随机分组。
(2)给予实验动物不同剂量的实验药物,如阿司匹林。
(3)观察实验动物的反应,如频率、强度等。
(4)根据实验结果,绘制药物剂量-反应曲线图。
(5)计算药物的EC50值。
3. 药物代谢实验(1)给予实验动物一定剂量的药物,如盐酸吗啡。
(2)在一定时间间隔内,采集实验动物的生物样本,如血液、尿液等。
(3)采用适当的实验方法,分离和检测药物及其代谢产物。
(4)绘制药物的浓度-时间曲线图,并计算药物的半衰期。
4. 药物相互作用实验(1)选择两种具有不同作用机制的药物,如阿司匹林和盐酸吗啡。
(2)给予实验动物单独使用这两种药物,并记录其反应。
(3)给予实验动物同时使用这两种药物,并记录其反应。
(4)比较两种情况下实验动物的药效差异,评估药物之间的相互作用。
5. 实验结果分析根据实验数据和观察结果,进行统计学分析,并进行合理的解释和讨论。
四、实验安全注意事项1. 遵循实验室安全操作规范,佩戴实验服和防护手套。
2. 确保实验动物的福利,遵循动物实验伦理的相关规定。
3. 注意药物的剂量和给药途径,避免超出安全范围。
4. 注意药物的保存和处理,避免污染和损坏。
五、实验总结与思考对实验结果进行总结,并提出对实验方法和结果的改进意见。
思考药物在临床应用中的重要性和意义。
六、实验拓展学生可以根据自身兴趣和实验条件,开展其他相关的药理实验,如药物对器官的作用、药物对行为的影响等。

药理学实验指导2实验报告的写作2.1实验题⽬实验题⽬⼀般应包括实验药物、实验动物、实验主要内容等。
如“⼼得安对⿇醉⽝的降压作⽤分析”,“普鲁卡因肌注对⼩⿏局⿇作⽤及中毒抢救”,“奎尼丁抗电诱发的蛙⼼⼼律失常的作⽤”等。
2.2实验⽬的2.3实验⽅法2.4实验结果实验结果是实验报告中最重要的部分,需绝对保证其真实性。
应随时将实验中观察到的现象在草稿本上记录,实验告⼀段落后⽴即进⾏整理,不可单凭记忆或搁置了长时间后再作整理,否则易致遗漏或差错。
实验报告上⼀般只列经过归纳、整理的结果。
但原始记录应予保存备查。
2.5讨论讨论应针对实验中所观察到的现象与结果,联系课堂讲授的理论知识,进⾏分析和讨论。
不能离开实验结果去空谈理论。
要判断实验结果是否为预期的。
如果属于⾮预期的,则应该分析其可能原因。
讨论的描述⼀般是:⾸先描述在实验中所观察到的现象,然后对此现象提出⾃⼰的看法或推论,最后参照教科书和⽂献资料对出现这些现象的机制进⾏分析,如实验观察到⽤药后动物出现了什么现象,提⽰了该药可能具有什么药理作⽤,⽂献曾报道该药可对什么受体有作⽤。
因此,可初步推测该药的这种药理作⽤可能与其作⽤于什么受体有关。
2.6结论实验结论是从实验结果归纳出来的概括性判断,也就是对本实验所能说明的问题、验证的概念或理论的简要总结。
不必再在结论中重述具体结果。
未获证据的理论分析不能写⼊结论。
第⼆章药理学实验设计的基本知识⼀实验设计的基本原则药理学研究的⽬的是通过动物实验来认识药物作⽤的特点和规律,为开发新药和评价药物提供科学依据。
由于⽣物学研究普遍存在的个体差异,要取得精确可靠的实验结论必须进⾏科学的实验设计,因此必须遵循以下基本原则。
1 重复“重复”包括两⽅⾯的内容,即良好的重复稳定性(或称重现性)和⾜够的重复数,两者含意不同⼜紧密联系。
有了⾜够的重复数才会取得较⾼的重现性,为了得到统计学所要求的重现性,必须选择相应的适当的重复数。
统计学中的显著性检验规定的P<0.05及P<0.01反映了重现性的⾼低;“P”表⽰不能重现的概率。

实验六三金片对家兔的利尿作用(膀胱漏斗法)
【目的】学习膀胱漏斗法以观察三金片的利尿作用。
【原理】三金片为治疗泌尿系统感染的特效中药,文献报道有利尿作用。
【器材】兔手术台、注射器、针头、剪刀、手术钳、导尿管、量筒、烧杯、婴儿秤。
【药品】三金片水溶液、葡萄糖盐水、生理盐水
【动物】家兔
【方法】取家兔背位固定在兔台上,耳缘静脉注入5g∕dl葡萄糖盐水10ml∕kg,造成水负荷。
耳缘静脉注射25%乌拉坦麻醉,进行手术,在耻骨联合上方沿腹中线作一个长约3~4cm的皮肤切口。
沿腹白线切开腹壁,将膀胱移出体外。
在其顶部用两把止血钳提起,在止血钳之间作一长约Icm 的切口,把膀胱漏斗放入膀胱,漏斗底要罩在两侧输尿管的膀胱入口上,用线将膀胱及漏斗柄结扎固定。
收集正常尿量2次,1次IOmin。
一只兔通过灌胃管灌入三金片水溶液IOml/kg,另一只兔灌入同容积生理盐水,60分钟后开邕收集尿液。
每隔30min收集1次,连续3次。
【结果】按表填写数据。


药学专业药理学实验设计与操作指南药理学是药学专业的一门重要课程,通过实验来研究药物在生物体内的作用机制和药效学特性。
本文将为药学专业的学生提供一份药理学实验设计与操作指南,帮助他们更好地理解和掌握实验技巧。
一、实验前准备1. 实验目的:明确实验的目标和预期结果。
2. 实验原理:了解实验所涉及的药物、试剂和动物模型的基本原理和作用机制。
3. 实验材料准备:准备所需的药物、试剂、仪器设备和实验动物等。
4. 实验安全措施:了解实验中可能存在的危险因素,并采取相应的安全措施。
5. 实验步骤设计:根据实验目的和原理,设计合理的实验步骤和操作流程。
二、实验操作技巧1. 药物制备:按照实验要求准备药物溶液,注意溶解度和浓度的调配。
2. 动物模型制备:根据实验需要选择适当的动物模型,并进行相应的处理和麻醉。
3. 药物给药:选择合适的给药途径和剂量,注意给药的时间和频率。
4. 采样和分析:根据实验设计,按时采集样本并进行相应的分析和测定。
5. 数据处理和统计:对实验结果进行数据处理和统计分析,得出科学合理的结论。
三、常见实验技术1. 动物行为观察:观察动物在给药后的行为变化,如活动性、食欲、睡眠等。
2. 组织切片制备:将动物组织标本进行切片处理,用于形态学和组织学观察。
3. 酶活性测定:通过测定酶的活性来评估药物对生物体内酶的影响。
4. 细胞培养技术:利用细胞培养技术研究药物对细胞的作用机制和毒性效应。
5. 分子生物学技术:应用PCR、Western blot等技术研究药物对基因表达和蛋白质水平的影响。
四、实验注意事项1. 实验记录:详细记录实验步骤、操作细节和实验结果,保证实验数据的准确性和可靠性。
2. 实验质量控制:严格按照实验要求进行实验操作,避免实验误差和干扰因素的影响。
3. 实验伦理:遵守实验伦理规范,保护实验动物的权益和福利。
4. 废弃物处理:正确处理实验废弃物,避免对环境和人体造成污染和危害。
5. 实验结果分析:对实验结果进行科学合理的分析和解释,得出结论并提出进一步研究的建议。
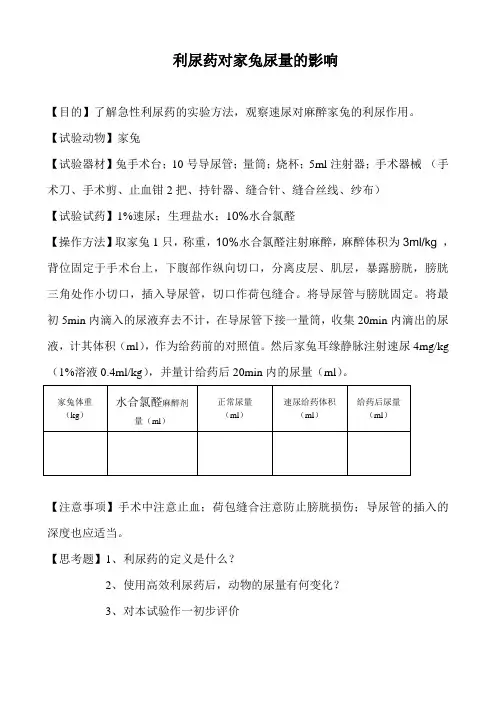
利尿药对家兔尿量的影响【目的】了解急性利尿药的实验方法,观察速尿对麻醉家兔的利尿作用。
【试验动物】家兔【试验器材】兔手术台;10号导尿管;量筒;烧杯;5ml注射器;手术器械(手术刀、手术剪、止血钳2把、持针器、缝合针、缝合丝线、纱布)【试验试药】1%速尿;生理盐水;10%水合氯醛【操作方法】取家兔1只,称重,10%水合氯醛注射麻醉,麻醉体积为3ml/kg,背位固定于手术台上,下腹部作纵向切口,分离皮层、肌层,暴露膀胱,膀胱三角处作小切口,插入导尿管,切口作荷包缝合。
将导尿管与膀胱固定。
将最初5min内滴入的尿液弃去不计,在导尿管下接一量筒,收集20min内滴出的尿液,计其体积(ml),作为给药前的对照值。
然后家兔耳缘静脉注射速尿4mg/kg (1%溶液0.4ml/kg),并量计给药后20min内的尿量(ml)。
【注意事项】手术中注意止血;荷包缝合注意防止膀胱损伤;导尿管的插入的深度也应适当。
【思考题】1、利尿药的定义是什么?2、使用高效利尿药后,动物的尿量有何变化?3、对本试验作一初步评价醋酸地塞米松对小鼠二甲苯致肿胀的影响1.试验目的:观察糖皮质激素对化学性致炎的影响。
2.试验原理:小鼠耳廓涂抹化学性致炎物质后,会使动物产生急性渗出性炎症,发生肿胀,事先给予口服糖皮质激素药物,可以缓解炎症的发生。
观察耳廓肿胀度,评价药物的抗炎肿胀率。
3.试验材料3.1试验动物昆明种小鼠,雄性,体重18~22g,符合健康一级动物标准。
3.2试验器材小鼠灌胃器(注射针筒,灌胃针),微量移液器,打孔器,木板3.3试剂试药二甲苯,醋酸地塞米松片,生理盐水4.试验方法各组选取健康昆明种小鼠10只,雄性,试验前禁食不禁水8小时。
试验时按表1所列药物与试剂灌胃给药一次。
表1 试验给药方案给药后,各组动物右侧耳廓涂抹二甲苯50ul/只,左侧不做处理,30min后托颈处死动物,迅速用打孔器打下动物双耳片,分别称重,计算肿胀度及肿胀抑制率。
药理学的实验报告药理学的实验报告引言:药理学是研究药物在生物体内作用的科学,通过实验研究药物的药理学特性可以更好地理解药物的作用机制,为新药的开发和临床应用提供依据。
本实验旨在探究某药物在实验动物体内的药理学特性,并对其药效、毒性以及副作用进行评估。
实验设计:本实验采用随机分组设计,将实验动物随机分为实验组和对照组,每组10只。
实验组动物接受药物处理,对照组动物接受安慰剂处理。
实验期间,记录动物的体重、行为和生理指标,并进行相关数据的收集和分析。
实验过程:1. 动物选择:选择健康、同龄、同种、同性别的实验动物。
2. 药物制备:按照一定比例将药物溶解于适当的溶剂中,制备成不同浓度的药液。
3. 实验组和对照组处理:将实验组动物按照体重随机分组,给予不同浓度的药物处理;对照组动物接受相同体积的安慰剂处理。
4. 观察记录:记录动物的体重变化、行为活动、食欲、水量摄入以及异常症状的出现。
5. 生理指标测定:在实验结束后,采集动物的血液样本,测定相关生理指标如血糖、血脂、肝功能等。
6. 数据分析:对实验数据进行统计学分析,计算药物的药效、毒性以及副作用。
实验结果:1. 药物的药效:根据实验数据分析,确定药物的药效参数,如ED50(半数有效剂量)和TD50(半数致死剂量)。
2. 药物的毒性:根据实验数据分析,评估药物的毒性指标,如LD50(半数致死剂量)和TDLo(最低致死剂量)。
3. 药物的副作用:根据实验数据分析,评估药物的副作用,如不良反应的发生率和严重程度。
讨论:1. 药物的药效:根据实验结果,药物的药效参数可以反映药物的效果和剂量-反应关系,为药物的合理使用提供依据。
2. 药物的毒性:根据实验结果,药物的毒性指标可以评估药物的安全性和剂量-毒性关系,为药物的剂量选择和副作用预防提供参考。
3. 药物的副作用:根据实验结果,药物的副作用评估可以指导临床用药的安全性和合理性,减少不良反应的发生。
结论:通过本实验,我们对某药物在实验动物体内的药理学特性进行了评估,确定了药物的药效、毒性以及副作用。
药学实验(药理学实验)实验五不同给药途径、给药剂量对药物作用的影响(一)不同给药途径对药物作用的影响?实验目的观察不同给药途径对药物(硫酸镁)作用的影响,了解核酸镁不同给药途径产生不同作用的原因;掌握硫酸镁的作用以及小鼠灌胃、腹腔注射方法?实验原理硫酸镁为一种容积性泻药(此外还有刺激性和润滑性泻药),口服在肠道难吸收,在肠内形成高渗压而阻止肠内水分的吸收,从而扩张肠道、刺激肠壁、促进肠道蠕动,产生泻下作用。
注射给药可使血中Mg2+增加,由于Ca2+和Mg2+化学结构相似,Ca2+和Mg2+间存在相互拮抗作用,Ca2+参与运动神经末梢Ach释放,而Mg2+拮抗Ca2+这种作用,结果使神经肌肉接头处Ach减少,骨骼肌紧张性降低,肌肉松弛。
同时对中枢神经及心血管系统产生抑制作用。
因此产生抗惊厥及降压效果。
本实验观察不同给药途径对硫酸镁作用性质的影响。
大多数药物需进入血液分布到作用部位才能发生作用。
药物自给药部位进入全身血液循环的过程为吸收(absorption),吸收速度的快慢及吸收数量的多少直接影响药物的起效时间及强度。
其中给药途径是决定药物起效时间及强度的重要因素之一。
给药途径不同,则药物吸收快慢亦不同,其吸收快慢顺序除静脉注射外是:腹腔注射>吸入>舌下>直肠>肌内注射>皮下注射>口服>皮肤。
给药途径不同,其吸收程度又不同,由此使药物作用强度不同。
药物经不同给药途径所致的吸收程度是:吸入、舌下、直肠、肌内注射较为完全,口服次之,皮下较差;皮肤表面吸收程度最差,一定要脂溶性特别高的药物才能通过此途径较好地吸收。
而胃肠道给药,影响因素较多,包括有首关消除的影响等,使药物吸收程度有所不同。
首关消除(first pass elimination):从胃肠道吸收入门静脉系统的药物在到达全身血循环前必先通过肝脏,如果肝脏对其代谢能力很强或由胆汁排泄的量大,则使进入全身血循环内的有效药物量明显减少,这种作用称为首关消除。
目录――基本知识与技能1、药理实验的基本操作技术⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 12、药理实验设计的基本原则⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 63、数理统计在药理学实验中的应用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 94、Casio fx-180p计算器的应用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 165、PowerLab系统基本操作指南⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯226、怎样写药理实验报告⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯267、处方⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯29 ――药代动力学部分8、药酶诱导剂及抑制剂对戊巴比妥钠催眠作用的影响⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 319、苯巴比妥钠对小鼠肝脏细胞色素P450含量的影响⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯3310、碱化尿液对水杨酸钠经肾排泄的影响⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 3511、酚磺酞(PSP)药代动力学参数的测定⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯37 ――药效动力学部分12、M胆碱受体系列实验之一−有机磷酸酯类中毒解救及胆碱酯酶活性的测定3913、M胆碱受体系列实验之二−氨甲酰胆碱对大鼠离体空肠的作用⋯⋯⋯⋯⋯4114、M胆碱受体系列实验之三−M胆碱受体亚型分析⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯ 4515、三种作用于传出神经系统的未知药的初步辨别⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯4716、抗癫痫药的抗电惊厥作用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯4917、氯丙嗪对小白鼠激怒反应的影响⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯5118、镇痛药物的辨别及药效测定⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯5319、夹竹桃对离体蟾蜍心脏的作用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯5520、普萘洛尔的抗心律失常作用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯5821、糖皮质激素的抗炎作用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯59 ――毒理学部分22、普鲁卡因半数致死量的测定⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯6123、烟碱的毒性作用⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯6424、局麻药的麻醉作用及毒性比较⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯6525、青霉素G钾和青霉素G钠快速静注的毒性比较⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯67 ――临床药理学部分26、临床药理学和新药临床研究⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯6827、临床用药讨论⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯69 ――附表1、实验动物用注射针头的大小及注射药容量⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯722、动物常用麻醉药用法和用量⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯723、常用生理溶液成分表⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯734、常用实验动物生理参数⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯731、药理实验的基本操作技术一、常见实验动物性别的鉴定二、常用实验动物捉拿法小白鼠与大白鼠:右手抓住尾部,将之置于铁丝笼或粗糙的平面上,另一手捏住颈部皮肤,即可将动物捉起。
实验十生三七粉对小白鼠凝血时间的影响(玻片法)
【目的】学习用玻片法测定小鼠凝血时间;观察生三七对小鼠凝血时间的影响。
【原理】三七属止血药,有明显止血功效,常用于治疗咯血、蝴血、崩漏、尿血等症。
【器材】注射器、载玻片、大头针、秒表、眼科弯银、棉花、鼠笼、天平。
【药品】生三七水浸液0∙15g∕mk生理盐水、苦味酸溶液。
【动物】小白鼠。
【方法】取小鼠6~8只,随机分为2组,给药组灌胃三七水浸液0.3ml∕10g,对照组灌胃生理盐水0.3ml∕10g030min后,用眼科弯银迅速摘去T则眼球,即有血液流出。
于载玻片的两端各滴一滴血,血滴直径约5mm,立即用秒表计时。
每隔30s用清洁大头针自血滴边缘向里轻轻拨动一次,并观察有无血丝挑起。
从采血开始至挑起血丝止,所历时间即凝血时间。
另一滴血供最后复验。
记录凝血时间。
【结果】按表记录数据。
【注意】
(1)凝血时间可受室温等因素影响,室温15。
C左右较好。
(2)每次挑血滴时,不应从各个方向多次挑动,以免影响纤维蛋白的形
成。
【思考题】
(1)三七有何功效?止血用的主要方剂有哪些?
(2)三七止血的主要成分是什么?。
[精选]药理学实验药理学实验一、实验目的1.学习药物对机体的作用机制。
2.掌握药物作用的实验研究方法。
3.了解药物作用的影响因素。
二、实验原理药理学是研究药物与机体相互作用的规律及其机制的科学,主要包括药物的作用机制、药物的代谢动力学、药物的疗效评价等内容。
药物作用的实验研究方法主要包括离体实验和整体实验两种。
离体实验是在体外条件下,观察药物对离体组织或器官的作用;整体实验是在整体动物或人体上,观察药物对机体的作用。
本实验主要采用整体实验方法,观察药物对小鼠的镇痛作用。
三、实验步骤1.实验准备:选取健康小鼠若干只,分为实验组和对照组,每组至少10只。
实验组小鼠腹腔注射某镇痛药物,对照组小鼠腹腔注射等体积的生理盐水。
2.疼痛刺激:采用热板法对小鼠进行疼痛刺激。
将小鼠放在55℃的热板上,记录小鼠舔后足的时间(潜伏期)。
每只小鼠测试3次,取平均值作为该小鼠的痛阈值。
3.数据记录:记录每组小鼠在给药前和给药后的痛阈值。
4.数据分析:将实验组和对照组小鼠给药前的痛阈值进行比较,以排除个体差异对实验结果的影响。
然后将实验组小鼠给药后的痛阈值与给药前进行比较,以观察药物对小鼠镇痛作用的影响。
最后,将实验组和对照组小鼠给药后的痛阈值进行比较,以观察药物对小鼠镇痛作用的差异。
5.实验结论:根据数据分析结果,得出药物对小鼠镇痛作用的结论。
四、实验结果1.实验数据记录:实验组小鼠给药前痛阈值(s):5.0 ± 1.0实验组小鼠给药后痛阈值(s):10.0 ± 2.0对照组小鼠给药前痛阈值(s):5.5 ± 1.5对照组小鼠给药后痛阈值(s):5.8 ± 1.82.数据分析:给药前,实验组和对照组小鼠的痛阈值无统计学差异(P > 0.05),说明两组小鼠在疼痛敏感性方面无差异。
给药后,实验组小鼠的痛阈值显著高于给药前(P < 0.01),说明药物对小鼠具有显著的镇痛作用。
药理学实验指导(供自学助考班用)实验一药理学实验基础知识与常用动物捉拿、给药【目的】1、学习药理学实验基础知识;2、掌握药理学实验常用动物捉拿、给药方法。
【器材】1ml、5ml、20ml注射器,大、小鼠灌胃针头,4号、6号注射针头,250ml烧杯、鼠笼(或铁丝笼),天平秤、砝码。
【药品】0.9%生理盐水。
【动物】小白鼠、大鼠、家兔。
【内容】一、实验动物的捉拿方法1、蛙和蟾蜍左手握持蛙或蟾蜍,食指和中指夹住左前肢,拇指压住右前肢;右手将双下肢拉直,左手无名指及小指将其压住而固定。
此法用于淋巴囊注射。
毁脑和毁脊髓则用左手食指和中指夹持蛙或蟾蜍的头部,拇指和无名指小指握持双下肢,右手持刺针进行操作。
2、小白鼠可采取双手法和单手法两种形式。
双手法:右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏住小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
单手法:小白鼠置于笼盖上,先用左手食指与拇指抓住鼠尾,手掌尺侧及小指夹住尾根部,然后用左手拇指与食指捏住颈部皮肤。
3、大白鼠大白鼠容易激怒咬人,捉持时左手应戴防护手套或用厚布盖住大鼠,先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与手掌握住背部和腹部。
不要用力过大,切勿捏其颈部,以免窒息致死。
4、家兔用左手抓住颈背部皮肤(抓的面积越大,其吃重点越分散)。
将兔提起,以左手托住其臀部,使兔呈坐位。
二、实验动物的给药途径与方法1、小白鼠给药途径与方法灌胃(ig):左手固定小鼠,右手持灌胃器,灌胃针头自口角进入口腔,紧贴上腭插入食道。
如遇阻力,将灌胃针头抽回重插,以防损伤。
常用灌胃量为0.1~0.2ml/10g。
皮下注射(ih):可用腹部、背部、腹股沟的皮下,此处皮肤比较松弛,也可由助手协助。
注药量一般为0.1~0.2ml/10g。
肌肉注射(im):一人抓住小鼠头部皮肤和尾巴,另一人持连4号针头的注射器,将针头刺入后腿外侧肌肉。
注射量一般不超过0.1~0.2ml/只。
静脉注射(iv):将小鼠置入固定器,酒精涂擦尾部使血管扩张。
自尾部末端刺入,刺入血管后抽针芯可见回血。
常用注射量为0.1~0.2ml/10g。
腹腔注射(ip):将小鼠固定后,从下腹部外侧进针,深度较皮下注射深(图3-8)。
常用注射量为0.1~0.2ml/10g。
2、大鼠给药途径与方法灌胃、腹腔注射、皮下注射及尾静脉注射与小鼠相似。
静脉注射也可在麻醉下行舌下静脉注射。
3、家兔给药途径与方法灌胃:一人将兔身固定于腋下,一手固定兔头,另一手将开口器放入兔口。
另一人将胃管从开口器孔插入口内,再慢慢插入食道和胃(图39)。
为慎重起见,可将胃管外端放入水中,如无气泡,则可证实胃管在胃内。
灌胃量一般为10ml/kg。
如用兔固定盒,可由一人操作。
静脉注射:一人固定兔身和兔头,另一人在使兔耳边缘血管(耳缘静脉)扩张后,将针头从静脉末端刺入血管,左手拇指和食指固定针头和兔耳,右手注药(图310)。
注药量一般为2ml/kg,等渗液可达10ml/kg。
皮下、肌肉、腹腔注射与鼠类相似。
常用注药量分别为0.5、1.0、5.0ml/kg。
三、实验动物的处死方法颈椎脱位法:小白鼠和大白鼠:术者左手持镊子或用拇指、食指固定鼠头后部,右手捏住鼠尾,用力向后上方牵拉,听到鼠颈部喀嚓声即颈椎脱位,脊髓断裂,鼠瞬间死亡。
豚鼠:术者左手倒持豚鼠,用右手掌尺侧或木棒猛击颈部,使颈椎脱位迅速死亡。
断头、毁脑法:常用于蛙类。
可用剪刀剪去头部或用金属探针经枕骨大孔破坏大脑和脊髓而致死。
大鼠和小鼠也可用断头法处死,术者需戴手套,两手分别抓住鼠头与鼠身,拉紧并显露颈部,由助手持剪刀,从颈部剪断头部。
空气栓塞法:术者用50~100ml注射器,向静脉血管内迅速注入空气,气体栓塞心腔和大血管而使动物死亡。
使猫与家兔致死的空气量为10~20ml,犬为70~150ml。
大量放血法:鼠可用摘除眼球,从眼眶动静脉大量放血而致死。
如不立即死亡,可摘除另一眼球。
猫可在麻醉状态下切开颈三角区,分离出动脉,钳夹上下两端,插入动脉插管,再松开下方钳子,轻压胸部可放大量血液,动物可立即死亡。
对于麻醉犬,可横向切开股三角区,切断股动静脉,血液喷出;同时用自来水冲洗出血部位(防止血液凝固),3~5min动物死亡。
采集病理切片标本宜用此法。
实验二不同给药途径、剂量、剂型对药物作用的影响【目的】观察不同给药途径、剂量、剂型对药物作用的影响。
【器材】1ml注射器,灌胃针头,4号针头、6号针头,250ml烧杯(或铁丝笼),天平秤。
【药品】10%硫酸镁(magnesium sulfate) 、0.2%、0.4%和0.8%戊巴比妥钠(sodium pentobarbital)溶液、8%乌拉坦(urethane)水溶液,8%乌拉坦胶浆液(含2.5%羧甲基纤维素) 【动物】小白鼠。
【方法】1、硫酸镁不同给药途径对药物作用的影响。
取体重接近、性别相同的小白鼠2只,称重并标记。
观察动物正常活动情况。
1号鼠腹腔注射10%硫酸镁溶液0.15ml/10g,2号鼠灌胃10%硫酸镁溶液0.15ml/10g。
观察并比较两鼠在呼吸、肌张力、大便有何不同。
【结果】将实验结果填入下表:表61硫酸镁不同给药途径对药物作用的影响鼠号给药途径给药体积(ml/只) 呼吸肌张力大便1号2号2、不同剂量对药物作用的影响取体重接近、性别相同的小白鼠3只,称重并标记。
观察正常活动。
.3号、4号和5号小鼠分别腹腔注射0.2%、0.4%和.8%戊巴比妥钠溶液0.1ml/10g,观察翻正反射消失、恢复的时间,并比较三鼠有何不同现象发生。
【结果】将所观察的实验结果填入下表:表63不同剂量戊巴比妥钠对药物作用的影响鼠号药物给药途径剂量(mg/10g) 现象3号4号5号3、不同剂型对药物作用的影响取体重接近、性别相同的小白鼠2只,称重并标记。
观察正常活动。
6号鼠皮下注射8%乌拉坦水溶液0.15ml/10g,7号鼠皮下注射8%乌拉坦胶浆液0.15ml/10g,观察小鼠对所注射药物的反应。
记录小鼠出现步态蹒跚、卧倒及翻正反射消失等反应的时间。
比较小鼠注射不同乌拉坦制剂后,造成中枢抑制的深度及作用出现的快慢与持续时间的长短。
【结果】将所观察的实验结果填入下表:表6-4乌拉坦不同剂型对小鼠中枢抑制作用的影响鼠号药物给药途径剂量(mg/kg) 剂型现象6号7号实验三药物的镇痛作用【目的】学习化学刺激动物疼痛模型的制备方法,观察阿司匹林、吗啡(或哌替啶)的镇痛作用。
【原理】小鼠腹腔注射刺激剂(如酒石酸锑钾、醋酸)可诱导疼痛,动物表现出特征性的躯体伸缩行为称之为扭体反应,表现为腹部内凹、躯干与后腿伸张、臀部抬高等。
将给药组与对照组相比,若能使扭体反应发生率减少50%以上,可认为该药有镇痛作用。
【器材】鼠笼,小动物电子秤(或天平),注射器。
【药品】0.1%盐酸吗啡(morphine hydrochloride),1%阿司匹林(aspirin),0.8%醋酸,生理盐水。
【动物】小鼠,体重20~25g。
【方法】取小鼠6只,称重,随机分为3组,分别为吗啡组、阿司匹林组和生理盐水组。
观察每组动物的正常活动情况,1组小鼠皮下注射0.1%吗啡0.1ml/10g,2组皮下注射1%阿司匹林0.1ml/10g,3组皮下注射等容量的生理盐水。
20min后,3组小鼠分别腹腔注射0.8%醋酸0.1ml/10g,观察15min内各组出现扭体反应动物数及其平均扭体次数。
【结果】汇总各组实验结果,记于表3-1,并依照下列公式计算药物抑制百分率。
表3-1药物对醋酸所致小鼠扭体反应的影响分组动物数(n) 平均扭体次数(次) 抑制百分率(%)吗啡组阿司匹林组生理盐水组抑制百分率(%) =(对照组平均扭体次数-给药组平均扭体次数)/ 对照组平均扭体次数×100%【注意事项】(1)醋酸应临时配制,以免挥发后浓度不准。
实验四传出神经系统药物对动物血压的作用【目的】1、学习麻醉动物血压的记录方法;2、观察传出神经系统药物对家兔血压的作用。
【器材】生物信号处理采集系统,压力换能器,直、弯手术剪,眼科剪,眼科镊,大、小止血钳(直、弯),动脉夹,1 ml、2 ml、5 ml注射器,6号针头。
【药品】20%乌拉坦(uretharum),1000U/ml肝素(heparin),0.001%肾上腺素(adrenaline),0.001%去甲肾上腺素,0.1%麻黄素,0.005%异丙肾上腺素(isoprenaline)【动物】家兔。
【方法】1、将家兔用20%乌拉坦5ml/kg腹腔麻醉,仰卧固定于手术台上;2、剪去颈腹部毛。
于颈部正中切开皮肤,钝性分离颈部和气管腹面肌肉;3、分离出气管和一侧颈总动脉,备线;静脉注射1000U/ml肝素1ml/kg;4、用线结扎一侧颈总动脉远心端,用动脉夹夹住近心端,在颈总动脉上作一V型切口,插入动脉导管,用线结扎固定;5、将压力换能器与生物信号处理采集系统连接,松开动脉夹,描记正常血压。
6、按照如下顺序从耳缘静脉给药,观察下列药物对血压的影响。
(1) 0.001%去甲肾上腺素0.2 ml。
BP恢复后;(2) 0.001%肾上腺素0.2 ml。
BP恢复后;(3) 0.005%异丙肾上腺素0.2 ml。
BP恢复后;(4) ;0.1%麻黄素0.2 ml;【注意事项】动脉导管用肝素生理盐水溶液充盈。
实验五常用药物制剂与处方学一、处方的意义处方是由注册的执业医师和执业助理医师(以下简称“医师”)在诊疗活动中为患者开具的由药学专业技术人员审核、调配、核对,并作为发药凭证的医疗用药的医疗文书,处方药必须凭医师处方销售、调剂和使用。
医师应当根据医疗、预防、保健需要,按照诊疗规范,药品说明书中的药品适应症、药理作用、用法、用量、禁忌、不良反应和注意事项等开具处方。
处方选药和用法是否正确,直接关系到病人身心健康和生命安全,所以医务人员必须以对病人高度负责的精神和严肃认真的态度对待处方。
凡由于开处方或配制、发药的差错而造成的医疗事故,处方便是重要的证据之一,借以帮助确定医师或药师应负的法律责任。
为了正确的书写处方,医师不仅应具有丰富的临床医疗知识,而且要熟悉药物的药理作用、不良反应、剂量、用法、配伍以及制剂学的知识。
二、处方规格及结构(一)处方规格处方由各医疗机构按规定的格式统一印制。
一般麻醉药品处方、急诊处方、儿科处方、普通处方的印刷用纸应分别为淡红色、淡黄色、淡绿色、白色;精神药品处方用白纸绿字印制;医用毒性药品处方用白纸红字印制;并在处方右上角以文字注明。
(二)处方内容1、前记:包括医疗、预防、保健机构名称、处方编号、患者姓名、性别、年龄、门诊或住院病历号,科别或病室和床位号、开具日期等,并可添列专科要求的项目。