最新 化学方程式练习题(含答案)
- 格式:doc
- 大小:186.00 KB
- 文档页数:9

(化学)化学化学方程式的计算练习题20篇及解析一、中考化学方程式的计算1.将一定质量的金属锌投入到100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)完全反应后生产氢气的质量为___________g。
(2)所用硫酸溶液的溶质质量分数_________。
(计算结果精确到0.1%)。
【答案】0.4 19.6%【解析】【分析】【详解】(1)由图可知,完全反应后生成氢气的质量为0.4g;(2)设所用硫酸溶液的溶质质量分数为x2442Zn+H SO=ZnSO+H982100gx0.4g98100gx =20.4gx=19.6%答|所用硫酸溶液的溶质质量分数为19.6%。
2.某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金 10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示:求:合金中铜的质量分数______。
【答案】67.5%【解析】【分析】铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,根据图示数据可以得出生成氢气的质量,根据氢气的质量可以计算出锌的质量,进一步计算出铜锌合金中铜的质量分数。
【详解】由图示数据可知,当加入20g 稀硫酸时,合金中的锌恰好反应完全,产生0.1g 氢气。
设参加反应的锌的质量为ag 。
2442n +H SO nSO H 652ag0.1g Z Z =+↑ 65a =20.1,解得a=3.25g 则合金中铜的质量为10g-3.25g=6.75g ,合金中铜的质量分数=6.75g 10g×100%=67.5%, 答:合金中铜的质量分数为67.5%。
3.一同学取来某品牌的钾肥(主要成分硫酸钾,还含少量的氯化钾)共200克,投入到908克的氯化钡溶液中恰好完全反应。
经过滤后得到硫酸钡沉淀233克和氯化钾的不饱和溶液。
请帮他计算:(注明:K 2SO 4+ BaCl 2= BaSO 4↓+2KCl )(1)氯化钾的相对分子质量是_______。

初三化学方程式练习题及答案化学方程式是描述化学反应过程的重要工具,它由反应物、产物和反应条件组成。
熟练掌握化学方程式的书写对于初三化学学科的学习至关重要。
下面是一些针对初三学生的化学方程式练习题及答案,帮助大家巩固知识点。
1. 氢气与氧气发生反应生成水的化学方程式是什么?答案:2H₂ + O₂ → 2H₂O解析:根据氢气和氧气的元素符号H₂和O₂,以及反应生成的水的元素符号H₂O,我们可以得到方程式2H₂ + O₂ → 2H₂O。
2. 碳酸钙分解产生二氧化碳和氧化钙的化学方程式是什么?答案:CaCO₃ → CO₂ + CaO解析:根据碳酸钙的元素符号CaCO₃,二氧化碳的元素符号CO₂,以及氧化钙的元素符号CaO,我们可以得到方程式CaCO₃ → CO₂ + CaO。
3. 氮气与氢气反应生成氨的化学方程式是什么?答案:N₂ + 3H₂ → 2NH₃解析:根据氮气的元素符号N₂,氢气的元素符号H₂,以及氨的元素符号NH₃,我们可以得到方程式N₂ + 3H₂ → 2NH₃。
4. 硫酸与钠氢碳酸反应生成二氧化碳、水和硫酸钠的化学方程式是什么?答案:H₂SO₄ + NaHCO₃ → CO₂ + H₂O + Na₂SO₄解析:根据硫酸的元素符号H₂SO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和硫酸钠的元素符号CO₂、H₂O 和Na₂SO₄,我们可以得到方程式H₂SO₄ + NaHCO₃ → CO₂ +H₂O + Na₂SO₄。
5. 磷酸与钠氢碳酸反应生成二氧化碳、水和磷酸钠的化学方程式是什么?答案:H₃PO₄ + NaHCO₃ → CO₂ + H₂O + Na₃PO₄解析:根据磷酸的元素符号H₃PO₄,钠氢碳酸的元素符号NaHCO₃,以及产物二氧化碳、水和磷酸钠的元素符号CO₂、H₂O 和Na₃PO₄,我们可以得到方程式H₃PO₄ + NaHCO₃ → CO₂ +H₂O + Na₃PO₄。

化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5(2) C + O2点燃CO(3) Al + O2点燃Al2O3(4)Fe + O2 点燃Fe3O4(5) Mg + O2点燃MgO(6) H2O2MnO2 H2O + O2↑(7) H2O H2↑+ O2↑(8) H2+ O2点燃H2OCuSO4 +NaOH —Na2SO4+ Cu(OH)2Mg + HCl —MgCl2+ H2↑KMnO4—K2MnO4+ MnO2+ O2↑Al + CuSO4 —Al2(SO4)3+ CuZn + HCl —ZnCl2 + H2↑CH4+ O2点燃CO2+ H2OC + CO2高温CONH3+ O2催化剂NO + H2OCO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2+ 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:A. CO B .CH4 C .CH3OH D.C2H41某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2+ 3 H2O,根据质量守恒定律可判断出X的化学式为:A . C2H4B. C2H4O C . C2H6D .C2H6O2在4Cu + 10HNO3 = 4Cu(NO3)2 +X + 5H2O反应方程式中,X的化学式为:A .NO B. NO2C. N2O D. N2O33物质X和B2能发生下列反应:2X + B2= 2 AB3,则X的化学式是:A .AB2 B. A2B2C. AB3D.A2B34某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:A .R一定含有碳,氢,氧三种元素B. R一定含有碳和氢元素,不含有氧元素C .R一定含有碳和氢元素,可能含有氧元素D .R不一定含有碳和氢元素,但一定不含有氧元素5某物质W在氧气中充分燃烧后,生成了和3.6克的水,消耗的氧气为4.4克CO26.4克,则W中所含有的元素判断正确的是:A .一定含有C H元素,不含O元素B.一定含有C H 元素,可能有O元素C . 一定含有C H O三种元素D. 条件不足,不能判断6氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:A .1 :1 B.2 :1 C. 2 :32 D .4 :327对于质量守恒定律的解释不正确的是:A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。

【化学】化学《化学方程式》练习题及答案一、选择题1.煤的气化是提高煤的利用率、减少环境污染的有效措施。
煤的气化过程中发生了化学反应C+H 2O (气)H 2+CO ,反应前后,发生了变化的是A .元素的种类B .分子的种类C .原子的数目D .物质的总质量【答案】B 【解析】试题分析:在化学反应中元素的种类、原子的数目和物质的总质量都不发生改变,分子的种类发生了变化. 考点:化学变化的实质;点评:参加反应的各种物质的质量总和等于反应后各种物质的质量总和,理解质量守恒定律的特征和本质是解题的关键.2.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。
故选B 。
3.食盐不仅可以做调味品,还是一种重要的化工原料。
电解饱和食盐水,不可能得到的产物是( ) A .H 2B .Cl 2C.NaOH D.Na2CO3【答案】D【解析】【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变进行分析。
【详解】饱和食盐水中不含有碳元素,所以电解饱和食盐水不可能得到碳酸钠,故选D。

《如何正确书写化学⽅程式》练习题(含答案及解析)《如何正确书写化学⽅程式》练习题⼀、单选题(本⼤题共16⼩题,共32.0分)1. 下列关于书写化学⽅程式的原则和步骤,叙述正确的是 ( )A. 必须遵守质量守恒定律B. 凡是⽓体物质应标上“↑”C. 凡是注明“点燃”条件都可以⽤“△”符号代替D. 因配平需要可改动化学式中右下⾓的数字2. 在反应□SO 2+□H 2S =□H 2O +□S 中,⽅框中各物质的化学计量数应该对应的是( )A. 1,3,3,2B. 1,2,2,3C. 1,2,3,2D. 1,3,2,3 3. 下列描述与化学⽅程式表⽰⼀致的是( )A. 碳在空⽓中充分燃烧B. 铁丝在纯氧⽓中燃烧C. 红磷在空⽓中充分燃烧D. 镁带燃烧4. 下列化学⽅程式书写正确的是( )A. KClO 3=MnO 2KCl +O 3↑B. H 2O 2=MnO 2H 2↑+O 2↑ C. 3Fe +2O 2=点燃Fe 3O 4D. Mg +O 2=点燃MgO 25. 有⼀学⽣写出了下列化学⽅程式:①Mg +O 2↑=点燃MgO 2;②KClO 3=KCl +O 2↑;;③C +O 2↑=CO 2↑;④CuSO 4+Fe =FeSO 4+Cu 。
下列说法正确的是( )A. 化学式有错误的是①②③B. “↑”或“↓”符号使⽤不当的是①③C. 未配平的是①②D. 需要注明条件⽽未注明的是②④ 6. 下列化学⽅程式书写正确的是( )A. 2P +5O 2P 2O 5B. 4Fe +3O 22Fe 2O 3C. 2Mg +O 2=2MgOD. 2KMnO 4Δ?K 2MnO 4+MnO 2+O 2↑7. 已知甲和⼄在⼀定条件下反应⽣成丙和丁,结合微观⽰意图分析,下列结论正确的是( )A. 甲的相对分⼦质量为34 gB. ⼄物质为氧化物C. 参加反应的甲和⼄的质量⽐为17:24D. 反应前后分⼦种类和数⽬均不发⽣改变8. .将汽车尾⽓中的有毒⽓体转化为空⽓中的成分,其微观结构⽰意图如图,说法不严谨的是A. 反应前有两种物质分⼦B. 化学变化的本质是:分⼦分成原⼦,原⼦重新组合成新物质的分⼦C. 在化学变化中,分⼦分成原⼦,原⼦重新组合成新物质D. 其微观结构⽰意图的化学反应⽅程式为2NO +2CO =催化剂N 2+2CO 29. 将宏观、微观及化学符号联系在⼀起是化学学科的特点。

【化学】化学《化学方程式》练习题及答案一、选择题1.下图是甲转化为丙的微观过程。
下列说法不正确...的是A.反应前后原子种类不变B.转化①中甲和O2反应的分子个数比为1:1C.转化②是化合反应D.丙中氢、硫、氧元素的质量比为1:16:32【答案】B【解析】【分析】根据微观示意图可知甲物质是H2S,乙物质是SO2,丙物质是H2SO4。
【详解】A、根据质量守恒定律可知,化学反应前后原子的种类、数目和质量不变,不符合题意;B、转化①发生的化学方程式是2H2S+3O22SO2+2H2O,甲和O2反应的分子个数比为2:3,符合题意;C、转化②是二氧化硫和过氧化氢反应生成硫酸,是多种物质反应生成一种物质,属于化合反应,不符合题意;D、丙中氢、硫、氧元素的质量比⨯⨯⨯=::::,不符合题意。
故选B。
12321164116322.某金属单质 X与非金属单质Y可发生反应:2X+Y=X2Y。
某实验探究小组进行了两次实验,测得数据如下表:实验序号X的用量/g Y的用量/g生成X2Y的质量/g17.4 1.68.029.6 3.212.0参加反应的X与Y的质量比为 ( )A.4:1 B.3:1 C.2:1 D.37:8【答案】A【解析】【分析】【详解】由两次实验数据表,Y的用量增加1倍,而生成X2Y的质量却没有增加1倍,说明第2次反应时,Y有剩余,9.6gX完全反应,生成12.0gX2Y,则同时参加反应的Y的质量为12.0g﹣9.6g=2.4g;故参加反应的X与Y的质量比为9.6g:2.4g=4:1.故选A.3.某仓库工作人员违章操作,在雨天转运“保险粉”引起爆炸。
“保险粉”化学名为连二亚硫酸钠(Na2S2O4),主要用于印染工业。
该化学品在潮湿空气中极不稳定,易分解并引起燃烧,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+X。
下列有关说法错误的是A.X 的化学式为 SO2B.连二亚硫酸钠与水能剧烈反应,化学性质很活泼C.Na2SO3 是一种盐,其中硫元素的化合价为+3 价D.Na2S2O4 通常要在干燥阴凉处密闭贮存【答案】C【解析】【详解】A、由反应的化学方程式为2Na2S2O4=Na2S2O3+Na2SO3+X,Na原子个数前后相等,由S、O 原子个数守恒,则X的化学式为SO2,说法正确,不符合题意;B、连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,说法正确,不符合题意;C、Na2SO3中Na元素为+1价,O元素为-2价,则由化合物中正负化合价的代数和为0可知,S元素的化合价为+4价,说法错误,符合题意;D、由该化学品在潮湿空气中极不稳定,易分解并引起燃烧可知,该物质应在干燥阴凉处密闭贮存,说法正确,不符合题意。


化学方程式配平1、化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 P2O5 (2) C + O2CO(3) Al + O2Al2O3 (4)Fe + O2Fe3O4(5) Mg + O2MgO (6) H2O2MnO2 H2O + O2↑(7) H2O H2↑+ O2↑(8) H2+ O2H2O1观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:()A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:()A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:()A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:()A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:()A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6物质W在氧气中燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素是:()A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:()A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:()A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。

化学方程式配平一化学方程式的基础知识:1化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5 (2) C + O2点燃CO(3) Al + O2点燃Al2O3 (4)Fe + O2点燃Fe3O4(5) Mg + O2点燃MgO (6) H2O2MnO2 H2O + O2↑(7) H2O 通电H2↑+ O2↑(8) H2+ O2点燃H2O2观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6某物质W在氧气中充分燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素判断正确的是:A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
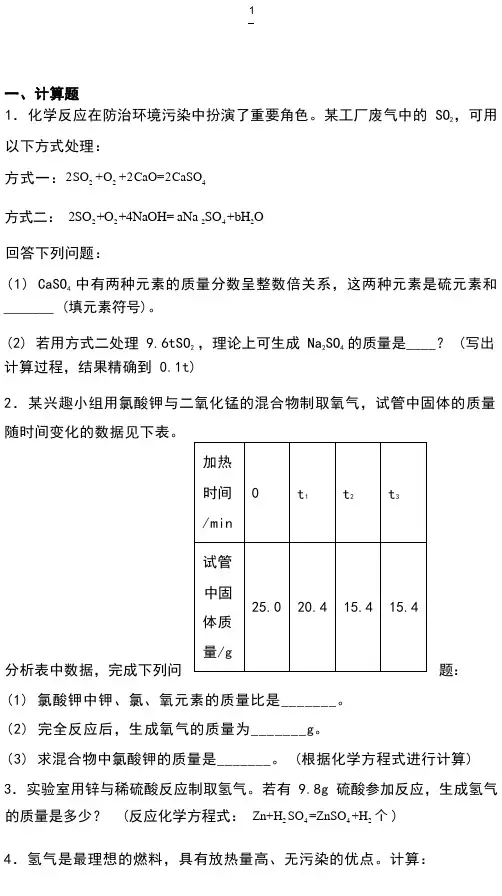
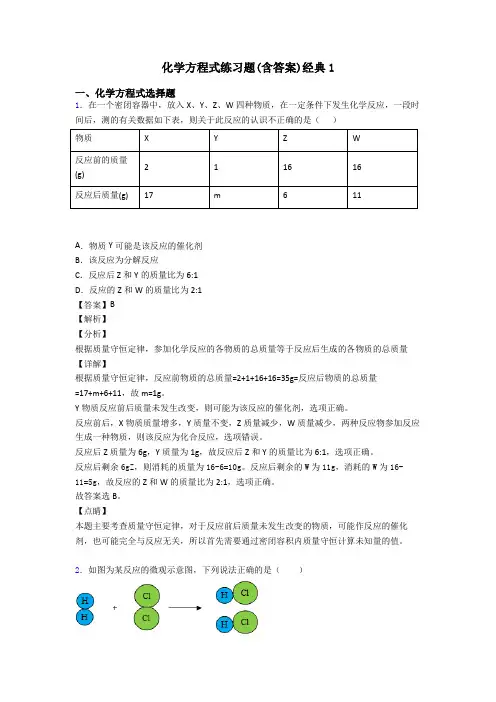
1.化学反应在防治环境污染中扮演了重要角色。
某工厂废气中的 SO2,可用以下方式处理:方式一:2SO2 +O2+2CaO=2CaSO4方式二:2SO2 +O2 +4NaOH= aNa 2SO4 +bH2O回答下列问题:(1) CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和_______ (填元素符号)。
(2) 若用方式二处理 9.6tSO2 ,理论上可生成 Na2SO4的质量是____? (写出计算过程,结果精确到 0.1t)2.某兴趣小组用氯酸钾与二氧化锰的混合物制取氧气,试管中固体的质量随时间变化的数据见下表。
(1) 氯酸钾中钾、氯、氧元素的质量比是_______。
(2) 完全反应后,生成氧气的质量为_______g。
(3) 求混合物中氯酸钾的质量是_______。
(根据化学方程式进行计算) 3.实验室用锌与稀硫酸反应制取氢气。
若有 9.8g 硫酸参加反应,生成氢气的质量是多少? (反应化学方程式:Zn+H2 SO4=ZnSO4+H2个)4.氢气是最理想的燃料,具有放热量高、无污染的优点。
计算:分析表中数据,完成下列问题:(1) 10kg 氢气完全燃烧可生成水的质量是多少?(2) 消耗氧气的质量至少是多少?5.碳酸氢钠固体受热易分解生成一种盐和两种氧化物,反应的化学方程式为______;将 10g 碳酸钠和碳酸氢钠的混合物充分加热至固体的质量不再改变,冷却,称量剩余固体的质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为______。
6.实验室常用氯酸钾和二氧化锰的混合物制取氧气。
现有氯酸钾和二氧化锰的混合物 50g,完全反应后称量剩余物质的质量为 40.4g。
请计算:(1) 制得氧气的质量为__________。
(2) 混合物中氯酸钾的质量分数。
7.加热氯酸钾和二氧化锰固体混合物来制取氧气时,反应时间和剩余固体质量的关系如图所示。
计算:的质量是___________g。
【化学】化学《化学方程式》练习题及答案一、选择题1.CH 4和某种氮的氧化物反应的化学方程式为CH 4+2口催化剂N 2+CO 2+2H 2O ,则框内物质的化学式是 A .NO B .NO 2C .N 2OD .N 2O 5【答案】B 【解析】试题分析:化学变化前后各种原子的个数不变,反应后有2N 、C 、4H 、4O ,而反应前有4H 、一个C 原子,反应前后差2N 、4O ,所以框内物质的化学式为NO 2,故选B 考点:质量守恒定律的应用2.将一定质量的氧化铜和氧化铁混合粉末与足量的CO 充分反应后,测得质量减少了4.0g 。
另取等质量的该粉末用适量的稀硫酸完全溶解后,再加入足量的氢氧化钠溶液,得到了20.5g 的沉淀。
则粉末中的氧化铜的质量分数为 A .20% B .40%C .50%D .80%【答案】C 【解析】 【分析】分别假设氧化铜和氧化铁的质量,进而结合化学方程式、关系式及对应的数据求解,进而求出粉末中氧化铜的质量分数。
【详解】设粉末中氧化铜的质量为x ,氧化铁的质量为y ,21CO +CuO Cu +CO 806416x m 高温固体质量减少116x xm ==80523223CO +Fe O 2Fe +3CO 16011248ym 高温固体质量减少248y 3ym ==16010氧化铜与稀硫酸反应生成硫酸铜和水,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和氢氧化钠反应生成氢氧化铁沉淀和硫酸钠,根据元素守恒列关系式:423CuO ~CuSO ~Cu(OH)8098xm398x 49xm ==80402324334Fe O ~Fe (SO )~2Fe(OH)160214ym4214y 107ym ==16080结合题干,列出方程:x 3y+=4.051049x 107y+=20.54080解得x=8g ,y=8g则粉末中氧化铜的质量分数为:8g100%50%8g+8g⨯= ,故选C 。
化学方程式练习题(含答案)经典一、化学方程式选择题1.科学家采用“组分转化”技术,将 CO2和H2按一定比例混合,在一定条件下反应的化学方程式为2CO2 + 6H2= X + 4H2O中,X的化学式是A.CH4 B.C2H4 C.H2CO3 D.H2C2O4【答案】B【解析】化学反应前后各种原子个数相等,反应前有2C、4O、12H,反应后(X除外)有4O、8H,所以x中有有2C、4H,X的化学式为C2H4,故选B。
点睛:要顺利解答此题,必须熟练掌握质量守恒定律并会灵活应用,化学反应前后各种原子个数相等,根据反应前后原子个数的差量即可推断出X的化学式。
2.某反应前后分子变化的微观示意图如下(图中“●”和“○”分别代表不同元素的原子),下列说法不正确的是()A.该反应前后涉及到三种物质B.反应后分子种类没有改变C.反应后分子数增多D.该反应属于分解反应【答案】B【解析】【详解】由化学反应的微观示意图可知,各物质反应的微粒个数关系是:A、由图示可知,该反应前后涉及到三种物质,故A正确;B、由微粒的变化可知,反应后分子种类发生了改变,故B不正确;C、由微粒的变化可知,该反应后分子数增多,故C正确;D、该反应由一种物质生成了两种物质,属于分解反应,故D正确。
故选B。
【点睛】化学变化中分子的种类一定改变,数目可变可不变。
3.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。
注意:1.化学式的书写正确2.化学方程式书写时条件状态的书写3.配平的各个要点注意一化学方程式的基础知识:1化学方程式配平常用方法:最小公倍数法、奇数配偶法(先配奇数大):(1) P + O2 点燃P2O5 (2) C + O2点燃CO(3) Al + O2点燃Al2O3 (4)Fe + O2点燃Fe3O4(5) Mg + O2点燃MgO (6) H2O2M nO2 H2O + O2↑(7) H2O 通电H2↑+ O2↑(8) H2+ O2点燃H2O2观察法:先金属后原子团(1)CuSO4 +NaOH —Na2SO4 + Cu(OH)2(2)Mg + HCl —MgCl2+ H2↑(3)Fe2O3 + H2SO4Fe2(SO4)3+ H2O(4)Al + H2SO4 —Al2(SO4)3+ H2↑(5)Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O(6)Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)33配平下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:A COB CH4C CH3OHD C2H42某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:A C2H4B C2H4OC C2H6D C2H6O3在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:A NOB NO2C N2OD N2O34物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:A AB2B A2B2C AB3D A2B35某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素6某物质W在氧气中充分燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素判断正确的是:A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断7氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:A 1 :1B 2 :1C 2 :32D 4 :328对于质量守恒定律的解释不正确的是:A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
《化学方程式》练习题(含答案)一、单选题1. 实验室加热一定质量的高锰酸钾制氧气,各物理量随加热时间变化的图像正确的是( )A. B.C. D.2. 下列关于2C+O22CO的说法中,正确的是( )A. 表示碳加氧气等于一氧化碳B. 该反应中,分子、原子的种类均发生了改变C. 参加反应的碳与氧气的质量比为3:8D. 参加反应的氧气与生成的一氧化碳的分子个数比为1:23. 化学反应前后肯定没有发生变化的是( ) ①原子数目; ②分子数目; ③元素种类; ④物质种类; ⑤原子种类; ⑥物质的总质量A. ① ④ ⑥B. ① ③ ⑤ ⑥C. ① ② ⑥D. ② ③ ⑤4. 乙烷(C2H6)是重要的化工原料,与氯气反应前后分子种类变化的微观示意图如图。
下列说法正确的是( )A. 甲中碳、氢元素质量比为1:3B. 乙的相对分子质量为71C. 甲和丙的元素组成相同D. 生成丙与丁的分子个数比为1:15. 下列化学方程式书写正确的是( )A. Mg+O=点燃MgO2B. 4Fe+3O=点燃2Fe2O32C. 2KMnO4=K2MnO4+MnO2+O2↑D. CO2+Ca(OH)2=CaCO3↓+H2O6. 某化学反应的微观示意图如图所示,下列有关说法正确的是( )A. 该反应的两种反应物均为化合物B. 该反应前后没有发生变化的粒子只有氧原子和氢原子C. 该反应的化学方程式为4NH3+5O24NO+6H2OD. 该反应读成:氨气加氧气在一定条件下生成一氧化氮加水7. 一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。
下列判断错误的是( )A. 参加反应的该化合物的质量为3.0gB. 该化合物中一定含有碳、氢、氧三种元素C. 该化合物中碳、氢、氧的原子个数比为2:4:1D. 该化合物中碳元素的质量分数为40%8. 从2H2+O22H2O中获取的信息错误的是( )A. 在反应前后,元素的种类没有变化B. 在常温下氢气与氧气混合就可以发生反应C. 4g氢气与32g氧气完全反应,可以生成36g水D. 在反应前后,氢原子和氧原子的数目都没有改变9. 漂白粉可用于自来水的杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。
化学方程式练习题(含答案)一、化学方程式选择题1.下图是甲转化为丙的微观过程。
下列说法不正确的是・・・O 氨原子尊氧原子 「 ■硫原子甲乙丙A .反应前后原子种类不变B .转化①中甲和O 反应的分子个数比为1:21C .转化②是化合反应D .丙中氢、硫、氧元素的质量比为1:16:32 【答案】B 【解析】 【分析】根据微观示意图可知甲物质是H 2S ,乙物质是SO 2,丙物质是H 2SO 4。
【详解】A 、根据质量守恒定律可知,化学反应前后原子的种类、数目和质量不变,不符合题 意;B 、转化①发生的化学方程式是2H 2S+3O 2鲁=2SO 2+2H 2O ,甲和O 2反应的分子个数 比为2: 3,符合题意;C 、转化②是二氧化硫和过氧化氢反应生成硫酸,是多种物质反应 生成一种物质,属于化合反应,不符合题意;D 、丙中氢、硫、氧元素的质量比 1x 2:32x1:16 x 4 = 1:16:32,不符合题意。
故选B 。
2 .某化学反应的微观示意图如图下所示,由该图示不能得出的的结论是()•氢原子00十七卢 0*十OO o 氧原子甲 乙丙 丁。
氟原子A .该反应属于置换反应B .氟气比氧气更活泼C .反应前后分子数目没有改变D .丙不是氧化物【答案】C【解析】 根据反应条件和图中信息知,A 、反应物是一种单质和一种化合物,生成物是另一种单质 和另一种化合物,该反应属于置换反应;B 、活泼的置换不活泼的,氟气能把氧气置换出 来,说明氟气比氧气更活泼;C 、根据质量守恒定律,反应前4个分子,反应后5个分子, 反应前后应分子数目已改变;D 、丙是氟化氢,不是氧化物。
故选C 。
点睛:对于金属来说,活泼的置换不活泼的;对于非金属单质来说,同样是活泼的置换不 活泼的。
a £完全燃烧)转化①3 .下图为某反应的部分微观示意图,其中不同的球代表不同元素的原子。
下列说法正确的 是( )A .该反应属于置换反应B .参加反应的两种分子个数比为1:1 C. 1个X 分子中含有3个原子 D. 1个X 分子中含有3种不同的原子 【答案】C 【解析】 【分析】由图可知,不同球代表不同元素的原子,两种化合物反应生成单质与化合物,由原子守恒 可知,X 中含1个大黑球和2个小白球,以此来解答。