硝酸盐
- 格式:docx
- 大小:23.33 KB
- 文档页数:2
硝酸盐硝酸盐是由硝酸衍生的化合物的总称。
硝酸盐是离子化合物,含有硝酸根离子NO3—和另一正离子,如硝酸铵中的NH4+离子。
由金属离子和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。
如:AgNO3(银离子和硝酸根离子),Zn(NO3)2(锌离子和硝酸根离子)……都是硝酸盐。
NaNO3(钠离子和硝酸根离子)只是“硝酸盐”的一种。
硝酸盐极易溶于水,所以溶液中硝酸根不与其他阳离子反应。
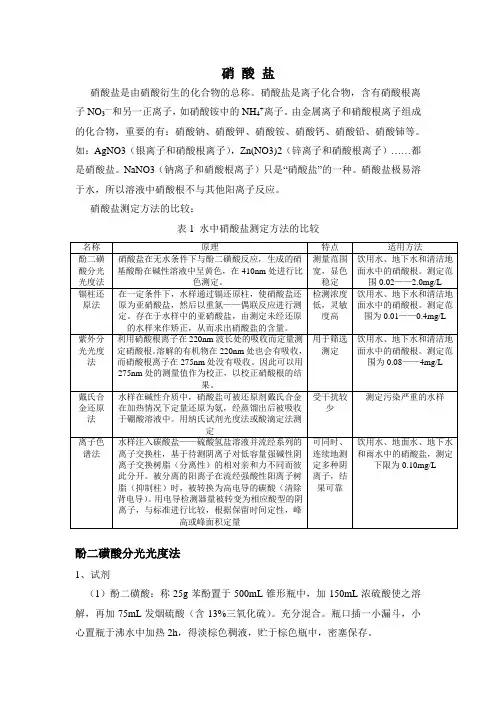
硝酸盐测定方法的比较:表1 水中硝酸盐测定方法的比较酚二磺酸分光光度法1、试剂(1)酚二磺酸:称25g苯酚置于500mL锥形瓶中,加150mL浓硫酸使之溶解,再加75mL发烟硫酸(含13%三氧化硫)。
充分混合。
瓶口插一小漏斗,小心置瓶于沸水中加热2h,得淡棕色稠液,贮于棕色瓶中,密塞保存。
(2)硝酸盐氮标准贮备溶液:称取0.7218g经105—110℃干燥后的硝酸钾(KNO3)溶于水中,移入1000mL容量瓶,稀释至标线,混匀。
加2mL三氯甲烷作保存剂,至少可稳定6个月。
每毫升该标准储备液含0.1000mg硝酸盐氮。
(3)硝酸盐氮标准使用溶液(10mg/L):吸取50.0mL硝酸盐氮标准贮备液,置蒸发皿内,加0.1mol/L氢氧化钠溶液使调至pH=8,在水浴上蒸发至干。
加入少量水,移入500mL容量瓶中,稀释至标线,混匀。
贮于棕色瓶中,此溶液至少稳定6个月。
(注:本标准溶液应同时制备两份,用以检查硝化完全与否。
如发现浓度存在差异时,应重新吸取标准贮备液进行制备。
)(4)硫酸银溶液:1.00g/L(5)氢氧化铝悬浮液:将125g硫酸铝[KAl(SO4)2·12H2O]或硫酸铝铵[NH4Al(SO4)2·12H2O]溶于1000mL蒸馏水,加热至60℃,然后边搅拌边加入55mL氨水。
放置约1h后,移至大瓶中,反复洗涤沉淀物,直至洗涤液中不含氯离子为止。
2、采样水样中硝酸盐的测定,应在采样后尽快进行。

硝酸盐和亚硝酸盐的符号
(原创实用版)
目录
1.硝酸盐和亚硝酸盐的定义
2.硝酸盐和亚硝酸盐的符号表示
3.硝酸盐和亚硝酸盐的性质和用途
4.硝酸盐和亚硝酸盐的安全注意事项
正文
硝酸盐和亚硝酸盐是两种常见的化学物质,它们在工业和生活中有着广泛的应用。
硝酸盐的符号为 NO3-,是一种阴离子,它是硝酸(HNO3)失去一个质子后形成的。
硝酸盐广泛应用于肥料、火药、染料等领域。
在农业上,硝酸盐被用作氮肥,可以提高作物的产量和品质。
在医疗上,硝酸盐也被用作消毒剂和防腐剂。
亚硝酸盐的符号为 NO2-,也是一种阴离子,它是亚硝酸(HNO2)失去一个质子后形成的。
亚硝酸盐的用途也很广泛,包括染料、印刷、医药等。
例如,亚硝酸盐在肉类制品中被用作防腐剂和发色剂,可以使肉类呈现出鲜艳的红色。
然而,硝酸盐和亚硝酸盐都有一定的毒性。
如果摄入过多,可能会对人体健康造成危害。
因此,在使用和储存硝酸盐和亚硝酸盐时,需要遵循相关的安全规定和注意事项。
例如,在食品中使用亚硝酸盐时,必须严格按照国家规定的用量标准,避免过量使用。
第1页共1页。

硝酸盐单位
硝酸盐单位是描述硝酸盐浓度的单位。
硝酸盐是一种广泛用于各种化学和农业应用的群体化合物,包括硝酸钠、硝酸镁和硝酸铵。
了解硝酸盐单位的重要性在于,它们对于准确测量硝酸盐浓度和控制硝酸盐含量至关重要。
以下是硝酸盐单位的一些关键信息:
1. 摩尔质量
硝酸盐的摩尔质量可以用来计算硝酸盐的浓度。
例如,在硝酸钾中,摩尔质量为101.1g/mol。
因此,如果你有100g的硝酸钾,你可以用下面的公式计算其浓度:
100g/101.1g/mol = 0.988 mol
2. 毫摩尔
毫摩尔是一个常用的浓度单位,尤其是在测量水中的硝酸盐含量时。
1毫摩尔(mM)等于1毫升水中含有1毫摩尔的硝酸盐。
因此,如果你在100毫升水中测量出10毫摩尔的硝酸盐,那么该水样的硝酸盐含量为10mM。
3. 毫克每升
毫克每升(mg/L)是另一种用于测量水中硝酸盐浓度的单位。
例如,在用于农业灌溉的水中,硝酸盐的安全浓度为40mg/L。
因此,如果你打算用该水进行灌溉,你需要确保其硝酸盐含量不超过40mg/L。
4. 超额含量
超额含量是指在硝酸盐溶液中超过其可溶性的硝酸盐量。
超额含量可以被用作一种化学反应中硝酸盐作用的速度测量。
例如,在土壤中添加硝酸盐,如果超额含量较高,这可能表明土壤缺乏生物活性,反之亦然。
总之,了解硝酸盐单位对于正确解释硝酸盐浓度和处理硝酸盐相关问题非常重要。
上述信息可以帮助你深入了解硝酸盐单位及其应用,以便更好地处理硝酸盐相关问题。

硝酸盐和硝酸盐氮硝酸盐是一类化合物,由阳离子和硝酸根阴离子组成,其中硝酸根离子是NO3-。
硝酸盐广泛应用于农业、医疗、工业等领域。
其中,硝酸盐氮是指通过测量土壤或水体中的硝酸盐含量来评估植物生长和环境污染的指标。
一、硝酸盐的基本概念1.1 硝酸盐的定义硝酸盐是由金属阳离子或氨基阳离子与硝酸根阴离子结合而成的化合物。
它们通常具有高度可溶性和良好的稳定性,并且在许多方面都有广泛应用。
1.2 硝酸盐的种类硝酸盐可以分为无机和有机两类。
无机硝酸盐包括钾、钠、氨、铵等,而有机硝酸盐则包括乙二胺四乙醇二钠(EDTA)等。
1.3 硝酸盐的应用由于其广泛应用,硝酸盐在农业、医疗、工业等领域都有重要作用。
在农业中,硝酸盐可以作为肥料提供植物所需的氮元素。
在医疗领域,硝酸盐可以用于制造药品和化妆品。
在工业中,硝酸盐则可以用于生产炸药等。
二、硝酸盐氮的基本概念2.1 硝酸盐氮的定义硝酸盐氮是指土壤或水体中的硝酸盐含量所包含的氮元素。
它是评估植物生长和环境污染程度的重要指标之一。
2.2 硝酸盐氮的来源土壤和水体中的硝酸盐氮主要来自于动植物排泄物、化肥、农药和废水等。
2.3 硝酸盐氮的影响因素影响土壤或水体中硝酸盐氮含量的因素包括土地使用方式、降雨量、温度、光照等。
三、硝酸盐与健康3.1 硝酸盐对健康的影响高浓度的硝酸盐会对人体健康造成危害,包括引起血液中氧气不足、致癌等。
此外,含有硝酸盐的食物也可能对健康产生负面影响。
3.2 如何减少硝酸盐的摄入为了减少硝酸盐的摄入,可以采取一些措施,如选择新鲜食材、避免过度烹调、避免加工食品等。
四、硝酸盐氮与环境4.1 硝酸盐氮对环境的影响高浓度的硝酸盐氮会导致水体富营养化和藻类爆发,从而破坏水生态系统。
此外,硝酸盐氮还会影响土壤中微生物和植物的生长。
4.2 如何减少硝酸盐氮的排放为了减少硝酸盐氮的排放,可以采取一些措施,如使用肥料和农药时注意控制用量、建立污染物治理设施等。
五、结论总之,硝酸盐和硝酸盐氮在农业、医疗、工业等领域都有广泛应用。

硝酸盐和亚硝酸盐的区别
答:硝酸盐和亚硝酸盐的区别:
酸盐几乎全部易溶于水,化学性质较为稳定。
大量存在于自然界中,主要来源是固氮菌固氮形成,或在闪电的高温下空气中的氮气与氧气直接化合成氮氧化物,溶于雨水形成硝酸,在与地面的矿物反应生成硝酸盐。
亚硝酸盐引起食物中毒的机率较高.食入0.05克的亚硝酸盐即可引起中毒甚至死亡。
1、碱金属和碱土金属的亚硝酸盐可由等当量的一氧化氮和二氧化氮通入该金属的氢氧化物溶液中便可得。
2、分解硝酸盐可制造出亚硝酸盐和氧气。
硝酸盐在还原菌的作用下,硝酸盐可以被还原为亚硝酸盐.在高温蒸煮,或者长期置于有氧环境下,硝酸盐会转化成亚硝酸盐。

硝酸盐的熔点
摘要:
1.硝酸盐的概述
2.硝酸盐的熔点特性
3.硝酸盐的实际应用
正文:
硝酸盐是一类含有硝酸根离子(NO3-)的盐,广泛存在于自然界和人类生活中。
硝酸盐具有广泛的用途,如肥料、火药、染料等。
了解硝酸盐的熔点特性,有助于我们更好地利用这一类物质。
硝酸盐的熔点受多种因素影响,如化学结构、晶体形态等。
一般来说,硝酸盐的熔点范围较宽,从几十摄氏度到几百摄氏度不等。
例如,硝酸钠(NaNO3)的熔点为306.8℃,硝酸钾(KNO3)的熔点为336.5℃。
在实际应用中,硝酸盐的熔点特性具有重要意义。
在农业领域,硝酸盐被广泛用作肥料,其熔点特性决定了肥料在施用时的物理状态。
在高温季节,硝酸盐肥料易溶于水,有利于作物吸收;而在低温季节,硝酸盐肥料则呈固态,不利于作物吸收。
因此,了解硝酸盐的熔点特性,有助于我们合理选择肥料类型和施用时机。
在工业领域,硝酸盐也被广泛应用。
例如,在火药制造中,硝酸盐是重要的成分,其熔点特性会影响火药的燃烧性能。
此外,硝酸盐还被用于染料、陶瓷釉料等领域。
总之,硝酸盐是一类具有广泛应用的盐类,了解其熔点特性有助于我们更
好地利用这一类物质。

硝酸盐加热分解产物
摘要:
1.硝酸盐的概述
2.硝酸盐加热分解的原理
3.硝酸盐加热分解的产物
4.硝酸盐加热分解的应用和影响
正文:
1.硝酸盐的概述
硝酸盐是一种广泛存在于自然界的化合物,其化学式为NO3-。
在化学和工业领域,硝酸盐被广泛应用于肥料、火药、染料、医药等领域。
2.硝酸盐加热分解的原理
硝酸盐在加热的条件下,会发生分解反应。
这种反应的机理主要是硝酸盐分子在高温下失去氧原子,形成一氧化氮、二氧化氮等气体。
随着温度的升高,反应速率会加快,产生的气体也会增多。
3.硝酸盐加热分解的产物
硝酸盐加热分解的产物主要有一氧化氮、二氧化氮、氧气等。
这些气体在工业生产中具有重要的应用价值,比如一氧化氮可以用于制取其他化学品,二氧化氮则可以用于消毒和漂白等。
4.硝酸盐加热分解的应用和影响
硝酸盐加热分解在工业生产中具有广泛的应用,比如在肥料生产中,硝酸盐的加热分解可以得到氮气,这是一种重要的肥料成分。
在火药制造中,硝酸
盐加热分解产生的气体也可以用于火药的制备。
然而,硝酸盐加热分解也会对环境产生影响。
例如,硝酸盐加热分解产生的一氧化氮和二氧化氮都是重要的空气污染物,长期接触会对人体健康产生影响。

硝酸盐的测定方法
硝酸盐的测定方法有多种,以下是常用的几种方法:
1. 硝酸盐与铁离子的反应法:将待测溶液与亚硫酸盐溶液混合,加入硫酸铁(II)溶液,如果溶液呈棕黄色,则说明存在硝酸盐。
2. 硝酸盐与酚酞的反应法:将待测溶液与酚酞溶液混合,如果溶液由无色变为红色,则说明存在硝酸盐。
3. 硝酸盐与银离子的反应法:将待测溶液与硝酸银溶液混合,若溶液呈白色沉淀,则说明存在硝酸盐。
4. 硝酸盐与镁离子的反应法:将待测溶液与氯化镁溶液混合,加入氯化铵溶液和氢氧化钠溶液,若溶液出现白色沉淀,则说明存在硝酸盐。
这些方法都是基于硝酸盐在一定条件下与其他物质发生化学反应的特性来进行测定的。
具体选择哪种方法,需要根据实际情况和待测样品的性质来确定。

硝酸盐含量测定方法硝酸盐是常见的无机盐之一,广泛应用于化工、医药、农业等领域。
为了确保产品质量和环境安全,对硝酸盐的含量进行准确测定是十分重要的。
下面将介绍几种常用的硝酸盐含量测定方法。
1.反应滴定法反应滴定法是测定硝酸盐含量的常用方法之一、该方法的原理是利用硝酸盐与还原剂之间的氧化还原反应,滴定过程中加入指示剂来判断滴定终点。
常用的还原剂有亚硫酸钠、硫酸亚铁等。
通过滴定测定,可以得到硝酸盐的含量。
2.稀硫酸显色法稀硫酸显色法是一种常用的草酸法测定硝酸盐含量的方法。
该方法通过将待测样品与草酸共热生成氮气,使样品中硝酸盐还原为亚硝酸盐。
然后用稀硫酸将亚硝酸盐转化为亚硝酸,再与巴曾试剂反应生成卡宾底物B,通过测定底物B的吸光度来计算硝酸盐的含量。
3.紫外分光光度法紫外分光光度法是一种利用物质对特定波长的紫外光的吸收来测定其中其中一种或几种组分浓度的方法。
硝酸盐在紫外光区域波长处有特定的吸收峰,通过测定吸光度可以计算硝酸盐的含量。
该方法准确度高,适用于测定硝酸盐含量较低的样品。
4.离子色谱法离子色谱法是测定硝酸盐含量的一种常用方法。
该方法是利用离子交换树脂对样品中硝酸盐进行吸附,然后通过改变洗脱剂的组成和流速,使硝酸盐逐渐从离子交换树脂上洗脱下来,再通过检测器测定硝酸盐的浓度。
该方法准确度高,可以同时测定多种离子。
5.毛管电泳法毛管电泳法是一种利用电场作用将样品中的物质分离并测定其含量的方法。
该方法通过在毛管中施加电场,使带电物质在电场的作用下迁移,并通过检测器测定不同组分的峰面积或峰高来计算硝酸盐的含量。
毛管电泳法具有分离效果好、分析速度快等优点。
总结:上述介绍了几种常用的硝酸盐含量测定方法,包括反应滴定法、稀硫酸显色法、紫外分光光度法、离子色谱法和毛管电泳法。
根据实际需要选择适合的方法进行硝酸盐含量的测定,以保障产品质量和环境安全。

硝酸盐的成分-概述说明以及解释1.引言1.1 概述硝酸盐是指含有氧化根离子NO3-的盐类化合物。
它们是一类重要的化学物质,在生活和工业生产中扮演着重要的角色。
硝酸盐可以通过将相应的金属与硝酸反应而制得,也可由其他硝酸盐经过置换反应得到。
硝酸盐可以分为无机硝酸盐和有机硝酸盐两大类。
无机硝酸盐是由无机金属与硝酸反应而生成的盐类化合物。
常见的无机硝酸盐有硝酸钠、硝酸钾、硝酸铵等。
它们在农业中被广泛应用作为肥料,提供植物所需的氮元素。
此外,在火药制造、炸药生产和化学实验室中,无机硝酸盐也具有重要的用途。
有机硝酸盐则是由有机化合物与硝酸反应而生成的盐类化合物。
这类化合物具有复杂的结构和多样的性质。
有机硝酸盐在医药领域中具有重要的应用价值,例如硝酸甘油是一种广泛用于心脑血管疾病治疗的药物。
了解硝酸盐的成分特点对我们理解其性质和应用具有重要的意义。
本文将在接下来的章节中详细介绍硝酸盐的定义和分类,以及常见的硝酸盐成分,希望能够为读者提供更全面的了解和知识。
1.2 文章结构文章结构:本文分为引言、正文和结论三个部分。
引言部分主要是对硝酸盐的成分进行介绍和概述。
首先,我们需要说明什么是硝酸盐及其分类。
然后,对整篇文章的结构进行简要介绍,引导读者了解文章的内容和组织。
最后,明确文章的目的,即探索硝酸盐的成分。
通过这部分的介绍,读者可以对本文的主题和内容有一个整体的了解。
接下来是正文部分。
正文首先详细解释了硝酸盐的定义和分类。
在这一部分中,我们可以对硝酸盐的结构、性质、制备方法等进行介绍,为后续的内容打下基础。
其次,我们介绍了硝酸盐的常见成分,包括一些常见的硝酸盐物质以及它们的特点、性质等。
通过对这些成分的描述,读者可以初步了解硝酸盐的组成和特点。
最后是结论部分。
结论部分总结了硝酸盐的成分特点,并指出了硝酸盐研究的意义和应用。
这一部分强调硝酸盐在工业、农业、医药等领域的重要性,并指出进一步研究硝酸盐的意义和方向。
通过这一部分的总结,有效地回顾了整篇文章的核心内容,并展望了未来的研究方向。

硝酸盐的主要产生过程1. 什么是硝酸盐硝酸盐是一类化合物,由硝酸根离子(NO3-)与阳离子结合形成。
硝酸盐在化工、农业、医药等领域被广泛应用,具有重要的经济和科学价值。
2. 硝酸盐的产生过程硝酸盐主要通过以下几种方式产生:2.1 氧化法氧化法是最常见的硝酸盐产生方式之一。
它包括以下步骤:1.氨氧化:在氧气的存在下,将氨氧化为亚硝酸(NO2-)。
2.亚硝酸氧化:将亚硝酸进一步氧化为硝酸(HNO3)。
3.生成硝酸盐:将产生的硝酸与相应的金属阳离子结合形成硝酸盐。
2.2 硝酸法硝酸法是另一种常用的硝酸盐产生方式。
通常使用硝酸和金属氧化物或碱来制备硝酸盐。
具体步骤如下:1.制备硝酸:在适当的条件下,将氮气与氧气反应生成硝酸。
2.与金属反应:将得到的硝酸与金属反应生成相应的硝酸盐。
2.3 蒸发法蒸发法是一种利用溶液中硝酸盐浓度随着溶液蒸发逐渐增大而产生硝酸盐的方法。
步骤如下:1.制备溶液:将含有硝酸盐的溶液置于容器中。
2.蒸发溶液:通过加热或自然蒸发使溶液中的水分逐渐蒸发。
3.晶体析出:随着溶液浓缩,硝酸盐晶体会逐渐析出。
2.4 生物转化法生物转化法利用特定的细菌或微生物将氨、尿素等氮化合物转化为硝酸盐。
该方法常用于农业领域,具有环保、高效的特点。
1.氨氧化:特定细菌通过氨氧化作用将氨转化为亚硝酸。
2.亚硝酸氧化:亚硝酸再经过特定细菌的作用被进一步氧化为硝酸。
3.生成硝酸盐:最终形成硝酸盐。
3. 硝酸盐的应用领域硝酸盐作为一类常见的化学品,在许多领域有着广泛的应用,包括:•农业领域:硝酸盐作为植物的氮源,可用于提供植物所需的养分。
•化工领域:硝酸盐广泛应用于染料、炸药、医药、涂料等行业。
•环境保护领域:硝酸盐在大气和水体的污染监测中起到重要作用。
•医学领域:硝酸盐在医学实验和药物制备中有一定的应用。
4. 总结硝酸盐的产生过程主要包括氧化法、硝酸法、蒸发法和生物转化法。
这些方法在不同的行业和领域中得到广泛应用。
硝酸盐的化学式全文共四篇示例,供读者参考第一篇示例:硝酸盐是一类含有硝酸根离子(NO3-)的化合物,常见的硝酸盐包括硝酸钠、硝酸铵、硝酸铝等。
硝酸盐在日常生活和工业生产中广泛应用,具有重要的化学和物理性质。
本文将从硝酸盐的基本概念、结构、性质以及应用等方面详细介绍硝酸盐的化学式及相关知识。
硝酸盐的化学式为MNO3,其中M代表金属离子。
硝酸盐的结构呈现出NO3- 根离子与金属离子之间的离子键结构,硝酸盐是由硝酸根离子(NO3-)与金属离子(M)通过离子键结合而成的盐类化合物。
硝酸盐的结构简单明了,但却具有重要的意义和广泛的应用。
硝酸盐具有许多重要性质,其中最重要的是氧化性和还原性。
硝酸盐在化学反应中可发生氧化-还原反应,以及其他各种化学反应。
硝酸盐还具有较强的腐蚀性和毒性,因此在操作时需谨慎处理。
硝酸盐在工业生产中广泛应用,可用作氧化剂、农药、火药等。
硝酸盐的应用十分广泛,其中最常见的硝酸盐包括硝酸钠、硝酸铵、硝酸铝等。
硝酸钠常用于金属加工、玻璃生产、化工生产等领域,是一种重要的工业原料。
硝酸铵则常用于化肥生产、炸药制造等领域。
硝酸铝则广泛用于皮革工业、印染工业、制革工业等领域。
第二篇示例:硝酸盐是一类由硝酸根离子组成的盐类化合物,是一类重要的化学物质,在工业生产、农业生产和医药领域都有广泛应用。
硝酸盐的化学式一般形式为MNO3,其中M代表金属元素。
在化学实验室中,常见的硝酸盐包括硝酸钠(NaNO3)、硝酸钾(KNO3)、硝酸铜(CuNO3)、硝酸铅(PbNO3)等。
硝酸盐的制备方法有多种,其中最常见的是通过硝酸和金属氢氧化物或碳酸盐反应得到。
硝酸银的制备方法为将硝酸和氢氧化银溶液反应,生成硝酸银沉淀,再用水洗涤得到硝酸银。
硝酸铅的制备方法为将硝酸和碳酸铅溶液反应,生成硝酸铅沉淀,用水洗涤得到硝酸铅。
硝酸盐是一类常见的氧化剂,可以被还原为氮气和水。
在工业生产中,硝酸银和硝酸铅被广泛应用于摄影和电镀工艺中,硝酸钾和硝酸钠被用作火药的主要成分。
硝酸盐的检测方法
硝酸盐的常见检测方法有以下几种:
1.磁力法(费氏试剂法):此检测法常用于水中硝酸盐含量的检测。
操作方法为将水样加入试管中,加入费氏试剂(亚硝酸磁装和硫酸钠溶液)后,在制备的磁振子上放置试管。
如果水中含有硝酸盐,则费氏试剂与硝酸盐反应生成氨气,使磁振子上的小磁铁发生明显的磁性变化。
2.重沉淀法:此检测法通用于分析化学及土壤中硝酸盐的检测。
操作方法为将待检测物(如土壤)中的硝酸盐通过提取、反应、过滤等手段转化为沉淀,然后取出沉淀进行称重,计算硝酸盐的含量。
3.光度法:此检测法对于医学、食品等领域的硝酸盐含量检测比较常见。
操作方法为将待检测物中的硝酸盐经过反应生成染色物质,然后利用光度计测量染色物质产生的光学密度,计算硝酸盐的含量。
4.电化学法:此检测法可用于水中硝酸盐的含量检测。
操作方法为将水样电解,利用电化学法测量出水中硝酸盐离子的浓度。
以上是常见的硝酸盐检测方法,具体使用哪种方法,取决于样品的来源、分析目的和分析手段的可用性等因素。
环境中的硝酸盐1.简介硝酸盐是指由硝酸衍生的化合物的总称。
硝酸盐是离子化合物。
硝酸盐以各种形式出现,但在干燥时通常是白色或结晶性粉末,在自然界中广泛存在,主要来源是固氮菌固氮形成,或在闪电的高温下空气中的氮气与氧气直接化合成氮氧化物,溶于雨水形成硝酸,在与地面的矿物反应生成硝酸盐。
固体的硝酸盐加热时能分解放出氧,其中最活泼的金属的硝酸盐仅放出一部分氧而变成亚硝酸盐,其余大部分金属的硝酸盐,分解为金属的氧化物、氧和二氧化氮[1]。
硝酸盐在高温时是强氧化剂,但水溶液几乎没有氧化作用。
主要用途是供植物吸收的氮肥,氮元素不仅是氨基酸与蛋白质的主要成分,还可以合成叶绿素,促进光合作用,所以如果植物缺氮就会叶子枯黄。
硝酸钠和硝酸钙是很好的氮肥。
硝酸钾是制黑色火药的原料。
硝酸铵可作肥料,也可制炸药。
由硝酸作用于相应的金属或金属氧化物等而制得[2]。
环境中化肥施用、污水灌溉、垃圾粪便、工业含氮废弃物、燃料燃烧排放的含氮废气等在自然条件下,经降水淋溶分解后形成硝酸盐,流入河、湖并渗入地下,从而造成地表水和地下水的硝酸盐污染。
滥施化肥、污灌、用硝酸盐污染的水源灌溉也使农作物吸收了大量的硝酸盐类,还有腌制的渍酸菜、经过长途运输和长期贮存的蔬菜以及隔夜的熟蔬菜不仅硝酸盐含量大量增加,而且在硝酸盐还原菌的作用下,硝酸盐被还原为亚硝酸盐[3]。
上述含有大量硝酸盐与亚硝酸盐的饮水、蔬菜、粮食、鱼、肉制品、渍酸菜、隔夜炒菜等经人食用后,大量亚硝酸盐可使人直接中毒,而且硝酸盐在人体内也可被还原为亚硝酸盐。
亚硝酸盐与人体血液作用,形成高铁血红蛋白,从而使血液失去携氧功能,使人缺氧中毒,轻者头昏、心悸、呕吐、口唇青紫,重者神志不清、抽搐、呼吸急促,抢救不及时可危及生命。
不仅如此,亚硝酸盐在人体内外与仲胺类作用形成亚硝胺类,它在人体内达到一定剂量时是致癌、致畸、致突变的物质,可严重危害人体健康[4]。
儿童可能的暴露途径包括摄入受污染的饮用水,最常见的是私人水井和含防腐剂的食物,特别是腌制肉类,如火腿和熏肉等。
硝盐是一种硝酸盐和亚硝酸盐(亚硝酸钠)的混合物,亚硝酸钠和人体当中的生物胺产生反应,会生成一种亚硝胺类物质,这类物质现在被证明具有很强的致癌作用。
硝酸盐(NO3)与亚硝酸盐(NO2)分别是硝酸(HNO3)和亚硝酸(HNO2)的酸根,它们作为环境污染物而广泛地存在于自然界中,尤其是在气态水、地表水和地下水中以及动植物体与食品内。
环境中硝酸盐与亚硝酸盐的污染来源很多,如:1.化肥:有硝酸铵、硝酸钙、硝酸钾、硝酸钠和尿素等;2.生活污水、生活垃圾与人畜粪便,据测试1升生活污水在自然降解过程中,可产生110毫克硝酸盐;1公斤垃圾粪便堆肥在自然条件下经淋滤分解后,可产生492毫克硝酸盐;3.食品、燃料等工厂排出大量的含氨废弃物,经过生物、化学转换后均形成硝酸盐进入环境中;4.汽车、火车、民用炉等燃烧石油类燃料、煤炭、天然气,可产生大量氮氧化物,平均燃烧1吨煤、1千升油和1万立方米天然气可分别产生二氧化氮气体9、13与63公斤,这些二氧化氮气体经降水淋溶后可形成硝酸盐降落到地面和水体中;5.食品防腐与保鲜:硝酸盐与亚硝酸盐被广泛用在肉品和鱼的防腐和保存上,以使肉制品呈现红色和香味,在每公斤肉食品中加入亚硝酸盐(一般为亚硝酸钠)5毫克以下,在一定时间内肉色观感良好;加入20毫克以上,可呈现商业上需要的稳定色彩;加入50毫克则有特殊气味。
环境中化肥施用、污水灌溉、垃圾粪便、工业含氮废弃物、燃料燃烧排放的含氮废气等在自然条件下,经降水淋溶分解后形成硝酸盐,流入河、湖并渗入地下,从而造成地表水和地下水的硝酸盐污染。
如污水下渗、污灌和滥施化肥可使地下水硝酸盐含量由数毫克/升剧增至400毫克/升以上(国家生活饮用水硝酸盐含量卫生标准小于88.6毫克/升,以氮计小于20毫克/升);滥施化肥、污灌、用硝酸盐污染的水源灌溉也使农作物吸收了大量的硝酸盐类,如过分施肥所产的菠菜中每公斤干重可含亚硝酸盐达3600毫克。
还有腌制的渍酸菜、经过长途运输和长期贮存的蔬菜以及隔夜的熟蔬菜不仅硝酸盐含量大量增加,而且在硝酸盐还原菌的作用下,硝酸盐被还原为亚硝酸盐。
硝酸盐和硝态氮一、引言硝酸盐和硝态氮是化学中常见的两种物质。
硝酸盐是一类含有硝酸根离子(NO3-)的化合物,而硝态氮则是指氮的氧化态为+5的物质。
本文将分别介绍硝酸盐和硝态氮的性质、应用以及对环境和健康的影响。
二、硝酸盐1. 硝酸盐的性质硝酸盐是由金属离子和硝酸根离子组成的盐类化合物。
常见的硝酸盐包括硝酸钠、硝酸钾、硝酸铜等。
硝酸盐通常为无色晶体,可溶于水。
硝酸盐在潮湿环境中会吸湿,易于形成结晶水合物。
2. 硝酸盐的应用硝酸盐在工业生产和农业中有广泛的应用。
在工业中,硝酸盐可用作炸药和火药的原料,因其含有丰富的氧源,能够加速燃烧过程。
此外,硝酸盐还可用于制备化肥、染料、医药等产品。
3. 硝酸盐对环境和健康的影响硝酸盐在农业中被广泛使用作为植物的氮源肥料。
然而,过量的硝酸盐施用会导致土壤和水体中硝酸盐浓度升高,对环境造成污染。
高浓度的硝酸盐还可引发水体富营养化,导致水体中藻类过度繁殖,造成水质恶化。
此外,硝酸盐也可通过饮用水或食物进入人体,过高的摄入量可能对健康造成危害,如引发亚硝酸盐中毒。
三、硝态氮1. 硝态氮的性质硝态氮是氮的氧化态为+5的化合物,以亚硝酸盐(NO2-)和硝酸盐(NO3-)两种形式存在。
硝态氮是一种无色气体,可溶于水,具有强氧化性。
硝态氮在自然界中广泛存在,常见于土壤、水体和大气中。
2. 硝态氮的形成与转化硝态氮的形成主要通过氮的细菌固氮作用、化学工业过程和大气氮氧化等途径。
在土壤中,硝态氮的形成主要来自于氨氧化细菌的作用,将氨氧化为亚硝酸盐和硝酸盐。
硝态氮还可通过大气中的氮氧化细菌的作用,将大气中的氮气氧化为亚硝酸盐和硝酸盐。
3. 硝态氮的应用和影响硝态氮在农业中被广泛应用作为植物的氮源肥料。
合理利用硝态氮可以促进植物生长,提高农作物产量。
然而,过量的硝态氮施用会导致土壤中硝酸盐浓度升高,增加氮素的流失,造成环境污染。
此外,硝态氮还可通过农田径流进入水体,引发水体富营养化,破坏水生态系统平衡。
硝酸盐
概述
硝酸盐是硝酸衍生的化合物的统称,一般为金属离子或铵根离子与硝酸根离子组成的盐类。
硝酸盐是离子化合物,含有硝酸根离子NO3-和对应的正离子,如硝酸铵中的NH4+离子。
常见的硝酸盐有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。
硝酸盐几乎全部易溶于水,只有硝酸脲微溶于水,碱式硝酸铋难溶于水,所以溶液中硝酸根不能被其他绝大多数阳离子沉淀。
结构
结构
硝酸根离子具有以下共振式:
硝酸根离子,其中氮氧键介于单双键之间。
化学性质
固体的硝酸盐加热时能分解放出氧,其中最活泼的金属的硝酸盐仅放出一部分氧而变成亚硝酸盐,其余大部分金属的硝酸盐,分解为金属的氧化物、氧和二氧化氮。
硝酸盐在高温或酸性水溶液中是强氧化剂,但在碱性或中性的水溶液几乎没有氧化作用。
硝酸根和金属离子可以按多种方式配位,包括单齿、双齿、叁齿或端梢、桥式等。
生产方法
硝酸盐大量存在于自然界中,主要来源是固氮菌固氮形成,或在闪电的高温下空气中的氮气与氧气直接化合成氮氧化物,溶于雨水形成硝酸,在与地面的矿物反应生成硝酸盐。
硝酸与金属、金属氧化物或碳酸盐反应是最简单的制备硝酸盐的方法。
某些含水的硝酸盐如Be(NO3)2,Mg(NO3)2和Cu(NO3)2加热水解,因此得不到相应的无水硝酸盐。
无水硝酸盐可通过下列途径制得:
在液态N2O4中反应:
Ni(CO)4 + N2O4→ Ni(NO3)2 + 2NO + 4CO
在纯HNO3-N2O5或液态N2O5中反应:
TiCl4 + 4N2O5→ Ti(NO3)4 + 2N2O4 + 2Cl2
与卤素的硝酸盐在低温反应。
如硝酸氯ClNO3:
TiCl4 + 4ClNO3 (-80℃)→ Ti(NO3)4 + 2Cl2
某些金属还可形成通式为MOx(NO3)y 的碱式硝酸盐,如BiO(NO3)2。
大多数硝酸盐为离子型晶体,易溶于水。
某些无水盐具有挥发性。
硝酸盐可以发生分解反应,产物可以是:
亚硝酸盐和氧气(碱金属和碱土金属的硝酸盐);
金属氧化物和氮氧化物和氧气(镁和铜之间的硝酸盐);金属单质和氮氧化物和氧气(铜后金属硝酸盐)。