有关氮的氧化物的计算专题
- 格式:pptx
- 大小:636.11 KB
- 文档页数:16

氮的氧化物溶于水的计算氮的氧化物指的是氮与氧元素形成的化合物,包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)。
这些化合物在大气中存在,并且会溶解于水中,通过以下计算可以了解氮的氧化物在水中的溶解性和相关的化学反应。
首先,我们来讨论一氧化氮(NO)。
一氧化氮是一种无色气体,其溶解度随温度和帕斯卡定律成正相关。
根据Henry定律,气体在液体中的溶解度与气体分压成正比。
换句话说,溶解度可以通过气体的分压来确定。
NO在水中的溶解度可以通过以下公式计算:溶解度(mol/L) = K * P其中,K是Henry定律的Henry常数,P是NO的分压。
当NO的分压为1 atm时,其在25°C下的溶解度约为0.0013 mol/L。
随着温度的升高,溶解度会增加,因为温度升高会使气体分压增加。
接下来,我们转向二氧化氮(NO2)。
二氧化氮是一种红棕色气体,其在水中会发生一系列复杂的反应。
首先,二氧化氮会与水反应生成硝酸(HNO3)和亚硝酸(HNO2):2NO2+H2O->HNO3+HNO2其中,硝酸是一种强酸,亚硝酸是一种较弱的酸。
此外,二氧化氮还可以通过以下反应转化为一氧化氮:2NO2<->2NO+O2最后,我们来讨论三氧化二氮(N2O3)。
N2O3+H2O->2HNO2与二氧化氮类似,硝酸是一种强酸,亚硝酸是一种较弱的酸。
总结起来,氮的氧化物在水中会发生一系列的化学反应,包括一氧化氮的溶解、二氧化氮和三氧化二氮的与水反应。
这些反应导致水溶液中存在硝酸和亚硝酸,这些化合物在环境中有重要的生物地球化学循环作用。
然而,需要注意的是以上只是理论计算,实际情况可能受到多种因素的影响,包括温度、压力、其他溶质的存在等。
因此,在实际实验中需要综合考虑这些因素来确定氮的氧化物在水中的溶解度和化学反应行为。



氮氧化物折算值计算公式氮氧化物折算值的计算公式,这可是个在化学和环境科学领域里挺重要的家伙呢!咱先来说说为啥要搞出个氮氧化物折算值来。
比如说,在工厂排放废气的时候,测量出来的氮氧化物浓度那可不能直接就拿来用,因为废气的含氧量啥的都不太一样。
这就好比你去买水果,同样是一斤,水分多的和水分少的实际果肉重量能一样嘛!所以就得有个折算的办法,让不同条件下测出来的数据能放在一起比较,这就是氮氧化物折算值存在的意义啦。
氮氧化物折算值的计算公式通常是这样的:氮氧化物折算值 = 氮氧化物实测值×(21 - 基准含氧量)÷(21 - 实测含氧量)。
这里面的“21”指的是空气中氧气的体积分数,一般认为是个固定的值。
给您举个例子吧。
有一回我去一家化工厂考察,他们的废气监测设备显示氮氧化物的浓度是 500mg/m³,实测含氧量是 10%。
那咱们按照公式来算算,基准含氧量假如规定是 8%,那氮氧化物折算值就是500×(21 - 8)÷(21 - 10),算下来大概是 642.86mg/m³。
这一折算,就能更准确地反映出这废气中氮氧化物的实际含量了。
在实际应用中,这个公式可重要了。
比如说环保部门要评估一个区域的空气质量,或者工厂要控制自己的污染物排放,都得靠这个公式来算出准确的氮氧化物折算值。
而且啊,不同的行业、不同的排放标准,对于基准含氧量的规定还可能不一样呢。
这就要求咱们在使用这个公式的时候,一定要搞清楚具体的规定,可不能瞎算。
再比如说,在研究汽车尾气排放的时候,也得用这个公式。
想象一下,一辆车在路上跑,尾气排出来,检测氮氧化物浓度的时候,也得考虑当时的含氧量,然后通过折算值才能真正知道这尾气排放到底合不合格。
总之,氮氧化物折算值计算公式虽然看起来有点复杂,但只要搞清楚里面每个参数的含义,用对地方,那就能在环保和相关领域发挥大作用,让我们能更科学、更准确地了解和控制氮氧化物的排放,保护好咱们的环境。



氮的氧化物与氧气水的计算1.氮与氧气反应:氮与氧气反应生成一氧化氮的化学方程式如下:N2+O2→2NO假设有0.3 mol的氮(N2)和0.4 mol的氧气(O2)反应,求生成的一氧化氮的摩尔数和质量。
根据化学方程式可以看出,1 mol的氮与1 mol的氧气反应生成2mol的一氧化氮。
所以,根据反应的摩尔比可以得到生成的一氧化氮的摩尔数:摩尔数= 0.3 mol × (2 mol/1 mol) = 0.6 mol一氧化氮的分子量为30.01 g/mol,可以根据摩尔数计算质量:质量 = 0.6 mol × 30.01 g/mol = 18.006 g因此,0.3 mol的氮和0.4 mol的氧气反应生成0.6 mol的一氧化氮,质量为18.006 g。
2.氮与水反应:氮与水反应生成氨的化学方程式如下:N2+3H2O→2NH3+O2假设有0.5 mol的氮(N2)和0.8 mol的水(H2O)反应,求生成的氨的摩尔数和质量。
根据化学方程式可以看出,1 mol的氮与3 mol的水反应生成2 mol 的氨。
所以,根据反应的摩尔比可以得到生成的氨的摩尔数:摩尔数 = 0.5 mol × (2 mol/1 mol) = 1 mol氨的分子量为17.03 g/mol,可以根据摩尔数计算质量:质量= 1 mol × 17.03 g/mol = 17.03 g因此,0.5 mol的氮和0.8 mol的水反应生成1 mol的氨,质量为17.03 g。
此外,还可以根据反应前后物质的摩尔比计算其他反应条件下的摩尔数和质量。
需要注意的是,这里给出的是理论计算,实际反应可能受到温度、压力、反应速率等因素的影响,需要在实验中进行验证和优化。

燃料(固体和液体燃料)中的N和输入空气中的N,在燃烧时会产生NOx,一般在燃烧时产生的NOx中的约90% 为NO ,其余主要是NO2。
燃料燃烧时产生氮氧化物量可用下列公式估算:
GNOx= 1.63 ×B ×(N ×β+ 0.000938)
GNOx—氮氧化物排放量,kg ;
B –消耗的燃煤(油)量,kg ;
N –燃料中的含氮量,%,见表7 ;
β—燃料中氮的转化率,%,见表8。
燃料中氮的含量
燃料名称含氮质量百分比(%)
数值平均值
煤 0.5—2.5 1.5
劣质重油 0.2—0.4 0.2
一般重油 0.08—0.4 0.14
劣质轻油 0.005—0.08 0.02
表8 燃料中氮的NOx转化率
炉型 NOx的转化率(%)
层燃煤 50
煤粉炉 25
燃油炉 40
表9 不同燃料、不同炉型燃烧时氮氧化物产污系数(kg/t煤)燃料及炉型含氮量(%) NOx的转化率(%) GNOx
层燃煤 1.5 50 13.8
煤粉炉 1.5 25 7.6
劣质重油 0.2 40 2.8
一般重油 0.14 40 2.4
劣质轻油 0.02 40 1.7。
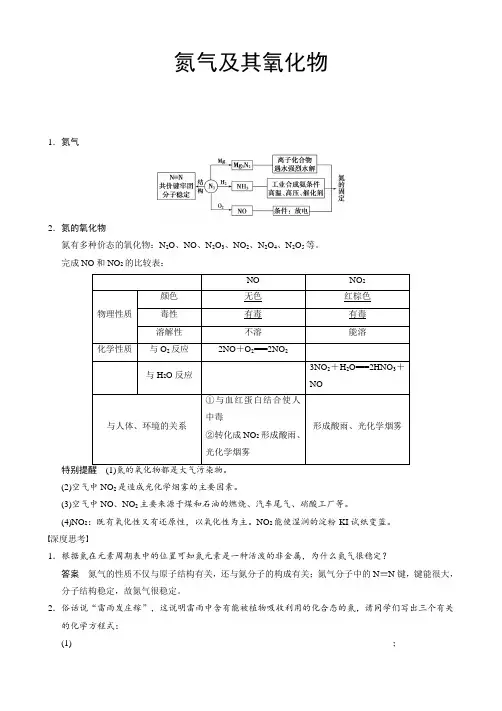
氮气及其氧化物1.氮气2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:NO NO 2物理性质颜色无色红棕色毒性有毒有毒溶解性不溶能溶化学性质与O2反应2NO+O2===2NO2与H2O反应3NO2+H2O===2HNO3+NO与人体、环境的关系①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
NO2能使湿润的淀粉-KI试纸变蓝。
深度思考1.根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?答案氮气的性质不仅与原子结构有关,还与氮分子的构成有关;氮气分子中的N≡N键,键能很大,分子结构稳定,故氮气很稳定。
2.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们写出三个有关的化学方程式:(1)________________________________________________________________________;(2)________________________________________________________________________; (3)________________________________________________________________________。
答案 (1)N 2+O 2=====放电或高温2NO (2)2NO +O 2===2NO 2(3)3NO 2+H 2O===2HNO 3+NO 3.如何鉴别NO 2与溴蒸气?答案 由于NO 2和Br 2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。

氮氧化物相关计算题型整理本文旨在整理氮氧化物相关计算题型,帮助广大学生更好地掌握这一知识点,并顺利通过考试。
一、氮氧化物简介氮氧化物是大气污染的主要成分之一,主要包括氧化氮(NO)、二氧化氮(NO2)等。
它们是空气中的有害物质,会对健康和环境造成危害。
因此,对氮氧化物的计算题型掌握是非常必要的。
二、计算题型1、NO和NO2的摩尔质量分别是30g/mol和46g/mol,如果一种氮氧化物混合气体的质量分数是80%,求这种混合气体的摩尔质量。
解析:假设混合气体的质量为100g,NO的质量为x(g),NO2的质量为100-x(g)。
则NO的摩尔数为x/30,NO2的摩尔数为(100-x)/46。
因为混合气体的质量分数是80%,所以NO和NO2的摩尔分数分别是0.8和0.2。
因此,混合气体的摩尔质量可以表示为:M=(0.8×x/30)+(0.2×(100-x)/46)= 0.026x + 0.0043(100-x)= 0.0218x + 0.43因为混合气体的质量分数是80%,所以x=0.8×100=80(g)。
代入上式,得到:M = 0.0218×80 + 0.43= 2.194 g/mole因此,这种混合气体的摩尔质量为2.194g/mol。
2、如果一台工厂的NOx排放浓度为200mg/m3,排放量为100m3/s,求这个工厂过去一年排放的总NOx量。
解析:首先,我们需要将单位统一。
NOx的摩尔质量为46g/mol,所以200mg/m3相当于0.2g/m3。
而100m3/s相当于100×3600s/h×24h/d×365d/y≈3.1536×109m3/y。
因此,这个工厂每年排放的NOx质量为:Q = c×V×M= 0.2g/m3 × 3.1536×109m3/y × 46g/mol≈ 2.754×1011g/y约合275.4万吨/年。

氮的氧化物(NO x)和O2、H2O混合反应的计算方法1.关系式法(1)NO和O2的混合气体通入水中由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。
(2)NO2和O2的混合气体通入水中由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
(3)NO、NO2和O2三种混合气体通入水中先按3NO2+H2O===2HNO3+NO计算出生成NO的体积,再加上原来混合气体中NO体积,再按(1)计算。
2.电子守恒法NO x转化为硝酸时失去电子,如果是NO x与O2的混合气体,则反应中O2得到的电子数与NO x 失去的电子数相等。
4NO2+O2和4NO+3O2从组成上均相当于2N2O5,都与N2O5+H2O===2HNO3等效;当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
1.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)() A.2∶3 B.3∶2 C.1∶4 D.4∶1答案A解析二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以,剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:3NO 2+H 2O===2HNO 3+NO 气体体积减少3 1 2V 20 mL -12 mL =8 mL所以V =3×8 mL 2=12 mL ,即二氧化氮的体积为12 mL ,则原混合气体中一氧化氮的体积为20 mL -12 mL =8 mL ,则原混合气体中NO 和NO 2体积比为8 mL ∶12 mL =2∶3。
2.将盛有12 mL NO 2和O 2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL 无色气体,则原混合气体中O 2的体积和剩余的2 mL 气体分别是( )A .1.2 mL ,NOB .2.4 mL ,O 2C .3.5 mL ,O 2D .4 mL ,NO 答案 A解析 解题依据的化学方程式:4NO 2+O 2+2H 2O===4HNO 3;3NO 2+H 2O===2HNO 3+NO 。
滕文涵:
含氮量✖️耗煤量=氮元素质量
滕文涵:
二氧化氮排放量=耗煤量×含氮量/14×转化效率×46
滕文涵:
转化率一般按70%计算
缘梦:
收到
缘梦:
14和46代表什么
滕文涵:
氮氧化物排放量=1.63×耗煤量×(含氮量×转化率+0.000938)
滕文涵:
这个是环保局算排污费的公式,1.63怎么来的我也不知道
滕文涵:
14是氮的分子质量。
46是二氧化氮的分子质量
滕文涵:
第一种算法就是物料衡算
缘梦:
计量单位是什么
缘梦:
mg /m3吗
滕文涵:
耗煤量的单位是什么,氮氧化物的单位就是什么
滕文涵:
mg/m3是浓度单位
缘梦:
知道了,我这得恶补一下了
滕文涵:
指的是烟气含放氧化物的浓度,乘以烟气量,就是氮氧化物的排放总量
滕文涵:
你可以用去年平均的360mg/m3乘以去年总烟气量=去年排放的氮氧化物总量
滕文涵:
然后因为今年排放量减半,再把去年排放的氮氧化物总量除以二。
一氧化氮与氮氧化物计算公式
一氧化氮和氮氧化物是大气中的主要污染物之一,对人类健康和环境造成了严重危害。
为了控制和减少这些污染物的排放,需要准确地测量它们的排放浓度。
以下是一氧化氮和氮氧化物的计算公式:一氧化氮(NO)浓度计算公式:
NO = (V × P × 10^6) ÷ (T × R)
其中,NO为一氧化氮的浓度(单位为ppm),V为样品容积(单位为升),P为样品压力(单位为帕斯卡),T为样品温度(单位为开尔文),R为气体常数(值为8.314 J/(mol·K))。
氮氧化物(NOx)浓度计算公式:
NOx = NO + NO2
其中,NOx为氮氧化物的浓度(单位为ppm),NO和NO2分别为一氧化氮和二氧化氮的浓度(单位均为ppm)。
以上公式可用于工业、交通、能源等领域中的一氧化氮和氮氧化物浓度的计算。
在实际测量中需要注意测量条件的准确控制,以保证结果的可靠性和精度。
- 1 -。
关于氮的氧化物的计算NO2、NO、O2混合气体与水反应的有关计算,通常有两种解题技巧:1.关系式法。
计算时经常用到的四个重要化学方程式:3NO2+H2O==2HNO3+NO ①2NO+O2==2NO2②将化学方程式①、②叠加得:4NO2+O2+2H2O==4HNO3③4NO+3O2+2H2O==4HNO3④利用化学方程式③解答NO2、O2混合气体溶于水的计算有三种类型:(1)当V NO2∶V O2=4∶1,完全反应,无气体剩余。
(2)当V NO2∶V O2<4∶1,O2过量,剩余O2。
(3)当V NO2∶V O2>4∶1,NO2过量,剩余NO。
利用化学方程式④解答NO、O2混合气体溶于水的计算也有三种类型:(1)当V NO∶V O2=4∶3时,完全反应,无气体剩余。
(2)当V NO∶V O2<4∶3时,O2过量,剩余O2。
(3)当V NO∶V O2>4∶3时,NO过量,剩余NO。
2.电子守恒法。
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,得电子的是O2,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。
例1将盛有N2和NO2混合气体25mL的量筒倒立于水槽里,过一段时间后,气体体积缩小到15mL,后不再变化(同温同压下),原混合气体中N2和NO2的体积比是 [ ]A.4∶1 B.2∶3C.1∶4 D.2∶1解析混合气体中的N2既不溶于水,也不与水反应,只有NO2溶于水:3NO2+H2O==2HNO3+NO △V3 1 3-1=2x 25-15=10答案为B。
例2在一定条件下,将充满NO2和O2的试管倒立于水槽中,充和O2体积比是 [ ]A.8∶1 B.7∶3C.7∶1 D.4∶1解析因题目未指明剩余的气体是什么,故可能是NO,也可能是O2,设原混合气体中NO2体积为x,O2体积为y,则剩余气体体积为整理得:x∶y=7∶1。
答案为B、C。
例3如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为 [ ]A.6mL B.12mLC.16mL D.18mL解析此类题可导出NO和O2混合气体溶于水的关系式:4NO+3O2+2H2O==4HNO3从上式可知:当V NO∶V O2=4∶3时,混合气体完全与水反应,无气体剩余,当V NO∶V O2≠4∶3时,可能O2剩余或NO剩余。