氮的循环
第一课时
联想•质疑
➢雷电交加时,空气中的氮气和有关的
含氮化合物发生了哪些化学反应? 产生了哪些物质?
➢这些化学反应和所产生的物质对于
人类的生产和生活有什么意义?
天上
自
然
界
中 氮
人间
循
环
N2 NH3
NO NO2 HNO3
地下
NH3 、NH4+、 NO3—
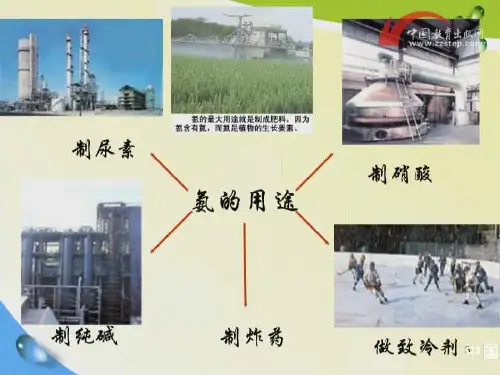
氮循环中重要物质
• (1)氮气 • 物理性质 :无色、无味的气体,难溶于水,
NO2气
2NO2→← N2O4
红棕色 无色
课堂小结
• 1 自然界中氮的循环是通过固氮方式;动,植 物转化;土壤和水体中微生物驱动形成氮的循 环过程. 2 氮分子内原子间共用三对电子使氮分子通 常情况下性质稳定.只有在放电条件下才能与 氧反应;氮和氢气要在高温高压,催化剂存在 下反应 ,且反应是可逆的 。
它能与氧反应生成C, A,C气体均溶于水, 90
80
其水溶液分别呈碱性和酸性.推断
70
60
A ,B ,C的化学式.
50 东部 40 西部
▪ A NH3
C Nபைடு நூலகம்2
30 北部 20 10
0 第一季度二第三季度四
• 4、一定条件下,将NO和O2 以体积比1:1混合,所得气体 的相对分子质量可能为:
• ( D)
2、一氧化氮和二氧化氮
NO是:
无色、难溶于水的 气体,在常温下 能与氧气反应生 成二氧化氮。
NO
NO2
2有NO毒+O2
2红N棕O色2 有毒
3NO2+H2O 2HNO3+NO
问题:1 将盛有氧气和二氧化氮混