fc受体研究进展(一):fc受体的结构与分类
- 格式:pdf
- 大小:1.17 MB
- 文档页数:15

sCD89分子的表面电荷分布不均匀,近膜的EC2结构域表面带有大量的正电荷,而远膜的ECl结构域表面正电荷极少,仅散布有少量负电荷,其中可能与IgA结合的区域以疏水性氨基酸残基侧链为主,几乎没有强烈的电荷存在,提示电荷相互作用在CD89和IgA的结合中不起主导作用。
利用分段表达的sCD89肽段,我们将中和抗体MIP8a在CD89上的结合位点限定在Ala74至Ser91之问。
点突变研究表明,Ar976、Tyr77和Gln78同时突变成Ala后,突变体丧失结合MIP8a的能力,但是任何一个单一位点的突变均不影响同MIP8a的结合;Ar982、His85突变为Gly和Glu后,也不再结合MIP8a。
sCD89的晶体结构疑示,Ar976.Gin78和Ar982一His85在CD89分子表面上相距较远,MIP8a不可能同时结合这两个区域。
推测Ar976一Gln78突变成Ala后,与Ala74、Gly75一起可能红:SDS微球上形成ct-helix结构,从而导致后面肽链构象的改变,失去结合MIP8a的能力。
MIP8a在CD89分子上的结合位点位于Ar982一His85附近。
CD89胞外区的结构证实了CD89与LIR和KIR等受体的相似性,保守的疏水性残基在LRC受体序列中的存在,提示结构域间疏水核心和肘型结构可能是多数LRC受体的共同特点。
关键词:免疫球蛋白IgACD89Fc受体疫球蛋白样受体白细胞免疫球蛋白样受体晶体结构点突变Sf9杀伤细胞免白细胞受体复合物111ABSTRACTFcⅡRI(alsocalledCD89)istheFcreceptorforImmunoglobuhnA(IgA).ItconnectsIgAandeffectorcellsthataremainlyfromthemyeloidlineageincludingneuffo口hils.eosinophils,monocytes/macrophages,etc.WhenclusteredbyIgAimmunecomplexes,CD89Calltriggerabroadrangeofimmuneresponsesincludingphagocytosis,antigenpresentation,ADCC,superoxidegenerationandreleaseofvariouscytokinesandinflammatorymediators.Structurally.CD89isatypeIglycoproteincontainingtwoextracellularIg—likedomainsandashoftcytoplasmictail.AlthoughCD89iSanFcreceptor.itssequenceiSleSShomologytoOtherFcreceptors.Inaddition.ithasdifferentchromosomelocation,ligandbindingandsignaltransductionpathways,indicatingthatCD89iSadistinctFcreceptor.InordertounderstandinteractionsofCD89withIgA.wetriedtoresolvecrystalstructureofCD89.Therefore.cDNAofmeextracellularpartofCD89(sCD89)wassubclonedintovariousvectorsandexpressedinbacteriaandinsectcells.InEcoli.sCD89withorwithoutexpressiontagssuchasGST·tag,His6-tagandpelBleaderpeptideformedinclusionbodies.Ininsectcells.sCD89cDNAwasclonedinthereformedtransfervectorofDAcHLT—Natandexpressedinsolubleform.WestemblottingshowedsCD89expressedininsectcellshadsimilarmolecularweightwiththatexpressedinbacteria.TWOconsecutiveAGAcodonscorrespondingtoAr950andAr95lofthematureCD89peptidewerefoundtobeharmfultotheexpressionofCD89inEcoli.SynonymousmutationsofAGAtoCGCorCGTsignificantlyincreasedexpressionofsCD89inEcoli.Ar西ninesalt.ureaandGuHClwereusedasreversibledetergentsforsCD89refolding.TherefoldingofsCD89peptidewasachievedinrenaturedbu髓rcontaining2.40一2.70MureaMGuHClbutfailedin0.5Margininesolution.TherenaturedsCD89couldor1.8recognizenativeIgA,indicatingitrecovereditsbiolclgicalfunctions.Inaddition,sCD89couldberecognizedbyasetofanti—nativeCD89antibodies,indicatingitheldarightconfonnafionasnativeCD89.RefoldedsCD89anditsselenomethioninederivativeweresuccessfullycrystallized.ThecrystalstructureofsCD89wassolvedbvmultiwavelengthanomalOUSdiffractionusingselenomethioninederivative.TheoverallstructureofsCD89takesacharacteristicshapeofelboworheartwithanangleof85。

重组人血小板生成素拟肽-fc融合蛋白-概述说明以及解释1.引言1.1 概述概述部分主要介绍本文的研究主题以及研究背景。
本文旨在探讨重组人血小板生成素拟肽-fc融合蛋白的相关研究进展。
血小板生成素是一种重要的生物活性因子,对于血小板的产生和成熟起着关键作用。
然而,由于其天然来源有限且存在一定的局限性,研究人员开始利用生物技术手段进行重组血小板生成素的合成和改造,以满足临床需求。
近年来,拟肽-fc融合蛋白作为一种新型药物设计策略备受关注。
拟肽是一种具有生物活性的多肽序列,而Fc区域则是免疫球蛋白的结构域,可以增强融合蛋白的稳定性和药效。
将重组人血小板生成素与Fc区域融合,可以进一步提高其在体内的半衰期和药效,从而更好地发挥其临床应用的潜力。
本文将从背景介绍开始,系统地介绍重组人血小板生成素和拟肽-fc 融合蛋白的研究进展。
重点讨论重组人血小板生成素拟肽-fc融合蛋白在临床治疗上的应用前景,并对其未来的研究方向进行展望。
总之,本文将通过对重组人血小板生成素拟肽-fc融合蛋白的深入研究,为临床医学领域的治疗策略提供新的思路和方向。
通过对该领域的理论和实践研究进行梳理和总结,旨在促进相关领域的发展和应用。
1.2 文章结构本文主要以“重组人血小板生成素拟肽-fc融合蛋白”为题,旨在对该融合蛋白的研究进行全面的介绍和归纳。
为了达到这一目的,本文将分为引言、正文和结论三个部分。
在引言部分,我们将首先对整篇文章进行概述,简要介绍重组人血小板生成素拟肽-fc融合蛋白的相关背景和研究现状。
接着,我们将详细说明本文的文章结构,以便读者能够清晰地了解每个章节的内容。
最后,我们将明确本文的目的,即通过综合分析和总结已有的研究成果,提供对重组人血小板生成素拟肽-fc融合蛋白研究的新的视角和思考。
在正文部分,我们将依次展开讲述背景介绍、重组人血小板生成素、拟肽-fc融合蛋白以及重组人血小板生成素拟肽-fc融合蛋白的研究进展。
在背景介绍中,我们将介绍与本课题相关的基本概念和研究背景,以便读者对该课题有一个全面的了解。

FC结构域1. 什么是FC结构域?FC结构域(Fibronectin type III domain)是一种常见的结构域,存在于许多蛋白质中。
它是由约90个氨基酸残基组成的结构域,具有β折叠结构。
FC结构域通常以模块的形式出现,可以单独存在,也可以与其他结构域组合形成多域蛋白质。
2. FC结构域的结构特点FC结构域的主要结构特点包括以下几个方面:•β折叠结构:FC结构域主要由平行的β链构成,这些β链通过疏水相互作用相互连接。
这种平行的β折叠结构使得FC结构域具有较高的稳定性和刚性。
•β折叠拓扑:FC结构域通常由2-3个β折叠拓扑单元组成,每个拓扑单元包含3-4个β链。
这种拓扑结构使得FC结构域具有一定的柔性和可变性,可以适应不同的结合伙伴。
•保守序列:FC结构域的氨基酸序列在不同蛋白质中具有一定的保守性,特别是在结构域的核心区域。
这些保守的氨基酸残基对于维持FC结构域的稳定性和功能至关重要。
3. FC结构域的功能和作用FC结构域在许多生物过程中发挥重要的功能和作用,包括以下几个方面:•细胞外基质组装:FC结构域可以通过与其他蛋白质结合,参与细胞外基质的组装和排列。
例如,FC结构域可以与胶原蛋白结合,促进胶原蛋白的聚集和纤维形成。
•细胞黏附和迁移:FC结构域可以与细胞表面受体结合,介导细胞与细胞外基质之间的黏附和迁移。
这种黏附和迁移过程对于细胞的正常生理功能和发育过程至关重要。
•信号转导:FC结构域可以作为信号转导的平台,通过与其他蛋白质结合,参与细胞内信号传递的调控。
例如,FC结构域可以与酪氨酸激酶受体结合,激活下游信号通路。
•蛋白质识别和结合:FC结构域可以通过与其他蛋白质结合,参与蛋白质的识别和结合。
这种结合过程对于蛋白质的功能调控和相互作用至关重要。
4. FC结构域在疾病中的作用FC结构域在许多疾病的发生和发展中起着重要的作用,包括以下几个方面:•癌症:FC结构域在癌症的侵袭和转移过程中发挥重要作用。



Fc受体——免疫调节物目录1 概述2 FcRs家族3 活化性或抑制性FcR信号通路4 活化性和抑制性FcRs在先天免疫效应细胞中的作用5 总结与展望摘要Fc受体与Fc段结合建立了一个纽带,可以将特定性适应性免疫系统与先天性免疫效应细胞触发产生效应相连。
多种不同的活化性或抑制性FcRs在同一细胞上共表达,建立了一个ICs激活免疫反应的“门槛”。
另外,FcRs也参与到免疫应答的传出相当中,它对于调节B细胞和DCs的激活作用至关重要,缺失抑制性FcR会导致人类缺乏免疫耐受,产生自身免疫性疾病。
DCs上的FcRs摄取ICs,然后激活或抑制信号通路,将决定T细胞响应的作用强度。
一旦激活和抑制的平衡被打破,将会导致组织损伤和自身免疫病的产生。
本章主要探讨了先天性、适应性免疫系统的不同免疫细胞的多种活化性和抑制性受体是如何共表达的,以及能够影响这一平衡的外因,例如环境因子和不同抗原糖基化的作用等。
1 概述与不同的免疫球蛋白(IgA、IgE、IgM和IgG)结合的受体统称为FcRs,它参与调节和执行抗体介导的免疫反应。
一般来说,FcRs连接特定的适应性免疫系统和先天性免疫细胞(肥大细胞、中性粒细胞、单核细胞和巨噬细胞)触发的效应区。
更为重要的是,这些促炎反应和调节机体免于组织损伤有密切关系。
如果调控不当,过度反应或者更为严重的自身免疫病都将产生。
因此,弄清这些成分有助于进一步研究这些疾病,也有助于开展新的治疗方法来干预慢性炎症。
本章重点关注结合IgG的FcRs的作用。
另外,也总结了一些外在的因素,比如促炎/抑炎细胞因子和不同抗体糖基化作用等,这些作用通过改变与FcRs的相互作用或表达水平来影响细胞的应答。
2 FcRs家族啮齿动物的FcRs有四种,分别为FcγRI、FcγR IIB、FcγRIII和FcγRIV。
FcγRs很保守,相应的人类蛋白为FcγRIA、FcγRIIB(CD32B)、FcγRIIA(CD32A) 、FcγRIIC、FcγRIIIA(CD16)和FcγRIIIB。

CHAPTER 5 Fc受体——免疫调节物目录1 概述2 FcRs家族3 活化性或抑制性FcR信号通路4 活化性和抑制性FcRs在先天免疫效应细胞中的作用5 总结与展望摘要Fc受体与Fc段结合建立了一个纽带,可以将特定性适应性免疫系统与先天性免疫效应细胞触发产生效应相连。
多种不同的活化性或抑制性FcRs在同一细胞上共表达,建立了一个ICs激活免疫反应的“门槛”。
另外,FcRs也参与到免疫应答的传出相当中,它对于调节B细胞和DCs的激活作用至关重要,缺失抑制性FcR会导致人类缺乏免疫耐受,产生自身免疫性疾病。
DCs上的FcRs摄取ICs,然后激活或抑制信号通路,将决定T细胞响应的作用强度。
一旦激活和抑制的平衡被打破,将会导致组织损伤和自身免疫病的产生。
本章主要探讨了先天性、适应性免疫系统的不同免疫细胞的多种活化性和抑制性受体是如何共表达的,以及能够影响这一平衡的外因,例如环境因子和不同抗原糖基化的作用等。
1 概述与不同的免疫球蛋白(IgA、IgE、IgM和IgG)结合的受体统称为FcRs,它参与调节和执行抗体介导的免疫反应。
一般来说,FcRs连接特定的适应性免疫系统和先天性免疫细胞(肥大细胞、中性粒细胞、单核细胞和巨噬细胞)触发的效应区。
更为重要的是,这些促炎反应和调节机体免于组织损伤有密切关系。
如果调控不当,过度反应或者更为严重的自身免疫病都将产生。
因此,弄清这些成分有助于进一步研究这些疾病,也有助于开展新的治疗方法来干预慢性炎症。
本章重点关注结合IgG的FcRs的作用。
另外,也总结了一些外在的因素,比如促炎/抑炎细胞因子和不同抗体糖基化作用等,这些作用通过改变与FcRs的相互作用或表达水平来影响细胞的应答。
2 FcRs家族啮齿动物的FcRs有四种,分别为FcγRI、FcγR IIB、FcγRIII和FcγRIV。
FcγRs很保守,相应的人类蛋白为FcγRIA、FcγRIIB(CD32B)、FcγRIIA(CD32A) 、FcγRIIC、FcγRIIIA(CD16)和FcγRIIIB。

新生儿Fc受体的研究进展
陈丽颖;王艳玲;杨国宇;胡广超
【期刊名称】《河南农业大学学报》
【年(卷),期】2007(041)004
【摘要】新生儿Fc受体(FcRn)是负责上皮细胞主动转运免疫球蛋白IgG的受体.IgG是初乳中含量最丰富的免疫球蛋白成分,哺乳动物新生儿的免疫力主要依赖于从母体获得IgG,而母源IgG向乳汁中的分泌以及被新生儿摄取均需要穿越上皮屏障,这一过程就是FcRn的胞转作用.本文对FcRn的特性、转运机制及其研究进展进行综述.
【总页数】6页(P469-474)
【作者】陈丽颖;王艳玲;杨国宇;胡广超
【作者单位】河南农业大学牧医工程学院,河南,郑州,450002;河南农业大学牧医工程学院,河南,郑州,450002;河南农业大学牧医工程学院,河南,郑州,450002;河南农业大学牧医工程学院,河南,郑州,450002
【正文语种】中文
【中图分类】S852.4
【相关文献】
1.新生儿Fc受体研究进展 [J], 张春林;王加启;卜登攀;魏宏阳;杨永新;董晓丽;刘光磊;周凌云;赵国琦
2.Fc受体研究进展(一):Fc受体的结构与分类 [J], 张新;项树林
3.Fc受体的研究进展(三)——Fc受体的功能与疾病 [J], 张新;项树林
4.新生儿Fc受体基础研究和临床应用进展 [J], 胡茫莎;韦树丽;周武源;王苹莉
5.早产和足月新生儿成熟中性粒细胞表面CD64(Fcγ受体Ⅰ)表达水平的研究 [J], Fjaertoft G.;Hkansson L.;Foucard T.;张振
因版权原因,仅展示原文概要,查看原文内容请购买。

免疫球蛋白G的Fc段受体ⅡB在自身免疫病中的研究进展朱准聂英坤在人类和小鼠中,免疫球蛋白(Ig)G的Fc段受体ⅡB (FcγRⅡB)广泛表达于髓系的大部分细胞,是IgG恒定部分中较低亲和力的FcR,并且它是唯一起抑制作用的FcγR。
FcγRⅡB是FcγR家族中唯一表达于B细胞上的成员,抗原同时结合FcγRⅡB和B细胞受体(BCR)来启动不同途径抑制细胞的增殖、成熟和细胞因子的产生[1]。
FcγRⅡB的表达减少可导致B细胞和浆细胞的活化与增殖,增加T细胞依赖性抗原抗体的产生,并通过免疫复合物增加巨噬细胞活化。
同时有研究者发现,患有自身免疫病小鼠的FcγRⅡB基因的启动子区域具有多态性,这一特点可引起巨噬细胞表面FcγRⅡB表达降低并激活B细胞。
然而人类功能性FcγRⅡB表达低下与一些自身免疫病的发病有关,如SLE、RA等。
现将对FcγRⅡB在自身免疫病中的最新研究进展介绍如下。
1FcγRⅡB的生物学功能FcγRⅡB有2个主要亚型,分别为:FcγRⅡB1和FcγR ⅡB2,这2种亚型的主要区别是调节内吞作用的能力和在免疫细胞上分布的不同[2]。
FcγRⅡB1主要分布于B细胞,而FcγRⅡB2主要分布于髓系细胞。
到目前为止发现,FcγRⅡB 是FcγR家族中表达最广泛的,除了NK细胞和T细胞,它几乎表达于所有白细胞。
由于FcγRⅡB具有广泛表达的特性,因此FcγRⅡB基因缺失将导致复杂的表型改变,进而不仅调节适应性免疫应答,而且也通过在肥大细胞、粒细胞和巨噬细胞上的作用来调节固有免疫应答。
FcγR的经典功能是通过触发与IgG结合的免疫应答细胞内的信号而调节多种炎症过程。
而FcγRⅡB的主要功能是传递抑制信号,通过胞质区域的免疫受体酪氨酸抑制基序(ITIM)来完成。
另外FcγRⅡB也可通过结合受体的特定IgG亚类而引起负调节的不同变化。
同时已有学者研究发现FcγRⅡB在外周免疫耐受中具有重要的作用,FcγRⅡB缺陷可促进自身免疫病的发生,如SLE、RA。


三、免疫球蛋白Fc段受体Ig根据其重链抗原性的差异分为IgM、IgG、IgA、IgD和IgE五类。
各类Ig的不同功能主要与其结构有关。
机体内许多细胞表面具有不同类Ig Fc的受体,通过Fc受体与Ig Fc的结合,参与Ig介导的生理功能或病理损伤过程。
目前已鉴定明确属于CD抗原的Fc受体有FcγR、FcαR和FcεR。
(一) FcγR(CD64、CD32、1. FcγR的结构和分布 FcγR可分为FcγRⅠ、FcγRⅡ和FcγRⅢ三类,它们的结构和分布有所不同。
(1) FcγRⅠ(CD64):70kDa穿膜糖蛋白,属Ig超家族成员,胞膜外区有3个C2结构,基因染色体定位于1q23~24。
识别CD64的代表性McAb有McAb22、McAb32.2、197和10.1等。
FcγRⅠ是高亲合力受体,Kd10-8~10-9M,主要与人的单体IgG1、IgG3以及小鼠IgG2a和IgG3结合。
与人IgG4结合的亲合力明显降低,与IgG2则无结合能力。
FcγRⅠ主要分布于单核细胞、巨噬细胞、中性粒细胞等,但表达水平各不相同。
FcγRⅠ位点数:15000~40000/每个单核细胞,>50000/巨噬细胞,<1000/新鲜中性粒细胞。
IFN-γ可刺激单核细胞、巨噬细胞和中性粒细胞表达FγRⅠ水平增加5~10倍,G-CSF也有这种促进作用。
(2) FcγRⅡ(CD32):40kDa穿膜糖蛋白,属于Ig超家族成员,胞膜外区有2个C2结构,基因染色体定位于1q23~24。
识别CD32的代表性McAb有CIkM5、IV·3、KuFc79和41H16等。
FcγRⅡ与单体人IgG1,IgG3、IgG4结合为低亲合力,Kd5×10-7M。
FcγRⅡ 表达于除红细胞外的其它血细胞,分子数目:20000~40000/每个细胞。
根据DNA序列和功能不同,FcγRⅡ 可分为三种形式,不同形式FcγRⅡ的差别主要在于胞浆区的结构不同。
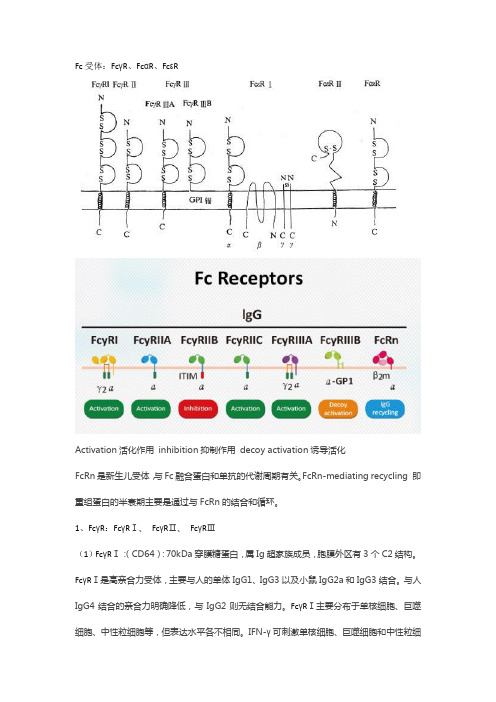
Fc受体:FcγR、FcαR、FcεRActivation活化作用inhibition抑制作用decoy activation诱导活化FcRn是新生儿受体,与Fc融合蛋白和单抗的代谢周期有关。
FcRn-mediating recycling 即重组蛋白的半衰期主要是通过与FcRn的结合和循环。
1、FcγR:FcγRⅠ、FcγRⅡ、FcγRⅢ(1)FcγRⅠ:(CD64):70kDa穿膜糖蛋白,属Ig超家族成员,胞膜外区有3个C2结构。
FcγRⅠ是高亲合力受体,主要与人的单体IgG1、IgG3以及小鼠IgG2a和IgG3结合。
与人IgG4结合的亲合力明确降低,与IgG2则无结合能力。
FcγRⅠ主要分布于单核细胞、巨噬细胞、中性粒细胞等,但表达水平各不相同。
IFN-γ可刺激单核细胞、巨噬细胞和中性粒细胞表达FcγRⅠ水平增加5~10倍,G-CSF也有这种促进作用。
(2)FcγRⅡ(CD32):40kDa穿膜糖蛋白,属于Ig超家族成员,胞膜外区有2个C2结构。
FcγRⅡ与单体人IgG1,IgG3、IgG4结合为低亲合力。
FcγRⅡ表达于除红细胞外的其它血细胞,根据DNA序列和功能不同,FcγRⅡ可分为三种(A、B、C)形式,不同形式FcγRⅡ的差别主要在于胞浆区的结构不同。
(3)FcγRⅢ(CD16):50~70kDa糖蛋白,属Ig超家族成员,有2个C2结构。
FcγRⅢ结合人IgG、IgG3,为低亲和力受体。
FcγRⅢ有FcγRⅢA和FcγRⅢB两种异型:①FcγRⅢA,穿膜结构,主要分布于巨噬细胞、NK细胞和嗜酸性粒细胞,巨噬细胞表达高水平FcγRⅢA,而单核细胞表达水平较低②FcγRⅢB,通过GPI“锚”在中性粒细胞表面,每个人中性粒细胞表达10万~20万血液中可溶性的FcγRⅢ主要来自这种形式,中性粒细胞激活剂短时间处理后可明显降低FcγRⅢB 的表达水平,可能与通过激活内源性蛋白酶切除GPI连接分子有关。

Ig根据其重链抗原性的差异分为IgM、IgG、IgA、IgD和IgE五类,各类Ig的不同功能主要与其结构有关。
机体内许多细胞表面具有不同类Ig Fc的受体,通过Fc受体与Ig Fc的结合,参与Ig介导的生理功能或病理损伤过程。
目前已鉴定明确属于CD抗原的Fc受体有Fc γR、FcαR、FcεR。
(一)FcγR(CD64、CD32、CD16)1.FcγR的结构和分布FcγR可分为FcγRⅠ、FcγRⅡ和FcγRⅢ三类,它们的结构和分布有所不同。
(1)FcγRⅠ(CD64):70kDa穿膜糖蛋白,属Ig超家族成员,胞膜外区有3个C2结构,基因染色体定位于1q23~24。
识别CD64的代表性McAb有McAb22、McAb32.2、197和10.1等FcγRⅠ是高亲合力受体,Kd值为10-8~10-9M,主要与人的单体IgG1、IgG3以及小鼠IgG2a和IgG3结合。
与人IgG4结合的亲合力明确降低,与IgG2则无结合能力。
FcγRⅠ主要分布于单核细胞、巨噬细胞、中性粒细胞等,但表达水平各不相同。
FcγRⅠ位点数:15000~40000/每个单核细胞,>50000/巨噬细胞,<1000/新鲜中性粒细胞。
IFN-γ可刺激单核细胞、巨噬细胞和中性粒细胞表达FcγRⅠ水平增加5~10倍,G-CSF也有这种促进作用。
(2)FcγRⅡ(CD32):40kDa穿膜糖蛋白,属于Ig超家族成员,胞膜外区有2个C2结构,基因染色体定位于1q23~24。
识别CD32的代表性McAb有CIkM5、IV·3、KuFc79和41H16等。
FcγRⅡ与单体人IgG1,IgG3、IgG4结合为低亲合力,Kd5×10-7M。
FcγR Ⅱ表达于除红细胞外的其它血细胞,分子数目:20000~40000/每个细胞。
根据DNA序列和功能不同,FcγRⅡ可分为三种形式,不同形式FcγRⅡ的差别主要在于胞浆区的结构不同。


fc受体阻断剂原理(一)FC受体阻断剂FC受体是免疫系统中的一种重要受体,它能够识别抗体Fc段,从而介导免疫系统的清除作用。
但是在某些疾病情况下,FC受体的过度活化会导致疾病的发展和进展,所以通过FC受体阻断剂来调节其活性,已经被广泛应用到许多临床治疗中。
FC受体的基本原理FC受体是一种与抗体Fc段相互作用的膜表面受体,它存在于各种免疫细胞表面上,包括单核细胞、粒细胞、巨噬细胞等。
在抗体结合到病原体表面以后,FC受体可以通过与抗体Fc段结合,诱导细胞内信号传递,从而介导细胞吞噬和抗体依赖性细胞毒性等清除作用。
FC受体的作用机制通过诱导细胞内信号传递,FC受体可以介导细胞的免疫应答,包括炎症反应、巨噬细胞吞噬和抗体依赖性细胞毒性等。
但是在某些疾病情况下,FC受体的过度活化会导致自身免疫性疾病和炎症反应的发生和进展。
例如,风湿性关节炎、溃疡性结肠炎和肝炎等疾病都与FC 受体的过度活化有关。
FC受体阻断剂的作用FC受体阻断剂是一种介入性疗法,它可以通过阻断FC受体的结合,从而调节FC受体的活性。
在临床中,FC受体阻断剂已经被广泛应用于各种自身免疫性疾病和炎症反应的治疗中,包括风湿性关节炎和溃疡性结肠炎等。
例如,抗CD20的单克隆抗体Rituximab就是一种常用的FC受体阻断剂,它可以通过诱导FC受体的去除来治疗自身免疫性疾病。
FC受体阻断剂的副作用虽然FC受体阻断剂在治疗某些疾病中具有显著的疗效,但是其也可能出现一些副作用,例如药物过敏、感染和免疫缺陷等。
因此,在使用FC受体阻断剂的同时应该注意到可能发生的安全问题,并且需要根据患者的具体情况进行剂量和用药方式的调整。
总结FC受体阻断剂是一种介入性治疗,它可以通过阻断FC受体的结合,调节FC受体的活性,并在临床中广泛应用于各种自身免疫性疾病和炎症反应的治疗中。
但是在使用FC受体阻断剂时,我们也需要注意到其可能的安全问题和副作用,并尽可能的选择适合患者的剂量和用药方式。

Ig根据其重链抗原性的差异分为IgM、IgG、IgA、IgD和IgE五类,各类Ig的不同功能主要与其结构有关。
机体内许多细胞表面具有不同类Ig Fc的受体,通过Fc受体与Ig Fc的结合,参与Ig介导的生理功能或病理损伤过程。
目前已鉴定明确属于CD抗原的Fc受体有FcγR、FcαR、FcεR。
(一)FcγR(CD64、CD32、CD16)1.FcγR的结构和分布FcγR可分为FcγRⅠ、FcγRⅡ和FcγRⅢ三类,它们的结构和分布有所不同。
(1)FcγRⅠ(CD64):70kDa穿膜糖蛋白,属Ig超家族成员,胞膜外区有3个C2结构,基因染色体定位于1q23~24。
识别CD64的代表性McAb有McAb22、McAb32.2、197和10.1等FcγRⅠ是高亲合力受体,Kd值为10-8~10-9M,主要与人的单体IgG1、IgG3以及小鼠IgG2a和IgG3结合。
与人IgG4结合的亲合力明确降低,与IgG2则无结合能力。
FcγR Ⅰ主要分布于单核细胞、巨噬细胞、中性粒细胞等,但表达水平各不相同。
FcγRⅠ位点数:15000~40000/每个单核细胞,>50000/巨噬细胞,<1000/新鲜中性粒细胞。
IFN-γ可刺激单核细胞、巨噬细胞和中性粒细胞表达FcγRⅠ水平增加5~10倍,G-CSF也有这种促进作用。
(2)FcγRⅡ(CD32):40kDa穿膜糖蛋白,属于Ig超家族成员,胞膜外区有2个C2结构,基因染色体定位于1q23~24。
识别CD32的代表性McAb有CIkM5、IV·3、KuFc79和41H16等。
FcγRⅡ与单体人IgG1,IgG3、IgG4结合为低亲合力,Kd5×10-7M。
FcγRⅡ表达于除红细胞外的其它血细胞,分子数目:20000~40000/每个细胞。
根据DNA序列和功能不同,FcγRⅡ可分为三种形式,不同形式FcγRⅡ的差别主要在于胞浆区的结构不同。

Fc融合蛋白应用前沿Fc 融合蛋白是指利用基因工程等技术将某种具有生物活性的功能蛋白分子与 Fc 片段融合而产生的新型重组蛋白,其不仅保留了功能蛋白分子的生物学活性,还具有一些抗体的性质,如通过结合相关 Fc 受体延长半衰期和引发抗体依赖细胞介导的细胞毒性效应等。
抗体类药物是当前药物研发的重点和热点,通常能较快获得上市许可,并带来较大的商业成功。
进入21 世纪以来,美国FDA 和欧洲药物管理局(European Medicines Agency,EMA)总共批准了约20 种抗体类药物。
借助传统抗体的成功平台,一种基于抗体结构,将蛋白或多肽与免疫球蛋白 Fc 片段相融合的新功能重组蛋白也获得了一定的发展。
Fc融合蛋白是指利用基因工程等技术将某种具有生物学活性的功能蛋白分子与Fc 片段融合而产生的新型蛋白,功能蛋白可以是能结合内源性受体(或配体)的可溶性配体(或受体)分子或其他需要延长半衰期的活性物质(如细胞因子)。
该类融合蛋白不仅保留了功能蛋白分子的生物学活性,并且还具有一些抗体的性质,如长效半衰期。
例如,普通重组 IL-2 体内半衰期仅为 6.9 min,而重组 IL-2/Fc 融合蛋白体内循环半衰期则延长了近700倍。
1 Fc 融合蛋白的类别根据是否需要发挥 Fc 段结合FcγR 来介导抗体依赖细胞介导的细胞毒性(antibody-dependentcell-mediated cytotoxicity,ADCC)或结合补体C1q 来介导补体依赖的细胞毒性(complement-dependent cytotoxicity, CDC)等的生物学活性,可将 Fc 融合蛋白分为溶细胞性(cyto-lytic)和非溶细胞性(non-lytic)。
前者由功能性蛋白与天然或活性提高的 Fc 片段融合而成,不仅具有功能蛋白的生物学活性和长效血浆半衰期,并且保留了 Fc 段介导 ADCC 及 CDC 效应的能力,可以靶向杀伤功能蛋白受体阳性细胞。