药品GMP指南2010版附录2_原料药-药品GMP实施指南
- 格式:pdf
- 大小:762.58 KB
- 文档页数:42

附录2:原料药电子版由全球最大的制备色谱溶剂生产商|宿松龙华友情提供第一章范围第一条本附录适用于非无菌原料药生产及无菌原料药生产中非无菌生产工序的操作。
第二条原料药的生产起始点必须符合注册批准要求。
第二章厂房与设施第三条非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应按照无菌药品附录中D级标准设置。
第四条质量标准中有热原或细菌内毒素等检验项目的,厂房的设计应特别注意防止微生物污染,根据预定用途、工艺要求等采取相应的控制措施。
第五条质控实验室区域通常应与生产区分开。
当生产操作对检验结果的准确性无不利影响,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
第三章设备第六条设备所需的润滑剂、加热或冷却介质等,应避免与中间产品或原料药直接接触,以免影响中间产品或原料药的质量。
当任何偏离上述要求的情况发生时,应进行评估,以确保对产品的质量和用途无不良影响。
第七条生产宜使用密闭设备;密闭设备、管道可以安置于室外。
使用敞口设备或打开设备操作时,应有避免污染的措施。
第八条使用同一设备生产多种中间体或原料药品种的,应说明设备可以共用的合理性,并有防止交叉污染的措施。
第九条难以清洁的设备或部件应专用。
第十条设备的清洁1.同一设备连续生产同一原料药或阶段性生产连续数个批次时,宜间隔适当的时间定期对设备进行清洁,以防止污染物(如降解产物或达到有害程度的微生物)的出现和遗留。
如有影响原料药质量的残留物,更换批次时,必须对设备进行彻底的清洁。
2.非专用设备更换品种生产前,必须对设备(特别是从粗品精制开始的非专用设备)进行彻底的清洁,以防止交叉污染。
3.对残留物的可接受标准、清洁规程和清洁剂的选择,应有明确规定并说明理由。
第十一条非无菌原料药精制工艺用水应至少符合纯化水的质量标准。
第四章验证第十二条关键的质量属性和工艺参数通常应在研发阶段或根据历史的资料和数据确定,应规定关键工艺参数的必要范围,以确保工艺操作的重现性,包括:1.确定产品的关键质量属性;2.确定影响产品关键质量属性的关键工艺参数;3.确定常规生产和工艺控制中的关键工艺参数范围。

实验室控制系统GMP实施指南1前言作为质量管理体系的一部分,质量控制实验室管理是确保所生产的药品适用于预定的用途,符合药品标准和规定的要求的重要因素之一。
为了帮助制药企业中的实验室更好地满足GMP的要求,本指南主要参照国内外相关法规和标准及指南对于实验室管理的阐述和要求,描述一个全面的实验室管理体系,以起到一定的指导作用。
本指南的内容不具有法律约束性,超出现行GMP规定的内容是建议性和参考性的,而非强制性要求,可以有选择地使用。
企业在运用本指南过程中,涉及到剂型特点或相关公用系统的内容时,还应参考其它配套指南(见下表),并结合本企业的实际情况和现行法规要求开展相关工作。
水平有限,不足之处,恳请指正。
建立、实施并维护一个有效的实验室管理体系能够有效支持企业整体质量管理体系的有效实施,持续稳定地生产出符合满足顾客、法律法规等方面所提出的质量要求如有效性、可靠性、安全性的产品,从而实现公众和个人的共同目标,即:为患者提供高质量的药品,具体表现在以下方面:及时放行合格的生产物料用于药品的制造,为生产出合格的药品提供必备的前提条件。
有效的药品生产过程中间控制保证了各个阶段生产产物的正确性和质量符合性,准确的终产品的检验数据为产品最终放行提供了重要的质量依据。
有效的稳定性数据和趋势分析指导企业确定药品正确的有效期、包装材料、运输/贮存条件等,并确保在市产品处于有效的质量保证状态。
通过实验室各个方面的有效管理,使质量系统始终处于受控状态,例,通过试验数据证明对工艺运行和产品质量的有效监控,为工艺能力及其稳定性提供保障。
本指南所描述的实验室管理是为了帮助企业的实验室更好地符合GMP的要求,推动整个企业有效地实施质量管理体系,达到长远发展的目的。
企业可以根据自身的规模、工艺复杂程度和有限的资源等特定的条件,在符合法规的要求下,量身制定相应的实验室管理体系。
质量是指为符合预定用途所具有的一系列固有特性的程度。
依此,药品质量是指,为了满足药品的安全性和有效性的要求,产品所具有的成分、含量、纯度等物理、化学或生物学等特性的程度。

药品GMP检查指南(通则)-药品GMP指南2010版前言2010年,国家药品监督管理局发布了《药品生产质量管理规范》(GMP),并将其列为强制性执行的标准。
该规范的目的是确保药品的质量、安全和有效性。
GMP规范覆盖了药品生产的全部过程,包括原料采购、生产、检验、包装、存储和运输等方面。
为确保GMP规范的有效实施,国家药监局还对药品生产企业进行了GMP认证和检查。
本文主要介绍GMP检查的通则,希望能帮助读者更好地了解GMP规范和GMP检查。
GMP检查的目的和原则目的GMP检查的目的是确保药品生产企业的生产质量和管理符合国家药品监管要求。
GMP检查需要检查企业是否满足以下要求:1.、安全和有效性符合法律、法规和标准的要求;2.,确保生产质量的稳定性和一致性; 3.。
原则GMP检查的实施原则如下:1.、公平、客观原则;2.,法规,标准为依据;3.;4.。
GMP检查的程序GMP检查的程序包括以下步骤:1.;2.;3.;4.;5.;6.;7.;8.。
GMP检查的内容GMP检查的内容主要包括以下几个方面:1. 生产设施检查生产设施检查主要包括对企业的GMP生产车间、生产设备、清洁区、物料储存区等生产现场基础设施的检查,重点检查企业是否符合GMP生产要求,如是否有足够的空间、设备是否完好、清洁是否到位等。
2. 原辅材料检查原辅材料检查主要检查企业的原辅材料是否符合GMP规范的要求,如是否有合格的供应商、是否设置了检验和控制程序等。
3. 生产过程检查生产过程检查主要检查企业生产车间的生产流程是否符合GMP规范的要求,如是否制定了生产流程标准化和记录规范等。
4. 检验检测检查检验检测检查主要检查企业的检验检测方法和设备是否符合GMP规范的要求,如检验人员是否具备相应的专业技能,检测仪器是否经过校准等。
5. 管理制度检查管理制度检查主要检查企业的管理制度是否符合GMP规范的要求,如是否制定了质量保证体系、适当的标准操作规程等。
![[实用参考]2010版药品GMP《实验室控制系统GMP实施指南》](https://uimg.taocdn.com/7022358969dc5022abea0014.webp)
实验室控制系统GMP实施指南1前言作为质量管理体系的一部分,质量控制实验室管理是确保所生产的药品适用于预定的用途,符合药品标准和规定的要求的重要因素之一。
为了帮助制药企业中的实验室更好地满足GMP的要求,本指南主要参照国内外相关法规和标准及指南对于实验室管理的阐述和要求,描述一个全面的实验室管理体系,以起到一定的指导作用。
本指南的内容不具有法律约束性,超出现行GMP规定的内容是建议性和参考性的,而非强制性要求,可以有选择地使用。
企业在运用本指南过程中,涉及到剂型特点或相关公用系统的内容时,还应参考其它配套指南(见下表),并结合本企业的实际情况和现行法规要求开展相关工作。
表1-1指南逻辑关系图水平有限,不足之处,恳请指正。
2目的建立、实施并维护一个有效的实验室管理体系能够有效支持企业整体质量管理体系的有效实施,持续稳定地生产出符合满足顾客、法律法规等方面所提出的质量要求如有效性、可靠性、安全性的产品,从而实现公众和个人的共同目标,即:为患者提供高质量的药品,具体表现在以下方面:及时放行合格的生产物料用于药品的制造,为生产出合格的药品提供必备的前提条件。
有效的药品生产过程中间控制保证了各个阶段生产产物的正确性和质量符合性,准确的终产品的检验数据为产品最终放行提供了重要的质量依据。
有效的稳定性数据和趋势分析指导企业确定药品正确的有效期、包装材料、运输/贮存条件等,并确保在市产品处于有效的质量保证状态。
通过实验室各个方面的有效管理,使质量系统始终处于受控状态,例,通过试验数据证明对工艺运行和产品质量的有效监控,为工艺能力及其稳定性提供保障。
本指南所描述的实验室管理是为了帮助企业的实验室更好地符合GMP的要求,推动整个企业有效地实施质量管理体系,达到长远发展的目的。
企业可以根据自身的规模、工艺复杂程度和有限的资源等特定的条件,在符合法规的要求下,量身制定相应的实验室管理体系。
3范围质量是指为符合预定用途所具有的一系列固有特性的程度。
实验室控制系统GMP实施指南1前言作为质量管理体系的一部分,质量控制实验室管理是确保所生产的药品适用于预定的用途,符合药品标准和规定的要求的重要因素之一。
为了帮助制药企业中的实验室更好地满足GMP的要求,本指南主要参照国内外相关法规和标准及指南对于实验室管理的阐述和要求,描述一个全面的实验室管理体系,以起到一定的指导作用。
本指南的内容不具有法律约束性,超出现行GMP规定的内容是建议性和参考性的,而非强制性要求,可以有选择地使用。
企业在运用本指南过程中,涉及到剂型特点或相关公用系统的内容时,还应参考其它配套指南(见下表),并结合本企业的实际情况和现行法规要求开展相关工作。
水平有限,不足之处,恳请指正。
建立、实施并维护一个有效的实验室管理体系能够有效支持企业整体质量管理体系的有效实施,持续稳定地生产出符合满足顾客、法律法规等方面所提出的质量要求如有效性、可靠性、安全性的产品,从而实现公众和个人的共同目标,即:为患者提供高质量的药品,具体表现在以下方面:及时放行合格的生产物料用于药品的制造,为生产出合格的药品提供必备的前提条件。
有效的药品生产过程中间控制保证了各个阶段生产产物的正确性和质量符合性,准确的终产品的检验数据为产品最终放行提供了重要的质量依据。
有效的稳定性数据和趋势分析指导企业确定药品正确的有效期、包装材料、运输/贮存条件等,并确保在市产品处于有效的质量保证状态。
通过实验室各个方面的有效管理,使质量系统始终处于受控状态,例,通过试验数据证明对工艺运行和产品质量的有效监控,为工艺能力及其稳定性提供保障。
本指南所描述的实验室管理是为了帮助企业的实验室更好地符合GMP的要求,推动整个企业有效地实施质量管理体系,达到长远发展的目的。
企业可以根据自身的规模、工艺复杂程度和有限的资源等特定的条件,在符合法规的要求下,量身制定相应的实验室管理体系。
质量是指为符合预定用途所具有的一系列固有特性的程度。
依此,药品质量是指,为了满足药品的安全性和有效性的要求,产品所具有的成分、含量、纯度等物理、化学或生物学等特性的程度。

附录1:无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差.第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0。
54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域.C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区.以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米.A级洁净区空气悬浮粒子的级别为ISO 4。


2010版药品GMP实施指南出版社:中国医药科技出版社开本16开共六册定价;1200.00元优惠价:980元详细分册如下:口服固体制剂:药品GMP指南定价:139元无菌药品:药品GMP指南定价:256元原料药: 药品GMP指南定价:198元质量管理体系:药品GMP指南定价:132元质量控制实验室与物料系统:药品GMP指南定价:256元厂房设施与设备:药品GMP指南定价:219元主要内容:《药品生产质量管理规范(2010年修订)》(以下简称新修订药品GMP)已经卫生部第79号令发布,并于2011年3月1日起施行。
为使药品生产企业及工程设计、设备制造、药品监管等部门的生产、技术、检查和管理人员正确理解、全面把握并有效执行新修订药品GMP,国家食品药品监督管理局药品认证管理中心组织编写了《药品GMP指南》。
《药品GMP指南》紧扣新修订的药品GMP,充分借鉴欧美等发达国家经验,紧密结合我国实际情况,各分册各有侧重,具有系统性和指导性,是目前国内有关新修订药品GMP 实施的最实用工具书。
《药品GMP指南》包括《质量管理体系》、《质量控制实验室和物料系统》、《厂房、设施、设备》、《口服固体制剂》、《无菌药品》、《原料药》六个分册,涵盖了新修订药品GMP的背景介绍、法规要求、技术要求、实施指导、实例分析及要点备忘等。
出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
然侍卫之臣不懈于内,忠志之士忘身于外者,盖追先帝之殊遇,欲报之于陛下也。
诚宜开张圣听,以光先帝遗德,恢弘志士之气,不宜妄自菲薄,引喻失义,以塞忠谏之路也。
宫中府中,俱为一体;陟罚臧否,不宜异同。
若有作奸犯科及为忠善者,宜付有司论其刑赏,以昭陛下平明之理;不宜偏私,使内外异法也。
侍中、侍郎郭攸之、费祎、董允等,此皆良实,志虑忠纯,是以先帝简拔以遗陛下:愚以为宫中之事,事无大小,悉以咨之,然后施行,必能裨补阙漏,有所广益。

2010版药品GMP《实验室控制系统GMP实施指南》真正word实验室控制系统 GMP 实施指南1 前言作为质量管理体系的一部分,质量控制实验室管理是确保所生产的药品适用于预定的用途,符合药品标准和规定的要求的重要因素之一。
为了帮助制药企业中的实验室更好地满足 GMP 的要求,本指南主要参照国内外相关法规和标准及指南对于实验室管理的阐述和要求,描述一个全面的实验室管理体系,以起到一定的指导作用。
本指南的内容不具有法律约束性,超出现行 GMP 规定的内容是建议性和参考性的,而非强制性要求,可以有选择地使用。
企业在运用本指南过程中,涉及到剂型特点或相关公用系统的内容时,还应参考其它配套,并结合本企业的实际情况和现行法规要求开展相关工作。
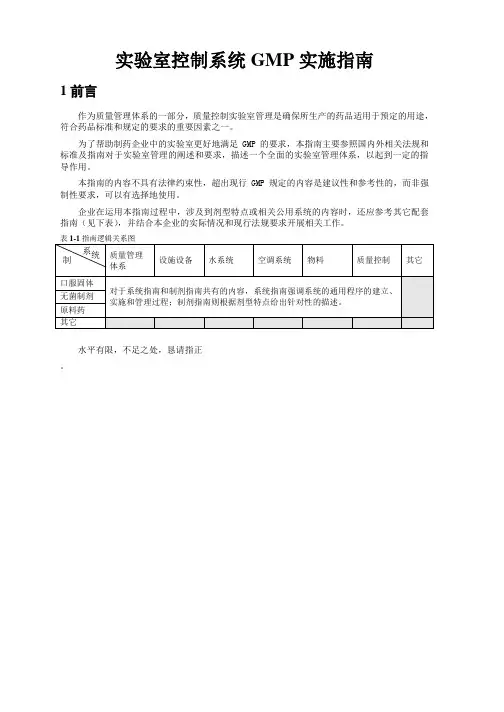
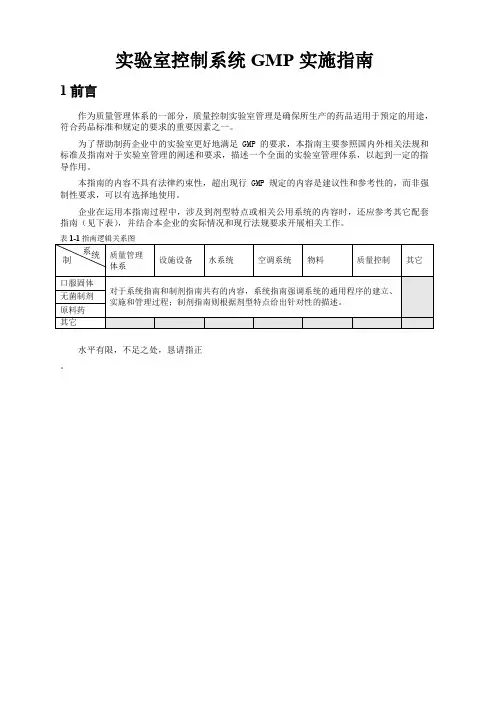
指南(见下表)表 1-1 指南逻辑关系图系统质量管理制设施设备水系统空调系统物料质量控制其它体系口服固体对于系统指南和制剂指南共有的内容,系统指南强调系统的通用程序的建立、无菌制剂实施和管理过程;制剂指南则根据剂型特点给出针对性的描述。
原料药其它水平有限,不足之处,恳请指正。
2 目的建立、实施并维护一个有效的实验室管理体系能够有效支持企业整体质量管理体系的有效实施,持续稳定地生产出符合满足顾客、法律法规等方面所提出的质量要求如有效性、可靠性、安全性的产品,从而实现公众和个人的共同目标,即:为患者提供高质量的药品,具体表现在以下方面: 及时放行合格的生产物料用于药品的制造,为生产出合格的药品提供必备的前提条件。
有效的药品生产过程中间控制保证了各个阶段生产产物的正确性和质量符合性,准确的终产品的检验数据为产品最终放行提供了重要的质量依据。
有效的稳定性数据和趋势分析指导企业确定药品正确的有效期、包装材料、运输/贮存条件等,并确保在市产品处于有效的质量保证状态。
通过实验室各个方面的有效管理,使质量系统始终处于受控状态,例,通过试验数据证明对工艺运行和产品质量的有效监控,为工艺能力及其稳定性提供保障。

药品生产质量管理规范(2010年修订)2011年02月12日发布2011年03月01日施行《药品生产质量管理规范(2010年修订)》2011年02月12日发布历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)今天对外发布,将于2011年3月1日起施行。
《药品生产质量管理规范》(以下简称药品GMP)是药品生产和质量管理的基本准则。
我国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
药品GMP的修订是药监部门贯彻落实科学发展观和医疗卫生体制改革要求,进一步关注民生、全力保障公众用药安全的又一重大举措,它的实施将进一步有利于从源头上把好药品质量安全关。
1998年修订的药品GMP的实施,在提升我国药品质量、确保公众用药安全方面发挥了重要的作用,取得了良好的社会效益和经济效益。
随着经济的发展和社会的进步,世界卫生组织及欧美等国家和地区药品GMP的技术标准得到很大的提升,新的理念和要求不断更新和涌现,我国现行药品GMP需要与时俱进,以适应国际药品GMP发展趋势,也是药品安全自身的要求。
我国现有药品生产企业在整体上呈现多、小、散、低的格局,生产集中度较低,自主创新能力不足。
实施新版药品GMP,是顺应国家战略性新兴产业发展和转变经济发展方式的要求。
有利于促进医药行业资源向优势企业集中,淘汰落后生产力;有利于调整医药经济结构,以促进产业升级;有利于培育具有国际竞争力的企业,加快医药产品进入国际市场。
无菌药品附录第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。
附录2:原料药第一章范围第一条本附录适用于非无菌原料药生产及无菌原料药生产中非无菌生产工序的操作。
第二条原料药生产起始点必须按注册批准的工艺执行。
第二章厂房与设施第三条非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应按照无菌药品附录中D级标准设置。
第四条原料药的质量标准中有热原或细菌内毒素等检验项目的,厂房的设计应特别注意防止微生物污染,如应根据工艺要求设定相应厂房的洁净度级别。
第五条质控实验室区域通常应与生产区分开。
当生产操作对检验结果的准确性无不利影响,且检验操作对生产也无不利影响时,中间控制实验室可设在生产区内。
第三章设备第六条设备所需的润滑剂、加热液或冷却剂等,应避免与中间产品或原料药直接接触,以免影响中间产品或原料药的质量。
当任何偏离上述要求的情况发生时,应进行评估,以确保对产品的质量和用途无不良影响。
第七条原料药生产宜使用密闭设备;密闭设备、管道可以安置于室外。
使用敞口设备或打开设备操作时,应有避免污染的措施。
第八条使用同一设备生产多种中间体或原料药品种的,应说明设备可以共用的理由,并有防止交叉污染的措施。
第九条难以清洁的设备或部件应专用。
第十条设备的清洁1)同一设备连续生产同一原料药或阶段性生产连续数个批次时,宜间隔适当的时间定期对设备进行清洁,以防止污染物(如降解产物或达到有害程度的微生物)的出现和遗留。
如有影响原料药质量的残留物,更换批次时,必须对设备进行彻底的清洁。
2)非专用设备更换品种生产前,必须对设备进行彻底的清洁,以防止交叉污染。
3)对残留物的可接受标准、清洁规程和清洁剂的选择,应有明确规定并说明理由。
第十一条非无菌原料药精制工艺用水应至少符合纯化水的质量标准。
第四章验证第十二条关键的工艺参数或特性通常应在研发阶段或根据历史的资料和数据确定,应规定工艺参数的必要范围,以确保工艺操作的重现性,包括:1)确定产品的质量特性;2)确定影响产品质量特性的关键工艺参数;3)确定常规生产和工艺控制中的关键工艺参数范围。
药品GMP质量控制指南(通则)-药品GMP指南2010版介绍本文档是关于药品GMP质量控制指南(通则)的指南,基于药品GMP指南2010版。
该指南旨在提供药品制造企业对于GMP质量控制的规定和要求。
范围本指南适用于所有药品制造企业,包括制造、处理和包装药品的所有阶段。
它涵盖了以下方面的要求:1. 组织和管理体系2. 建筑和设施3. 设备和仪器4. 物料管理5. 生产过程控制6. 样品管理7. 质量控制和分析实验室8. 文件管理9. 审计和复核10. 应急预防和规划重要要求以下是本指南中的一些重要要求的简要概述:1. 制造企业应建立和维护一个有效的质量管理体系,以确保符合GMP要求。
2. 建筑和设施应具备适当的环境和工艺控制,并符合卫生标准。
3. 设备和仪器应定期进行校准和维护,并记录相关的记录。
4. 物料管理应包括物料的采购、接收、储存和分发,并确保其符合规定的要求。
5. 生产过程控制应涵盖所有生产阶段,包括原料的混合、制剂的制备、包装和贮存。
6. 样品管理应确保准确采样和记录,并按照规定的程序进行测试和分析。
7. 质量控制和分析实验室应具备适当的设备和资格,以进行分析和测试,并确保准确记录结果。
8. 文件管理应包括制定、更新和控制所有相关的GMP文件和记录。
9. 审计和复核应定期进行,以确保GMP要求的遵守和改进。
10. 应急预防和规划应包括灾难、事故或其他紧急情况的预防和处理计划。
总结本文档提供了药品GMP质量控制指南(通则)的概要,旨在帮助药品制造企业满足GMP要求。
制造企业应按照该指南的要求建立和实施适当的质量管理体系,并确保符合所有相关的要求和标准。