最新fda批准新药简介汇总
- 格式:ppt
- 大小:721.00 KB
- 文档页数:18

抗精神病新药!美国FDA批准Lybalvi(奥氮平samidorphan):治疗精神分裂症。
2021年06⽉02⽇讯 /⽣物⾕BIOON/ --Alkermes是⼀家全⾯整合的爱尔兰⽣物制药公司,致⼒于开发治疗中枢神经系统(CNS)疾病和肿瘤的创新药物。
近⽇,该公司宣布,美国⾷品和药物管理局(FDA)已批准Lybalvi(olanzapine/samidorphan),这是⼀款新型、每⽇⼀次的⾮典型抗精神病药物,⽤于治疗:(1)精神分裂症成⼈患者;(2)双相I型障碍成⼈患者。
在双相I型障碍成⼈患者中,Lybalvi可作为维持单药治疗,也可作为单药疗法或作为锂盐或丙戊酸盐的辅助疗法⽤于躁狂或混合发作的急性治疗。
Alkermes已计划于2021年第四季度将Lybalvi推向市场。
Lybalvi是由⼀种已上市的抗精神病药物奥氮平(olanzapine)和⼀种新颖的新分⼦实体samidorphan(新型选择性µ-阿⽚受体拮抗剂)制成的⼀种双层⽚剂。
体重增加和临床相关的代谢问题是⾮典型抗精神分裂药物常见的副作⽤。
奥氮平是⼀种⾮常有效的抗精神病药物,但临床使⽤受限于其⾼发的体重增加。
Lybalvi的设计⼒图在提供奥氮平的强⼒抗精神病疗效的同时,降低对体重和新陈代谢的副作⽤,从⽽提⾼治疗的安全性。
精神分裂症和双相I型障碍是复杂的慢性疾病,仍然需要安全有效的新药。
Lybalvi是⼀种新型、每⽇⼀次、⼝服⾮典型抗精神病药物,旨在提供奥氮平(olanzapine)的疗效,同时减轻奥氮平引起的体重增加。
Lybalvi有4种固定剂量组合,由10mg剂量的samidorphan与不同剂量的奥氮平(5mg、10mg、15mg、20mg)配制⽽成。
samidorphan分⼦结构式(图⽚来源:)Alkermes董事长兼⾸席执⾏官Richard Pops表⽰:“Lybalvi代表了精神分裂症或双相I型障碍患者及其临床医⽣和护理⼈员的⼀个重要的新治疗选择,反映了Alkermes致⼒于开发⽀持以患者为中⼼的护理的新疗法。
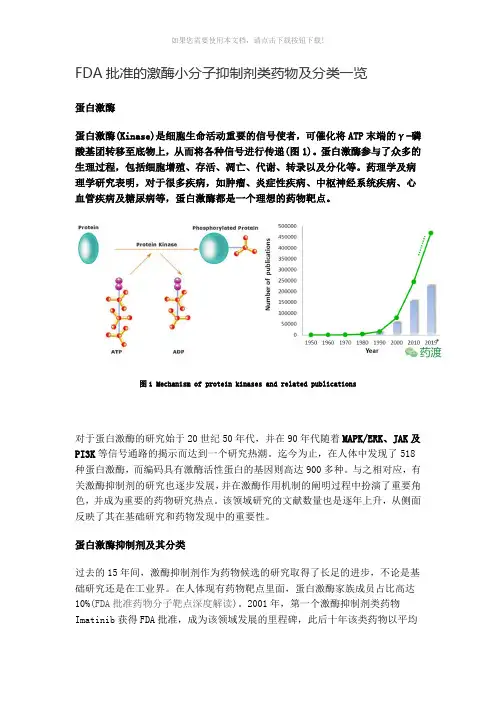
FDA批准的激酶小分子抑制剂类药物及分类一览蛋白激酶蛋白激酶(Kinase)是细胞生命活动重要的信号使者,可催化将ATP末端的γ-磷酸基团转移至底物上,从而将各种信号进行传递(图1)。
蛋白激酶参与了众多的生理过程,包括细胞增殖、存活、凋亡、代谢、转录以及分化等。
药理学及病理学研究表明,对于很多疾病,如肿瘤、炎症性疾病、中枢神经系统疾病、心血管疾病及糖尿病等,蛋白激酶都是一个理想的药物靶点。
图1 Mechanism of protein kinases and related publications对于蛋白激酶的研究始于20世纪50年代,并在90年代随着MAPK/ERK、JAK及PI3K等信号通路的揭示而达到一个研究热潮。
迄今为止,在人体中发现了518种蛋白激酶,而编码具有激酶活性蛋白的基因则高达900多种。
与之相对应,有关激酶抑制剂的研究也逐步发展,并在激酶作用机制的阐明过程中扮演了重要角色,并成为重要的药物研究热点。
该领域研究的文献数量也是逐年上升,从侧面反映了其在基础研究和药物发现中的重要性。
蛋白激酶抑制剂及其分类过去的15年间,激酶抑制剂作为药物候选的研究取得了长足的进步,不论是基础研究还是在工业界。
在人体现有药物靶点里面,蛋白激酶家族成员占比高达10%(FDA批准药物分子靶点深度解读)。
2001年,第一个激酶抑制剂类药物Imatinib获得FDA批准,成为该领域发展的里程碑,此后十年该类药物以平均每年获批一种的速度稳步发展。
而在2012年1月至2015年2月期间,小分子激酶抑制剂类药物迎来爆发式发展,共有15种新药获得审批。
截至2016年12月底,共有31种小分子激酶抑制剂类药物获得审批,同时还有大量的化合物处于临床或临床前研究中。
除此之外,科研人员还解析了超过5000种的蛋白激酶或蛋白激酶-抑制剂复合体的晶体结构,且超过五分之一的人类蛋白激酶具有明确的小分子抑制剂。
因此,小分子激酶抑制剂已成为药物研发的一个热点领域。

FDA批准的放射性药物都有哪些?展开全文中华医学会核医学分会放射性药物学组整理1、药物名称:Carbon-11 choline(11C-胆碱)生产商:Mayo Clinic 商品名:—用途:前列腺癌复发诊断2、药物名称:Carbon-14 urea(14C-尿素)生产商:Kimberly-Clark 商品名:PYtest用途:胃中幽门螺杆菌感染诊断3、药物名称:Fluorine-18 florbetaben(18F-AV1)生产商:Piramal Imaging 商品名:Neuraceq™用途:阿尔茨海默(AD)患者和痴呆患者评价4、药物名称:Fluorine-18florbetapir(18F-AV45)生产商:Eli Lilly 商品名:Amyvid™用途:阿尔茨海默症诊断与治疗5、药物名称:Fluorine-18sodium fluoride(18F-氟化钠)生产商:Various 商品名:—用途:成骨能力的骨显像剂6、药物名称:Fluorine-18fludeoxyglucose(18F-FDG)生产商:Various 商品名:—用途:肿瘤、癫痫病灶糖代谢异常检测7、药物名称:Fluorine-18flutemetamol(18F-PIB)生产商:GE Healthcare 商品名:Vizamyl用途:阿尔茨海默(AD)患者和痴呆患者评价8、药物名称:Gallium-67 citrate(67Ga-柠檬酸)生产商:Lantheus MedicalImaging、Mallinckrodt商品名:—用途:霍奇金病、淋巴瘤、支气管癌以及一些急性炎症病变诊断9、药物名称:Indium-111capromab pendetide(111In-卡罗单抗喷地肽)生产商:AytuPharmaceuticals 商品名:ProstaScint®用途:前列腺癌患者、前列腺癌术后高度怀疑转移患者的检测10、药物名称:Indium-111 chloride(111In-氯化铟)生产商:GE Healthcare、Mallinckrodt 商品名:Indiclor™用途:用于放射性标记11、药物名称:Indium-111 pentetate(111In-DTPA)生产商:GE Healthcare 商品名:—用途:放射性核素脑池造影12、药物名称:Indium-111oxyquinoline(111In-羟基喹啉)生产商:GE Healthcare 商品名:—用途:用于自体白细胞标记,炎症及感染的诊断13、药物名称:Indium-111pentetreotide(111In-奥曲肽)生产商:Mallinckrodt 商品名:Octreoscan™用途:原发性和转移性内神经分泌肿瘤生长抑素受体定位14、药物名称:Iodine I-123iobenguane(123I-MIBG)生产商:GE Healthcare 商品名:AdreView™用途:原发或转移性嗜铬细胞瘤或神经母细胞瘤的辅助诊断15、药物名称:Iodine I-123 ioflupane(123I-氟潘)生产商:GE Healthcare 商品名:DaTscan™用途:对疑似帕金森症患者的评估16、药物名称:Iodine I-123sodium iodide capsules(123I-碘化钠胶囊)生产商:Cardinal Health、Mallinckrodt 商品名:—用途:甲状腺功能及形态学评价17、药物名称:Iodine I-125 humanserum albumin(125I-人血清白蛋白)生产商:IsoTex Diagnostics 商品名:Jeanatope用途:全血及血浆容量测定18、药物名称:Iodine I-125iothalamate(125I-酞酸盐)生产商:IsoT ex Diagnostics商品名:Glofil-125用途:肾小球滤过率的评价19、药物名称:Iodine I-131 humanserum albumin(131I-人血清白蛋白)生产商:IsoTex Diagnostics 商品名:Megatope用途:全血及血浆量、心脏输出、心脏及肺血容量、蛋白质周转研究、脑肿瘤定位等20、药物名称:Iodine I-131sodium iodide(131I-碘化钠)生产商:DRAXIMAGE、Mallinckrodt 商品名:HICON™用途:甲状腺疾病的诊断与治疗21、药物名称:MolybdenumMo-99 generator(钼锝发生器)生产商:GE Healthcare、Lantheus MedicalImaging、Mallinckrodt商品名:DRYTEC™、T echnelite、UltraTechneKow®DTE用途:放射性药物的制备22、药物名称:Nitrogen-13 ammonia(13N-氨水)生产商:Various 商品名:—用途:心肌灌注评价冠状动脉疾病23、药物名称:Radium-223 dichloride(223Ra-二氯化镭)生产商:Bayer HealthCarePharmaceuticalsInc. 商品名:Xofigo®用途:去势性前列腺癌治疗24、药物名称:Rubidium-82 chloride(82Ru-氯化铷)生产商:Bracco Diagnostics 商品名:Cardiogen-82®用途:心肌灌注显像剂25、药物名称:Samarium-153lexidronam(153Sm-EDTMP)生产商:Lantheus MedicalImaging 商品名:Quadramet®用途:减轻骨转移患者的疼痛26、药物名称:Strontium-89 chloride(89Sr-氯化锶)生产商:GE Healthcare商品名:MetastronTM用途:减轻骨转移患者的疼痛27、药物名称:T echnetium-99mbicisate(99mT c-ECD)生产商:Lantheus MedicalImaging 商品名:Neurolite®用途:脑卒中患者卒中的诊断与治疗28、药物名称:Technetium-99mdisofenin(99mTc-地索芬宁)生产商:Pharmalucence 商品名:Hepatolite®用途:急性胆囊炎诊断29、药物名称:Technetium-99mexametazine(99mTc-HMPAO)生产商:GE Healthcare 商品名:C eretec™用途:脑卒中患者血脑灌注、白细胞标记显像用用于腹腔感染及肠道炎症定位30、药物名称:T echnetium-99mmacroaggregatedalbumin (99mT c-MAA)生产商:DRAXIMAGE 商品名:—用途:肺灌注评价、腹静脉分流畅通性评价31、药物名称:Technetium-99mmebrofenin(99mT c-甲溴苯宁)生产商:Bracco Diagnostics、Pharmalucence 商品名:Choletec®用途:肝胆显像剂32、药物名称:Technetium-99mmedronate(99mTc-MDP)生产商:DRAXIMAGE、GE Healthcare、Pharmalucence 商品名:MDP-25、MDP Multidose用途:骨显像剂33、药物名称:Technetium-99mmertiatide(99mTc-MAG3)生产商:Mallinckrodt 商品名:TechnescanMAG3TM用途:肾动态显像34、药物名称:Technetium-99moxidronate(99mT c-HDP)生产商:Mallinckrodt 商品名:Tec hnescan™HDP用途:骨显像剂35、药物名称:Technetium-99mpentetate(99mT c-DTPA)生产商:DRAXIMAGE 商品名:—用途:脑显像、肾显像36、药物名称:T echnetium-99mpyrophosphate(99mTc-PYP)生产商:Mallinckrodt、Pharmalucence 商品名:Technescan™、PYP™用途:骨显像、心脏显像剂、血池显像剂37、药物名称:Technetium-99m redblood cells(99mT c-红细胞)生产商:Mallinckrodt 商品名:UltraTag™用途:血池造影、消化道出血定位38、药物名称:T echnetium-99msestamibi(99mTc-MIBI)生产商:Cardinal Health、DRAXIMAGE、Lantheus MedicalImaging、Mallinckrodt、Pharmalucence商品名:Cardiolite®用途:心肌灌注,用于检测缺血、评价心机功能,乳腺成像39、药物名称:Technetium-99msodium pertechnetate (99mT c-高锝酸钠)生产商:GE Healthcare、Lantheus MedicalImaging、Mallinckrodt商品名:—用途:脑显像、甲状腺显像、胎盘定位、膀胱显像等40、药物名称:Technetium-99msuccimer(99mT c-DMSA)生产商:GE Healthcare 商品名:—用途:肾显像41、药物名称:Technetium-99msulfur colloid(99mT c-硫胶体)生产商:Pharmalucence 商品名:—用途:肝、脾、骨髓显像等42、药物名称:Technetium-99mtetrofosmin(99mTc-替曲膦)生产商:GE Healthcare 商品名:MyoviewTM用途:心肌灌注剂43、药物名称:Technetium-99mtilmanocept(99mTc-替马诺噻)生产商:NavideaBiopharmaceuticals,Inc. 商品名:Lymphoseek®用途:淋巴结定位44、药物名称:Thallium-201chloride(201Tl-氯化铊)生产商:GE Healthcare、Lantheus MedicalImaging、Mallinckrodt商品名:—用途:心肌灌注显像45、药物名称:Xenon-133 gas(133Xe气体)生产商:Lantheus MedicalImaging 商品名:—用途:肺功能评估与肺显像、脑血流评估46、药物名称:Yttrium-90chloride(90Y-氯化钇)生产商:MDS Nordion、Eckert&ZieglerNuclitec商品名:—用途:放射性标记47、药物名称:Yttrium-90ibritumomab tiuxetan(90Y-替伊莫单抗)生产商:SpectrumPharmaceuticals商品名:Zevalin®用途:非霍奇金氏淋巴瘤治疗截止至2015年8月1日。



最具潜力十大新药5月4日美国行业评估商标准普尔(Standard&Poor’s)在其数据网站上发布了10个进入研发后期、预计未来两年有可能在美国上市的最具市场前景的新药汇总报告。
这十个新药分别为:1.Denosumab (骨质疏松症)/安进制药(标准普尔信用评级:A+)入选原因:因为安进公司的大分子药物核心产品组合处于高度成熟期,最近几年正面临着销售低速增长。
由于种种原因,占该公司销售额90%以上的高端产品阿法达贝泊汀((darbepoetin alfa,Aranesp)、阿法依泊汀(Epoetin Alfa,Epogen)、聚乙二醇化非格司亭(pegfilgrastim,Neulasta)、非格司亭(filgrastim,Neupogen)及依那西普(etanercept,Enbrel),预计在今后5年不会有实质性增长(还可能有所下滑)。
状态:2008年12月向FDA提交申请,如在规定时限内获得FDA批准,预计该产品将在2009年后期上市。
简介:Denosumab是一种针对核因子k B配体受体活化因子(RANKL)的人源化单克隆抗体。
RANKL是骨代谢过程中重要分子,是骨重吸收主要信号。
安进公司已经完成Denosumab对更年期妇女和药物引起的乳腺癌及前列腺癌患者骨质疏松的治疗和预防的III期临床研究,取得了肯定结果。
预防前列腺癌患者骨转移和预防乳腺癌、前列腺癌及实体瘤患者骨相关事件的III期临床试验将分别在2009年底和2010年结束。
用于预防骨质疏松患者骨折,每年只需用药两次,与目前需要每天或每周给药的药物相比,其依从性将大大提高。
2. Brilinta (AZD6140; 动脉血栓)/阿斯利康(S&P credit rating, AA-)入选原因: 阿斯利康公司最近两年在进入最后阶段的药物研发方面取得了长足进步,无论内部研发还是外部合作方面都有所改观,而此前的2006年则显得较弱。

美国FDA批准Zelsuvmi(Berdazimer)治疗传染性软疣夏训明(编译)
【期刊名称】《广东药科大学学报》
【年(卷),期】2024(40)1
【摘要】美国FDA于2024年1月5日批准新药Zelsuvmi(有效成分berdazimer,Berdazimer sodium的CAS登记号为308075-87-8)用于治疗传染性软疣(molluscum contagiosum)。
据了解,Zelsuvmi剂型为外用凝胶(10.3%),研发商为Ligand药业公司(Ligand Pharmaceuticals),是FDA在2024年批准的第1种新药。
【总页数】1页(P66-66)
【作者】夏训明(编译)
【作者单位】不详
【正文语种】中文
【中图分类】R95
【相关文献】
1.美国FDA批准Nurtec ODT作为可用于急性治疗/预防性治疗的偏头痛药物
2.美国FDA批准Jesduvroq(daprodustat)口服片剂用于血液透析患者治疗因慢性肾病引起的贫血
3.美国FDA批准新型抗逆转录病毒药物Sunlenca(lenacapavir)用于治疗1型HIV感染
4.美国FDA批准Padcev(enfortumab vedotin-ejfv/恩福单抗凡酯)用于治疗尿路上皮细胞癌
5.美国FDA批准Fabhalta(iptacopan)治疗阵发性睡眠性血红蛋白尿症
因版权原因,仅展示原文概要,查看原文内容请购买。


马法兰、爱克兰、Alkeran【别名】左旋苯丙氨酸氮芥、马尔法兰、美法仑。
【厂家】英国葛兰素史克,英国葛兰素史克公司(GlaxoSmithKline),简称GSK,全球最大药剂集团【英文名】Alkeran,Melphalan,L-Sarcolysin,L-PAM。
【作用特点】本品为溶肉瘤素的左旋体,较消旋体溶内瘤素作用强。
口服吸收良好,均匀分布体内各脏器,但不能透过血——脑脊液屏障。
【功能主治】本品可用与多种肿瘤,在单一化疗及联合化疗中,为多发性骨髓瘤的首选药。
对精原细胞瘤、乳腺癌、卵巢癌、慢性白血病、真性红细胞增多症,恶性淋巴瘤、儿童晚期神经母细胞瘤、甲状腺癌有效。
动脉灌注治疗肢体恶性肿瘤如:恶性黑色素瘤、软组织肉瘤和骨肉瘤有较好疗效,偶用于治疗某些自身免疫性疾病以及防止器官移植时的排异反应。
用法用量因为美法仑具有骨髓抑制作用,故在治疗期间内,必需频繁监测血象(血细胞计数),必要时暂缓用药或调整剂量。
或遵医嘱。
成年口服用药口服美法仑的吸收是易变的,为了确保达到可能的治疗水平。
应谨慎增加剂量,直到出现出现骨髓抑制作用为止。
多发性骨髓瘤有多种治疗方案,应详细查阅文献,美法仑与强的松合用,可能比单用美法仑更有效,通常联合用药间歇进行。
虽然延长连续用药的优越性仍未证实,但典型的剂量是每日每公斤体重0.15毫克分次服用共四天,六周后重复疗程。
对治疗有反应者延长疗程超过一年不会改进疗效。
卵巢腺癌典型的治疗方案是每日每公斤体重0.2毫克共五天,每4~8周或当外周血象恢复时重复疗程;当出现骨髓毒性时应减低剂量。
晚期乳腺癌口服美法仑每日每公斤体重0.15毫克或每平方米体表面积6毫克,共5日,每六周重复疗程,也可使用美法仑静脉注射治疗。
真性红血球增多症诱导缓解期,每日用6~10毫克共5~7天,之后可每日2~4毫克直至能满意地控制症状,维持剂量可每周一次用2~6毫克,其间必须对患者仔细谨慎地进行血液学控制,以血细胞计数结果为依据,适当调整剂量。

出国看病,美国最新抗血液肿瘤药物Zydelig经FDA批准上市2014年7月23日,美国食品和药物管理局(FDA)批准Zydelig(idelalisib)可用于治疗三种类型的血液肿瘤。
Zydelig获得批准用于治疗复发性慢性淋巴细胞白血病。
Zydelig可与Ritux an (rituximab)联合,应用于因其他共存的疾病(合并症)而适合单药Ritux an治疗的患者。
Zydelig是第五个通过突破性疗法认定的新药被美国食品和药物管理局批准,并且是第三个经此认定批准用于治疗慢性淋巴细胞白血病的药物。
此外,美国食品和药物管理局还加速批准Zydelig用于治疗复发性滤泡B细胞非霍奇金淋巴瘤(FL)和复发性小淋巴细胞性淋巴瘤(SLL)——另外一种类型的非霍奇金淋巴瘤。
根据规定,Zydelig适用于那些接受过至少2个系统治疗的患者。
“不到一年时间,我们就看到慢性淋巴细胞白血病治疗有效性方面的巨大进展,”医学博士Richard Pazdur说道,他是美国食品和药物管理局药品评价和研究中心的血液和肿瘤产品办公室主任,“Zydelig批准用于治疗CLL让我们看到了突破性疗法认定的意义,反映出美国食品和药物管理局在和企业开展合作、加快药物研发、审核和通过方面做出的努力。
美国食品和药物管理局分别在2013年11月、2014年2月和2014年4月1日,批准Gazyva (obinutuzumab)、Imbruvica (ibrutinib)和Arzerra (ofatum umab)用于治疗慢性淋巴细胞白血病。
Gazyva 和Arzerra都获得了突破性疗法认定。
与另外两种药物一样,Zydelig还获得了孤儿产品认定,因为它将被用于治疗一种罕见疾病。
220人参与了Zydelig治疗复发性慢性淋巴细胞白血病安全性和有效性的临床试验,他们被随机分配到使用Zydelig和Rituxan组或对照剂和Rituxan组。
到达初次预先指定的期中分析点时,结果显示:使用对照剂和Rituxan的患者无进展生存期大概5.5月,而使用Zydelig和Rituxan的患者无进展生存期至少1 0.7个月。
FDA批准的激酶小分子抑制剂类药物及分类一览蛋白激酶蛋白激酶(Kinase)是细胞生命活动重要的信号使者,可催化将ATP末端的γ-磷酸基团转移至底物上,从而将各种信号进行传递(图1)。
蛋白激酶参与了众多的生理过程,包括细胞增殖、存活、凋亡、代谢、转录以及分化等。
药理学及病理学研究表明,对于很多疾病,如肿瘤、炎症性疾病、中枢神经系统疾病、心血管疾病及糖尿病等,蛋白激酶都是一个理想的药物靶点。
图1 Mechanism of protein kinases and related publications对于蛋白激酶的研究始于20世纪50年代,并在90年代随着MAPK/ERK、JAK 及PI3K等信号通路的揭示而达到一个研究热潮。
迄今为止,在人体中发现了518种蛋白激酶,而编码具有激酶活性蛋白的基因则高达900多种。
与之相对应,有关激酶抑制剂的研究也逐步发展,并在激酶作用机制的阐明过程中扮演了重要角色,并成为重要的药物研究热点。
该领域研究的文献数量也是逐年上升,从侧面反映了其在基础研究和药物发现中的重要性。
蛋白激酶抑制剂及其分类过去的15年间,激酶抑制剂作为药物候选的研究取得了长足的进步,不论是基础研究还是在工业界。
在人体现有药物靶点里面,蛋白激酶家族成员占比高达10%(FDA批准药物分子靶点深度解读)。
2001年,第一个激酶抑制剂类药物Imatinib获得FDA批准,成为该领域发展的里程碑,此后十年该类药物以平均每年获批一种的速度稳步发展。
而在2012年1月至2015年2月期间,小分子激酶抑制剂类药物迎来爆发式发展,共有15种新药获得审批。
截至2016年12月底,共有31种小分子激酶抑制剂类药物获得审批,同时还有大量的化合物处于临床或临床前研究中。
除此之外,科研人员还解析了超过5000种的蛋白激酶或蛋白激酶-抑制剂复合体的晶体结构,且超过五分之一的人类蛋白激酶具有明确的小分子抑制剂。
因此,小分子激酶抑制剂已成为药物研发的一个热点领域。
美国FDA简略新药申请(ANDA)概览摘要:本文通过对美国简略新药申请流程,原料药、制剂技术审评要求及部分注册资料关键控制点进行介绍以构建出美国FDA简略新药申请(ANDA)的概览。
关键词 FDA ANDA 简略新药申请1.背景介绍美国食品药品监督管理局(U.S. Food & Drug Administration)简称FDA,是药品监管相当严苛的市场,只有经过FDA批准的药品,才可以在美国上市销售。
简略新药申请(Abbreviated New Drug Application)简称ANDA,与新药申请(New Drug Application,简称NDA)相比新药申请(New Drug Application,简称NDA)不需要开展非临床试验研究及临床试验研究。
美国负责ANDA审评的机构为FDA下属的仿制药办公室(Office of Generic Drugs, OGD)。
新化合物(New Chemical Entity,简称NCE)专营期从NDA获批开始计时,用于阻止ANDA和505(b)(2)含有此化合物产品进入市场。
5年NCE专营期内FDA不接受ANDA递交,或者4年后,ANDA可以通过专利挑战来递交申请。
按照《药品价格竞争和专利期恢复法》法案,对挑战专利的、首个仿制药申请可能获得180天专营期。
180天的计算开始时间是申请人开始商业上市的日期,或法院判决专利无效、不侵权的日期,两者中较早的时间。
通用技术文件(Common Technical Document,简称 CTD),FDA要求ANDA以CTD格式提交注册资料。
CTD是人用药品注册技术要求国际协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,简称ICH)为协调ICH地区注册申报资料的格式而制定的,其实施的目的是规范注册申请,统一技术格式要求,减少不必要浪费。
FDA新药许可申请及审核简介新药申请(一)药物的定义依据联邦食品药物及化妆品法第二章第 201节,药物的定义如下:l.美国药典,同种治疗法药典,或者国家处方集(National Formulary)中所列的物质。
2.任何物质用于人或动物以利诊断、治愈、治疗、预防疾病。
3.任何物质用于改变人体或动物构造或功能。
4.任何物质属于上述1、2或3的一部分。
药物定义范围广泛,本文着重于人用新药,不包括生物制剂在内。
(二)新药申请手续新药申请可分为两个阶段,即新药临床试验申请。
(Investigational New Drug Application,简称IND)及新药上市许可申请(New Drug Application,简称NDA)。
1.新药临床试验申请(IND)新药试验申请的目的是请求FDA核准进行第一次人体临床试验,不管是否已在美国之外其他各国进行人体试验,只要是在美国申请,需填Form FDA1571表及Form FDA1572表。
新药试验申请所提出的内容应包括新药的物理化学性质、临床前(preclinical)或非临床(nonclinical),以及健康志愿者(healthy volunteer)或病人使用的经验[若是已在美国以外之国家取得人体试验结果,最重要的资料是第一次在美国进行人体试验的计划书(clinical protocol)]。
进一步说明,新药试验申请至少应包括下列资料:(1)药物的化学名称、分子式、构造、给药方式(rade name)亦可先用公司暗码名称(code name)代替。
(2)主要成分及所知之非主要成分(没作用的成分)及所测得之杂物(impurities),并列出成分组成。
(3)供应药物公司的地址。
(4)药物来源,工厂设备(facilities)及质量控制(controls)的资料以说明如何制造、包装等,以确保药物的认定(identity)、效力(strength)、质量(quality)及纯度(purity)。
2020年2月FDA批准新药概况【摘要】2020年2月,FDA批准了一批新药,为医药行业带来了新的变化。
本文将对这些新药进行概况,分析批准数量的统计数据,了解新药上市情况并进行分类概况。
我们也将关注新药的批准快讯和研发趋势,以揭示未来可能的发展方向。
结论将总结2020年2月FDA批准新药的整体趋势,为读者提供一个全面的了解。
通过本文,读者将了解到近期FDA批准新药的最新动态,为医疗行业的发展提供参考和借鉴。
FDA的批准对于新药研发和市场推广起着至关重要的作用,因此本文将为读者带来独特的洞察和启发。
【关键词】FDA, 新药, 批准, 2020年2月, 概况, 数量统计, 上市情况分析, 分类概况, 批准快讯, 研发趋势分析, 整体趋势1. 引言1.1 2020年2月FDA批准新药概况2020年2月,美国食品药品监督管理局(FDA)批准了多批新药,引起了广泛关注。
这些新药的上市将给患者带来新的治疗选择,也将推动医药行业的发展。
在这个充满挑战和机遇的时代,了解和分析FDA批准的新药概况对于医药从业者、患者和投资者都至关重要。
本文将从FDA批准的新药数量、新药上市情况、新药分类、新药批准快讯以及新药研发趋势等方面进行分析和解读,帮助读者全面了解2020年2月FDA批准新药的情况。
通过深入分析这些数据和趋势,我们可以更好地把握医药行业的动态,为未来的研发和投资决策提供参考。
在这个信息爆炸的时代,了解最新的药品批准情况对于医药行业的专业人士和投资者至关重要。
我们希望本文能够帮助读者更好地了解2020年2月FDA批准新药的整体趋势,为未来的发展提供有益的参考和启示。
2. 正文2.1 FDA批准的新药数量统计FDA在2020年2月共批准了20种新药上市,这表明FDA在新药审批方面的工作效率正在不断提高。
据统计,这20种新药涵盖了多个治疗领域,包括癌症、心血管疾病、罕见病等,为患者提供了更多治疗选择。
针对罕见病的新药占比较高,这也反映了制药公司在研发方向上越来越关注罕见病市场的潜力。
广东药科大学学报第40卷[33]VERHAART I E C, AARTSMA-RUS A. Therapeutic devel‐opments for Duchenne muscular dystroph y[J]. Nat Rev Neurol, 2019, 15(7):373-386.[34]MACKENZIE S J, NICOLAU S, CONNOLLY A M, et al.Therapeutic approaches for Duchenne muscular dystrophy: old and ne w[J]. Semin Pediatr Neurol, 2021, 8(37):100877.[35]张慈柳, 洪思琦, 彭镜, 等. 儿童神经系统疾病糖皮质激素治疗专家系列建议之六—进行性假肥大型肌营养不良的治疗[J]. 中国实用儿科杂志, 2022, 37(5):343-346.[36]FISCHER R, PORTER K, DONOVAN J M, et al. A Mixed-method study exploring patient-experienced and caregiver-reported benefits and side effects of corticosteroid use in Duchenne muscular dystroph y[J]. J Neuromuscul Dis, 2023, 10(4):593-613.[37]TUNG J Y, LAN T P, CHAN S H, et al. Bone microarchitec‐tural alterations in boys with Duchenne muscular dystrophy on long-term glucocorticoid treatment [J]. J Bone Miner Metab,2021, 39(4):606-611.[38]LUCE L, CARCIONE M, MAZZANTI C, et al. Theragnosisfor Duchenne muscular dystroph y[J]. Front Pharmacol, 2021, 3(12):648390.[39]谢佩玉, 戴国瑶, 朱叶华, 等. 泼尼松龙高剂量单用及低剂量联用他克莫司治疗成人微小病变肾病综合征的疗效和安全性分析[J]. 广东药科大学学报, 2023, 39(2):27-31.[40]GROUNDS M D, LLOYD E M. Considering the promise ofvamorolone for treating duchenne muscular dystroph y[J]. J Neuromuscul Dis, 2023, 10(6):1013-1030.[41]LIU Xu, WANG Yashuo, GUTIERREZ J S, et al. Disruptionof a key ligand-H-bond network drives dissociative properties in vamorolone for Duchenne muscular dystrophy treatmen t [J]. Proc Natl Acad Sci U S A, 2020, 117(39):24285-24293. [42]张贤政, 葛瑾茹, 张玲玲, 等. 进行性肌营养不良动物模型及治疗药物研究进展[J]. 中国药理学通报, 2022, 38(1):16-21.(责任编辑:刘晓涵)2023年美国FDA共批准55种新药美国FDA下属的药品评审与研究中心在2023年共批准各类新药(包括新分子实体、新治疗用生物制品)55种,但不含由生物制品评审与研究中心负责评审的疫苗、致敏性产品、血液与血液制品、细胞与基因治疗产品:(1)有20种为同类首款(first-in-class)新药(商品名,下同):Daybue,Defencath,Fabhalta,Filspari,Filsuvez,Jesduvroq,Joenja,Lamzede,Miebo,Ogsiveo,Paxlovid,Qalsody,Rivfloza,Skyclarys,Sohonos,Talvey,Truqap,Veopoz,Veozah,Xdemvy。
2020年10—11月FDA批准新药概况2020年10月,FDA批出1个新分子实体和1个新生物药物,分别为治疗COVID-19药品Veklury(瑞德西韦)和治疗埃博拉病毒药物Inmazeb(atoltivimab+ maftivimab+odesivimab-ebgn)。
11月,FDA批出3个新分子实体和1个新生物药物,分别为治疗早衰综合征药品Zokinvy(lonafarnib)、治疗高草酸尿症药品Oxlumo (lumasiran)、治疗肥胖症药品Imcivree(setmelanotide)和治疗神经母细胞瘤药物Danyelza(naxitamab-gqgk)。
1 Veklury(瑞德西韦)Veklury有注射液和冻干粉两种剂型,被正式批准用于治疗年龄在12岁及以上、体重至少40 kg的需要住院治疗的COVID-19患者,成为美国首个也是唯一一个获批的新冠肺炎治疗药物。
瑞德西韦是核苷类RNA依赖的RNA聚合酶竞争性抑制剂,通过阻碍SARS-CoV-2的复制而起作用。
2 Inmazeb(atoltivimab+maftivimab+odesivimab-ebgn)Inmazeb为注射液,被批准用于治疗由扎伊尔型埃博拉病毒引起的成人和儿童患者感染,包括感染检测呈阳性母亲的新生儿。
Inmazeb靶向埃博拉病毒表面表达的糖蛋白,这种糖蛋白通过与细胞表面的受体相结合,导致病毒和宿主细胞膜的融合,使病毒进入细胞。
组成Inmazeb的3种中和抗体可同时与这种糖蛋白结合,从而阻断病毒的附着和进入细胞。
3 Zokinvy(lonafarnib)Zokinvy为口服胶囊,被批准用于减少哈金森-吉尔福德早衰综合征(Hutchinson-Gilford progeria syndrome, HGPS)患者的死亡风险,以及治疗患有特定早衰样核纤层蛋白病的1~2岁的患者。
Zokinvy是一种首创性的口服法尼基转移酶抑制剂,可阻断早衰蛋白的法尼基化,故而降低早衰蛋白在细胞核中的积累,使得早老症儿童生存获益。