乙烯的物理性质
- 格式:doc
- 大小:68.00 KB
- 文档页数:2

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。

乙烯化学式结构式-概述说明以及解释1.引言1.1 概述概述:乙烯是一种简单的烃类化合物,也被称为乙烯烷或乙烯烃。
它是一种无色、可燃的气体,具有较强的燃烧性能。
乙烯是最简单的不饱和烃,由两个碳原子和四个氢原子组成,化学式为C2H4。
乙烯是一种广泛应用于化工领域的重要有机化合物。
它是许多合成化工产品的基础原料,如聚乙烯、乙烯醇等。
乙烯的重要性不仅在于其作为原料的广泛应用,还在于它具有多种化学反应和反应机理的研究价值。
本文将对乙烯的化学性质、物理性质以及其在各个应用领域中的重要性进行深入探讨。
通过对乙烯的化学式结构式的认识,可以更好地理解乙烯的性质和应用。
最后,我们将展望乙烯在未来发展中的潜力和前景。
总之,乙烯作为一种重要的化学物质,在化工领域具有广泛的应用和研究价值。
对乙烯的深入认识,有助于我们更好地理解它的特性和应用,并为乙烯的未来发展提供更多的可能性。
文章结构部分的内容应该对整篇长文的结构进行介绍和概括,可以按以下方式进行撰写:1.2 文章结构本文将按照以下结构进行阐述乙烯化学式和结构式的相关内容:第二部分:乙烯的化学性质在本部分,我们将探讨乙烯的化学性质,包括其化学反应、反应机理以及与其他物质的相互作用等方面。
我们将深入研究乙烯的化学性质,为读者呈现一个全面的乙烯化学行为的图景。
第三部分:乙烯的物理性质在这一部分,我们将重点介绍乙烯的物理性质,如密度、熔点、沸点和溶解度等。
我们将通过实验数据和理论分析,对乙烯的物理性质进行解读,并探索其中的规律和特点。
第四部分:乙烯的应用领域乙烯作为一种重要的化工原料,在工业领域有着广泛的应用。
本部分将详细介绍乙烯在塑料、橡胶、纺织品、医药和日用化学品等领域的应用情况。
我们将探讨乙烯的应用特点、应用领域的前景以及相关产业的发展趋势。
第五部分:结论在这一部分,我们将总结对乙烯化学式和结构式的认识,并强调乙烯在工业和生活中的重要性。
此外,我们将探讨乙烯的未来发展趋势,并对相关科研和技术创新方向进行展望。


生产工艺路线选择乙烯物理性质:通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4 沸点(℃):-103.9 相对密度(水=1):0.61 相对蒸气密度(空气=1):0.98 饱和蒸气压(kPa):4083.40(0℃) 燃烧热(kJ/mol):1411.0 临界温度(℃):9.2 临界压力(MPa):5.04 闪点(fp):无意义引燃温度(℃):425 爆炸上限%(V/V):36.0 爆炸下限%(V/V):2.7 溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
乙醛:外观与性状:无色液体,有强烈的刺激臭味,易挥发。
熔点(℃):-121沸点(℃):20.8相对密度(水=1):0.78相对蒸气密度(空气=1):1.52饱和蒸气压(kPa):98.64(20℃)燃烧热(kJ/mol):279.0 kcal/mol临界温度(℃):188闪点(℃):-39 原料来源:石油裂化催化剂性能:钯盐催化剂溶液有毒,具有酸性,并含有高浓度的氯离子,有强烈的腐蚀性.安全:产品都是易燃易爆有毒物质,与空气能形成爆炸混合物。
环保分析:如是用碳钢制造,要求内衬耐酸耐温橡胶和瓷砖,各法兰连接处和同氧气的罐子腐蚀更严重,一般需采用特种材料。
先进性:通过可得区与理想反应器超级结构法两步系统预分析确定基本单元数量与连接类型,提供求解初值与变量边界,大大降低了模型求解复杂度。
经济性分析:1.反应条件缓和,有较高的选择性2.反应热的除去比较方便,有氧化可用反应物或溶剂的蒸发以移走反应热3.反应温度易控,温度分布均匀4.反应设备结构简单,生产能力高,工艺条件乙醛生产方法1.乙醇氧化法2CH3CH2OH+O2→2CH3CHO+2H2O2.乙炔水合法C2H2+H2O→CH3CHO3.乙烯直接氧化法CH2CH2+O2→CH3CHO1、反应温度一席液相痒化生产乙醛在热力学上是很有利的,温度因素主要影响反应速率和选择性。
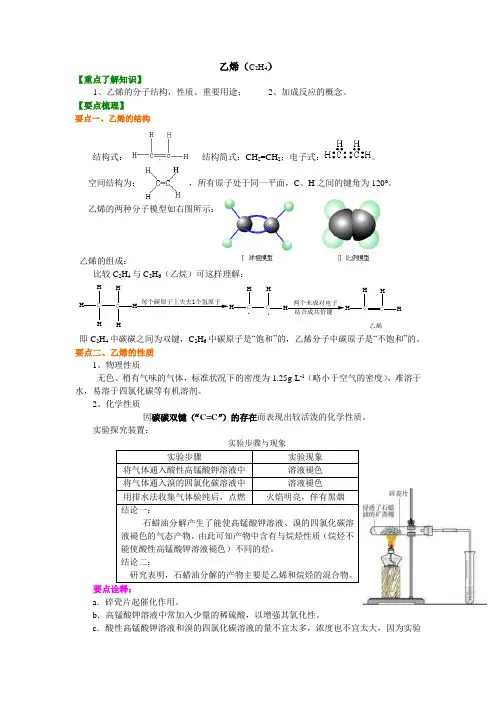
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。

石油化工的龙头——乙烯一、乙烯的组成和结构乙烯分子的结构简式:CH2〓 CH2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置①浓H2SO4的作用:催化剂、脱水剂。
②浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL酒精,再将15 mL浓硫酸缓缓地加入,并不断搅拌。
③由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(使溴水褪色)乙烯除了与溴之外还可以与H 2O 、H 2、卤化氢、Cl 2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H 2O 的加成反应而生成乙醇。
3)聚合反应nCH2=其中 CH 2=CH 2 为单体 —CH 2—CH 2— 为链节 n 为聚合度聚乙烯的分子很大,相对分子质量可达到几万到几十万。

乙烯中碳和氢的成键轨道乙烯是一种有机化合物,由两个碳原子和四个氢原子组成。
它是一种无色气体,具有特殊的化学性质和重要的应用价值。
乙烯中碳和氢的成键轨道是乙烯分子中碳原子与氢原子之间形成化学键的轨道。
本文将从乙烯分子结构、碳和氢原子成键特点、分子轨道理论等方面对乙烯中碳和氢的成键轨道进行深入探讨。
第一章乙烯分子结构及其物理性质1.1乙烯的物理性质乙烯(C2H4)是一种无色、无臭的气体,具有较高的化学活性。
在标准条件下,乙烯的摩尔体积为24.5 L/mol,摩尔质量为28.05g/mol。
本章节将详细介绍乙烯的物理性质,包括密度、熔点、沸点等。
1.2乙烯分子结构模型乙烯分子由两个碳原子和四个氢原子组成。
碳原子之间以双键相连,氢原子与碳原子以单键相连。
根据碳原子的杂化方式,乙烯分子的结构模型可以分为sp2和sp3两种。
1.3乙烯分子中碳原子与氢原子的相对位置在乙烯分子中,两个碳原子之间的距离约为1.34 Å,碳氢键的长度约为1.09 Å。
碳原子与氢原子的相对位置对乙烯的物理性质和化学反应活性具有重要影响。
1.4乙烯分子的空间构型与键角乙烯分子的空间构型为平面三角形,三个原子(两个碳原子和一个氢原子)在平面上呈120°排列。
碳氢键与碳碳双键之间的键角约为180°。
第二章碳与氢之间成键特点2.1炭-碳单键形成机制炭-碳单键的形成主要通过碳原子间的σ键形成。
在乙烯分子中,碳原子通过sp2杂化形成σ键,两个碳原子之间的距离约为1.34 Å。
2.2炭-碳双键形成机制炭-碳双键的形成是通过一个碳原子上的π电子与另一个碳原子上的空π轨道相互作用形成的。
在乙烯分子中,碳原子通过sp2杂化形成π键,两个碳原子之间的距离约为1.34 Å。
2.3炭-氢单键形成机制炭-氢单键的形成是通过碳原子上的σ轨道与氢原子上的电子相互作用形成的。
在乙烯分子中,碳原子通过sp3杂化形成σ键,碳氢键的长度约为1.09 Å。

乙烯物理化学性质归纳乙烯是一种无色、易燃、带有特殊气味的化学物质,其化学式为C2H4。
它是最简单的烯烃,也是最重要的工业化学品之一。
由于其独特的物理和化学性质,乙烯在许多领域都有广泛的应用。
本文将重点归纳乙烯的物理和化学性质。
一、物理性质1、外观与形态:乙烯是一种无色透明气体,具有流动性,没有固定的形状。
2、沸点和熔点:乙烯的沸点为-169℃,熔点为-173℃。
这两个温度点均低于其他常见的烃类化合物。
3、密度和折射率:乙烯的密度为1.179kg/m³,折射率为1.369。
4、蒸汽压和临界参数:乙烯的蒸汽压在常温下为0.537kPa,临界温度为91.7℃,临界压力为4.87MPa。
二、化学性质1、反应活性:乙烯具有高度的反应活性,可以参与多种化学反应,如氧化、氢化、卤化、聚合等。
2、氧化反应:在空气中,乙烯容易被氧化,生成乙醛、乙酸等化合物。
3、氢化反应:乙烯可以与氢气发生加成反应,生成乙烷。
这种反应是工业上生产高纯度乙烷的主要途径。
4、聚合反应:乙烯可以自身聚合生成聚乙烯,也可以与其他烯烃进行共聚。
这是生产聚乙烯的主要化学反应。
5、卤化反应:乙烯可以与卤素(如氯、溴)发生取代反应,生成二氯乙烷、二溴乙烷等化合物。
6、其他反应:乙烯还可以与水发生加成反应,生成乙醇;在高温下,乙烯可以发生裂解反应,生成炭黑和氢气。
三、应用领域由于乙烯的上述物理和化学性质,它在许多领域都有广泛的应用。
以下是几个主要的应用领域:1、塑料和橡胶生产:乙烯是生产聚乙烯的主要原料,聚乙烯是世界上产量最高的塑料。
乙烯也用于生产橡胶和其他合成材料。
2、化学工业:乙烯是许多化学品的原料,如乙醛、乙酸、乙胺等。
这些化学品广泛应用于制药、农业、纺织等领域。
3、燃料工业:乙烯可以用于生产乙醇和乙烷等燃料,也可以直接用作燃料。
4、农业:乙烯可以促进植物生长,提高产量。
在农业上,它常被用作催熟剂。
5、其他领域:除了上述应用领域,乙烯还广泛应用于纤维、涂料、电子等领域。

乙烯性质实验报告乙烯性质实验报告引言:乙烯是一种重要的有机化合物,广泛应用于化工、塑料、橡胶等领域。
为了更好地了解乙烯的性质,我们进行了一系列实验。
本报告将详细介绍实验的目的、方法、结果和讨论。
实验目的:1. 了解乙烯的物理性质,如密度、沸点、熔点等。
2. 探究乙烯的化学性质,如燃烧性质、与溴水反应等。
3. 研究乙烯的溶解性,包括与水、醇类溶剂的相容性。
实验方法:1. 测定乙烯的密度:使用比重瓶法,将乙烯装入比重瓶中,通过称重的方式计算密度。
2. 测定乙烯的沸点:使用沸点仪,将乙烯加热至沸腾,记录沸点温度。
3. 测定乙烯的熔点:使用熔点仪,将乙烯加热至熔化,记录熔点温度。
4. 探究乙烯的燃烧性质:将乙烯点燃,观察燃烧现象和产物。
5. 与溴水反应:将乙烯与溴水混合,观察反应现象。
6. 研究乙烯的溶解性:将乙烯加入水和醇类溶剂中,观察其溶解情况。
实验结果:1. 乙烯的密度为0.971 g/cm³。
2. 乙烯的沸点为-103.7°C。
3. 乙烯的熔点为-169.2°C。
4. 乙烯在空气中燃烧,产生二氧化碳和水。
5. 乙烯与溴水反应,生成1,2-二溴乙烷。
6. 乙烯可溶于水和乙醇,但不溶于正己烷和二氯甲烷。
讨论:通过实验我们可以得出以下结论:1. 乙烯的密度较小,说明其分子比较轻,具有较低的相对分子质量。
2. 乙烯的沸点和熔点较低,表明其分子间力较弱,易于挥发和熔化。
3. 乙烯在空气中燃烧,说明其具有较好的可燃性。
4. 乙烯与溴水反应生成1,2-二溴乙烷,表明乙烯具有不饱和的化学性质。
5. 乙烯可溶于水和乙醇,说明其具有一定的极性。
结论:本实验通过测定乙烯的密度、沸点、熔点,以及研究其燃烧性质、与溴水反应和溶解性等方面,深入了解了乙烯的性质。
乙烯具有较低的密度、沸点和熔点,可燃性较好,具有不饱和的化学性质,并且可溶于水和乙醇。
这些性质使得乙烯在化工、塑料、橡胶等领域有着广泛的应用。
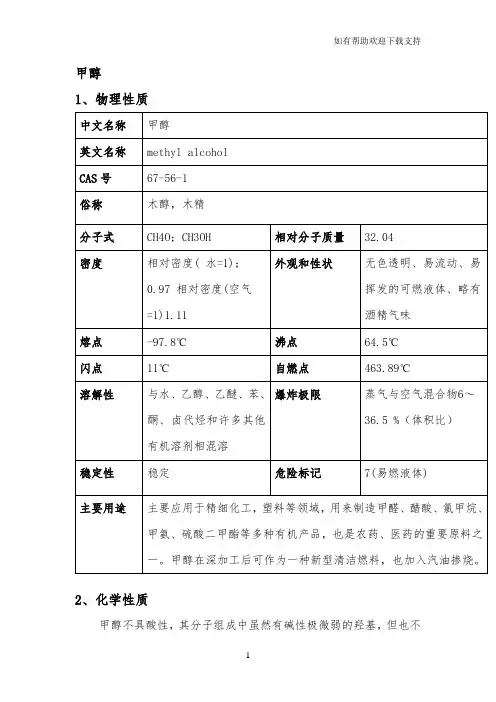
甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质可作为电视、雷达等的高频绝缘材料。
2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质中文名称聚丙烯英文名称polypropylene ,简称PPCAS号9003-07-0俗称百折胶分子式[C3H6]n 结构简式溶解性不溶于常见的酸、碱有机溶剂外观和性状无毒、无臭、无味的乳白色高结晶的聚合物2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。

乙烯熔沸点乙烯,也称为乙烯烷,是一种有机化合物,由两个碳原子和四个氢原子组成,为双键烯烃。
乙烯是在室温下无色有味的气体,有时也可以存在于液态或固态。
乙烯是非常重要的化工原料,在制造塑料、橡胶、溶剂、涂料、染料等方面广泛应用。
在本文中,我们将探讨乙烯的熔沸点及其相关信息。
乙烯的熔点和沸点是物质的重要性质,并且对于乙烯的应用也非常重要。
乙烯是双键烯烃,由于其分子结构不规则,因此乙烯的分子间相互作用较弱,在室温下只能以气态存在。
乙烯的熔点较低,为-169.4℃,沸点为-103.7℃。
乙烯熔点的测定可以通过差示扫描量热法或差示扫描量热分析法进行。
差示扫描量热法是一种通过比较样品和参照物质的热量差异来测定物质熔点的方法,常常用于测定高熔点化合物的熔点,如聚合物、合成晶体等。
差示扫描量热分析法是一种结合了差示扫描量热和热重分析的方法,可以同时测量乙烯的熔点和热重。
除了熔点和沸点,乙烯的物理性质还包括密度、黏度、表面张力等。
乙烯的密度较低,为0.972 g/cm³,黏度较小,表面张力较低。
这使得乙烯在工业生产中易于运输和加工。
乙烯的熔沸点是影响其应用的一个关键因素。
在制造塑料和橡胶方面,乙烯需要在高温、高压的环境下进行聚合反应。
在制造涂料、染料、溶剂等方面,乙烯需要在较低温度和压力下进行反应。
因此,对于不同的应用领域,乙烯的熔沸点有着不同的要求。
此外,乙烯的熔沸点还受到许多因素的影响,如环境温度、压力、杂质、化学结构等。
通过调节这些因素,可以调整乙烯的熔沸点,以满足特定的应用需求。
总之,乙烯的熔沸点是其重要的物理性质之一,影响着乙烯的应用。
通过测定和调节乙烯的熔沸点,可以获得适合不同应用领域的乙烯制品。
甲醇1、物理性质2、化学性质甲醇不具酸性,其分子组成中虽然有碱性极微弱的羟基,但也不具有碱性,对酚酞和石蕊呈中性。
遇热、明火或氧化剂易燃烧。
甲醇的主要下游产品有甲醛、甲酸甲酯、醋酸等乙烯1、物理性质2、化学性质乙烯分子里含有C=C双键,C═C双键的键能比两倍C—C单键能略小,所以其中的一个键较易断裂,这就决定了乙烯的化学性质比较活泼。
干净的乙烯能在空气中燃烧,有明亮的火焰,同时发出黑烟。
乙烯不仅能和溴、氢气、氯气、卤化氢以及水等在适宜的反应条件下起加成反应,还能被氧化剂氧化,如被高锰酸钾(KMnO4)氧化。
乙烯能在催化剂的作用下发生聚合反应,生成聚乙烯,聚乙烯是一种重要的塑料。
乙烯主要的下游产品有聚乙烯(约占乙烯耗量的45%)、二氯乙烷、氯乙烯、环氧乙烷、乙二醇、苯乙烯、乙醛、酒精、高级醇等丙烯1、物理性质2、化学性质丙烯除了在烯键上起反应外,还可在甲基上起反应,决定了丙烯能够发生许多化学反应。
丙烯在不同种催化剂的催化下发生各类聚合反应,如生成聚丙烯等聚合物,还可与硫酸、氯和水等发生加成反应,也能在催化剂存在下与氨和空气中的氧起氨氧化反应,生成丙烯腈,它是合成塑料、橡胶、纤维等高聚物的原料,等等。
丙烯主要的下游产物是聚丙烯,另外丙烯可制丙烯腈、异丙醇、苯酚和丙酮、丁醇和辛醇、丙烯酸及其脂类以及制环氧丙烷和丙二醇、环氧氯丙烷和合成甘油等。
聚乙烯1、物理性质2、化学性能聚乙烯有优异的化学稳定性,室温下耐盐酸、氢氟酸、磷酸、甲酸、胺类、氢氧化钠、氢氧化钾等各种化学物质,硝酸和硫酸对聚乙烯有较强的破坏作用。
聚乙烯容易光氧化、热氧化、臭氧分解,在紫外线作用下容易发生降解,碳黑对聚乙烯有优异的光屏蔽作用。
受辐射后可发生交联、断链、形成不饱和基团等反映。
聚丙烯1、物理性质2、化学性能聚丙烯的化学稳定性很好,除能被浓硫酸、浓硝酸侵蚀外,对其它各种化学试剂都比较稳定,但低分子量的脂肪烃、芳香烃和氯化烃等能使PP软化和溶胀,同时它的化学稳定性随结晶度的增加还有所提高,所以聚丙烯适合制作各种化工管道和配件,防腐蚀效果良好。
乙烯的化学性质
1、乙烯分子式:C2H4结构简式:CH2═CH2结构式:(6个原子在同一平面上)
根据乙烯的结构,可以推测其他烯烃的结构,如C6H12中6个C在同一平面上的结构为
2、物理性质
常温下为无色、无味稍有气味,比空气略轻,难溶于水
3、化学性质
(1)氧化性
①可燃性:CH2=CH22CO2+2H2O
现象:火焰明亮,有黑烟;原因:含碳量高
②可使酸性高锰酸钾溶液褪色
(2)加成反应
有机物分子中双键(或叁键)两端的碳原子上与其他的原子或原子团直接结合生成新的化合物的反应
CH2=CH2+Br2→CH2BrCH2Br1,2﹣二溴乙烷
CH2=CH2+H2CH3CH3
CH2=CH2+Cl2CH2ClCH2Cl1,2﹣二氯乙烷
CH2=CH2+HCl CH3CH2Cl氯乙烷
CH2=CH2+H2O CH3CH2OH
(3)加聚反应
聚合反应:由相对分子量小的化合物互相结合成相对分子量很大的化合物.这种由加成发生的聚合反应叫加聚反应
(反应条件为高温高压催化剂)
4、乙烯的用途:
(1)石油化工基础原料;(2)植物生长调节剂、催熟剂
评价一个国家乙烯工业的发展水平已经成为衡量这个国家石油化学工业的重要标志之一.。
鉴别甲烷和乙烯的方法甲烷和乙烯都是常见的碳氢化合物,它们在结构上有一定的差异。
下面我将从物理性质、化学性质和实验方法等几个方面详细介绍甲烷和乙烯的鉴别方法。
一、甲烷和乙烯的物理性质鉴别方法:1. 熔点和沸点:甲烷的熔点为-182.5摄氏度,沸点为-161.5摄氏度;乙烯的熔点为-169摄氏度,沸点为-103.7摄氏度。
通过测量样品的熔点和沸点,可以初步判断其是否为甲烷或乙烯。
2. 密度:甲烷的密度为0.7164 g/cm³,乙烯的密度为0.5678 g/cm³。
通过测量样品的密度,可以进一步鉴别甲烷和乙烯。
二、甲烷和乙烯的化学性质鉴别方法:1. 燃烧反应:甲烷与氧气发生燃烧反应生成二氧化碳和水,乙烯也能与氧气发生燃烧反应生成二氧化碳和水。
但是由于甲烷的热效应更高,因此甲烷的燃烧反应更为剧烈,火焰明亮耀眼。
2. 与卤素的反应:乙烯能与卤素发生加成反应,生成醋酸乙烯。
而甲烷由于缺乏双键,无法与卤素发生加成反应。
3. 与溴水的反应:溴水是检验烯烃的试剂之一。
乙烯与溴水反应,溴在乙烯上发生加成反应,生成无色液体溴化乙烷。
而甲烷由于无双键,无法与溴水发生反应,溴水仍为黄色。
4. 氢化反应:乙烯能与氢气发生加氢反应,生成乙烷。
而甲烷已经是最高度饱和的烃,无法发生氢化反应。
三、甲烷和乙烯的实验鉴别方法:1. 使用气体色谱仪(GC):气体色谱仪是一种常见的用于鉴别和分离化合物的仪器。
乙烯和甲烷在气体色谱上会有不同的保留时间或峰值,通过检测样品在气相色谱上产生的色谱图,可以鉴别甲烷和乙烯。
2. 使用红外光谱仪(IR):红外光谱主要用于分析和鉴别化合物的官能团。
甲烷和乙烯在红外光谱上会有不同的吸收峰,可以通过检测样品在红外光谱上的吸收峰来鉴别甲烷和乙烯。
3. 使用质谱仪(MS):质谱仪主要用于分析和鉴别化合物的分子结构和分子量。
甲烷和乙烯在质谱上会有不同的质谱图,可以通过检测样品在质谱上产生的质谱图来鉴别甲烷和乙烯。
生产工艺路线选择乙烯物理性质:通常情况下,乙烯是一种无色稍有气味的气体,密度为1.25g/L,比空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂。
外观与性状:无色气体,略具烃类特有的臭味。
少量乙烯具有淡淡的甜味。
吸收峰:吸收带在远紫外区pH:水溶液是中性熔点(℃):-169.4 沸点(℃):-103.9 相对密度(水=1):0.61 相对蒸气密度(空气=1):0.98 饱和蒸气压(kPa):4083.40(0℃) 燃烧热(kJ/mol):1411.0 临界温度(℃):9.2 临界压力(MPa):5.04 闪点(fp):无意义引燃温度(℃):425 爆炸上限%(V/V):36.0 爆炸下限%(V/V):2.7 溶解性:不溶于水,微溶于乙醇、酮、苯,溶于醚。
溶于四氯化碳等有机溶剂。
乙醛:外观与性状:无色液体,有强烈的刺激臭味,易挥发。
熔点(℃):-121沸点(℃):20.8相对密度(水=1):0.78相对蒸气密度(空气=1):1.52饱和蒸气压(kPa):98.64(20℃)燃烧热(kJ/mol):279.0 kcal/mol临界温度(℃):188闪点(℃):-39 原料来源:石油裂化催化剂性能:钯盐催化剂溶液有毒,具有酸性,并含有高浓度的氯离子,有强烈的腐蚀性.安全:产品都是易燃易爆有毒物质,与空气能形成爆炸混合物。
环保分析:如是用碳钢制造,要求内衬耐酸耐温橡胶和瓷砖,各法兰连接处和同氧气的罐子腐蚀更严重,一般需采用特种材料。
先进性:通过可得区与理想反应器超级结构法两步系统预分析确定基本单元数量与连接类型,提供求解初值与变量边界,大大降低了模型求解复杂度。
经济性分析:1.反应条件缓和,有较高的选择性2.反应热的除去比较方便,有氧化可用反应物或溶剂的蒸发以移走反应热3.反应温度易控,温度分布均匀4.反应设备结构简单,生产能力高,工艺条件乙醛生产方法1.乙醇氧化法2CH3CH2OH+O2→2CH3CHO+2H2O2.乙炔水合法C2H2+H2O→CH3CHO3.乙烯直接氧化法CH2CH2+O2→CH3CHO1、反应温度一席液相痒化生产乙醛在热力学上是很有利的,温度因素主要影响反应速率和选择性。