edta二钠结构式
- 格式:docx
- 大小:11.18 KB
- 文档页数:2

乙二胺四乙酸二钠乙二胺四乙酸二钠本文主要介绍了乙二胺四乙酸二钠的基本信息,离解平衡,特点,危险性与应急处理,操作处置与储存等基本信息药品名称中文名称:乙二胺四乙酸二钠。
化学名称:EDTA-2Na中文别名:乙二胺四乙酸二钠,乙二胺四乙酸二钠盐,EDTA二钠,EDTA二钠盐。
英文名称: Ethylenediaminetetraacetic acid disodium salt英文别名:Edetate disodium,Disodium ethylenediaminetetraacetate dihydrate;Ethylenediaminetetraacetic acid disodium salt solution; disodium dihydrogen ethylenediaminetetraacetate; Edetic acid disodium salt; EDTA disodium salt; (Ethylenedinitrilo)tetraacetic acid disodium salt简介【等级】: PT乙二胺四乙酸二钠的分子结构图【CAS号】: 6381-92-6【分子式】: C10H14N2Na2O8【分子量】: 372.24【结构式】:HOOCH2C CH2COONa N-CH2-CH2-N HOOCH2C CH2COONa【性状】:为无味无臭或微咸的白色或乳白色结晶或颗粒状粉末。
溶于水,不溶于乙醇、乙醚。
【用途】:作重金属解毒药、络合剂、抗氧增效剂、稳定剂及软化剂等;钙、镁及其他金属试剂,金属掩蔽剂。
乙二胺四乙酸二钠是一种重要络合剂,用于络合金属离子和分离金属。
乙二胺四乙酸二钠与钙离子作用【性状】:白色结晶性粉末,能溶于水,几乎不溶于乙醇、乙醚,其水溶液pH值约为5.3。
【熔点】:252°C【贮藏】:密封保存。
制备可由EDTA与氢氧化钠和碳酸钙作用制得。
乙二胺四乙酸又叫做EDTA,是化学中一种良好的配合剂,它有六个配位原子,形成的配合物叫做鳌合物,EDTA在配位滴定中经常用到,一般是测定金属离子的含量。

edta 2na分子量EDTA-2Na,全称为二钠盐乙二胺四乙酸,是一种常用于化学分析、医药制造和环境保护等领域的化学物质,也是一种强烈的螯合剂。
本文将从分子量的角度来介绍EDTA-2Na的相关知识。
EDTA-2Na的分子式为C10H14N2Na2O8,其分子量约为336.21g/mol。
可以看出,EDTA-2Na分子量相对较大,这意味着它的分子内含有很多原子。
具体来说,EDTA-2Na由4个乙二胺基(NH2CH2CH2NH2)和4个乙二酸基(HOOCCH2CH2COOH)构成,每个乙二胺基和乙二酸基之间都有一个羧基(COOH)和一个氨基(NH2)相连。
此外,EDTA-2Na分子中还含有2个钠离子(Na+),这些离子与EDTA-2Na分子中的羧基形成盐桥,使其分子具有一定的电荷。
由于EDTA-2Na分子中含有多个羧基和氨基,因此它具有很强的螯合性。
螯合是指通过配位键将金属离子与配体结合在一起的过程。
EDTA-2Na可以与多种金属离子形成稳定的络合物,如钙、镁、锌、铁、铜等离子,这些络合物具有广泛的应用,如螯合剂、缓冲剂、稳定剂等。
除此之外,EDTA-2Na还具有多种其他的特性。
例如,它可以作为一种强酸性树脂的交联剂,在化学分析中广泛应用;它还可以与某些粘合剂相容,用于制备一些高性能粘合剂;此外,EDTA-2Na还可以用于水质处理、医药制造等领域。
总之,EDTA-2Na是一种重要的化学物质,它具有很强的螯合性和多种应用特性。
不同于其他化学物质,它的分子量相对较大,其中包含了多个乙二胺基、乙二酸基和钠离子等,这些基团相互作用形成了稳定的分子结构。
在今后的研究和应用中,我们有信心发掘出更多EDTA-2Na的潜力,为科学技术的发展做出更多的贡献。

乙二胺四乙酸二钠0基本信息中文名称:乙二胺四乙酸二钠。
化学名称:EDTA-2学中文别名:乙二胺四乙酸二钠,乙二胺四乙酸二钠盐,EDTA二钠,EDTA 二钠盐。
英文名称:Ethylcnediaminetetraacetic acid disodium salt【CAS 号】:6381-92-6【分子式】:C10H14N2Na208 - 2H20【分子量】:372. 24式】:H00CH2C CH2C00Na N-CH2-CH2-N H00CH2CCH2C00Na【性状】:为无味无臭或微咸的白色或乳白色结晶或颗粒状粉末。
溶于水, 不溶于乙醇、乙酷。
【用途】:作重金属解毒药、络合剂、抗氢增效剂、稳定剂及软化剂等;钙、镁及其他金属试剂,金属掩蔽剂。
乙二胺四乙酸二钠是一种重要络合剂, 用于络合金属离子和分离金属。
【性状】:白色结晶性粉末,能溶于水,几乎不溶于乙醇、乙醛,其水溶液pH 值约为5. 3O【熔点】:252。
C【贮藏】:密封保存。
2、使用须知操作注意事项密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
远离火种、热遮,工作场所严禁吸烟。
使用防爆型的通风系统和设备。
避免产生粉尘。
避免与氧化剂接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备相应品种和数量的消防器材及泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项储存于阴凉、通风的库房。
远离火种、热源。
应与氧化剂分开存放,切忌混储。
配备相应品种和数量的消防器材。
储区应备有合适的材料收容泄漏物。
运输注意事项起运时包装要完整,装载应稳妥。
运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。
严禁与氧化剂、食用化学品等混装混运。
运输途中应防曝晒、雨淋,防高温。
车辆运输完毕应进行彻底清扫。
3、应急处理危害危险健康危害:对粘膜和上呼吸道有刺激作用。
对眼睛、皮肤有刺激作用。

EDTA的性质及其配合物——配位滴定法(一)一、EDTA的性质简称EDTA或EDTA酸(以H4Y表示),它同时含有羧基和氨基,其结构式如下: EDTA溶解度较小(在22℃时每100mL 水能溶解0.2g),难溶于酸和普通有机溶剂,易溶于氨水和氢氧化钠溶液,并生成相应的盐。
通常都用它的二钠盐(可用符号Na2H2Y 2H2O 表示),习惯上仍称为EDTA,它在水中溶解度较大,22℃时100mL水中可溶11.1g,此溶液浓度约为0.3mol·L-1,pH约为4.5。
它的两个氨基氮可再接受H+,形成H6Y2+,因此相当于六元酸,有六级离解平衡:可见,EDTA在溶液中可能以H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、HY3-、Y4-7种形式存在。
在不同的pH条件下,7种形式所占的比例不同。
例如,在pH 2的强酸性溶液中,EDTA主要以H4Y形式存在;在pH=2.67~6.16的溶液中,主要以H2Y2-形式存在;在pH=6.2~10.2的溶液中,主要以HY3-形式存在;在pH 10.2的碱性溶液中,主要以Y4-形式存在。
在这7种形式中,惟独Y4-能与金属离子挺直协作。
溶液的酸度越低,Y4-的浓度越大。
因此,EDTA在碱性溶液中配位能力较强。
二、EDTA与金属离子形成协作物的特点在EDTA分子中,2个氨基氮和4个羧基氧均可给出电子对而与金属离子形成配位键,其整合物的结构式见图4-2.该协作物有如下特点;①普遍性。
EDTA能与许多金属离子配位形成鳌合物。
②组成一定。
除极少数的金属离子外,EDTA 与任何价态的金属离子均生成1:1的协作物,即1mol金属离子总是作用1molEDTA。
如:③稳定性强。
EDTA与金属离子形成的赘合物中包含了多个五元环,因此具有高度的稳定性。
④易溶性。
EDTA与金属离子形成的协作物大多易溶于水。
因为这一特点才使配位滴定法在水溶液中举行,不至于形成沉淀干扰滴定。

浅谈EDTA在水泥化学分析中的应用1 EDTA的特性乙二胺四乙酸是一个有机四元酸.简称EDTA,习惯上用H4Y表示。
由于它在水中的溶解度很小(22℃时,每100ml水中仅能溶解0.029),故常用它的二钠盐Na2H2Y·2H2 O(一般也简称EDTA),其二纳盐的溶解度大(22℃时,每100ml水中能溶解11.1g)。
在水溶液中乙二胺四乙酸(即H4Y)具有双偶极离子结构:此外,两个羧酸根还可以接受质子.随溶液酸度不同,它在水溶液中可以存在以下七种形式:H6Y“,H5Y+,H4Y,H3Y一,H2Y2。
,HY3-,Y4—。
随溶液pH值不同,EDTA在溶液中各种形式的分布分数也不同,酸度越高,含H存在形式越多。
在这七种形式中,只有Y4-能与金属离子直接配位,所以溶液的酸度越低,Y4-的分布分数越大,EDTA配位能力越强。
由于EDTA分子中具有两个氨氮原子和四个羧氧原子,都有孤对电子,即有6个配位原子。
因此,绝大多数金属离子都能与EDTA形成多个五元环的较稳定的螯合物,其配位比除极少数高价离子以外,皆为l:l配位,不存在分级配位现象。
并且生成的配合物大多能溶于水,从而可以在水溶液中进行滴定。
2 EDTA配合物的稳定性及影响因素EDTA(这里指二钠盐Na2H2Y·2H2 O,以下均相同)与大多金属离子形成l:1型的配合物,主反应通式如下(略去电荷):M+Y MY此反应为配位滴定的主反应。
平衡时配合物的稳定常数K MY为:K MY=C MY(C M·C Y)式中C MY,C M,C Y分别为产物和反应物的物质的量浓度。
K MY越大.形成的配合物越稳定,测定误差越小,结果的准确度越高。
由于EDTA与金属离子配合物的稳定性随金属离子的不同而存在较大的差别,这是金属离子的本质因素所决定的,本文对此不予考虑。
以下所说的影响配合物稳定性的因素是指分析测定过程中人为可以控制的因素。
(1)溶液的酸度。

edta2钠检测指标分析与解读标题:EDTA-2钠检测指标分析与解读概述:本文将深入探讨EDTA-2钠(二乙酸亚铁)的检测指标,重点分析其在化学分析、金属离子螯合等领域的应用,并提供一份基于深度和广度标准的全面分析。
导言:EDTA-2钠作为一种重要的配位试剂,广泛应用于化学、医学、环境科学等领域。
在本文中,我们将探讨其检测指标的意义及其应用,并解读其在分析化学中的重要性。
目录:1. EDTA-2钠的基本特点2. EDTA-2钠的化学性质与结构3. EDTA-2钠的检测指标与方法3.1 重铬酸钾法3.2 紫外分光光度法3.3 电化学法4. EDTA-2钠的应用领域4.1 化学分析中的应用4.2 金属离子螯合剂4.3 医学和生物化学中的应用5. 总结与展望第一部分:EDTA-2钠的基本特点EDTA-2钠,化学名二乙酸亚铁二钠盐,是一种白色晶体粉末。
它是一种强大的螯合剂,可以与金属离子形成稳定的络合物。
EDTA-2钠在化学反应和分析化学中的应用广泛,并且具有较好的选择性和灵敏性。
第二部分:EDTA-2钠的化学性质与结构EDTA-2钠的化学结构为C10H14FeN2Na2O8,包含了8个氧原子和两个负电荷。
它具有强碱性和配位性,能够与多种金属离子形成络合物。
理解其化学性质和分子结构对于理解其检测指标和应用具有重要意义。
第三部分:EDTA-2钠的检测指标与方法本部分将介绍几种常用的EDTA-2钠检测指标及其相应的分析方法。
其中包括重铬酸钾法、紫外分光光度法和电化学法。
每种方法都有其适用范围和优缺点,我们将详细分析其原理和操作步骤。
第四部分:EDTA-2钠的应用领域EDTA-2钠作为一种重要的化学试剂,在各个领域都有广泛的应用。
本部分将探讨其在化学分析、金属离子螯合剂、医学和生物化学等方面的具体应用。
我们将展示其在病理学、环境科学等领域中的优势和潜在应用前景。
第五部分:总结与展望本文将回顾EDTA-2钠的检测指标、化学性质和应用领域,并对目前的研究现状进行总结。

乙二胺四乙酸二钠乙二胺四乙酸二钠(EDTA-Na2)是一种常用的螯合剂,广泛应用于化学、生物和环境科学领域。
它不仅具有良好的螯合性能,还具有较高的稳定性和无毒性,因此在许多领域都有重要的应用。
结构和性质乙二胺四乙酸二钠是一种无色结晶性固体,其分子式为C10H14N2Na2O8,相对分子质量为336.21。
它可溶于水和多数有机溶剂,呈碱性,在水溶液中呈现正离子形式。
由于其四个乙酸根与二个乙胺氮原子配位,形成了一种稳定的螯合络合物。
应用领域化学应用乙二胺四乙酸二钠在化学分析中广泛应用。
由于它能与许多金属离子形成稳定的络合物,因此可以用于金属离子的螯合分离和确定。
在水质分析中,乙二胺四乙酸二钠被用作去除水样中的金属离子,分析中常用来螯合重金属离子,如铁、铜、锌等。
生物科学乙二胺四乙酸二钠在生物科学领域具有重要的应用。
它可以与金属离子结合,形成配位化合物,可以用于分离和纯化蛋白质。
在细胞培养中,乙二胺四乙酸二钠也经常被用作络合剂,用于组织工程、基因转染等实验研究。
环境科学在环境科学中,乙二胺四乙酸二钠常被用作重金属离子的螯合剂。
由于它能有效地与金属离子结合,可以用于废水处理和土壤修复。
乙二胺四乙酸二钠可以形成络合物,稳定了金属离子的结构,减少了其对环境的污染。
使用方法乙二胺四乙酸二钠的使用方法根据具体应用可以有所不同。
在化学分析中,可以将乙二胺四乙酸二钠直接加入溶液中进行金属离子的螯合反应。
在生物实验中,可以将乙二胺四乙酸二钠溶解在适当的缓冲溶液中,然后进行蛋白质的分离和纯化。
在环境科学中,可以将乙二胺四乙酸二钠溶解在废水中,通过与金属离子的络合来达到净化废水的目的。
需要注意的是,乙二胺四乙酸二钠应该存放在干燥的地方,避免与湿气接触,以免影响其稳定性和效果。
在使用过程中应注意安全,避免其误食或接触眼睛和皮肤。
安全性乙二胺四乙酸二钠是一种相对安全的化合物,对人体无毒。
但在操作时仍需注意安全,避免误食和长时间接触皮肤。

•乙二胺四乙酸二钠别名:EDTA二钠盐CAS No.:6381-92-6 分子式:C10H14N2O8Na2·2H2O 分子量:372.24 性状:白色结晶粉末,溶于水, 几乎不溶于乙醇。
技术指标:符合Q/STJS02标准(参照《日本食品添加物公定书》1996年版) 指标名称指标含量,%≥ 99.0 pH值(10g/L溶液,25℃) 4.3—4.7 砷(以AS 计),mg/Kg ≤ 10.0 重金属(以Pb计),mg/Kg ≤ 1.5 主要用途:根据食品添加剂使用卫生标准GB2760-1996(含1997-2002年增补品种),本产品广泛用作稳定剂、抗氧化剂、防腐剂、螯合剂、防止金属离子引起的变色、变质、变浊及维生素的氧化损失。
使用于酱菜和罐头,饮料、食品(根据美国FDA的资料,EDTA 二钠可用于香肠,色拉酱,蛋黄酱,谷类食品)、水产养殖。
工业上也可用于电镀、洗涤剂、液体肥皂、洗发剂、彩色感光材料冲洗加工漂白定影液、净水剂、pH调节剂、阻凝剂、丁苯橡胶聚合过程中的活化剂等。
EDTA二钠乙二胺四乙酸二钠是强效螯合剂,防腐剂和抗氧化剂。
因具有很高稳定常数,能与碱金属以外的绝大多数金属离子生成稳定的络合物,消除金属离子或由其引起的有害作用,抑制水煮食品的水混浊,防止食品氧化变色,从而起到抗氧化、护色、防腐的作用,使产品质量稳定,是极为广泛使用的护色剂、品质改良剂和抗氧化剂,防腐保鲜剂。
广泛应用于水果、蔬菜制品、奶制品、饮料、肉制品、果脯、酱料的保鲜、护色,也应用于油脂、香精的抗氧化。
分子式:C10H14N2Na2O8·2H2O分子量:372.24性状::白色结晶颗粒或白色结晶粉末 .名称标准含量% ≥98.0重金属(按Pb计)% ≤0.005氯化物(Cl)% ≤0.02名称范围最大用量(mg/Kg)乙二胺四乙酸二钠海鲜、肉类罐头、酱菜、酸渍蔬菜、果脯250饮料、油脂、香精35沙拉酱、沙司、酱料、人造奶油75应用举例:渍酸菜、泡菜:发缸时和盐混合加入,或发缸变酸后和防腐剂一起加入,用量为20g/100kg,可使酸菜菜色均匀鲜亮,组织脆香味纯正。

edta钠二水合物相对分子质量
摘要:
一、介绍乙二胺四乙酸二钠的基本信息
二、阐述乙二胺四乙酸二钠的化学性质
三、介绍乙二胺四乙酸二钠在各个领域的应用
四、总结乙二胺四乙酸二钠的特点和优势
正文:
乙二胺四乙酸二钠(EDTA 钠二水合物)是一种多功能的螯合剂,由乙二胺、四乙酸和钠离子组成。
它的化学式为C10H14N2Na2O8·2H2O,分子量为372.24。
乙二胺四乙酸二钠具有稳定的化学性质,能与多种金属离子形成稳定的螯合物。
它具有六个配位原子,形成的配合物叫做螯合物。
乙二胺四乙酸二钠能与多种金属离子形成稳定的螯合物,如铜离子、铁离子、锌离子等。
乙二胺四乙酸二钠具有良好的溶解性和热稳定性,能在不同温度和pH 值下保持稳定。
它在我国化工、食品、医药等行业有广泛的应用。
在化工行业,乙二胺四乙酸二钠常用作染料、涂料、胶粘剂等的稳定剂,以提高产品的稳定性和耐候性。
在食品行业,它可用作食品添加剂,如防腐剂、抗氧化剂等。
在医药行业,乙二胺四乙酸二钠可用作血液抗凝剂、洗剂、注射剂等。

乙二胺四乙酸二钠二水合物的用途在我们认知的EDTA系列产品中常用的有EDTA-2K,EDTA-3K,EDTA-2Na。
其中应用比较广泛的为EDTA二钠产品,EDTA作为工业中最重要的螯合剂,可用作重金属解毒药、络合剂、抗氧增效剂、稳定剂及软化剂等;钙、镁及其他金属试剂,金属掩蔽剂。
乙二胺四乙酸二钠是一种重要络合剂,用于络合金属离子和分离金属。
日化、清洗方面常用!乙二胺四乙酸二钠二水合物,又称 EDTA二钠,CAS号是6381-92-6,分子式为C10H14N2O8Na2·2H2O ,外观是为白色结晶粉末,它无臭、无味,能溶于水,极难溶于乙醇。
EDTA-2Na可对粘膜、上呼吸道、眼睛及皮肤产生刺激作用,另外,EDTA-2Na还可与钙离子结合成可溶的络合物,如果不按规定或超限量使用EDTA-2Na会影响身体健康,可引起呕吐、腹泻、和急腹痛等症状,也可能导致人体中微量元素的流失,如减少血钙浓度,引起低钙血症。
乙二胺四乙酸二钠二水合物有六个配位原子,两个结晶水,是一种优良的螯合剂,络合多种金属离子和分离金属的能力相当强,可用作彩色感光材料冲洗加工的漂白定影液及染色助剂、纤维处理剂、化妆品添加剂、医药、食品、农业化学微肥生产、血液抗凝剂、洗涤剂中的软水剂、稳定剂、合成橡胶、聚合引发剂和重金属定量分析剂等。
具体应用示例如下:1. 乙二胺四乙酸二钠二水合物作为络合剂:用于将硬水软化,有效络合硬水中的多种金属离子,如钙、镁及铁、铅、铜、锰等;在洗涤助剂和感光化学品中作用较大,可增强洗涤剂中的洗净力、起泡力、浸透力和乳化力,也可以控制漂白液中三价铁离子的浓度,防止沉淀的产生,提高洗涤质量;2. 乙二胺四乙酸二钠二水合物作为基准试剂:用于各行各业的化学分析,它是化学分析标准溶液的重中之重,是分析检测中必不可少的工作变量基准物。
3. 乙二胺四乙酸二钠二水合物作为稳定剂:用于医药注射剂中,能有效增强药物的稳定性,其原理为依地酸二钠可以与金属离子形成稳定的水溶性螯合物,能够防止自身的氧化,有利于提高药物在制备、存储和临床配制过程中的稳定性。
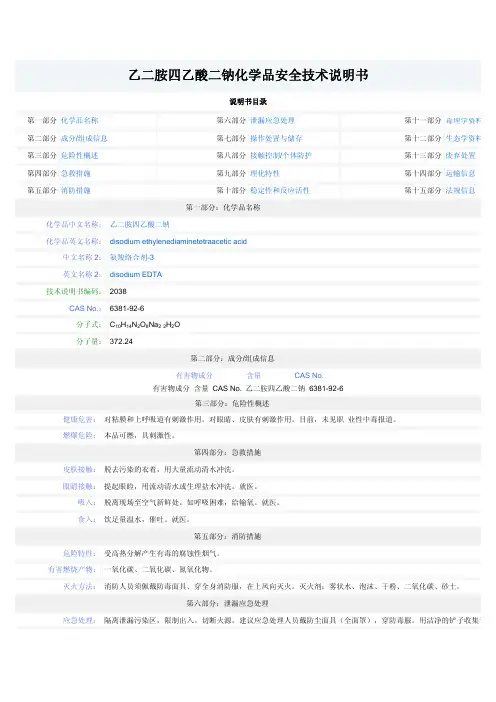
乙二胺四乙酸二钠化学品安全技术说明书说明书目录第一部分化学品名称第六部分泄漏应急处理第十一部分毒理学资料第二部分成分/组成信息第七部分操作处置与储存第十二部分生态学资料第三部分危险性概述第八部分接触控制/个体防护第十三部分废弃处置第四部分急救措施第九部分理化特性第十四部分运输信息第五部分消防措施第十部分稳定性和反应活性第十五部分法规信息第一部分:化学品名称化学品中文名称:乙二胺四乙酸二钠化学品英文名称:disodium ethylenediaminetetraacetic acid中文名称2:氨羧络合剂-3英文名称2:disodium EDTA技术说明书编码:2038CAS No.:6381-92-6分子式:C10H14N2O8Na22H2O分子量:372.24第二部分:成分/组成信息有害物成分含量CAS No.有害物成分含量CAS No. 乙二胺四乙酸二钠6381-92-6第三部分:危险性概述健康危害:对粘膜和上呼吸道有刺激作用。
对眼睛、皮肤有刺激作用。
目前,未见职业性中毒报道。
燃爆危险:本品可燃,具刺激性。
第四部分:急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:脱离现场至空气新鲜处。
如呼吸困难,给输氧。
就医。
食入:饮足量温水,催吐。
就医。
第五部分:消防措施危险特性:受高热分解产生有毒的腐蚀性烟气。
有害燃烧产物:一氧化碳、二氧化碳、氮氧化物。
灭火方法:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
第六部分:泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
切断火源。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
用洁净的铲子收集于干盖的容器中,转移至安全场所。
若大量泄漏,收集回收或运至废物处理场所处置。
第七部分:操作处置与储存操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
第六章思考题与习题1.填空(1)EDTA是一种氨羧络合剂,名称,用符号表示,其结构式为。
配制标准溶液时一般采用EDTA二钠盐,分子式为,其水溶液pH为,可通过公式进行计算,标准溶液常用浓度为。
(2)一般情况下水溶液中的EDTA总是以等型体存在,其中以与金属离子形成的络合物最稳定,但仅在时EDTA才主要以此种型体存在。
除个别金属离子外。
EDTA与金属离子形成络合物时,络合比都是。
(3)K'MY称,它表示络合反应进行的程度,其计算式为。
(4)络合滴定曲线滴定突跃的大小取决于。
在金属离子浓度一定的条件下,越大,突跃;在条件常数K'MY一定时,越大,突跃。
(5)K'MY值是判断络合滴定误差大小的重要依据。
在pM'一定时,K'MY越大,络合滴定的准确度。
影响K'MY的因素有,其中酸度愈高愈大,lg'MY ;的络合作用常能增大,减小。
在K'MY一定时,终点误差的大小由决定,而误差的正负由决定。
(6)在[H+]一定时,EDTA酸效应系数的计算公式为。
答:2.解:Cu2+、、Zn2+、、Cd2+、Ni2+等离子均能与NH3形成络合物,为什么不能以氨水为滴定剂用络合滴定法来测定这些离子?答:3.不经具体计算,如何通过络合物ML n的各βi值和络合剂的浓度[L]来估计溶液中络合物的主要存在型体?答:4.已知乙酰丙酮(L)与Al3+络合物的累积常数lgβ1~lgβ3分别为8.6,15.5和21.3,AlL3为主要型体时的pL范围是多少?[AlL]与[AlL2]相等时的pL为多少?pL为10.0时铝的主要型体又是多少?解:5.铬蓝黑R(EBR)指示剂的H2In2-是红色,HIn2-是蓝色,In3-是橙色。
它的p K a2=7.3,p K a3=13.5。
它与金属离子形成的络合物MIn是红色。
试问指示剂在不同的pH的范围各呈什么颜色?变化点的pH是多少?它在什么pH范围内能用作金属离子指示剂?解:6.Ca2+与PAN不显色,但在pH=10~12时,加入适量的CuY,却可以用PAN作为滴定Ca2+的指示剂,为什么?解:7.用NaOH 标准溶液滴定FeCl3溶液中游离的HCl时,Fe3+将如何干扰?加入下列哪一种化合物可以消除干扰?EDTA,Ca-EDTA,柠檬酸三钠,三乙醇胺。
edta二钠盐化学式《edta二钠盐化学式》同学们,今天咱们来聊聊edta二钠盐的化学式,不过在这之前呢,咱们得先搞清楚一些化学里的基础概念,这样才能更好地理解这个化学式。
咱们先说说化学键吧。
化学键就像是原子之间的小钩子,把原子们连接在一起。
这里面有离子键和共价键两种常见的。
离子键啊,就像是带正电和带负电的原子像超强磁铁一样吸在一起。
比如说氯化钠,钠原子带正电,氯原子带负电,“嗖”的一下就吸在一块儿了。
那共价键呢,就是原子们共用小钩子连接起来的。
就像两个人共同拿着一个东西,谁也不放手,就这么连接起来了。
再说说化学平衡,这个就好比是拔河比赛。
反应物和生成物就像是两队人,在反应的过程中,一开始两边的力量可能不一样,但是到最后会达到一种正逆反应速率相等、浓度不再变化的状态,就像拔河的时候两边都用同样的力气拉着绳子,绳子就不动了,这时候反应就达到平衡了。
分子的极性也很有趣哦。
咱们可以把分子想象成小磁针。
就拿水来说吧,水是极性分子。
水的分子结构是氧原子和两个氢原子连接,氧一端就像磁针的南极,带负电,氢一端就像北极,带正电。
而二氧化碳呢,它是直线对称的,就像一个两边完全一样的东西,它就是非极性分子啦。
还有配位化合物,这个概念也不难理解。
咱们可以把中心离子当成是聚会的主角,配体呢就是提供孤对电子共享的小伙伴。
这些小伙伴们围绕着主角,就形成了配位化合物。
氧化还原反应中的电子转移也可以用很简单的方式来理解。
就像做交易一样。
比如说锌和硫酸铜反应,锌原子就像是一个慷慨的人,把自己的电子给了铜离子。
锌原子失去电子就变成了离子,铜离子得到电子就变成了原子。
化学反应速率的影响因素也很容易明白。
温度就像天气,温度高的时候呢,原子就像人在大晴天里一样,更有活力,反应就更快。
浓度就像是跑道上的人多少,人多(浓度大)的时候,相互碰撞反应的机会就多,反应就快。
催化剂呢,就像是一个神奇的教练,为反应物指出一条更方便的路,让它们能更快地反应。
依地酸二钠的结构式简介依地酸二钠(Disodium EDTA)是一种常用的螯合剂,化学名为乙二胺四乙酸二钠。
它是一种无色结晶粉末,可溶于水。
依地酸二钠在医药、食品、化妆品、农业等领域广泛应用,具有良好的螯合性能和稳定性。
结构式依地酸二钠的结构式如下所示:分子结构依地酸二钠的分子式为C10H14N2Na2O8,相对分子质量为336.21。
它是由两个乙二胺四乙酸根离子与两个钠离子组成的。
依地酸二钠的分子结构中含有多个羧酸基团和两个乙二胺基团,这些基团赋予了它良好的螯合性能。
螯合性能依地酸二钠具有良好的螯合性能,它可以与金属离子形成稳定的配合物。
依地酸二钠的螯合作用是通过其羧酸基团与金属离子形成配位键实现的。
它可以与多种金属离子形成稳定的配合物,如钙离子、镁离子、铁离子等。
螯合是指配体与金属离子之间形成配位键,使得金属离子被包围在配合物的中心。
依地酸二钠的羧酸基团可以提供多个孤对电子,与金属离子形成稳定的配位键。
这使得依地酸二钠具有良好的螯合性能,可以用来稳定金属离子,防止其发生不良反应或沉淀。
应用领域依地酸二钠在医药、食品、化妆品、农业等领域有广泛应用。
医药领域在医药领域,依地酸二钠常用作螯合剂,用于治疗重金属中毒。
由于依地酸二钠可以与重金属离子形成稳定的配合物,可以通过螯合作用将重金属离子与体内其他分子结合,减少其毒性。
同时,依地酸二钠也可以用作药物的辅料,增强药物的稳定性和溶解性。
食品领域在食品领域,依地酸二钠常用作食品添加剂,用于稳定食品中的金属离子和色素。
依地酸二钠可以与金属离子形成稳定的配合物,防止金属离子的氧化和沉淀,延长食品的保鲜期。
同时,依地酸二钠还可以与食品中的色素结合,提高色素的稳定性和色泽。
化妆品领域在化妆品领域,依地酸二钠常用作配方稳定剂和防腐剂。
依地酸二钠可以与化妆品中的金属离子形成稳定的配合物,防止金属离子的氧化和沉淀,保持化妆品的稳定性和质量。
同时,依地酸二钠还可以抑制细菌和霉菌的生长,延长化妆品的保质期。
乙二胺四乙酸二钠相对原子质量一、什么是乙二胺四乙酸二钠?乙二胺四乙酸二钠(EDTA-2Na)是一种常用的配位化合物,其化学式为Na2C10H14N2O8,相对分子质量为372.24g/mol。
它是一种白色粉末状物质,易溶于水,在水中呈现出无色透明的溶液。
EDTA-2Na具有良好的配位性能,可以与金属离子形成稳定的络合物。
二、乙二胺四乙酸二钠相对原子质量的计算方法1. 原子质量原子质量是指一个元素中原子核和电子云所占据空间总体积的平均密度。
根据国际上通行的标准,原子质量单位被定义为碳-12同位素中一个碳原子核和电子云所占据空间总体积的1/12。
2. 相对原子质量相对原子质量是指一个元素中所有同位素相对于碳-12同位素的相对质量。
例如,氧元素有三种同位素:氧-16、氧-17和氧-18,它们分别占据了氧元素自然界存在的比例,其相对原子质量分别为15.9949、16.9991和17.9992。
3. 乙二胺四乙酸二钠相对原子质量的计算乙二胺四乙酸二钠的化学式为Na2C10H14N2O8,其中包含了多个元素。
根据各元素在化学式中的摩尔数和其相对原子质量,可以计算出EDTA-2Na的相对分子质量。
具体计算方法如下:Na:2个,相对原子质量为22.99,摩尔数为2C:10个,相对原子质量为12.01,摩尔数为10H:14个,相对原子质量为1.01,摩尔数为14N:2个,相对原子质量为14.01,摩尔数为2O:8个,相对原子质量为16.00,摩尔数为8根据上述数据可以得到:EDTA-2Na的相对分子质量= 22.99×2 + 12.01×10 + 1.01×14 + 14.01×2 + 16.00×8 = 372.24g/mol。
三、乙二胺四乙酸二钠的应用领域1. 医药工业EDTA-2Na在医药工业中被广泛应用,主要用于制备药物和生产生物制品。
例如,EDTA-2Na可以用于制备治疗心血管疾病的药物和治疗铁过载症的药物。
丙二醇、乙二胺四乙酸二钠1. 【别号】1,2-丙二醇【英文名】propylene glycol 【分类代码】CNS: 18.004; INS:1520 【化学结构式】CH3CH(OH)CH2OH 【相对分子质量】76.10 【理化性质】为无色、清澈、透亮黏稠液体,无臭,略有辛辣味和甜味,外观与甘油相像,有吸湿性,对金属不腐蚀。
能与水、醇等多数有机溶剂随意混合。
对光、热稳定,有可燃性。
可溶解于挥发性油类,但与油脂不能混合。
相对密度1.035~1.039,沸点187.3℃,黏度0.056Pa.s(20℃),流淌点-56℃。
和脂肪酸反应生成脂肪酸酯,起乳化剂作用,是调味品和色素的优良溶剂。
由丙烯与氯水反应生成丙氯仲醇,再用溶液水解而得。
或由丙烷氧化成,再用盐酸水解而得。
【毒理学依据】①LD50;(小鼠,经口)22~23mg/kg (bw),(大鼠,经口)21.0~33.5mg/kg(bw)。
②ADI:0~25mg/kg(bw)(FAO/WHO,1994)。
③GRAs:FDA-21CFR184.1666。
【质量标准】[JECFA (2006)] 【应用】稳定剂和凝固剂、抗结剂、消泡剂、乳化剂、水分保持剂、增稠剂。
我国《食品平安国家标准食品添加剂用法标准》(GB 2760-2014)规定:糕点,最大用法量为3.0g/kg;生湿面制品(如面条、饺子皮、馄饨皮、烧麦皮),最大用法量为1.5g/kg。
【参考】用于酪农于酪、稀奶油混合物,用量为5g/kg(单用或与其他载体稳定剂合用)。
可用作香草豆、焙炒咖啡豆、自然香料等的萃取溶剂。
也可作为糖果、面包、包装肉类、于酪等的保湿剂,松软剂。
加工面条添加本品,能增强弹性,防止面条干燥崩裂,增强光泽。
加工豆腐添加本品,可增强风味,增强白度,使油炸豆腐膨胀,并增强光泽。
本品有防腐作用,可作为罐头食品、果酱、腌制品、火腿、香肠等的防腐用。
可作为抗冻液,对食品有防冻作用。
2. 【别号】EDTA二钠(disodium EDTA);isodium edetate 【英文名】disodium ethylene-diamine-tetra-acetate 【分类代码】CNS 18.005; INS 386 【化学结构式】【相对分子质量】372.24 【理化性质】白色结晶性颗粒和粉末,无臭,无味。
EDTA二钠结构式
1. 介绍
EDTA二钠(又称乙二胺四乙酸二钠)是一种重要的配位化合物,化学式为
Na2C10H14N2O8,是一种白色结晶粉末。
它是一种强螯合剂,常用于配位化学、分
析化学和工业应用中。
在本文中,我们将详细介绍EDTA二钠的结构式、化学性质、制备方法及应用。
2. 结构式
EDTA二钠的结构式如下所示:
H H H H H H H H
| | | | | | | |
H-C--C--C--C--N--C--C--C-O-Na+
| | | | | | | |
H H H H H H H H
在EDTA二钠的结构中,有四个乙酸根(CH2COO-)与一个乙二胺基(H2NCH2CH2NH2)配位形成一个五元环结构。
两个钠离子(Na+)与乙二胺基上的两个氧原子配位。
3. 化学性质
3.1 配位性质
EDTA二钠具有很强的配位能力,可以与多种金属离子形成稳定的配位化合物。
它
的配位性质主要来自于乙二胺基和乙酸根的配位作用。
3.2 溶解性
EDTA二钠在水中溶解度较高,可以完全溶解。
溶解后的溶液呈碱性,pH值通常在
8-10之间。
3.3 稳定性
由于EDTA二钠与金属离子形成的配位化合物具有较高的稳定性,因此可用于稳定
金属离子的存在。
这种稳定性使得EDTA二钠在分析化学和工业应用中具有重要作用。
4. 制备方法
EDTA二钠的制备方法有多种,下面介绍一种常用的方法:
4.1 材料准备
准备乙二胺(H2NCH2CH2NH2)、氯乙酸(CH2ClCOOH)和氢氧化钠(NaOH)。
4.2 反应步骤
1.将氯乙酸溶解在适量的水中,得到氯乙酸溶液。
2.在氯乙酸溶液中加入适量的乙二胺,反应生成乙二胺四乙酸
(H2NCH2CH2N(CH2COOH)2)。
3.在反应混合物中加入氢氧化钠溶液,使其pH值达到碱性,反应生成EDTA二
钠。
4.过滤得到EDTA二钠的固体产物,用水洗涤并干燥。
5. 应用
EDTA二钠在配位化学、分析化学和工业应用中有广泛的应用。
5.1 配位化学
由于EDTA二钠具有很强的配位能力和稳定性,常用于配位化学反应中。
它可以与
多种金属离子形成稳定的配位化合物,用于分离和测定金属离子。
5.2 分析化学
EDTA二钠是一种常用的分析试剂,可以用于测定金属离子的含量。
它可以与金属
离子形成络合物,通过滴定法或分光光度法测定金属离子的浓度。
5.3 工业应用
EDTA二钠在工业上有多种应用,包括水处理、纺织工业、制药工业等。
它可以用
作水处理剂,用于去除水中的金属离子和硬水成分。
此外,EDTA二钠还可以用于
制备染料和药物。
6. 总结
EDTA二钠是一种重要的配位化合物,具有很强的配位能力和稳定性。
它的结构式、化学性质、制备方法和应用都被详细介绍。
EDTA二钠在配位化学、分析化学和工
业应用中发挥着重要作用,对于分离、测定和稳定金属离子具有广泛的应用价值。