普通化学物质结构基础
- 格式:ppt
- 大小:1.10 MB
- 文档页数:25


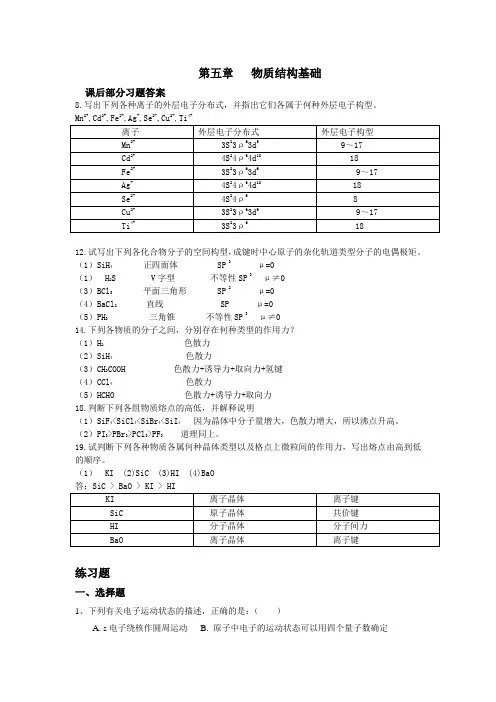
第五章物质结构基础课后部分习题答案8.写出下列各种离子的外层电子分布式,并指出它们各属于何种外层电子构型。
2+2+2++2-2+4+12.试写出下列各化合物分子的空间构型,成键时中心原子的杂化轨道类型分子的电偶极矩。
(1)SiH4正四面体 SP 3μ=0(1)H2S V字型不等性SP 3 μ≠0(3)BCl3平面三角形 SP 2μ=0(4)BaCl2 直线 SP μ=0(5)PH3 三角锥不等性SP 3 μ≠014.下列各物质的分子之间,分别存在何种类型的作用力?(1)H2 色散力(2)SiH4 色散力(3)CH3COOH 色散力+诱导力+取向力+氢键(4)CCl4 色散力(5)HCHO 色散力+诱导力+取向力18.判断下列各组物质熔点的高低,并解释说明(1)SiF4<SiCl4<SiBr4<SiI4因为晶体中分子量增大,色散力增大,所以沸点升高。
(2)PI3>PBr3>PCl3>PF3道理同上。
19.试判断下列各种物质各属何种晶体类型以及格点上微粒间的作用力,写出熔点由高到低的顺序。
(1)KI (2)SiC (3)HI (4)BaO练习题一、选择题1、下列有关电子运动状态的描述,正确的是:()A. s电子绕核作圆周运动B. 原子中电子的运动状态可以用四个量子数确定C. p 电子绕核走“8”字D. 电子在固定的轨道上不停地自旋 2、核外电子运动的特征是:( )A. 绕核高速旋转B. 具有无穷大的动能C. 有确定的运转轨道D. 具有波粒二象性 3、近代原子结构理论中的原子轨道是指:( )A. 电子绕核运动的轨迹B. 波函的平方2||ψ C. 电子云 D. 波函数ψ4、主量子数为3的电子层中:( )A. 只有s 和p 轨道B. 只有s 、p 和d 轨道C. 只有s 轨道D. 有s 、p 、d 和f 轨道 5、下列各组量子数取值合理的是:( )A. n=2 l =1 m=0 m s =0B. n=7 l =1 m=0 m s =+21C. n=3 l =3 m=2 m s =-21 D. n=3 l =2 m=3 m s =-21 6、钠原子1s 轨道能级E 1s,Na 与氢原子1s 轨道能级E 1s,H 的相对高低为:( )A. E 1s,Na =E 1s,HB. E 1s,Na <E 1s,HC. E 1s,Na >E 1s,HD. 无法比较 7、下列用量子数描述的、可以容纳电子数最多的电子亚层是:( )A. n=2,l =1B. n=3,l =2C. n=4,l =3D. n=5,l =0 8、决定多电子原子系统原子轨道能级大小的量子数是:( )A. n 和mB. l 和mC. n 和m sD. n 和l 9、屏蔽效应所起作用是:( )A. 对核电荷的增强作用B. 对核电荷的抵消作用C. 正负离子间的吸引作用D. 电子层的排斥作用二、填空题1、波函数ψ是描述 数学函数式,它和 是同义词,|ψ|2的物理意义是 ,电子云是 的形象化表示。

普通化学大一必考知识点化学作为一门自然科学,既关注物质的构成和性质,又探讨物质之间的相互作用和变化规律。
作为大一化学课程的学习者,掌握一些基础的知识点是必要的。
下面将讨论一些普通化学大一必考的知识点。
1. 元素和化合物- 元素是构成物质的基本单位,由具有相同原子数的原子组成。
有一些常见元素如氢、氧、碳等。
- 化合物是由不同元素的原子通过化学键结合而成的物质。
例如,水是由氢和氧原子组成的。
2. 原子结构- 原子是最小的化学单位,由质子、中子和电子组成。
质子带有正电荷,中子带有中性,电子带有负电荷。
- 原子核位于原子的中心,电子则绕原子核运动。
3. 周期表和元素分类- 周期表是按照元素的原子序数排列的表格,可以显示元素的各种性质。
- 元素可以根据化学性质和物理性质进行分类,常见分类包括金属、非金属、半金属等。
4. 化学键和分子- 化学键是原子之间的相互作用力,常见的包括共价键、离子键和金属键。
- 分子是由原子通过化学键结合而成的粒子。
5. 反应速率和化学平衡- 反应速率是反应物消耗或生成物形成的速度。
影响反应速率的因素包括浓度、温度和催化剂等。
- 化学平衡是指反应物和生成物浓度达到一定比例的状态,符合化学平衡定律。
6. 酸碱中和反应- 酸是指能够产生H+离子的物质,碱是指能够产生OH-离子的物质。
酸碱反应是指酸和碱反应形成盐和水的化学反应。
- 酸碱中和反应是酸碱反应的一种特殊形式,反应产物是水和相应的盐。
7. 氧化还原反应- 氧化还原反应是指物质中的电子的转移。
氧化是指物质失去电子,还原是指物质获得电子。
- 氧化还原反应常见的应用包括腐蚀、电池和火焰等。
8. 化学方程式和摩尔- 化学方程式用符号和式子表示化学反应。
反应物在方程式的左侧,生成物在右侧。
- 摩尔是物质的计量单位,表示物质的质量以及化学反应中的比例关系。
9. 溶液和溶解度- 溶液是由溶质和溶剂组成的均匀混合物,溶剂是溶解其他物质的介质。
- 溶解度是指在特定温度下溶质在溶剂中的最大溶解量。

化学初步认识物质的组成物质是我们身边的一切,无论是固体、液体还是气体,都由不同的化学元素组成。
化学是研究物质的组成、性质和变化的科学,通过初步认识物质的组成,我们可以更好地理解这个世界。
本文将从原子和分子的角度,探索物质的组成。
一、原子的基本结构我们知道,一切物质都是由原子构成的。
原子是物质的基本单位,其结构由子结构组成。
原子核是原子的中心部分,由质子和中子构成。
质子带正电荷,中子不带电,它们一起组成原子的核心。
在原子核外围,环绕着电子,它们带有负电荷。
原子的质量主要集中在原子核中,电子的质量相对较小,而占据较大的体积。
二、元素和化合物元素是由具有相同原子序数(即原子核中质子的数量)的原子组成的物质。
目前已知的元素有118个,它们在元素周期表中有着特定的位置。
元素通过原子的核质子数量的不同而区分,如氢、氧、铁等。
化合物是由两种或两种以上不同元素的原子以一定比例结合而成的物质。
化合物具有独特的化学和物理性质,不同于构成它的各种元素。
例如,水分子(H2O)由两个氢原子和一个氧原子组成。
元素和化合物的形成和分解都会伴随着能量的变化。
三、分子和离子分子是由两个或两个以上原子以共价键相结合而成的物质。
共价键是通过原子间的电子共享而形成的。
例如,氧气分子(O2)是由两个氧原子通过共享电子得到的。
离子是原子或分子中失去或获得电子而带有电荷的物质。
正离子是质子数比电子数多的离子,带正电荷;负离子是电子数比质子数多的离子,带负电荷。
当正离子和负离子相互结合时,形成离子化合物。
例如,氯化钠(NaCl)是由钠离子(Na+)和氯离子(Cl-)组成的。
四、化学式和化学方程式化学式是用来表示化学物质组成的符号和数字的组合。
分子式表示化合物中各种原子的数量和比例。
例如,水的分子式是H2O,表示水分子由两个氢原子和一个氧原子组成。
化学方程式用化学式和符号表示化学反应的过程。
化学方程式同时表示原子数的守恒,不仅说明了反应物和生成物的组成,还表示了它们之间的摩尔比例关系。

普通化学 马家举 第一章 物质结构基础习题4 假定有下列电子的各套量子数,指出哪几套不可能存在,并说明原因。
(1)3,2,2,1/2;(2)3,0,-1,1/2;(3)2,2,2,2;(2)当角量子数l 取0时,磁量子数m 不能取-1。
(3)当主量字数取2时,角量子数不能取2;自旋量子数不能取2,只能取+1/2或-1/2。
5写出原子序数为47的银原子的电子分布式,并用四个量子数表示最外层电子的运动状态。
Ag :1s 22s 22p 63s 23p 63d 104s 24p 64d 105s 1 5,0,0,+1/2。
试用杂化轨道理论解释:(1) H 2S 分子的键角为920,而PCl 3的键角为1020。
(2) NF 3分子为三角锥形构型,而BF 3分子为平面三角形构型。
(1) H 2S 分子与H 2O 分子一样,中心原子采取sp 3不等性杂化,在两个孤电子对的作用下,两个H-S键键角减小。
之所以键角小于H 2O 分子中两个H-O 键的键角104045’,是因为H-S 键的成键电子对更靠近H 原子,两个H-S 键之间的斥力小,被压缩的程度更大。
PCl 3分子与NH 3分子一样,也是中心原子采取sp 3不等性杂化,同理Cl-P 键的成键电子对更靠近Cl 原子,所以两个P-Cl 键的键角小于NH 3分子中两个N-H 键的键角。
(2) NF3分子与NH 3分子一样中心原子采取sp 3不等性杂化,使分子产生三角锥形构型;BF 3分子中心原子B 采用sp 2等性杂化,使分子产生平面三角形构型。
7 为什么(1)室温下CH 4为气体,CCl 4为液体,而CI 4为其固体?(2)水的沸点高于H 2S ,而CH 4的沸点低于SiH 4?(1) 从CH 4→CCl 4→CI 4分子量增加,分子间色散力增大,而色散力在范德华力中占较大比例,即分子间力是增大的,而分子间力越大,熔沸点越高。
(2) H 2O 分子与H 2S 分子相比,水中H 2O 分子之间存在氢键,虽然H 2O 分子间的色散力较小,氢键的存在却使沸点更高一些。


普通化学原理(物质结构与基本化学原理)_西安交通大学中国大学mooc课后章节答案期末考试题库2023年1.凡是能形成氢键的物质,其熔、沸点比同类物质的都高。
答案:错误2.色散力只存在于非极性分子之间,而取向力只存在于极性分子之间。
答案:错误3.H2O 的熔点比HF高,所以O—H…O氢键的键能比F—H…F氢键的键能大。
答案:错误4.在化学热力学中所谓标准条件是指:在 298.15 K 下,系统中各气体物质的分压均为标准压力,或者溶液中溶质浓度均为标准浓度。
答案:错误5.物质的温度越高,熵值越大。
答案:错误6.在298K时,指定单质的【图片】=0,【图片】=0,【图片】=0。
答案:错误7.化学反应的焓变,是反应的热效应。
答案:错误8.对于一个定温反应,如果【图片】>【图片】,则该反应必定是熵增的反应。
答案:正确9.|ф|2代表电子在核外空间的概率密度。
答案:正确10.价键理论中,共价分子中形成的π键,不决定分子的几何构型。
答案:正确11.含有d电子的原子都是副族元素。
答案:错误12.原子中核外电子的运动具有波粒二象性,没有经典式的轨道,并需用统计规律来描述。
答案:正确13.所谓的“镧系收缩”是指镧系元素随着原子序数的增加,原子半径迅速增大的现象答案:错误14.在同一个多电子原子内,若两个电子n、l、m都相同,则其自旋状态一定相反答案:正确15.29号元素Cu的基态原子的核外电子排布式是1s22s22p63s23p63d94s2答案:错误16.N元素的第一电离能比其后的O元素的要高,这可以用“半充满”电子构型更稳定来解释答案:正确17.对24号元素Cr来说,价电子构型3d54s1为其激发态答案:错误18.n=2 时,描述电子运动状态的四个量子数最多有四组。
答案:错误19.下列各组粒子中,具有相同核外电子排布的是()。
答案:K+,S2-20.下列晶格能(离子键能)大小顺序中正确的是:答案:NaCl > KCl > RbCl21.如果某一级反应的半衰期为50年,下列描述正确的为:答案:反应进行50年后,反应物的浓度减半22.Qp、Qv之间的换算只适合气相反应,不适合有凝聚相参与的反应。

化学手抄报物质的基本构成
物质的基本构成是指物质的组成成分和结构特征。
根据化学的
角度,物质的基本构成主要包括元素、化合物和混合物三个方面。
首先,元素是构成物质的基本单位,它由一种类型的原子组成。
原子是由质子、中子和电子构成的基本粒子,每种元素都有特定数
量的质子,决定了其化学性质。
元素可以根据其原子序数和周期表
中的位置进行分类,例如氢、氧、铁等元素。
其次,化合物是由两种或更多种不同元素以一定的化学方式结
合而成的物质。
化合物具有独特的化学性质,其成分比例是固定的。
化合物可以通过化学反应进行分解,分解后得到的仍然是同种物质。
例如水(H2O)是由氢和氧元素以一定的比例结合而成的化合物。
最后,混合物是由两种或两种以上的物质以物理方式混合而成
的物质。
混合物的组成比例可以变化,可以通过物理方法进行分离。
例如空气就是由氮气、氧气、二氧化碳等气体混合而成的混合物。
除了以上提到的基本构成,物质的性质也是其基本构成的重要
组成部分。
物质的性质包括物理性质和化学性质,物理性质包括颜
色、形状、密度等,而化学性质则包括物质与其他物质发生化学反
应的能力等。
总的来说,物质的基本构成是由元素、化合物和混合物组成的,而物质的性质则是由其基本构成和结构特征决定的。
希望这些信息
能够帮助你更好地理解物质的基本构成。

普通化学知识点总结大一化学是一门研究物质组成、性质和变化的科学,大一阶段我们学习了许多普通化学的基础知识,包括元素周期表、原子结构、化学键、化学方程式等等。
下面给大家总结一下大一阶段所学的一些普通化学知识点。
1. 元素周期表元素周期表是由俄国化学家门捷列夫·门捷列夫所创立的,它是化学的重要工具,按照元素的原子序数、化学性质和电子结构的规律进行排列。
元素周期表可以帮助我们了解元素的基本性质,如原子半径、电子亲和能、电离能等。
2. 原子结构原子是构成物质的基本单位,由带正电荷的质子、带负电荷的电子和不带电荷的中子组成。
原子结构包括原子核和电子云,原子核内含有质子和中子,电子云则包围在原子核周围,由电子组成。
3. 电子排布电子的排布遵循一定的规则,如阿贝尔原理、泡利不相容原理和奥克塔规则。
阿贝尔原理指出每个能级能容纳2个电子,泡利不相容原理指出同一能级的电子应该尽量填满不同的轨道,奥克塔规则则指出第3能级以后的电子,有时可以放在d轨道中。
4. 化学键化学键是原子之间的相互作用力。
常见的化学键有共价键、离子键和金属键。
共价键是通过原子间的电子共享来实现的,离子键是通过正负离子间的静电作用力实现的,而金属键是通过金属原子间的电子云共享实现的。
5. 化学方程式化学方程式用化学式和符号表示化学反应。
它由反应物、产物和反应条件组成。
化学方程式能够表达反应物的种类和数量,以及反应后产生的产物。
6. 酸碱反应酸碱反应是指发生在酸和碱之间的化学反应。
常见的酸碱反应有中和反应和酸碱溶液的中性化反应。
中和反应指的是酸和碱反应生成盐和水,酸碱溶液的中性化反应则是酸和碱反应生成中性物质。
7. 氧化还原反应氧化还原反应是指物质在化学反应中电荷的转移。
氧化反应是指物质失去电子,而还原反应是指物质获得电子。
在氧化还原反应中,氧化剂接受电子,而还原剂则失去电子。
8. 摩尔计算摩尔计算是化学中常用的计算方法。
通过摩尔计算,我们可以计算出物质的摩尔质量、摩尔容积和摩尔浓度等。

《普通化学》课程学习指南根据知识模块顺序,教学要求如下一、理论课学习指南第一章热化学与能源基本要求知识点:热力学第一定律,热效应,反应焓变,盖斯定律。
学习目标:了解用弹式热量计测量等容热效应(Qv)的原理,熟悉Qp的实验计算法,了解状态函数的意义,了解化学反应中的焓变的关系;了解Qv与化学反应的内能的关系;初步掌握化学反应的标准摩尔焓变(△rH mθ)的近似计算,适当了解能源中的燃料燃烧反应的热效应。
第二章化学反应的基本原理与大气污染控制知识点:环境化学,热力学第二定律,热力学等温方程,热力学第三定律,标准平衡常数,多重平衡规则,质量作用定律,吉布斯函数变判据,化学平衡的移动原理。
学习目标:了解化应中的熵变及吉布斯函数变在一般条件下的意义;初步掌握化学反应的标准摩尔吉布斯函数变(△rGmθ)的近似计算;能应用△rGm 或△rGmθ判断反应进行的方向;理解标准平衡常数(Kθ)的意义及其与△rGmθ的关系,并初步掌握有关计算;理解浓度,压力和温度对化学元素反应的影响;了解浓度,温度与反应速率的定量关系,了解基元反应和反应级数概念;能用阿仑尼乌斯公式进行初步计算;能用活化能和活化分子的概念说明浓度,催化剂对化学元素反应速率的影响;了解环境化学元素中大气主要污染物及其防治。
第三章水溶液化学知识点:共轭酸碱对,缓冲溶液,溶度积,溶液的通性,酸碱解离平衡,难溶电解质。
学习目标:了解溶液的通性(蒸气压下降,沸点上升,凝固点下降及渗透压);明确酸碱的解离平衡,分级解离和缓冲溶液的概念,能进行溶液pH的基本计算,能进行同离子效应,等离子平衡如缓冲溶液的计算,了解配离子(络离子)的解离平衡移动;初步掌握溶度积和溶液解的基本计算;了解溶度积规则及其应用;了解环境化学中水的主要污染物及其某些处理方法的原理。
第四章电化学与金属腐蚀知识点:电极,氧化还原电对,电极电势,原电池,电动势,电解,化学电源,析氢腐蚀,吸氧腐蚀。
学习目标:了解电极电势的概念,能用能斯特方程式进行有关计算;能应用电极电势的数据判断氧化剂和还原剂的相对强弱及氧化还原反应自发进行的方向和程度;了解摩尔吉布斯函数△rGmθ与原电动势,△rGmθ与氧化还原反应平衡常数的关系;联系电极电势概念,了解电解的基本原理,了解电解在工程实际中的某些应用;了解金属腐蚀及防护原理。
第一章:物质结构基础Chapter 1:Structure of substance第一节:原子结构本节教学目的要求:只是核外电子的运动状态发生变化。
因此,要说明化学反应的本质,了解物质的性质与结构的关系,推测新化合物合成的可能性,就必须了解原子结构,特别是原子的电子层结构。
一、原子结构理论的发展概况1、道尔顿(John Dalton )的原子论——物质由原子构成,原子不可再分。
2、原子的含核模型1911年,卢瑟福通过α粒子散射实验认为:原子的中心有一个带正电的原子核,电子在它的周围旋转,原子中绝大部分是空的。
电子的质量极小(质子的1/1836),原子的质量主要集中在原子核上,由质子数和中子数决定,原子是电中性的。
核外电子数=核内质子数=核外电子数=原子序数 质量数(A )=质子数(Z )+中子数(N )原子核 质子 Z其关系为:原子X AZ中子 A-Z核外电子 Z3、原子结构的玻尔模型玻尔提出原子中的电子能量也是不连续的、量子化的。
并假设: (1)定态假设 原子中电子在固定轨道上旋转,不吸收能量。
(2)能级的概念 原子在不同轨道上旋转时,有不同的能量(能级)。
2n BE -= 式中 n ——量子数,1,2,3……;B ——2.18×10-18J基态:能量最低状态,如氢原子n =1的状态。
激发态:能量较高状态,如氢原子n =,3,4……的状态。
(3)跃迁时有能量放出或吸收 νh E E E =∆=-12, 式中 h ——普朗克常数,h =6.626×10-34J·s ;ν——辐射能的频率,s -1;E ——辐射能,J 。
在氢原子光谱中,电子从n =3,4,5,6,7跃迁回到n =2时,放出可见光中的五条光谱(其波长为λ=C /ν,C =3×108m /s ),即H α(656.3)、青H β(486.1)、蓝H γ(434.0)、紫H δ(410.2)、紫H ε(390.0)。
普通化学大一知识点及公式化学作为一门基础科学,是学习其他自然科学的基础。
对于大一学习化学的学生来说,了解一些基本的化学知识和公式,可以帮助他们更好地理解化学原理和解决化学问题。
本文将介绍一些普通化学大一知识点及公式。
一、原子结构1. 原子组成原子由质子、中子和电子组成,质子和中子位于原子核中,电子绕核运动。
2. 质子数和电子数在一个原子中,质子数等于核电荷数,也等于电子数,原子中电子数等于核电荷数。
3. 原子序数原子序数等于原子核中质子的数目,是准确描述一个元素的标志。
二、化学键和分子1. 化学键化学键是原子之间由于电子的相互作用而形成的。
常见的化学键有共价键、离子键和金属键。
2. 共价键共价键的形成是由于原子间电子的共享。
共价键又可分为单键、双键和三键。
3. 分子分子是原子之间通过化学键连接形成的一个电中性粒子。
分子的化学式可以用来表示分子的组成。
三、化学方程式化学方程式用来描述化学反应,显示反应物和生成物之间的化学变化。
一个完整的方程式包括反应物、生成物的化学式和反应的反应条件。
四、摩尔与化学计量1. 摩尔摩尔是化学物质中的基本计量单位,摩尔的数量可以用阿伏伽德罗常数(6.02214076×10^23 mol^-1)来表示。
2. 化学计量化学计量是指在化学反应中不同物质的摩尔比例关系。
从化学方程式中可以得到摩尔比例关系。
五、溶液和浓度计算1. 溶液溶液是由溶质和溶剂组成的,其中溶质为被溶解的物质,溶剂为溶解溶质的物质。
2. 浓度计算浓度通常用溶液中溶质的摩尔浓度表示,摩尔浓度可以用溶质的物质的摩尔数除以溶液的体积来计算。
六、化学平衡和化学反应热学1. 化学平衡在一定条件下,反应物和生成物的浓度保持一定比例,称为化学平衡。
化学平衡可以用化学方程式和反应物摩尔浓度来表示。
2. 阿伦尼乌斯方程阿伦尼乌斯方程描述了化学平衡条件下,反应物摩尔浓度与反应平均速率的关系。
七、酸碱和溶液的pH1. 酸碱酸和碱是指溶液中所含的化学物质,酸具有酸性,碱具有碱性。
普通化学物质结构基础(一)引言概述:普通化学物质结构是化学研究的基本内容之一,它研究的是物质内部原子和分子的排列方式及其结构特征。
本文将从五个大点出发,对普通化学物质结构的基础内容进行阐述。
正文:一、元素与化合物的结构1. 元素的结构:介绍元素是由原子构成的,原子的结构特征包括核和电子壳层的组成和排列方式。
2. 化合物的结构:阐述化合物是由两种或更多种元素通过化学键相互连接而成的,并介绍离子键、共价键和金属键的结构特征。
二、分子和离子的结构1. 分子的结构:分子是由一种或多种原子通过共价键连接而成的,介绍共价键的形成、键长和键角等结构特征。
2. 离子的结构:离子是由正离子和负离子通过离子键相互连接而成的,说明离子键的形成和离子晶体的结构特征。
三、晶体和非晶体的结构1. 晶体的结构:晶体是具有规则排列的原子、离子或分子组成的物质,在讲解晶体结构时,介绍晶体的晶格、晶胞和晶面等基本概念。
2. 非晶体的结构:非晶体是没有规则排列的原子、离子或分子组成的物质,解释非晶体的结构特征和形成机制。
四、分子式和结构式的表示方法1. 分子式的表示方法:介绍分子式是用化学符号表示化合物中各种原子的种类和数量,解释分子式的命名规则和应用场景。
2. 结构式的表示方法:结构式是用线条代表化合物中原子之间的化学键和空间排列关系,介绍平面结构和空间结构的表示方法和应用。
五、物质结构与性质的关系1. 结构与物质性质的关系:分析物质的结构特征和物质的性质之间的关系,例如分子大小、分子形状和极性对物质的溶解性和化学反应等的影响。
2. 结构与物质用途的关系:探讨不同结构化合物在工业生产和日常生活中的应用,阐述物质的结构对其用途和性能的影响。
总结:本文从普通化学物质结构的基础内容出发,阐述了元素与化合物的结构、分子和离子的结构、晶体和非晶体的结构、分子式和结构式的表示方法以及物质结构与性质的关系。
对于理解化学物质的内部结构和性质之间的关系具有重要意义。
普通化学原理
普通化学原理是研究物质成分、结构、性质以及它们之间的相互转化关系的科学。
它是化学的基础,为我们理解和解释各种化学现象和反应提供了框架。
以下是一些常见的化学原理:
1. 元素周期表:元素周期表是一个将所有已知元素按照一定规律排列的表格。
它反映了元素的周期性变化以及元素性质之间的关联。
2. 原子结构:原子是构成物质的最基本单位,由带正电荷的质子、带负电荷的电子和无电荷的中子组成。
质子和中子位于核心,而电子分布在核心周围的能级上。
3. 化学键和分子结构:化学键是原子之间的相互作用力,可以将原子连接在一起形成分子。
常见的化学键有离子键、共价键和金属键。
分子结构描述了分子中原子的排列方式。
4. 反应速率和化学平衡:反应速率指的是反应物消耗或生成的速度。
化学平衡是指在一个封闭系统中,反应物和生成物的浓度保持不变的状态。
5. 酸碱中和和氧化还原反应:酸碱中和反应是指酸和碱反应生成盐和水的反应。
氧化还原反应是指物质失去电子被氧化剂氧化,同时另一物质获得电子被还原。
6. 动力学和热力学:动力学研究反应速率和反应机理,而热力学研究反应的能量变化和反应的可行性。
这些化学原理是研究化学现象和反应过程中的基本概念和理论,对于深入理解化学的基本原理和应用有着重要的作用。
《普通化学》课程教学大纲英文名称:General Chemistry课程编码:总学时:32 实验学时:6 学分:2适用对象:水利类、生态类、土建类、机械及材料类等理工科专业本科生开课单位:理学院大纲主撰人:大纲审核人:制定时间:2014年9月使用教材与参考书:《普通化学》(第六版),浙江大学普通化学教研组编,高等教育出版,2011《大学化学》韩选利,张思敬,张凤云编,高等教育出版社,2005《普通化学实验》,李聚源主编,化学工业出版社,2007一、课程性质、目的和任务《普通化学》是理工科本科生必修的基础课程之一,课程内容主要包括物质结构理论基础、化学热力学、化学反应的基本规律与工程实际密切有关的重要元素和化合物、新技术、新材料等基本知识。
通过该门课程的学习,使学生了解近代化学的基本理论,具备化学基本实验技能,培养学生正确的学习和研究方法,为以后的学习和工作提供必要的化学基础,同时树立辩证唯物主义世界观。
二、教学内容及要求第1章化学的发展授课学时: 1基本要求:1-1 大学化学课程简介1-2 化学分支学科的形成与发展1-3 现代化学的发展1-4 课程学习方法及与专业关系重点:课程学习方法及与专业关系难点:课程学习方法及与专业关系第2章物质结构基础授课学时:2基本要求:2-1 了解原子核外电子运动的特征(量子化、波粒二象性、统计性);2-1 了解波函数、四个量子数和电子云的基本概念;2-3 了解s、p、d 波函数和电子云的角度分布示意图;2-4 掌握周期系元素的原子核外电子分布的一般规律及其与周期表的关系;2-5 理解元素按s、p、d (或d、ds)、f分区的情况,原子、离子、分子、金属晶体;2-6了解原子结构,分子结构和晶体结构等。
重点:四个量子数;原子和离子的电子分布式;核外电子分布与周期系的关系;杂化轨道理论与分子空间构型的关系;分子间力和氢键对物质性质的影响;原子、离子、分子、金属晶体的特征;晶体结构与物质性质的关系;配合物的组成及命名。