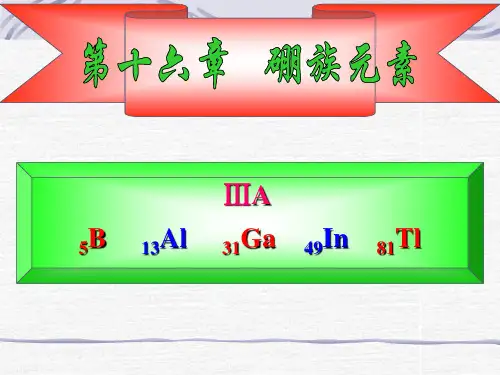
无机化学总结 硼族元素
- 格式:doc
- 大小:66.50 KB
- 文档页数:12


硼族元素及其化合物
一、硼的性质
硼(Boron)是一种族IIIb的元素,在化学元素周期表中第五位,原子序数为5,原子质量为10.81、硼元素是一种半金属元素,具有金属质地,保持着类似硅的结构。
硼具有极强的抗氧化、加热稳定性、腐蚀性,使其有着优良的电性能,适用于电子设备中的导电成份,还拥有稳定的介电性能,是线路板制作的上佳材料。
二、硼的化合物
(1)氢氧化硼
氢氧化硼(H₂BO₃)是硼元素的最常见的化合物。
它是一种无色粉末状的晶体,熔点为350℃,有特殊的稀酸味,非常溶于水,但在碳酸钠、碳酸氢钠水溶液中极难溶解。
氢氧化硼是一种电解质,是用作电缆、电池和电磁浮动的主要材料。
(2)硼酸
硼酸(HBO₂)是硼的重要的化合物之一,其有机半氧化物的形式为
H₃BO₃,通常以白色粉末的形式存在,溶于水,不溶于二氯甲烷,拥有特殊的稀酸性味道。
硼酸有着广泛的应用,主要用作农药、洗涤剂、轻工业中制作消光剂、染料、防腐剂和焊条等。
(3)硼酸钠
硼酸钠(Na₂B₂O₄·2H₂O)是一种水溶性的硼酸盐,主要用作染料、洗涤剂、消光剂、增塑剂、绝缘剂、涂料等。



硼与氮气:2B+N2 高温 2BN2. 硼与浓硫酸:2B+3H2SO4(浓) △2B(OH)3 +3SO2 ↑3. 碘化硼分解:2BI3 1000K Ta2B+3I 24. 乙硼烷与氧气:B2 H6 +3O2 自然 B2O3 +3H2O5. LiBH4 +2H2O=LiBO2 +4H2 ↑6. 三氧化二硼与水:3B2O3 +3H2O(g)=2B3O3(OH)3(g)7. 氟化硼与水:BF3 +3H2O=B(OH)3 +3HF氟化硼与氟化氢:BF3 +HF=H[BF4]8. 硼与硫:2B+3S 高温 B2S39. 硼与氯气:2B+3Cl2 高温 2BCl310. 硼与水:2B+6H2O(g)=2B(OH)3 +3H211. Na2 B4O7 +H2SO4 +5H2O=4H3 BO3 +Na2SO412. 硼酸受热分解:2H3 BO3 △B2O3 +3H2O13. 三氧化二硼与镁:B2O3 +3Mg 高温 2B+3MgO14. 硼与浓硝酸:B+3HNO3(浓) △B(OH)3 +3NO2 ↑15. 硼与浓硫酸:2B+3H2SO4(浓) △2B(OH)3 +3SO2 ↑16. 硼与氢氧化钠:2B+2NaOH+3KNO3 熔融 2NaBO2 +3KNO2 +H2O17. 三氯化硼与氢气:2BCl3 +6H2 无声放电 B2 H6 +6HCl18. 3LiAlH4 +4BCl3 乙醚中 2B2 H6 +3LICl+3AlCl319. 乙硼烷与氯气:B2 H6(g)+6Cl2(g)=2BCl3(l)+6HCl(g)20. 乙硼烷与甲醇:B2 H6 +6CH3OH=2B(OCH3)3 +6H221. 4NaH+B(OCH3)3 =NaBH4 +3NaOCH322. 三氧化二硼与水:B2O3 +3H2O=2H3 BO3(aq)23. 三氧化二硼与氧化铜:B2O3 +CuO 熔融 Cu(BO2)2 (蓝色)24. 三氧化二硼与氧化铁:3B2O3 +Fe2O3 熔融 2Fe(BO2)3 (黄色)25. 硼酸与水:B(OH)3 +H2O=[B(OH)4]- +H +26. 硼酸与乙醇:B(OH)3 +3C2 H5OH 浓 H2SO4(C2 H5O)3 B+3H2O27. [B4O5(OH)4]2- +5H2O=2H3 BO3 +2[B(OH)4]-28. 氟化硼与氨气:BF3(g)+NH3 =H3 N→ BF331. 三氯化硼与水:BCl3 +3H2O=B(OH)3 +3HCl32. 硼与氟气:2B+3F2 =2BF333. 硼酸与磷酸:B(OH)3 +H3 PO4 =BPO4 +3H2O34. 偏硼酸钠与过氧化氢:NaBO2 +H2O2 =NaBO3 · H2O35. B2O3 +8CaF2 +8H2SO4(浓)+3H2O=2B(OH)3 +16HF+8CaSO4铝与氢氧化钠:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H 22. 偏铝酸钠与氯化铵:NaAlO2 +NH4Cl+H2O=Al(OH)3 +NH 3 +NaCl3. Al2O3 +2NaOH+3H2O 加压煮沸 2Na[Al(OH)4]4. 2Na[Al(OH)4]+CO 2 =2Al(OH)3 ↓+Na2CO3 +H2O5. 氢氧化钠受热分解:2Al(OH)3 △Al2O3 +3H2O6. 电解三氧化二铝:2Al2O3 通电熔融冰晶石 4Al+3O2 ↑7. 铝与氯气:2Al+3Cl2 △2AlCl38. 六水氯化铝受热分解:AlCl3 · 6H2O△Al(OH)2Cl+4H2O+2HCl↑9. 铝离子与氨水:Al3++3NH3 · H2O=Al(OH)3 ↓+3NH4+10. Na[Al(OH)4]+NH4Cl=Al(OH)3 ↓+NaCl+NH3 +H2O11. 铝与三氧化二铁:2Al+Fe2O3 点燃镁条 2Fe+Al2O312. 铝与盐酸:2Al+6HCl(aq)=2AlCl3 +3H2 ↑13. 铝与硫单质:2Al+3S 高温 Al2S314. 氯化铝与氢化锂:3nLiH+nAlCl3 乙醚中(AlH3)n+3nLiCl15. 氢氧化铝与氢氧化钠:Al(OH)3 +NaOH(aq)=Na[Al(OH)4] 1. 镓与稀硫酸:2Ga+3H2SO4(稀)=Ga2(SO4)3 +3H2 ↑2. 镓与浓硝酸:Ga+6HNO3(浓)=Ga(NO3)3 +3NO2 ↑+3H2O1. 铟与稀硫酸:2In+3H2SO4(稀)=In2(SO4)3 +3H2 ↑1. 氢氧化铊与氯化钠:TlOH+NaCl=TlCl+NaOH2. 三氯化铊与碘化钾:TlCl3 +3KI=TlI+I2 +3KCl3. 三氯化铊与硫化钠:2TlCl3 +3Na2S=Tl2S↓+2S↓+6NaCl4. 氯化铊与氯气:TlCl+Cl2 =TlCl35. 铊与稀硫酸:2Tl+H2SO4(稀)=Tl2SO4 +H2 ↑6. 铊与稀硝酸:Tl+2HNO3(稀)=TlNO3 +NO2 ↑+H2O7. 硫酸铊与硫酸亚铁:Tl2(SO4)3 +4FeSO4 =Tl2SO4 +2Fe2(SO4)38. 硝酸铊与二氧化硫:Tl(NO3)3 +SO2 +2H2O=TlNO3 +H2SO4 +2HNO39. 铊离子与硫离子:2Tl3++3S2- =Tl2S↓+2S↓。

第十六章硼族元素1.硼 单质 硼烷 硼的含氧化合物 硼与硅的相似性2.铝 Al2O3的两种变体 铝盐 §本章摘要§3.镓铟铊Tl(III)的氧化性§1.硼 一.单质 黄棕色固体,高硬度,高沸点1. 制备和Si制备相比较 用Mg或Al 还原B2O3,相当于用C还原SiO2 B2O3 + 3Mg --- 3MgO + 2B (高温) 用H2还原三溴化硼,相当于用H2还原SiCl4 2BBr3 + 3H2 --- 2B + 6HBr (W丝, 高温) 2. 硼的反应 常温下不活泼,高温下活泼 4B + 3O2 --- 2B2O3 2B + 3Cl2 --- 2BCl3与硅相似 2B + N2 --- 2BN (均在高温下进行) 和氧化性酸起反应,比硅活泼些 B + 3HNO3(浓) --- H3BO3 + 3NO2 和强碱起反应 2B + 2NaOH(浓) + H2O ---2NaBO2 + 3H2(气体) (偏硼酸钠) 二硼烷 硼氢化合物虽没有碳氢化合物种类多, 但远比硅烷多. 其结构比烷烃、硅烷复杂.1. 结构 最简单的硼烷,理应是BH3, 但结构研究表明它的分子式是B2H6, 分子间键联关系: 2. 乙硼烷制备质子置换法: 相当于Mg2Si和盐酸反应制备SiH4。
还原法: 4BCl3 + LiAlH4 --- 2B2H6 + 3LiCl + 3AlCl3相当于SiCl4和LiAlH4反应制SiH4。
端基上的H和B之间形成σ键(sp3-s). 四个端H和两个B形成分子平面,中间两个H不在分子平面内,其连线垂直于分子平面,上下各一个, 上面的H所成的键共用价电子44个3. 乙硼烷的性质1°稳定性 B2H6 ----B + H2 B2H6要在100℃以下保存,稳定性不如硅烷。
2 °还原性 B2H6 + 3O2 --- B2O3 + H2O 自燃 属高能燃料,但毒性极大,不易储存。


无机化学总结硼族元素无机化学总结硼族元素无机化学总结硼族元素一硼单质及其化合物制作成员:摆宫泽贾震韦仕富硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色硬度极高,导电性差但它的电导率却随着温度的升高而增大从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低无定形硼相对活泼。
硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
a—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体其中所以硼原子间均形成共价键使单质硬度大导热能力强,导电能力弱。
B—菱形硼:结构更复杂其中含B84结构单元。
硼单质的化学性质常温下与F2化合:2B+3F2=2BF3在空气中燃烧放出大量热:4B+3O2=2B2O33由于硼氢键的键能很大所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4赤热下无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H2 5在高温下硼能同N2,S,_2等非金属单质反应2B+N2=2BN2B+3CI2=2BCI22B+3S=B2S36在高温下硼也能同金属反应生成金属硼化物如NbB4,ZrB2,LaB6等。
硼化物一般具有咼硬度咼熔点。
7无定形硼不与非氧化性酸作用但可以与热浓H2SO4,热的HN03反应:B+3HN03(浓)=B(OH)3+3NO2f2B+3H2SO4(浓)=2B(0H)3+3SO2f8有氧化剂存在时硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5?H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7?10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5?H2O+2H2SO4=2H3BO3+2MgSO4硼氢化合物称为硼烷已知的有:B2HqB4Hio,B5H9,B8Hi6,B8Hi8等,BnHn+4与BnHn+6共20多种。

化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。
如硼酸用作植物生长调节剂,硼氢化钠在有机合成中作为还原剂等。
一硼单质及其化合物制作成员:摆宫泽贾震韦仕富(1) 硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色,硬度极高,导电性差,但它的电导率却随着温度的升高而增大,从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低,无定形硼相对活泼。
①硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
α—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体,其中所以硼原子间均形成共价键,使单质硬度大,导热能力强,导电能力弱。
β—菱形硼:结构更复杂,其中含B84结构单元。
②硼单质的化学性质1 常温下与F2化合:2B+3F2=2BF32 在空气中燃烧,放出大量热:4B+3O2=2B2O33 由于硼氢键的键能很大,所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4 赤热下,无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H25 在高温下硼能同N2,S,X2等非金属单质反应2B+N2=2BN2B+3Cl2=2BCl22B+3S=B2S36 在高温下硼也能同金属反应生成金属硼化物,如NbB4,ZrB2,LaB6等。
硼化物一般具有高硬度高熔点。
7 无定形硼不与非氧化性酸作用,但可以与热浓H2SO4,热的HNO3反应:B+3HNO3(浓)=B(OH)3+3NO2↑2B+3H2SO4(浓)=2B(OH)3+3SO2↑8 有氧化剂存在时,硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O③硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5•H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7•10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5•H2O+2H2SO4=2H3BO3+2MgSO4(2) 硼氢化合物称为硼烷,已知的有:B2H6,B4H10,B5H9,B8H16,B8H18等,BnHn+4与BnHn+6共20 多种。
硼烷中常出现五种类型的化学键,其中有包括氢桥键,硼桥键与闭合式硼键的三种缺电子的三中心二电子键与两种一般的化学键——硼氢键 B-H、硼硼键 B-B。
①乙硼烷B2H6就是最简单的硼烷。
BH3不存在就是由于B的价轨道没有被充分利用,且配位数未达到饱与,又不能形成稳定sp2 杂化态的离域π键。
乙硼烷的结构:每个硼原子均采取sp3 杂化,4个杂化轨道中有3个单电子轨道与一个空轨道。
上方氢原子的有1个电子的1s轨道与两个硼原子的共含1个电子的两个sp3 杂化轨道三者互相成键。
这种键称为三中心二电子键,同时由于其类似一座桥,故称为氢桥键。
1976年,威廉·利普斯科姆因为硼烷结构的研究得到诺贝尔化学奖。
乙硼烷的性质自燃性:乙硼烷就是一种还原性极强的物质,在空气中可以自燃B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)水解:B2H6+6H2O=2B(OH)3↓+6H2↑从上述的反应我们知道,硼烷类化合物遇水、遇氧气极不稳定,容易失效,因此在硼烷化合物的储存与运输过程要在无水无氧条件下进行。
被氯气氧化:B2H6(g)+6Cl2(g)=2BCl3(l)+6HCl(g)乙硼烷的制备:(1)质子置换法:Mg3B2+6H+→B2H6+3Mg2+(2)氢还原发:2BCl+6H2→B2H6+6HCl(3)负氢离子:3LiAlH4 +4BCl3→ 2B2H6 + 3LiCl+ 3AlCl3(3) 硼的含氧化合物①三氧化二硼(又称氧化硼、硼酸酐)无色玻璃状晶体或粉末,熔点450℃。
具有强烈吸水性而转变为硼酸,故应于干燥环境下密闭保存,防止吸水变质导致含量下降。
微溶于冷水,易溶于热水中。
B2O3(s) + 3 H2O(l) = 2 H3BO3B2O3(s) + H2O(g) = 2 HBO23B2O3+3H2O=B3O3(OH)3在熔融条件下B2O3与金属氧化物化合,能得到有特征颜色的片硼酸盐熔珠,例如CuO+B2O3=Cu(BO2)2蓝色Fe2O3+3B2O3=2Fe(BO2)3 黄色②硼酸B(OH)3化学性质1.一元Lewis弱酸:不就是三元质子酸B(OH)3+H2O=B(OH)4 - +H + Ka = 5、8×10-10,很弱2.与多元顺式羟基化合物反应,酸性增强3、与单元醇反应H2SO4H3BO3+3CH3OH====== B(OCH3)3+3H2O4、与强酸时,显碱性B(OH)3+H3PO4=BPO4+3H2O5、加热脱水B(OH)3→HBO2→B2O3③硼酸盐Na2B4O7·H2O (重要的硼酸盐)NaBO2Mg2B2O5·H2O④四硼酸钠(硼砂,Borax)(重点)(一)硼砂晶体结构1.四硼酸根[B4O5(OH)4]2-2个B: sp2 BO3另2个B: sp3 BO4氢键2.各[B4O5(OH)4]2- ──→成链(二)T升高, 硼砂溶解度T/℃10 50 100S /g/100g H2O 1、6 10、6 52、5 可用重结晶法提纯●(三)硼砂化学性质1.标准缓冲溶液(重点) 缓冲原理:[B4O5(OH)4]2- + 5H2O = 2H3BO3+ 2B(OH)4-+OH-+H+1:1摩尔比外加少量H+或OH-,本身pH变化小。
20℃pH=9、242、制备(BN)xNa2B4O7+10 H2O + 2 NH4Cl= 2NaCl +B2O3(g) + 4H2O+ 2BN●(四)硼砂珠试验——鉴定金属离子硼砂与B2O3、B(OH)3一样,与一些金属氧化物共熔→带特征颜色的偏硼酸盐。
△例Na2B4O7+CoO ——Co(BO2)2·2NaBO2蓝色△3Na2B4O7+Cr2O3——2Cr(BO2)3·6NaBO2 绿色Cu(BO2)2蓝CuBO2红Fe(BO2)2绿Fe(BO2)3 棕Ni(BO2)2黄棕MnO2·2B2O3紫色●硼的卤化物BX3(X=Cl Br I):•BX3的结构:B采取sp2杂化。
分子构型为三角形,硼原子周围有6个电子,属于缺电子结构。
·键能/kJ•mol-1结构:BF3BCl3BBr3BI3结构平面三角形室温下聚集态: g g l s熔点/℃-127、1 -107 -46 49、9沸点/℃-100、4 12、7 91、3 210键级3+ 1 46键长/pm B-F 132 (正常B-F单键150)B-X键能613、3 456 377 263、6 (F I )BCl3、BBr3Ⅱ64较弱,BI3可忽略Ⅱ64卤化物的水解:BX3+3H2O=B(OH)3+3HX (Cl Br I)4BF3+3H2O=B(OH)3+3H[BF4]BF3+HF=HF BF3BX3(g) + 3H2O(l)= B(OH)3(s)+ 3HX(g)亲核机理X = Cl , △r Gθ= -157、07 kJ·mol-1 < 0X = F , △r Gθ= +29、59 kJ·mol-1> 0∴S、S、, 298K, BF3水解非自发1.Lewis酸性:BX3就是缺电子化合物,可与Lewis碱加合。
BF3 + :NH3= F3B←NH3BF3 + HF = HBF4氟硼酸,强酸(似H2SiF6)BX3+ X-= BX4-sp2sp32、Lewis酸性强弱顺序: BF3 < BCl3 < BBr3 > BI3若只考虑电负性:BF3 > BCl3 > BBr3 > BI3若只考虑∏46强度↘:BF3 <BCl3 <BBr3 < BI3二:铝单质及其化合物●2、1:铝的物理性质铝就是银白色金属,熔点就是660、32℃,沸点在2519℃,密度2、699g/cm3,,因为铝的密度较小,所以被广泛用于制造轻合金,作为飞机与航天器的材料。
而且铝具有良好的延展性,能代替铜用来制作电线,尽管其导电性能不如铜,但却有资源丰富与密度小的优势。
●2、2:铝的化学性质(1) 首先要明确铝的最重要的化学性质在于它具有两性,即:铝不仅可以与酸反应生成对应的盐与氢气(铝属于一种活泼的金属),铝还可以与强碱(如NaOH)生成偏铝酸盐以及氢气)反应的方程式为:铝与酸反应, 2Al +6 HCl =2AlCl3+3H2↑铝与碱反应, 2Al +2NaOH+2H2O=2NaAlO2+3H2↑(2) 铝在空气中易于中的氧气发生反应,生成一种致密的氧化膜,可以保护内部的铝不再与氧气与水发生作用,甚至遇到浓硝酸或浓硫酸时也可以不发生作用,所以铝可以用来做日用器皿的材料。
但就是NaCl可以腐蚀致密的铝的氧化膜,所以长期盛放在铝制器皿中的菜肴容易败坏就就是这样的原因。
(3)工业上铝的制备方法及流程因为铝在自然界中大多以氧化物存在于它的矿物里面,所以工业上通常采取化学法来制备单质铝。
而铝矾土就是提取与冶炼铝的主要原料。
制备流程如下:首先用碱浸取铝矾土,并加压煮沸,使其中的铝元素以铝酸盐形式存在:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]再过滤将铝酸钠溶液与一些不溶性杂质分开。
之后通入CO2调节pH,使Al(OH)3沉淀,析出;2Na[Al(OH)4]+CO2=2Al(OH)3↓+Na2CO3+H2O经分离,焙烧得到符合电解需要的较纯净的Al2O3:2Al(OH)3=Al2O3+3H2O将Al2O3溶解在熔融的冰晶石(Na3[AlF6],主要目的在于降低Al2O3的熔点),在1223K下进行电解。
在阴极上得到金属铝。
电解反应可以表示为:2Al2O3=4Al+3O2↑电解出来的铝定时的放出,冷却制成铝锭。
即可得到工业用Al(4)铝与硼相似,都就是亲氧元素,可以与氧气化合并且放出大量的热,工业生产中也可以用该反应来从其她金属氧化物置换出金属。
我们通常称其为铝热反应。
例如铝粉与氧化物粉末的混合物,点燃镁条引发反应:2Al+Fe2O3=2Fe+Al2O3反应放出来的热量可以使体系升温至3000℃以上,产物中的Fe将被熔化。
这个反应可以用来焊接损坏的铁轨。
(5)在高温下,铝容易同P, S , Si 等非金属反应,例如:2Al+3S=Al2O3(6) 铝就是不可以直接与氢化合的,但就是铝的氢化物(AlH3)n就是存在的。
制备需要在乙醚的环境中进行,3n LiH+ n AlCl = (AlH3)n+3nLiCl但就是当混合物中中的LiH过量时,将有氢化锂铝(LiAlH4)生成、氢化锂铝就是重要的还原剂,尤其在有机反应中十分重要。