溶解热的测定讲解
- 格式:ppt
- 大小:2.78 MB
- 文档页数:19


溶解热的测定溶解热是指在恒定压力下,单位质量固体物质在溶液中完全溶解时所放出或吸收的热量。
它是化学热力学中的一项重要物理量,与溶解过程的热力学性质和反应机理密切相关。
溶解热的测定方法有很多种,我们这里介绍两种典型的实验方法:计算比热容法和测定热效应法。
一、计算比热容法比热容法是根据热平衡原理,在温度为T1的热源中将样品加热至温度为T2,测定样品的质量m、热容Cp、初始温度T1和终末温度T2,从而计算出溶解热ΔH。
其计算公式为:ΔH = (Q2 - Q1) / m = Cp × (T2 - T1)其中,Q1和Q2分别表示样品在T1和T2温度下吸收的热量,Cp是样品的比热容,m是样品质量,ΔH为溶解热。
此外,由于固体在溶液中溶解时通常伴随着熔化,因此在计算时应将熔化热考虑在内,即:其中,ΔHm为熔化热,通常可以参考文献或手册给出的数据进行修正。
比热容法的优点是测量精度高,操作简单,但需要较精确的温度测量和热量测量,且需要考虑熔化热的影响。
二、测定热效应法测定热效应法是通过测量溶解过程中反应热量的变化来计算溶解热。
通常是在恒定压力下将固体样品加入到溶液中,测定反应热量和样品的质量,从而计算出溶解热ΔH。
其计算公式为:ΔH = Q / m其中,Q为反应过程中放出或吸收的热量,m为样品质量,ΔH为溶解热。
测定热效应法有多种实验方法,比如热量计法、差热分析法、反应热法等,不同的方法适用于不同类型的样品和反应体系。
其中,热量计法是一种较为常用的测定方法,其基本原理是通过测量加热物体的能量变化量来计算反应热量。
它的优点是可应用于各种类型的样品和反应体系,能够直接测定反应过程的热量变化,但需要一定的操作技能和仪器支持。
总之,溶解热的测定是化学热力学中的一项重要实验。
通过计算比热容法和测定热效应法等方法,可以获得溶解过程的热力学性质和反应机理,为化学工艺控制和工业生产提供重要的参考数据。

实验3 溶解热的测定一、实验目的1.用量热计简单测定硝酸钾在水中的溶解热。
2.掌握贝克曼温度计的调节和使用。
二、实验原理盐类的溶解往往同时进行着两个过程:一是晶格破坏,为吸热过程;二是离子的溶剂化,为放热过程。
溶解热是这两种热效应的总和。
最终是吸热还是放热,则由这两种热效应的相对大小来决定。
本实验在定压、不做非体积功的绝热体系中进行时,体系的总焓保持不变,根据热平衡,即可计算过程所涉及的热效应。
T C C W C W W M H m sol ∆⋅++-=∆][322111)( (3.1)式中: m Sol H ∆为盐在溶液温度和浓度下的积分溶解热,单位:kJ·mo1–1;1W 为溶质的质量,单位:kg ;T ∆为溶解过程的真实温差,单位:K ;2W 为水的质量,单位:kg ;M 为溶质的摩尔质量,单位:kg·mo1–1; 21C C 、分别为溶质和水的比热,单位:11--⋅K kg kJ ;3C 为量热计的热容(指除溶液外,使体系温度升高1℃所需要的热量) ,单位:kJ 。
实验测得W 1、W 2、ΔT 及量热计的热容后,即可按(3.1)式算出熔解热m Sol H ∆。
三、仪器与药品溶解热测量装置一套(如图3.1所示);500ml 量筒一个;KCl(A.R.) ;KNO 3(A.R.)四、实验步骤1.量热计热容的测定:本实验采用氯化钾在水中的溶解热来标定量热计热容3C 。
为此,先在干净的量热计中装入500m1蒸馏水,将与贝克曼温度计接好的传感器插入量热计中,放在磁力搅拌器上,启动搅拌器, 保持60-90转/分钟的搅拌速度,此时,数字显示应在室温附近,至图3.1溶解热测定装配图1.磁力搅拌器;2.搅拌磁子;3.杜瓦瓶;4.漏斗;5.传感器;6.SWC —IIC 数字贝克曼温度仪.温度变化基本稳定后,每分钟准确记录读数一次,连续8次后,打开量热计盖,立即将称量好的10克氯化钾(准确至0.01克)迅速加入量热计中,盖上盖,继续搅拌,每分钟记录一次读数,读取12次即可停止。

物化实验报告-溶解热的测定一、实验目的本实验旨在通过科学的测定方法,准确地得到溶解热数据,进一步理解溶解热现象和物质溶解过程中的热力学性质。
二、实验原理溶解热是指一定温度下,一定量的溶剂中溶质溶解时所需的热量。
通过测量溶解热,可以了解溶质和溶剂之间的相互作用、溶解过程的动力学性质等。
溶解热的测定有助于我们深入理解溶解现象和溶液的热力学性质。
本实验采用综合量热法测定溶解热。
综合量热法是一种通过测量热量和温度变化来确定溶解热的实验方法。
在实验过程中,需要精确控制温度变化和溶液浓度等因素,以减小误差。
三、实验步骤1.准备实验器材:恒温水浴、量热计、搅拌器、称量纸、电子天平、保温杯、热水浴、计时器等。
2.配制一定浓度的溶质溶液:用称量纸称取一定质量的溶质,加入热水浴中搅拌均匀,冷却至室温。
3.将量热计和保温杯放入恒温水浴中,确保其处于稳定状态。
4.将配制好的溶质溶液倒入保温杯中,记录初始温度T1。
5.开启搅拌器,将保温杯置于恒温水浴中,记录最终温度T2。
6.测量此过程中溶液的体积变化ΔV,计算溶液的密度ρ=m/ΔV(m为溶质的质量)。
7.根据综合量热法公式计算溶解热ΔH:ΔH = cm(T2-T1) +mΔTc·ΔV/ΔV·m·c·ΔT (c为水的比热容,m为溶质的质量,ΔTc为溶液的密度变化)。
四、实验数据分析通过本次实验,我们得到了一系列溶质的溶解热数据。
从数据中可以看出,不同溶质具有不同的溶解热。
这些数据有助于我们深入理解溶解现象和物质溶解过程中的热力学性质。
溶解热在化学、物理、生物等许多领域都有重要应用,例如化学反应过程的动力学分析、生物大分子的溶液性质研究等。
本实验方法具有较高的精度和可靠性,为后续相关领域的研究提供了有价值的参考数据。

实验九溶解热的测定9.1实验原理9.1.1了解电热补偿法测定热效应的基本原理;9.1.2通过用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水的微分冲淡热、积分冲淡热和微分溶解热;9.1.3掌握电热补偿法的仪器使用。
9.2实验原理9.2.1 物质溶解于溶剂过程的热效应称为溶解热。
它有积分溶解热和微分溶解热两种。
前者指在定温定压下把1mol物质溶解在n0mol溶剂中所产生的热效应,由于过程中溶液的浓度逐渐改变,因此也称为变浓溶解热以Q s表示。
后者指在定温定压下把1mol物质溶解在无限量的某一定浓度的溶液中所产生的热效应。
由于在溶解过程中溶液浓度可实际上视为不变,因此也称为定浓溶解热,以表示。
把溶剂加到溶液中使之稀释,其热效应称为冲淡热。
它有积分(或变稀)冲淡热和微分(或定浓)冲淡解热两种。
通常都以对含有1mol溶质的溶液的冲淡情况而言。
前者系指在定温定压下把原有1mol溶质和n01mol溶剂的溶液冲淡到含溶剂为n02mol时的热效应,亦即为某两浓度的积分溶解热之差,以Q d表示。
后者系溶剂加到某一浓度的无限量溶液中所产生的热效应,以表示。
9.2.2积分溶解热由实验直接测定,其它三种热效应则可通过Q s~n0曲线求得。
设纯溶剂、纯溶质的摩尔焓分别为9.3仪器与药品定点式温差报警仪1台,数字式直流稳流电源1台,直流伏特计1台,量热计(包括500ml杜瓦瓶,搅拌器,加热器)1套,停表1只,称量瓶(20×40mm)8只,称量瓶(35×70mm)1只,毛笔1支,硝酸钾(AR)约26g。
9.4实验步骤9.4.1硝酸钾26g(已进行研磨和烘干处理),放入干燥器中。
9.4.2将8个称量瓶编号,并精确称量,依次加入约2.5、1.5、2.5、3.0、3.5、4.0、4.0和4.5g的硝酸钾,再至分析天平精确称量,把称量瓶依次放入干燥器中待用。
9.4.3用量筒加200mL蒸馏水于杜瓦瓶内,按图Ⅱ-4-2装置接妥线路。

溶解热的测定实验目的:了解热效应测定的基本原理;用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分溶解热,积分冲淡热和微分溶解热;掌握溶解热测定仪的使用。
实验讲授:溶解热:物质溶解于溶剂过程的热效应。
它有积分溶解热和微分溶解热两种。
积分溶解热:指定温定压下把1mol 物质溶解在n 0 mol 溶剂中时所产生的热效应。
由于在溶解过程中浓度不断改变,因此又称为变浓溶解热,以Q s 表示。
微分溶解热:指在定温定压下把1mol 物质溶解在无限量某一定浓度溶液中所产生的热效应。
在溶解过程中浓度可视为不变,因此又称为定浓溶解热,以0,,n p T s n Q ⎪⎭⎫⎝⎛∂∂表示(定温,定压,定浓状态下,由微小的溶质增量所引起的热量变化)。
冲淡热:把溶剂加到溶液中使之稀释,过程中的热效应称为冲淡热。
它也有积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。
积分冲淡热:在定温定压下把原为含1mol 溶质和n 01 mol 溶剂的溶液冲淡到含有n 02 mol 溶剂时的热效应。
它为两浓度的积分溶解热之差。
以Q d 表示。
微分冲淡热:1mol 溶剂加到某一浓度的无限量溶液中所产生的热效应,以np T sn Q ,,0⎪⎪⎭⎫⎝⎛∂∂表示(定温,定压,定溶质状态下,由微小溶剂增量所引起的热量变化)。
积分溶解热的大小与浓度有关,而且不具备线性关系。
积分溶解热由实验测定,在测定时可画出一条积分溶解热Q s 与溶剂浓度n 0之间的关系曲线。
其它三种热效应由Q s ~n 0曲线求得。
溶解过程的焓变为:2211'H n H n H H H ∆+∆=-=∆式中的11H n ∆为溶剂在指定浓度溶液中溶质与纯溶质摩尔焓的差,即为微分溶解热。
由于积分溶解热为:210121212/H H n H H n n n H Q s ∆+∆=∆+∆=∆= 在Q s ~n 01图上,不同Q s 点的切线斜率为对应于该浓度溶液的微分冲淡热np T s n Q ,,0⎪⎪⎭⎫⎝⎛∂∂(偏微分)。

实验八 溶解热的测定一、实验目的及要求1.掌握采用电热补偿法测定热效应的基本原理;2.用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分溶解热,积分稀释热和微分稀释热;3.掌握溶解热测定仪器的使用。
二、实验原理物质溶解过程所产生的热效应称为溶解热,可分为积分溶解热和微分溶解热两种。
积分溶解热是指定温定压下把1 mol 物质溶解在 n 0 mol 溶剂中时所产生的热效应。
由于在溶解过程中溶液浓度不断改变,因此又称为变浓溶解热,以Q s 表示。
微分溶解热是指在定温定压下把 1 mol 物质溶解在无限量某一定浓度溶液中所产生的热效应。
在溶解过程中浓度可视为不变,因此又称为定浓溶解热,以0,,n p T s n Q ⎪⎭⎫ ⎝⎛∂∂表示,即定温,定压,定溶剂状态下,由微小的溶质增量所引起的热量变化。
稀释热是指将溶剂添加到溶液中,使溶液稀释过程中的热效应,又称为冲淡热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
积分稀释热是指在定温定压下把原为含 1 mol 溶质和 n 01 mol 溶剂的溶液冲淡到含有 n 02 mol 溶剂时的热效应,它为两浓度的积分溶解热之差,以Q d 表示。
微分冲淡热是指将 1 mol 溶剂加到某一浓度的无限量溶液中所产生的热效应,以n p T s n Q ,,0⎪⎪⎭⎫ ⎝⎛∂∂表示,即定温,定压,定溶质状态下,由微小溶剂增量所引起的热量变化。
积分溶解热的大小与浓度有关,但不具有线性关系。
通过实验测定,可绘制出一条积分溶解热Q s 与相对于 1 mol 溶质的溶剂量 n 0 之间的关系曲线(如图8-1所示),其它三种热效应由Q s ~n 0曲线求得。
设纯溶剂、纯溶质的摩尔焓分别为H 1和H 2,溶液中溶剂和溶质的偏摩尔焓分别为H 1,m 和H 2,m ,对于由 n 1 摩尔溶剂和 n 2 摩尔溶质所组成的体系,在溶剂和溶质未混合前,体系总焓为: 2211H n H n H += (1) 将溶剂和溶质混合后,体系的总焓为:m m H n H n H ,22,11'+= (2) 因此,溶解过程的热效应为:22112,221,11)()('H n H n H H n H H n H H H m m ∆+∆=-+-=-=∆ (3) 在无限量溶液中加入 1 mol 溶质,(3)式中的第一项可认为不变,在此条件下所产生的热效应为(3)式第二项中的ΔH 2,即微分溶解热。

溶解度和溶解热的测定方法
溶解度和溶解热的测定方法各有不同,它们是深入了解物质特性和
行为的重要参数。
而这两大测定方法的基本介绍和作用是必不可少的。
一、溶解度的测定方法
溶解度是指在一定温度下,特定的溶剂中能溶解特定溶质的最大量,计量单位常为g/100g溶剂。
主要的测试方法有以下几种:
1. 温度 - 饱和溶液法:对于溶解度较大的物质,采用这种方法。
先
将溶质加入溶剂中,随着溶质的添加,直到溶剂不能再溶解时,再加
热至特定温度,测得此时的溶液浓度即为溶解度。
2. 直接滴定法:用于酸碱之类的溶液。
将溶质悬浮在溶剂中,用滴
定液滴到反应终点,从碱液或酸液的消耗量计算溶解度。
3. 凝固点降低法:适用于溶质透析困难的某些生物组织。
通过测定
溶液的凝固点降低量,可逆推得溶质的溶解度。
二、溶解热的测定方法
溶解热指溶质在特定溶剂中溶解时吸收或释放的热量,通常用焓来
表示。
其测定方法在实验条件下有以下两种:
1. 恒温释热量计法: 利用溶解过程中吸收或释放的热量,改变恒温
释热量计内的水温,从而得出溶解热。
2. 恒压卡计法:测定溶质溶解过程产生或吸收的热量,通过改变恒
压卡计中的气体的压力,推算出溶解热。
以上就是溶解度和溶解热的测定方法,了解这些方法不仅有助于实
现精确地测定,还可以通过观察溶解过程提供对物质行为的深入理解。
而这两项测定,对于科学研究或者工业生产来说,都具有非常重要的
意义。

溶解热的测定溶解热是指在一定压力和温度下,单位质量的物质从固态转变为溶解态所释放或吸收的热量。
溶解热是反映固体与溶液相互作用强度、稳定性的重要指标,对于理解化学反应、确定物质的结构等方面都具有重要的意义。
那么,如何测定溶解热呢?一、原理:通常我们使用定温法,即先将药品(固态)放在一定量的溶液中,使其达到热平衡,记录下溶解时药品和溶液的初温度和终温度,然后再测定空盛的控制试验,最后计算溶解热。
这个原理是根据热力学的一级定律,即能量守恒的原理。
药品溶解时所吸收的热量等于溶液放出的热量。
溶液放出的热量可以用溶液的比热容×质量×热效值(即水的热效值为4.18J/g℃)进行计算。
二、步骤:1.准备试样:将约1克左右的样品(需要精确称量)粉碎,过筛,放在干燥的试管中备用。
2.准备溶液:按照需求设置好溶液的浓度和体积,倒入烧杯中,通过恒温器加热到预设温度。
建议使用热水浴或恒温水槽来控制恒温器。
3.称量固态药品:将准备好的粉末样品逐个分配到干燥的试管中。
为确保精度,建议不要将样品直接放入溶液中。
4.测定初始温度:用铂电极在溶液中测定初始温度。
该步骤应与测定结束的温度差不大。
为提高测量精度,建议取平均值。
5.将药品加入溶液中:取准备好的样品试管,打开塞子,将药品逐渐加入溶液中,并立即关上塞子,摇晃试管,使药品完全溶解。
为确保精度,建议在药品完全溶解前不要移动试管或打开试管盖。
6.测量结束温度:用铂电极在溶液中测定药品和溶液的终温度。
该步骤应与测定初温度时间尽可能接近。
7.计算:计算公式为(热效值×溶液的质量×溶液的比热容)÷样品质量。
三、注意事项:1.样品需精确称量。
对于粉末样品,建议使用量筒来测量体积。
2.试管须干燥。
使用化学用品器皿干燥后,倒出任何剩余的物质。
试管晾干后再使用。
3.初始温度和结束温度的时间应该相同。
当测量结束温度时,需要多次测量,对测量数据进行求平均值。

补充实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫ ⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂ ⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,A s m A m B m A m BB B n H Q H H n H H n n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
实验三溶解热的测定实验目的:1.学习利用热化学方程式来计算溶解热。
2.理解溶解过程中生成的热量与溶质的吸热或放热性质有关。
3.掌握通过计算得出的溶解热的方法。
实验原理:当固体溶质溶解于溶剂中时,如果是放热现象,称为溶解热,溶解热记作 $\Delta H_s^{\theta}$ 。
如果是吸热现象,则称为溶解热(再结晶热),记作 $\DeltaH_c^{\theta}$ 。
在剧烈搅拌下、在保证反应物质量及环境温度恒定的条件下,实验结果表明,在一定限度内,溶解热与溶质的重量(m)、溶液的质量(m(Ls))、环境温度(T)成正比例关系,即:$\Delta H_s^{\theta} = \frac{Q}{m} = \frac{C_pm(Ls)\Delta T}{m}$其中:Q: 热量,单位:焦耳(J);$m$:固体溶质的质量,单位:克(g);$C_p$:水的摩尔热容,单位:$\frac{J}{mol·K}$;$\Delta T$:溶液温度升高量,单位:℃。
实验步骤:1.称重取1.0g 沫菜酸(或钠)标准样品,转移至50mL量瓶中,加入适量的水,用滴定管加入2~3滴苯酚作为指示剂,摇匀溶解。
2.测定电动势(e)和溶液温度(t)。
3.将溶液倒入量热器中,立即快速盖上绝热的盖子,用热计测量溶液的温度变化(ΔT),直到温度稳定,记录数据。
4.将上述步骤1~3重复一次,测得第二组数据。
1.计算出氧化锌标准态生成焓的摩尔热或钠标准态在水溶液中生成焓的摩尔热。
n:以下两种物质产生1 mol 反应热。
氧化锌:Zn + 1/2O2 = ZnO,$\Delta H_m^{\theta}=-622.8kJ/mol$2.计算出固体溶质的溶解热。
其中,$m$ 为沫菜酸(或钠)的质量。
实验注意事项:1.装药和投药要快,能快则快。
2.保护好数据处理部件,严格按操作要求。
3.药品投放及位置要求准确,不能松懈。
实验思考题:1.影响固体溶质溶解热的因素有哪些?2.在本实验中,沫菜酸或钠是放热或吸热过程?请解释原因。
实验3溶解热的测定1 引言1.1 实验目的1.1.1 测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
1.1.2 掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
1.1.3 复习和掌握常用的测温技术。
1.2 实验原理1.1.1基本概念溶解热在恒温恒压下,溶质B 溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示。
sol sol m BHH n ∆∆=(1) 式中,B n 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A H n ∂∆∂表示,简写为()B sol n AHn ∂∆∂。
1.1.2计算原理在恒温恒压下,对于指定的溶剂A 和溶质B ,溶解热的大小取决于A 和B 的物质的量,即(,)sol A B H n n ∆=⎰(3)由(3)式可推导得:,,,,()()B A sol sol sol A T P n B T P n A B H HH n n n n ∂∆∂∆∆=+∂∂(4) 或,,,,()()B A sol sol A sol m T P n T P n B A BH H n H n n n ∂∆∂∆∆=+∂∂(5) 令0/A B n n n =,(5)改写为:0,,,,()()B A sol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂(6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。
实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
KNO 3溶解热的测定一、实验目的1.用电热补偿法测定KNO 3在不同浓度水溶液中的积分溶解热。
2.用作图法求KNO 3在水中的微分冲淡热、积分冲淡热和微分溶解热。
二、预习要求1.复习溶解过程热效应的几个基本概念。
2.掌握电热补偿法测定热效应的基本原理。
3.了解如何从实验所得数据求KNO 3的积分溶解热及其它三种热效应。
4.了解影响本实验结果的因素有那些。
三、实验原理1.在热化学中,关于溶解过程的热效应,引进下列几个基本概念。
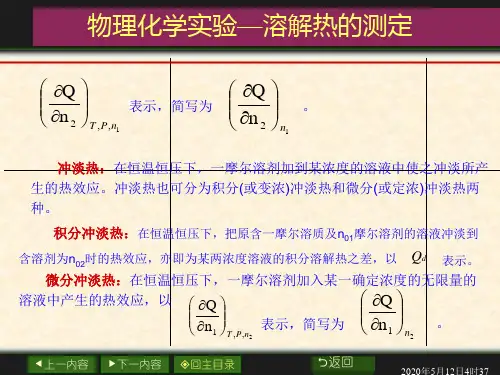
溶解热: 在恒温恒压下,n 2摩尔溶质溶于n 1摩尔溶剂(或溶于某浓度的溶液)中产生的热效应,用Q 表示,溶解热可分为积分(或称变浓)溶解热和微分(或称定浓)溶解热。
积分溶解热:在恒温恒压下,一摩尔溶质溶于n 0摩尔溶剂中产生的热效应,用s Q 表示。
微分溶解热:在恒温恒压下,一摩尔溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以1,,2n p t n Q ⎪⎪⎭⎫⎝⎛∂∂表示,简写为12n n Q ⎪⎪⎭⎫⎝⎛∂∂。
冲淡热:在恒温恒压下,一摩尔溶剂加到某浓度的溶液中使之冲淡所产生的热效应。
冲淡热也可分为积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。
积分冲淡热:在恒温恒压下,把原含一摩尔溶质及n 01摩尔溶剂的溶液冲淡到含溶剂为n 02时的热效应,亦即为某两浓度溶液的积分溶解热之差,以d Q 表示。
微分冲淡热:在恒温恒压下,一摩尔溶剂加入某一确定浓度的无限量的溶液中产生的热效应,以2,,1n p t n Q ⎪⎪⎭⎫ ⎝⎛∂∂表示,简写为21n n Q ⎪⎪⎭⎫ ⎝⎛∂∂。
2.积分溶解热(s Q )可由实验直接测定,其它三种热效应则通过s Q —n 0曲线求得。
设纯溶剂和纯溶质的摩尔焓分别为)1(m H 和)2(m H ,当溶质溶解于溶剂变成溶液后,在溶液中溶剂和溶质的偏摩尔焓分别为m H ,1和m H ,2,对于由1n 摩尔溶剂和2n 摩尔溶质组成的体系,在溶解前体系总焓为H 。
实验九溶解热的测定9.1实验目的9.1.1了解电热补偿法测定热效应的基本原理;9.1.2. 通过用电热补偿法测定硫酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分冲淡热、积分冲淡热和微分溶解热;9.1.3掌握电热补偿法的仪器使用。
9.2实验原理9.2.1物质溶解于溶剂过程的效应称为溶解热。
它有积分溶解热和微分溶解热两种。
前者指在定温定压下把1mol溶质溶解在n0 mol的溶剂中所产生的热效应,由于过程中溶液的浓度逐渐改变,因此也称为变浓溶解热以Q s表示。
后者指在定温定压下把1mol溶质溶解在无限量的某一定浓度的溶液中所产生的热效应。
由于在溶解过程中溶液浓度可实际上视为不变,因此也称为定浓溶解热,以表示。
把溶剂加到溶液中使之稀释,其热效应称为冲淡热。
它有积分(变浓)冲淡热和微分(或定浓)冲淡热两种。
通常都以对含有1mol溶质的溶液的冲淡情况而言。
前者系指在定温定压下把原为含1mol溶质和n01mol溶剂的溶液冲淡到含溶剂为n02mol时的热效应。
亦即为某两浓度的积分溶解热之差,以Q d表示。
后者系指1mol溶剂加到某一浓度的无限量溶液中所产生的热效应,以表示。
9.2.2积分溶解热由实验直接测定,其它三种热效应则可通过Q s~n0曲线求得:设纯溶剂、纯溶质的摩尔焓分别为和,溶液中的溶剂和溶质的偏摩尔焓分别为和,对于n1摩尔溶剂和n2摩尔溶质所组成的体系而言,在溶剂和溶质未混合前H= n1+ n2(9.1)当混合成溶液后= n1+ n2(9.2)因此溶解过程的热效应为△H=- H= n1(-)+n2(-)=n1△H1+n2△H2 (9.3)式中,△H 2为在指定浓度溶液中溶质与纯溶质摩尔焓的差,即为微分溶解热。
根据积分溶解热的定义:Q s =△H/n 2=n 1/n 2△H 1+△H 2 =n 01△H 1+△H 2 (9.4)所以在Q s ~n 01图上,不同Q s 点的切线斜率为对应于该浓度溶液的微分冲淡热,即=AD /CD 。