DNA琼脂糖凝胶电泳制备全过程图解
- 格式:ppt
- 大小:923.00 KB
- 文档页数:10

实验原理、材料、方法、结果、讨论琼脂糖凝胶电泳操作步骤琼脂糖凝胶的制备:溶化,冷却,EB凝胶板的制备:加梳子,倒胶样品的制备:样品+1/5体积溴酚蓝加样:加样端为负极(黑)电泳:5V/cm观察:紫外灯下观察,照相PCR-SSCP聚合酶链反应单链构象多态性PCR实验原理:在微量离心管中,加入适量的缓冲液,模板DNA,dNTPs ,Taq DNA 聚合酶,一对引物,以高温变性、低温退火和中温延伸三个反应为一个循环,经过25~35次循环,最终使特异区段的DNA扩增数百万倍,满足分子生物学下游操作。
介绍:PCR-SSCP分析技术是一种DNA单链凝胶电泳技术,它根据形成不同构象的等长DNA单链在中性聚丙烯酰胺凝胶中的电泳迁移率变化来检测基因变异。
该技术已被广泛用于癌基因和抗癌基因变异的检测、遗传病的致病基因分析以及基因诊断、基因制图等领域。
PCR-SSCP分析的基本程序:1、通过PCR扩增特定靶序列,2、将扩增产物变性为单链,3、进行非变性聚丙烯酰胺凝胶电泳。
PCR反应体系:(单位:微升)Buffer液: 2.5引物1: 1引物2: 1dNTP: 2模板DNA: 1双蒸水: 16.5Taq DNA聚合酶: 1非变性聚丙烯酰胺凝胶:1、30%聚丙烯酰胺(交联度49:1) 4ml,2、50×TAE缓冲液 0.2ml,3、1%TEMED 1ml5、蒸馏水 4.7ml,4、10%过硫酸铵(AP) 0.1ml银染步骤:1、电泳结束,小心取出凝胶,置10%乙醇液中固定5分钟。
(防止再扩散)2、置凝胶于1%硝酸氧化3分钟。
(预处理)3、用双蒸水荡洗凝胶1分钟,换液两次。
4、置凝胶于0.012mol/L硝酸银液中20分钟。
使银离子与DNA结合。
5、弃去硝酸银,用双蒸水荡洗凝胶1分钟,换液两次。
6、用0.019%甲醛液,含0.28mol/L无水碳酸钠使胶还原,银离子变成银颗粒而显色。
直至所需的显色深度。
7、置凝胶于10%冰乙酸停止还原反应。

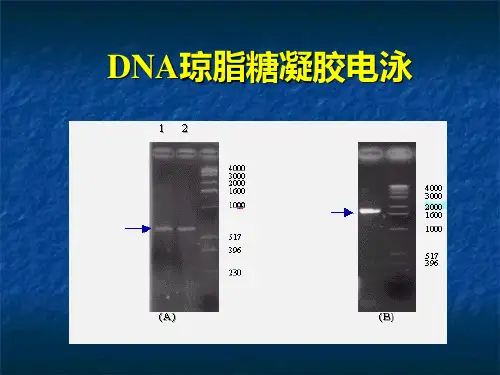
DNA凝胶电泳
制胶,铺胶
材料工具:制胶模板,TAE或TBE缓冲液,TAE专用瓶,Aarose I-H,配DAB瓶,微波炉应用液制备:取200ml 5×TBE缓冲液到TAE专用瓶中;
向瓶中加水,使液面到1000ml处
取电泳槽内的有机玻璃内槽洗干净,晾干,放入制胶玻璃板,将内槽置于水平位置,并在固定位置放好梳子;
取Aarose I-H 3g至“配DAB瓶”中;
向瓶中加入200ml应用液,混匀液体;
将盖子斜放于瓶口,将瓶置于微波炉中,火力设定10,时间3min;
取出瓶,加入10ul 10ug/ul EB,滴加时枪头置于液面以下,吹打几次,尽量完全打出;将瓶放置几分钟,使瓶中液体降温到65℃左右;
将琼脂糖凝胶液小心均匀地倒入内槽玻璃板,尽量一次铺胶,减少补胶行为的出现,倒入量为使液面距离板梳5mm处左右;
室温静置,待凝胶完全凝固,垂直轻拔梳子,铲掉多余凝胶,将制好的凝胶板放置于保鲜盒中保存;
加样:
向电泳槽中加入应用液,应用液应为制胶时使用的应用液;
将制好的凝胶板放置于电泳槽中,方向为从负极到正极即加样孔在靠近负极方向,应用液的量需要满足将凝胶板完全淹没,注意排出加样孔中气泡;
取加样板,在板上滴加2ul 6×上样缓冲液,每滴之间距离大于1cm;
取10ul DNA样品,滴加到上样缓冲液滴中,用枪吹打混匀,吸取10ul混合液垂直滴加到胶板小槽内,加样时注意不要破坏样品孔周围的凝胶;
开启电源,设置电压 120~140V
时间 30~40分钟
当溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳;
取出凝胶板,置于紫外灯下观察,采用凝胶成像系统拍照保存。


琼脂糖凝胶电泳的操作步骤琼脂糖凝胶电泳的操作步骤如下:1. 制备1%琼脂糖凝胶(大胶用70ml,小胶用50ml):称取0.7 g(0.5 g)琼脂糖置于锥形瓶中,加入70 ml(50ml)1×TAE,瓶口倒扣小烧杯.微波炉加热煮沸3次至琼脂糖全部融化,摇匀,即成1.0%琼脂糖凝胶液.2. 胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板.取透明胶带将玻璃板与内槽两端边缘封好,形成模子.将内槽置于水平位置,并在固定位置放好梳子.将冷却到65?左右的琼脂糖凝胶液混匀小心地倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层.室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中.添加1×TAE电泳缓冲液至没过胶板为止 .3. 加样:在点样板或parafilm上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1X.用10 ul微量移液器分别将样品加入胶板的样品小槽内,每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围的凝胶面.(注意:加样前要先记下加样的顺序).4. 电泳:加样后的凝胶板立即通电进行电泳,电压60-100V,样品由负极(黑色)向正极(红色)方向移动.电压升高,琼脂糖凝胶的有效分离范围降低.当溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳.(5)电泳完毕后,取出凝胶,用含有0.5 ug/ml的溴化乙锭1×TAE溶液染色约20 min,再用清水漂洗10 min.(6)观察照相:在紫外灯下观察,DNA存在则显示出红色荧光条带,采用凝胶成像系统拍照保存实验原理闭合环状质粒、线性质粒和开环质粒DNA由于构形不同,在加溴化乙锭的琼脂糖凝胶电泳上呈现不同的迁移率,因而在紫外灯下观察,能区别闭合环状质粒DNA(cccDNA)、线性质粒DNA(L-DNA)和开环质粒DNA(ocDNA)。
实验材料和试剂(一)实验样品质粒pUC118(二)试剂1(l DNA/HindIII分子量标准2(溴酚蓝指示剂点样缓冲液0.2% 溴酚蓝50% 蔗糖3(1mg/ml溴化乙锭溶液4(电泳缓冲液(TAE)40 mmol/L Tris-乙酸1 mol/L EDTA(配制方法:24.2克Tris碱,5.71ml冰乙酸,10ml 0.5mol/L EDTA(pH8.0),定容至5000ml)5(0.7% 琼脂糖凝胶(配制方法:称取琼脂糖0.35克,加入50ml TAE电泳缓冲液)(三)仪器微量移液器电泳仪水平电泳槽透射紫外观察仪实验步骤1(选择合适的水平式电泳槽,调节电泳槽平面至水平。
DNA琼脂糖凝胶电泳实验原理及超详细步骤物品准备水平电泳槽、电泳仪、微波炉、紫外透射仪、锥形瓶、琼脂糖、电泳缓冲液(1xTBE) 溴化乙锭(EB)溶液、上样缓冲液等实验原理DNA分子在琼脂糖中泳动时有电荷效应和分子筛效应,但主要为分子筛效应。
在pH值为8.0- 8.3时,核酸分子碱基几乎不解离,磷酸全部解离,核酸分子带负电,在电泳时向正极移动。
采用适当浓度的凝胶介质作为电泳支持物,在分子筛的作用下,使分子大小和构象不同的核酸分子泳动率出现较大的差异,从而达到分离核酸片段检测其大小的目的。
核酸分子中嵌入荧光染料(如EB )后,在紫外灯下可观察到核酸片段所在的位置。
实验步骤(1)准备制胶架,用蒸馏水将电泳槽和梳子冲洗干净,放在水平桌面上,并架好梳子(2)配制琼脂糖凝胶及倒胶,琼脂糖凝胶浓度与线形DNA的最佳分辨范围a.以1%的胶为例,三角瓶内0.6g琼脂糖+60ml(0.5xTBE)煮胶溶解冷却至60C(不烫手)b.加入溴化乙锭溶液(终浓度0.5ug/ml)或按照1ul/30mL的比例加入DNAgreen 染料,并充分混匀。
c.倒板,小胶倒入25-30ml左右琼脂糖溶液,大胶则60-70ml左右,若需切胶回收,凝胶可适当加厚。
d.室温下充分凝固,大约30分钟-1小时e.垂直向上拔出梳子f.将胶板放入电泳槽g.向电泳槽中加入0.5xTBE缓冲液至刚没过凝胶表面1-2nm.(3)加样将DNA样品(5ul)与6X上样缓冲液( 1ul)混匀后,用微量加样枪小心加入样品孔内,上样量根据样品浓度可适当调整,若DNA含量偏低,则可依上述比例增加上样量,但总体积不可超过样品槽容量(一般小孔40ul为上限,大孔200ul为上限,具体和制胶膜规格相关)。
注意加样枪的枪头不可插入过深,以免刺穿凝胶,导致样品外溢。
每加完一个样品要更换枪头,以防止EB污染。
(4)电泳接通电源,一般红色为正极,黑色为负极,切记DNA样品由负极往正极泳动(靠近加样孔的一端为负),电压为5V/cm (长度以两个电极之间的距离计算),一般控制电压保持在110v,电流在40mA以上。

DNA的琼脂糖凝胶电泳实验原理和方法步骤脂糖凝胶泳是用于分别、定和提DNA 片段的准方法。
脂糖是从脂中提取的一种多糖,具水性,但不荷,是一种很好的泳支持物。
DNA 在碱性条件下〔pH8 0 的冲液〕荷,在中通凝胶介向正极移,不同样 DNA 分子片段由于分子和构型不同样,在中的泳速率液不同样。
溴化乙〔 EB〕可嵌入 DNA分子碱基形成光合物,紫外照射后,可分出不同样的区,到达分别、定分子量,重子的目的。
⋯一、实验目的学习和掌握琼脂糖电泳法判断DNA 的原理和方法。
二、实验原理琼脂糖凝胶电泳是用于分别、判断和提纯DNA 片段的标准方法。
琼脂糖是从琼脂中提取的一种多糖,具亲水性,但不带电荷,是一种很好的电泳支持物。
DNA 在碱性条件下〔的缓冲液〕带负电荷,在电场中经过凝胶介质向正极搬动,不同样DNA 分子片段由于分子和构型不同样,在电场中的泳动速率液不同样。
溴化乙锭〔EB〕可嵌入 DNA 分子碱基对间形成荧光络合物,经紫外线照射后,可分出不同样的区带,到达分别、判断分子量,精选重组子的目的。
三、实验资料实验 14 提取的 DNA 样品,四、器具及药品电泳仪,电泳槽,紫外透射反射仪,恒温水浴锅,微波炉,微量进样器,三羟甲基氨基甲烷,盐酸,醋酸钠, EDTA,琼脂糖,溴酚蓝,溴化乙锭。
五、实验步骤1、安装电泳槽将有机玻璃的电泳凝胶床洗净,晾干,用胶带将两端的张口封好,放在水平的工作台上,插上样品梳。
2、琼脂糖凝胶的制备称取琼脂糖溶解在电泳缓冲液中,〔按的琼脂糖含量,1-25kb 大小的 DNA 用1%的凝胶,20-100kb 的 DNA 用%的凝胶, 200-2000bp 的 DNA 用 %的凝胶〕置微波炉或沸水浴中加热至完好溶化〔不要加热至沸腾〕,取出摇匀。
3、灌胶将冷却到60℃的琼脂糖溶液轻轻倒入电泳槽水平板上。
4、待琼脂糖胶凝固后,在电泳槽内参加电泳缓冲液,尔后拔出梳子。
5、加样将 DNA 样品与加样缓冲液〔 loading buffer 〕按 4: 1 混匀后,用微量移液器将混杂液加到样品槽中,每槽加 10-20μl,记录样品的点样次序和加样量。

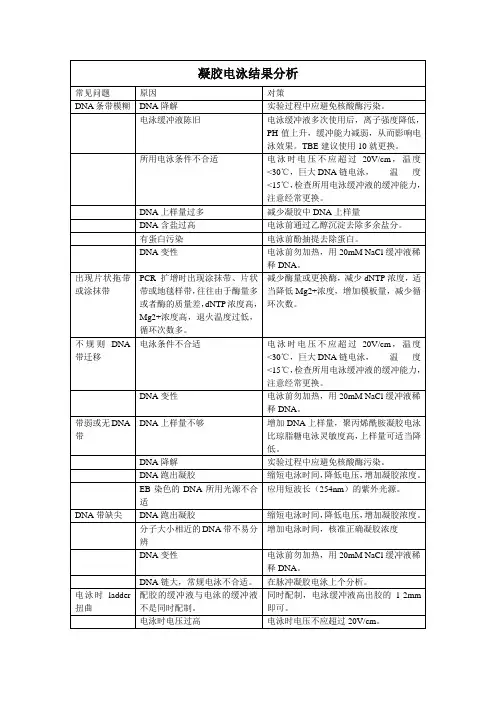
凝胶电泳结果分析常见问题原因对策DNA条带模糊DNA降解实验过程中应避免核酸酶污染。
电泳缓冲液陈旧电泳缓冲液多次使用后,离子强度降低,PH值上升,缓冲能力减弱,从而影响电泳效果。
TBE建议使用10就更换。
所用电泳条件不合适电泳时电压不应超过20V/cm,温度<30℃,巨大DNA链电泳,温度<15℃,检查所用电泳缓冲液的缓冲能力,注意经常更换。
DNA上样量过多减少凝胶中DNA上样量DNA含盐过高电泳前通过乙醇沉淀去除多余盐分。
有蛋白污染电泳前酚抽提去除蛋白。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
出现片状拖带或涂抹带PCR扩增时出现涂抹带、片状带或地毯样带,往往由于酶量多或者酶的质量差,dNTP浓度高,Mg2+浓度高,退火温度过低,循环次数多。
减少酶量或更换酶,减少dNTP浓度,适当降低Mg2+浓度,增加模板量,减少循环次数。
不规则DNA 带迁移电泳条件不合适电泳时电压不应超过20V/cm,温度<30℃,巨大DNA链电泳,温度<15℃,检查所用电泳缓冲液的缓冲能力,注意经常更换。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
带弱或无DNA 带DNA上样量不够增加DNA上样量,聚丙烯酰胺凝胶电泳比琼脂糖电泳灵敏度高,上样量可适当降低。
DNA降解实验过程中应避免核酸酶污染。
DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
EB染色的DNA所用光源不合适应用短波长(254nm)的紫外光源。
DNA带缺尖DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
分子大小相近的DNA带不易分辨增加电泳时间,核准正确凝胶浓度DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
DNA链大,常规电泳不合适。
在脉冲凝胶电泳上个分析。
电泳时ladder 扭曲配胶的缓冲液与电泳的缓冲液不是同时配制。
同时配制,电泳缓冲液高出胶的1-2mm即可。
电泳时电压过高电泳时电压不应超过20V/cm。


琼脂糖凝胶电泳鉴定DNA琼脂糖凝胶电泳琼脂糖凝胶电泳是用琼脂或琼脂糖作支持介质的一种电泳方法。
对于分子量较大的样品,如大分子核酸、病毒等,一般可采用孔径较大的琼脂糖凝胶进行电泳分离。
琼脂糖凝胶约可区分相差100bp的DNA片段,其分辨率虽比聚丙烯酰胺凝胶低,但它制备容易,分离范围广,尤其适于分离大片段DNA。
普通琼脂糖凝胶分离DNA的范围为0.2-20kb,利用脉冲电泳,可分离高达10^7bp的DNA片段。
琼脂糖凝胶电泳操作流程准备干净的配胶板和电泳槽注意DNA酶污染的仪器可能会降解DNA,造成条带信号弱、模糊甚至缺失的现象。
选择电泳方法一般的核酸检测只需要琼脂糖凝胶电泳就可以;如果需要分辨率高的电泳,特别是只有几个bp的差别应该选择聚丙烯酰胺凝胶电泳;用普通电泳不合适的巨大DNA链应该使用脉冲凝胶电泳。
注意巨大的DNA链用普通电泳可能跑不出胶孔导致缺带。
正确选择凝胶浓度对于琼脂糖凝胶电泳,浓度通常在0.5~2%之间,低浓度的用来进行大片段核酸的电泳,高浓度的用来进行小片段分析。
低浓度胶易碎,小心操作和使用质量好的琼脂糖是解决办法。
注意高浓度的胶可能使分子大小相近的DNA带不易分辨,造成条带缺失现象。
适合的电泳缓冲液常用的缓冲液有TAE和TBE,而TBE比TAE有着更好的缓冲能力。
电泳时使用新制的缓冲液可以明显提高电泳效果。
注意电泳缓冲液多次使用后,离子强度降低,PH值上升,缓冲性能下降,可能使DNA电泳产生条带模糊和不规则的DNA带迁移的现象。
电泳的合适电压和温度电泳时电压不应该超过20V/cm,电泳温度应该低于30℃,对于巨大的DNA 电泳,温度应该低于15℃。
注意如果电泳时电压和温度过高,可能导致出现条带模糊和不规则的DNA带迁移的现象。
特别是电压太大可能导致小片段跑出胶而出现缺带现象DNA样品的纯度和状态是电压太大可能导致小片段跑出胶而出现缺带现象DNA样品的纯度和状态注意样品中含盐量太高和含杂质蛋白均可以产生条带模糊和条带缺失的现象。