前 18 种 元 素 表
- 格式:doc
- 大小:82.00 KB
- 文档页数:2

第一章物质结构元素周期律第一节元素周期表重难点一元素周期表1.构成原子(离子)的微粒间关系(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
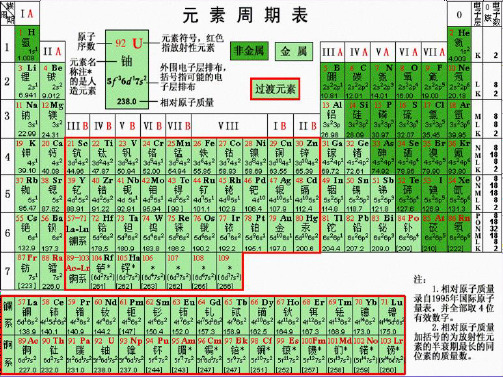
2.元素周期表的结构(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。
“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。
重难点二 零族定位法确定元素的位置 1.2.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。
(2)若比相应的0族元素少1~5时,则应处在同周期的ⅢA ~ⅦA 族。
(3)若差其他数,则由相应差值找出相应的族。
重难点三 元素的性质与原子结构 1.碱金属单质的相似性和递变性 (1)相似性①与O 2反应生成相应的氧化物,如Li 2O 、Na 2O 等。
②与Cl 2反应生成RCl ,如NaCl 、KCl 等。
③与H 2O 反应,能置换出H 2O 中的氢,反应通式为2R +2H 2O===2ROH +H 2↑。
④与非氧化性酸反应,生成H 2,反应通式为2R +2H +===2R ++H 2↑。
(R 表示碱金属元素)(2)递变性从Li 到Cs ,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强。

一、元素周期表的结构(一)编排三原则:1. 按原子序数递增顺序从左到右排列。
2. 将电子层数相同的元素排列成一个横行。
3. 把最外电子层的电子数相同的元素按电子层数递增的顺序由上而下排列成纵行。
(二)周期:具有相同电子层数的元素按照原子序数递增的顺序排列的一行,叫周期。
(1)周期序数= 电子层数。
周期序数用阿拉伯数字表示。
(2)元素周期表目前有7个周期。
第1、2、3周期称为短周期,分别含有2、8、8种元素;第4、5、6、7周期称为长周期,分别含有18、18、32、26种元素;第7周期又称为不完全周期。
(三)族(1)元素周期表有18个纵行,称为族,共16个族。
族序数用罗马数字表示。
(2)元素周期表中含有7个主族(ⅠA族~ⅦA族)、7个副族(ⅢB族~ⅦB族、ⅠB族~ⅡB族)、1个第Ⅷ族(三个纵行)和1个0族(稀有气体)。
(3)主族元素族序数= 最外层电子数。
(4)稀有气体元素化学性质不活泼,很难与其他物质发生化学反应,把它们的化合价定为0,因而叫做0族。
二、元素的性质与元素在周期表中位置的关系(一)元素的金属性和非金属性与元素在周期表中位置1、同周期从左到右,元素的金属性减弱,非金属性增强。
2、同主族从上至下,元素的金属性增强,非金属性减弱。
3、(1(2域;(312、主族元素化合价的判断。
(1)元素最高正化合价的数值=族的序数=最外电子层电子数(即价电子数)(2)非金属元素最低负化合价的绝对值=8-其最高正化合价三、元素周期律和元素周期表的意义1869年,门捷列夫发现了元素周期律,并编制了第一张元素周期表。
元素周期表是学习研究的一种重要工具。
门捷列夫用元素周期律预言了未知元素,为发现新元素提供了线索。
元素周期律与元素周期表可以指导工农业生产。
【典型例题】[例1] 对比下列两组元素性质:(1)下列各组元素最高价氧化物对应的水化物碱性逐渐减弱、酸性逐渐加强的是( )A. NaOH 、2)(OH Mg 、43PO H 、42SO HB. KOH 、NaOH 、42SO H 、4HClOC. 2)(OH Ca 、2)(OH Ba 、4HBrO 、4HClOD. 2)(OH Mg 、2)(OH Ba 、43PO H 、42SO H(2)下列各组气态氢化物稳定性由强到弱的顺序正确的是( )A. 4SiH 、3PH 、S H 2、HClB. HF 、HCl 、HBr 、HIC. 3PH 、S H 2HCl 、HFD. 3NH 、3PH 、3AsH 、HF精析:(1)A 项第三周期的Na 、Mg 、P 、S 四元素最高价氧化物的水化物的碱性逐渐减弱,酸性逐渐增强。

118种元素化学元素是构成物质的基本单位,目前已知118种元素。
这些元素按照它们的原子结构、化学性质和物理性质进行分类。
以下是这些元素的列表和简介:1. 氢(H):最轻的元素,常见于水和气体中。
2. 氦(He):第二轻的元素,常用于气体灯泡和电子设备中。
3. 锂(Li):是一种轻金属,具有很强的化学反应性。
4. 铍(Be):硬度极高的金属,主要用于合金生产中。
5. 碳(C):是生命的基础,当中较软的形态称为石墨,较硬的则称为金刚石。
6. 氮(N):占空气的大部分成分,也可用于肥料和氮气制备。
7. 氧(O):是人类和其他生命体的呼吸必需品,同时也灭火必需品。
8. 氟(F):非常活跃的元素,可作为牙科医学中的材料以及工业进程中的催化剂。
9. 氖(Ne):光谱分析和气体放电管的主要组成部分。
10. 钠(Na):常见于盐和水中,也用于制造钠灯。
11. 镁(Mg):是一种轻金属,被广泛用于合金和轻便材料制造。
12. 铝(Al):是一种轻金属,广泛用于建筑、飞机和汽车零件制造。
13. 硅(Si):是晶体管和太阳能电池的重要组成部分,也可用于制造玻璃和陶瓷。
14. 磷(P):人体必需的元素,用于肥料和农业生产中。
15. 硫(S):用于制造硫酸和其他化学品中,也常出现于火山爆发和马来酸储层中。
16. 氯(Cl):常见于盐和其他化学品中,可用作消毒剂。
17. 钾(K):人体必需元素之一,在肥料和药物生产中也有广泛应用。
18. 钙(Ca):是骨骼和牙齿的重要成分,也用于补钙和农业肥料中。
19. 钪(Sc):与铝等合金中使用,也可用于核反应堆中。
20. 钛(Ti):是一种重金属,用于制造飞机和汽车零件,也用于人工关节和医疗器械中。
21. 钒(V):在制造钢铁和其他合金中广泛使用。
22. 铬(Cr):用于产生不锈钢和其他合金中。
23. 锰(Mn):用于制造钢铁和其他合金中。
24. 铁(Fe):人类历史上最重要的金属之一,广泛用于制造车辆、机器、电器和建筑材料。

118种化学元素发现先后顺序前5000年原子序82 铅:Pb 铅古人发现。
前4000年原子序29 铜:Cu 铜古人发现。
前3100年原子序51 锑:Sb 锑古人发现。
前2600原子序79 金:Au 金古人发现。
前2000年原子序26 铁:Fe 铁古人发现。
前1500年原子序80 汞:Hg 汞古希腊人发现。
三千年前原子序30 锌:Zn 锌中国古人发现。
前7世纪原子序50 锡:Sn 锡古人发现。
前600年原子序47 银:Ag 银古人发现。
317原子序33 砷:As 砷公元317年,中国葛洪从雄黄、松脂、硝石合炼制得,后由法国拉瓦锡确认为一种新元素。
14501669原子序15 磷:P 磷1669年,德国人波兰特通过蒸发尿液发现。
1735原子序27 钴:Co 钴1735年,布兰特发现。
1735原子序78 铂:Pt 铂1735年,西班牙安东尼奥.乌洛阿在平托河金矿中发现,1748年有英国化学家W.沃森确认为一种新元素。
1751原子序28 镍:Ni 镍中国古人发现并使用。
1751年,瑞典矿物学家克朗斯塔特首先认为它是一种元素。
1766原子序1 氢:H 氢1766年,英国贵族亨利.卡文迪西(1731-1810)发现。
氢[hydrogen],金属氢[Hydrogenium]。
气体元素符号。
无色无臭无味。
是元素中最轻的。
工业上用途很广。
1770原子序16 硫:S 硫古人发现(法国拉瓦锡确定它为一种元素)。
1771原子序8 氧:O 氧1771年,英国普利斯特里和瑞典舍勒发现;中国古代科学家马和发现(有争议)。
1772原子序7 氮:N 氮1772年,瑞典化学家卡尔.威廉.舍勒和法国化学家拉瓦节和蘇格兰化学家丹尼尔.卢瑟福(1749-1819) 同时发现氮气。
1774原子序17 氯:Cl 氯1774年,瑞典化学家舍勒发现氯气,1810年英国戴维指出它是一种元素。
1774原子序25 锰:Mn 锰1774年,瑞典舍勒从软锰矿中发现。

元素周期表的发展史化学发展到18世纪,由于化学元素的不断发现,种类越来越多,反应的性质越来越复杂.化学家开始对它们进行了整理、分类的研究,以寻求系统的元素分类体系.首先在1789年,法国化学家拉瓦锡在他的专著《化学纲要》一书中,列出了世界上第一张元素表.他把已知的33种元素分成了气体元素、非金属、金属、能成盐之土质等四类.但他把一些物,如光、石灰、镁土都列入元素. 26年后,英国的威廉·普劳特提出:1、所有元素的原子量均为氢原子量的整数倍;2、氢是原始物质或“第一物质”, 他试图把所有元素都与氢联系起来作为结构单元。
到1829年,德国的化学家贝莱纳首先敏锐地察觉到已知元素所表露的这种内在关系的端倪:某三种化学性质相近的元素,如氯,溴,碘,不仅在颜色、化学活性等方面可以看出有定性规律变化,而且其原子量之间也有一定理的关系,即:中间元素的原子量为另两种元素原子量的算术平均值。
这种情况,他一共找到了五组,他将其称之为"三元素族",即:锂3 钠11 钾19钙20 锶88 钡137氯17 溴35 碘127硫16 硒79 碲128锰55 铬52 铁56在化学家贝莱纳之后,法国的地质学家尚古多(Chancourtois,A.E.B.1820-1886)于1862年绘出了“螺旋图”.他将已知的62个元素按原子量的大小次序排列成一条围绕圆筒的螺线,性质相近的元素出现在一条坚线上. 他最先提出元素性质和原子量之间有关系, 并初步提出了元素性质的周期性。
螺旋图是向揭示周期律迈出了有力的第一步, 但缺乏精确性。
1864年英国人欧德林用46种元素排出了《元素表》。
同年德国人迈尔依原子量大小排出《六元素》表。
该表对元素进行了分族, 有了周期的雏型。
之后在1865年,英国的化学家纽兰兹(Newlands,J.A.R.1837-1898)排出一个“八音律”.他把已知的性质有周期性重复,每第八个元素与第一个元素性质相似,就好象音乐中八音度的第八个音符有相似的重复一样. 八音律揭示了元素化学性质的重要特征, 但未能揭示出事物内在的规律性。

元素周期表相关知识点元素周期表相关知识点我们从初三开始接触化学,第一个知识就是元素周期表的学习,以下是店铺为大家准备好的元素周期表相关知识点,欢迎大家阅读参考!元素周期表相关知识点篇1元素周期表共分18纵行,其中第1、2、13、14、15、16、17七个纵行依次为ⅠA族、ⅡA族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族(纵行序号的个位数与主族序数相等);第3、4、5、6、7、11、12七个纵行依次为ⅢB族、ⅣB族、ⅤB族、ⅥB族、ⅦB族、ⅠB族、ⅡB族(纵行序号个位数与副族序数相等);第8、9、10三个纵行为合称为Ⅷ族;第18纵行称为0族。
ⅠA族称为碱金属元素(氢除外);ⅡA族称为碱土金属元素;ⅢA族称为铝族元素;ⅣA族称为碳族元素;ⅤA族称为氮族元素;ⅥA族称为氧族元素;ⅦA族称为卤族元素。
元素周期表共有七个横行,称为七个周期,其中第一(2种元素)、二(8种元素)、三(8种元素)周期为短周期(只有主族元素);第四(18种元素)、五(18种元素)、六(32种元素)周期为长周期(既有主族元素,又有过渡元素);第七周期(目前已排26种元素)为不完全周期。
在元素周期表中,越在左下部的元素,其金属性越强;越在右上部的元素(惰性气体除外),其非金属性越强。
金属性最强的稳定性元素是铯,非金属性最强的元素是氟。
在元素周期表中位于金属与非金属分界处的金属元素,其氧化物或氢氧化物一般具有两性,如Be、Al等。
主族元素的价电子是指其最外层电子;过渡元素的价电子是指其最外层电子和次外层的部分电子;镧系、锕系元素的价电子是指其最外层电子和倒数第三层的部分电子。
在目前的112种元素中,只有22种非金属元素(包括6种稀有气体元素),其余90种都是金属元素;过渡元素全部是金属元素。
在元素周期表中,位置靠近的元素性质相近。
一般在周期表的右上部的元素用于合成新农药;金属与非金属分界处的元素用于制造半导体材料;过渡元素用于制造催化剂和耐高温、耐腐蚀的合金材料等等。

元素周期表中各元素介绍氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米?/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米?/千克水。




元素周期表发现过程18世纪,科学家发现了20多种元素,如金、银、铁、氧、磷、硫等。
到19世纪,已经发现了63种元素。
人们自然会问,还有多少其他元素没有被发现?这些元素是单独存在的,还是相互之间有某种联系?一、元素分类的工作1829年,德国化学家德贝莱纳(dobereiner,j.w.1780~1849)研究元素的相对原子质量和化学性质之间的关系,发现在当时已知54种元素中存在5个相似的“三元素组”:①锂、钠、钾;②钙、锶、钡;③氯、溴、碘;④硫、硒、碲;⑤锰、铬、铁。
同组元素的性质相似,中间元素的化学性质介于前后两个元素之间,它的相对原子质量也差不多是前后两个元素的平均值。
例如锂、钠、钾三个元素中,钠的原子量为(6.9+39.1)/2=23。
1862年,法国的地质学家尚古多(chancourtois,a.e.b.1820~1886)绘出了“螺旋图”。
他将当时已知的62个元素按原子量的大小次序排列成一条围绕圆筒的螺线,性质相近的元素出现在一条坚线上。
他第一个发现了元素性质的周期性变化。
1864年,英国w.奥德林发表了一张比较详细的周期表,表中的元素基本上按相对原子质量递增的顺序排列,体现了元素性质随相对原子质量递增会出现周期性的变化。
他还在表中留下空位,认识到它们是尚未被发现但性质与同一横列元素相似的元素。
1865年,英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近。
这很像音乐上的八度音循环(当时没有发现稀有气体),因此,他干脆把元素的这种周期性叫做“八音律”,并据此画出了标示元素关系的“八音律”表。
纽兰兹已经接近发现元素周期律了。
不过,条件限制了他作进一步的探索,因为当时相对原子质量的测定值有错误,只是机械地按当时的相对原子质量大小将元素排列起来,而且他也没有考虑到还有尚未发现的元素,所以他没能揭示出元素之间的内在规律。

化学元素周期表和周期律一.完成下列元素周期表1.并标明元素性质变化趋势、非金属性最强和金属性最强元素。
12.、完成氢化物周期表并标明氢化物稳定性趋势、氢化物最稳定的物质23.、完成最高价氧化物对于水化物周期表并标明最高价氧化物对于水化物性质变化趋势、最强酸和最强碱3第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克二.熟悉元素周期表的结构,熟记前36号元素及主族和零族元素的名称及符号。
1.记住7个横行,即个周期(短、长)。
2.记住18个纵行,包括个主族(ⅠA~ⅦA)、个副族(ⅠB~ⅦB)、1个第族(第8、9、10纵行)和1个族(即稀有气体元素)。
3.记住金属与非金属元素的分界线(氢、硼、硅、砷、碲、砹与锂、铝、锗、锑、钋之间)。
三、特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯()。
2、最活泼的非金属元素、无正价的非金属元素、无含氧酸的非金属元素、无氧酸(或氢化物)可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子的还原性最弱的元素是氟()。
3、最强的碱是()最强的含氧酸是()最高价氧化物的水化物能与其气态氢化物发生化合反应的短周期元素是()最高价氧化物的水化物能与其气态氢化物发生氧化还原反应的短周期元素是(())气态氢化物和它的氧化物在常温下生成该元素的单质的元素是()3、最稳定的气态氢化物是()气态氢化物中含氢质量分数最大的是()最小的是()4、形成化合物种类最多的元素是()、单质是自然界中硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素是碳()。
空气中含量最多的元素是()或气态氢化物的水溶液呈碱性的元素是氮()。
地壳中含量最多的元素是()地壳中含量最多的金属元素是()5、焰色反应呈黄色的元素是()透过蓝色钴玻璃观察焰色反应呈紫色的元素是()46、常温下单质呈液态的元素是()常温下单质呈液态的非金属元素是()7、无氧酸能腐蚀玻璃的元素是()最易着火的非金属单质的元素是()8、既能与酸反应又能与碱溶液反应可产生H2的金属元素为铝(),与碱溶液反应可产生H2的非金属元素为(),Al2O3和Al(OH)3都有两性。

的1表示最外层电子的数目(是电子自旋态以及pauli原理决定的)。
详情请参考量子力学。
1 H 1s12 He 1s23 Li 2s14 Be 2s25 B 2s2 2p16 C 2s2 2p27 N 2s2 2p38 O2s2 2p49 F 2s2 2p510 Ne 2s2 2p611 Na 3s112 Mg 3s213 Al 3s2 3p114 Si 3s2 3p215 P 3s2 3p316 S 3s2 3p417 Cl 3s2 3p518 Ar 3s2 3p619 K 4s120 Ca 4s221 Sc 3d1 4s222 Ti 3d2 4s223 V 3d3 4s224 Cr 3d5 4s125 Mn 3d5 4s226 Fe 3d6 4s227 Co 3d7 4s228 Ni 3d8 4s229 Cu 3d10 4s130 Zn 3d10 4s231 Ga 4s2 4p132 Ge 4s2 4p233 As 4s2 4p334 Se 4s2 4p435 Br 4s2 4p536 Kr 4s2 4p637 Rb 5s138 Sr 5s239 Y 4d1 5s240 Zr 4d2 5s241 Nb 4d4 5s142 Mo 4d5 5s143 Tc 4d5 5s244 Ru 4d7 5s145 Rh 4d8 5s146 Pd 4d1047 Ag 4d10 5s148 Cd 4d10 5s249 In 5s2 5p150 Sn 5s2 5p251 Sb 5s2 5p352 Te 5s2 5p453 I 5s2 5p554 Xe 5s2 5p655 Cs 6s156 Ba 6s257 La 5d1 6s258 Ce 4f1 5d1 6s259 Pr 4f3 6s260 Nd 4f4 6s261 Pm 4f5 6s262 Sm 4f6 6s263 Eu 4f7 6s264 Gd 4f7 5d1 6s265 Tb 4f9 6s266 Dy 4f10 6s267 Ho 4f11 6s268 Er 4f12 6s269 Tm 4f13 6s270 Yb 4f14 6s271 Lu 4f14 5d1 6s272 Hf 5d2 6s273 Ta 5d3 6s274 W 5d4 6s275 Re 5d5 6s276 Os 5d6 6s277 Ir 5d7 6s278 Pt 5d9 6s179 Au 5d10 6s180 Hg 5d10 6s281 Tl 6s2 6p182 Pb 6s2 6p283 Bi 6s2 6p384 Po 6s2 6p485 At 6s2 6p586 Rn 6s2 6p687 Fr 7s188 Ra 7s289 Ac 6d1 7s290 Th 6d2 7s291 Pa 5f2 6d1 7s292 U 5f3 6d1 7s293 Np 5f4 6d1 7s294 Pu 5f6 7s295 Am 5f7 7s296 Cm 5f7 6d1 7s297 Bk 5f9 7s298 Cf 5f10 7s299 Es 5f11 7s2100 Fm 5f12 7s2101 Md (5f13 7s2) 102 No (5f14 7s2) 103 Lr (5f14 6d17s2) 104 Rf (6d2 7s2)105 Db (6d3 7s2)106 Sg 5f146d47s2 107 Bh 5f146d57s2 108 Hs 5f146d67s2 109 Mt 5f146d77s2 110 Ds 5f146d97s1 111 Rg 5f146d107s1112 Cn 5f146d107s2113 Uut 5f146d107s27p1114 Uuq 5f146d107s27p2115 Uup 5f146d107s27p3116 Uuh 5f146d107s27p4117 Uus 5f146d107s27p5118 Uuo 5f146d107s27p61 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。


②加速脱碳当Al含量增加至3~5%时,8~9%将会大大地促进钢锭的柱状结晶过程。
因此而大大增加钢的机械热加工的困难,也使钢极易脱碳。
〔其热加工之所以困难是因为该合金钢锭具有粗晶结构,且其晶体的解理极弱,所以导热性低,加热时容易出现大的温度差而锻裂,甚至钢锭的去皮加工都会使其晶界氧化而破坏。
此外,它在800℃以上的高温长时间停置也极易变脆。
一般合金钢中含Al量:合金结构钢:Al=0.4~1.1% (38CrAlA、38CrMoAlA、38CrWVAlA等)耐热不起皮钢:Al=1.1~4.5% (Cr13SiAl、Cr24Al2Si、Cr17Al4Si等)电热合金:Al=3.5~6.5% (Cr13Al4、1Cr17Al5、Cr8Al5、0Cr17Al5等)甚至Al=8% Cr7Al7:考虑电热合金受荷不大,虽有脆性,仍可使用。
2、Si〔1〕一般合金钢中的Si含量不会高于3.5%,更多时〔4.8~6.5%〕将使钢具有很高的脆性。
Si的有益作用:高的热强性和弹性极限,高的导磁率,涡流损失少。
①象Al、Cr一样,其氧化物均是尖晶石类型的组织。
其晶格常数与α-Fe、γ-Fe区别小。
因为其氧化物与金属分界处的晶胞之间就紧密而强固地结合在一起,氧化皮紧密地被贴在金属上,甚至在高温下也不剥落。
所以它具有很强的抗氧化性和耐热性能,而被加入耐热钢。
②有利于提高钢的弹性极限,在中碳钢中加入1~2%的Si,调质中σb 将增15~20%,而Aku也提高了,还提高了σs和δ。
③利于促进钢中石墨化而用于炼制石墨钢。
此钢可制轴承,甚至作为工具钢代替,制冲头,拉模、弯曲模等。
④脱氧能力较强,是炼钢常用的脱氧剂,故一般钢中均含Si,其量≤0.5%。
⑤硅可减小晶体的各向异性,使磁化容易,使磁阻减小,它还可减轻钢中其他杂质对磁场磁感的危害〔使%C石墨化,脱氧,与N形成氢化硅等〕。
所以可大大减少涡流损失。
由于硅的脆性,目前高硅钢片硅含量规定为低于4.5%,最多只为4.8%,正在研究提高至6.5%。


前18 种元素表
一些常见的元素
序数
相对原子质量=质子数+核外电子数
稀有气体原子最外层有8个电子(氦
为2个电子)
金属原子最外层一般少于4个
非金属原子最外层一般多于4个
“多得,少失”
多于4个电子,容易得到电子
少于4个电子,容易失去电子
带“钅”的元素一般是金属元素
带“气”的元素一般是非金属元素
化学式书写和命名
1.单质:①习惯用元素符号表示
②双原子分子:在右下角加上数字
例:N₂(氮气)O₂(氧气)H₂(氢气)F₂(氟气)Cl(氯气)
Br(溴气) I₂(碘)
初中化学基础知识笔记(附录1)。