108、临床PCR实验室常见问题及整改措施
- 格式:pdf
- 大小:2.93 MB
- 文档页数:66


PCR核酸检测实验室自检自查整改报告一、整改背景我实验室负责进行PCR核酸检测工作,经过自检自查发现存在一些问题,不仅影响了工作效率,还可能对检测结果产生误差,为了保证检测结果的准确性和可靠性,我决定开展整改工作,并报告整改情况。
二、问题分析1.设备运行不稳定:实验室PCR仪器出现频繁故障,导致实验进度受阻,影响工作效率。
2.试剂保存不当:一部分试剂未按照要求储存,导致试剂失效或效果下降,影响了检测结果。
3.数据记录不完整:实验过程和结果记录不规范,缺乏关键信息的记录,影响了结果的追溯和分析。
4.实验室清洁和消毒不及时:仪器和试剂的清洁消毒不及时,可能造成交叉污染,影响结果的准确性。
三、整改措施1.设备运行不稳定问题的整改:(1)定期检查设备状态,及时发现问题并解决;(2)建立设备维护保养制度,确保设备运行稳定;(3)配备备用设备,确保实验进展不受阻。
2.试剂保存不当问题的整改:(1)制定试剂存储和使用规范,明确存储温度、有效期等要求;(2)建立试剂使用登记制度,及时更新试剂信息,避免使用失效试剂;(3)实行试剂定期盘点,清理不合格和失效试剂。
3.数据记录不完整问题的整改:(1)建立标准的实验记录表格,详细记录实验过程和结果;(2)明确记录项目、时间、操作人员等关键信息;(3)实行项目负责人审核制度,确保记录的准确性和可追溯性。
4.实验室清洁和消毒问题的整改:(1)制定实验室清洁消毒制度,明确清洁和消毒频率;(2)定期进行实验室清洁和消毒,清除交叉污染源;(3)培训实验人员正确进行仪器和试剂的清洁消毒。
四、整改效果评估经过整改措施的落实,以下是整改效果的评估:1.设备运行不稳定问题:设备故障率显著下降,实验工作进展顺利,工作效率明显提升。
2.试剂保存不当问题:试剂使用失效或下降的情况明显减少,检测结果更加可靠稳定。
3.数据记录不完整问题:实验记录规范化,关键信息完整记录,结果可追溯性明显增强。
4.实验室清洁和消毒问题:实验室清洁和消毒规范化,交叉污染风险得到控制。

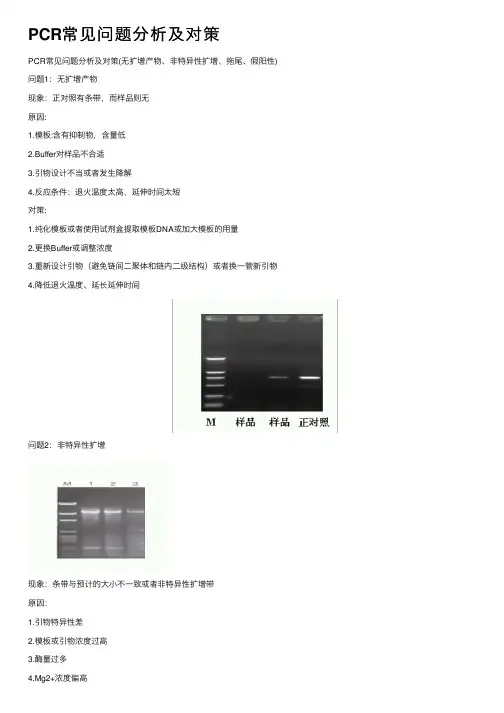
PCR实验常见问题、原因分析及其解决方案PCR产物的电泳检测时间,一般为48h以内,有些最好于当日进行检查,大于48h后带型不规则甚至消失。
但有时仍会与到这样那样的问题,影响检测结果的判断,具体归类为以下常见的4点,描述如下:问题一:无扩增产物现象:正对照有条带,而样品则无原因:1、模板:含有抑制物,含量低2、Buffer对样品不合适3、引物设计不当或者发生降解4、反应条件:退火温度太高,延伸时间太短对策:1、纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2、更换Buffer或调整浓度3、重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4、降低退火温度、延长延伸时间问题二:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1、引物特异性差2、模板或引物浓度过高3、酶量过多4、Mg2+浓度偏高5、退火温度偏低6、循环次数过多对策:1、重新设计引物或者使用巢式PCR2、适当降低模板或引物浓度3、适当减少酶量4、降低镁离子浓度5、适当提高退火温度或使用二阶段温度法6、减少循环次数问题三:拖尾现象:产物在凝胶上呈Smear状态原因:1、模板不纯2、Buffer不合适3、退火温度偏低4、酶量过多5、dNTP、Mg 2+浓度偏高6、循环次数过多对策:1、纯化模板2、更换Buffer3、适当提高退火温度4、适量用酶5、适当降低dNTP和镁离子的浓度6、减少循环次数问题四:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交叉污染对策:1、操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2、除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3、各种试剂最好先进行分装,然后低温贮存[ 来源]:实验室之家,以及相关网络知识、转载仅为分享知识,如有侵权请联系删除。
}热文推荐:1、化学分析方法确认和验证指南PDF版全文(新版2018年4月1日实施)2、最全微生物实验室规划设计方案3、谱知识总结篇4、移液器操作六部曲,这些细节很重要化学先生(号码:chemistrysir),化学检测工作者自己的公众号。

PCR实验室核酸检测的常见问题及解决办法检验科人员是核酸检测工作的主力军,我们不但要保证检测结果的有效性,还时刻面临着被感染的风险。
本文为大家讲解《PCR实验室新冠核酸检测操作注意事项》,重点从新冠病毒生理特性、荧光PCR原理、PCR实验室筹备规范、样本检测环节操作、实验室数据分析、常见问题解析等几个方面讨论学习。
1、传染源目前所见传染源主要是新型冠状病毒感染的患者。
无症状感染者也可能成为传染源。
2、传播途径经呼吸道飞沫和密切接触传播是主要的传播途径。
在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能。
由于在粪便及尿中可分离到新型冠状病毒,应注意粪便及尿对环境污染造成气溶胶或接触传播。
3、荧光PCR原理重复进行“变性 - 退火 - 延伸”三个过程,模板DNA的量就会呈指数倍增加,理论上讲经过 n 个循环之后,模板量就会达到2的n次方。
4、常见问题解析①新冠试剂出现翘尾,怎么处理?答:如果是个别单一通道翘尾,不管是FAM还是VIC通道,首先按照要求复查,复查建议重新采样,如果不方便重新采样建议对原有样本进行重新提取核酸验证,如果复查阴性判读阴性,如果复查还是同一通道翘尾,就要对结果仔细审核,一是要排除实验室污染,二是要对病人信息了解清楚,从临床症状及接触史排查,如果没法确认,建议必须重新采样复查,如有必要可以采用另一家试剂来验证。
如果出现大量的弱阳性扩增翘尾,首要原因是考虑实验室污染,可以通过做环境样本和阴性对照做验证排除。
②N基因和1ab基因是新冠病毒的特有基因吗,灵敏度哪个更高?是否会和其他冠状病毒片段重叠?答:N基因跟1ab都是特异的,不会跟其他呼吸道病原体交叉反应。
设计时候,两个基因的序列不一样,导致灵敏度不一样,N基因的灵敏度比1ab灵敏度高。
③新冠检测结果和临床诊断不符合,怎么解读?答:新冠病毒由于是RNA病毒,容易降解,另外检测结果也和取样,核酸提取以及样本本身的核酸浓度有关,需要逐一分析,同时可以结合临床症状判读。

P C R检测常见问题与解决途径------------------------------------------作者xxxx------------------------------------------日期xxxxPCR检测常见问题与解决途径利用PCR方法检测转基因成分时,经常出现假阳性、假阴性、非特异性扩增和涂抹带。
尤其是假阳性和假阴性可使检测结果得出错误结论,有时可造成严重后果。
为了提高转基因检测的准确性和可靠性,PCR检测应尽量减少假阳性、假阴性、非特异性扩增和涂抹带现象的发生。
一个好的PCR方法不但要求特异性好、灵敏度高、还要求具有高的可重复性、重现性、鲁棒性,尽量减少假阳性、假阴性和非特异性扩增。
本文对PCR检测中出现的假阳性、假阴性、非特异性扩增和涂抹带的原因及其解决方法予以综述。
一、假阳性:(一)假阳性现象假阳性是指检测阴性材料得到阳性结果。
如果一次实验中的几个阴性对照中出现一个或几个阳性结果,提示本次实验中其它标本的检测结果可能有假阳性。
实验中设立的阴性对照可提示有无假阳性结果出现。
(二)造成假阳性的原因1. 样品间交叉污染:样本污染主要有收集样本的容器被污染,或样本放置时,由于密封不严溢于容器外,或容器外粘有样本而造成相互间交叉污染;样本核酸模板在提取过程中,由于吸样枪污染导致标本间污染;2. PCR试剂的污染:主要是由于在PCR试剂配制过程中,由于加样枪、容器、双蒸水及其它溶液被PCR核酸模板污染。
3. PCR扩增产物污染:这是PCR反应中最主要最常见的污染问题。
因为PCR产物拷贝量大(一般为1013拷贝/ml),远远高于PCR检测数个拷贝的极限,所以极微量的PCR产物污染,就可形成假阳性。
4. 气溶胶污染:在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染。
据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个值得特别重视的问题。

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。


PCR常见问题分析及对策PCR常见问题分析及对策(⽆扩增产物、⾮特异性扩增、拖尾、假阳性)问题1:⽆扩增产物现象:正对照有条带,⽽样品则⽆原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发⽣降解4.反应条件:退⽕温度太⾼,延伸时间太短对策:1.纯化模板或者使⽤试剂盒提取模板DNA或加⼤模板的⽤量2.更换Buffer或调整浓度3.重新设计引物(避免链间⼆聚体和链内⼆级结构)或者换⼀管新引物4.降低退⽕温度、延长延伸时间问题2:⾮特异性扩增现象:条带与预计的⼤⼩不⼀致或者⾮特异性扩增带原因:1.引物特异性差2.模板或引物浓度过⾼3.酶量过多4.Mg2+浓度偏⾼5.退⽕温度偏低6.循环次数过多对策:1.重新设计引物或者使⽤巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离⼦浓度5.适当提⾼退⽕温度或使⽤⼆阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退⽕温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏⾼6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提⾼退⽕温度4.适量⽤酶5.适当降低dNTP和镁离⼦的浓度6.减少循环次数问题4:假阳性现象:空⽩对照出现⽬的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应⼩⼼轻柔,防⽌将靶序列吸⼊加样枪内或溅出离⼼管外;2.除酶及不能耐⾼温的物质外,所有试剂或器材均应⾼压消毒。
所⽤离⼼管及加样枪头等均应⼀次性使⽤。
3.各种试剂最好先进⾏分装,然后低温贮存琼脂糖凝胶电泳回收PCR产物⼀.原理DNA⽚断的分离与回收是基因⼯程操作中的⼀项重要技术,例如可收集特定酶切⽚断⽤于克隆或制备探针,回收PCR产物⽤于再次鉴定等。
回收实验中两个最重要的技术指标是纯度和回收率:前者未达标时会严重影响以后的酶切、连接、标记等酶参与的反应;后者不理想时往往会⼤⼤增加前期的⼯作量。

pcr实验室整体解决方案及措施一、PCR实验室的布局。
1.1 功能分区的重要性。
PCR实验室啊,就像一个精密的小世界,功能分区那可是相当重要的。
它得有试剂准备区,这就好比是厨房的食材准备区,得干干净净、整整齐齐的。
在这里,我们要准备好各种试剂,容不得一点马虎。
要是这里乱了套,就像做饭没有好食材一样,后面的实验肯定会出问题。
1.2 样本制备区的讲究。
样本制备区呢,这可是关键中的关键。
这就像厨师切菜、处理食材的地方。
在这个区域,要小心地处理样本,避免样本之间的交叉污染。
这就如同做菜的时候,不能把不同的菜弄混了,不然做出来的菜就不是那个味儿了,实验结果也会变得乱七八糟。
1.3 扩增区和检测区的要求。
扩增区和检测区也是各有各的门道。
扩增区像是一个魔法区域,把样本中的微量核酸进行大量扩增,就像把一颗小种子培育成一片大森林。
检测区呢,就是要精准地判断这些扩增后的产物,要做到火眼金睛,不能有丝毫差错,就像孙悟空识别妖怪一样。
二、设备的选择与维护。
2.1 主要设备的挑选。
PCR实验室的设备挑选可不能含糊。
像PCR仪,这就是实验室的“顶梁柱”,得选质量好、性能稳定的。
这就好比打仗要选好武器一样,好的PCR仪能让实验事半功倍。
还有离心机,那得是转速精准、运行平稳的,不然样本离心不好,后续的实验就没法好好进行,这就叫“一着不慎,满盘皆输”。
2.2 设备维护的要点。
设备维护更是重中之重。
要像照顾自己的孩子一样照顾这些设备。
定期清洁、校准是必不可少的。
要是忽略了设备维护,设备就会像生病的人一样,工作起来没精打采,给出的实验结果也不可靠。
这就如同开一辆没有保养的汽车,随时可能抛锚。
三、人员管理与操作规范。
3.1 人员培训的必要性。
人员管理首先得从培训开始。
实验室的人员就像一群战士,没有经过训练怎么能上战场呢?培训要全面,从理论知识到实际操作,都得让大家熟练掌握。
只有这样,在实验室里才能做到游刃有余,而不是像没头的苍蝇一样到处乱撞。
PCR实验室污染的原因分析、处理及整改措施2022年5月29日中午12:30开始PCR实验室假阳性频率增高,考虑可能出现实验室污染,检测工作立即停止,首先,查找污染源和明确污染范围。
经排查本次实验室污染的主要来源可能是部分配置好的反应体系放置时间过久、实验室二区出现扩增产物的污染。
一、发生污染的原因分析。
1.核酸检测工作频次过高,导致每批样本检测之间没有足够时间消毒。
2、核酸检测人员短缺,检测人员需要多次往返二区、三区,极容易导致扩增产物的污染。
二、实验室污染的处理:1.生物安全柜的操作台消毒处理:使用5000mg∕L含氯消毒剂进行喷洒消毒。
消毒液需要现用现配,24小时内使用。
2.实验室台面、地面、物体表面等的消毒处理:立即使用润湿有5000mg∕L含氯消毒剂的毛巾擦拭、消毒。
清洁、消毒通风系统滤网。
采用房间固定和可移动紫外灯进行紫外照射2小时以上。
3.清理污染物时:严格遵循活病毒生物安全操作要求,采用压力蒸汽灭菌处理,并进行实验室换气等,防止次生危害。
整改措施:1.严格实验室功能分区确保实验室人、物及空气单向流动核酸检测实验室的人、物及空气流向按照试剂储存和准备区一样本制备区T扩增和产物分析区,防止扩增产物随人流、物流及空气进入扩增前的区域。
空气流向应按照从试剂储存和准备区一样本制备区一扩增区一扩增产物分析区方向空气压力递减的方式进行。
2、力口强实验室检测安全管理(1)基本要求核酸检测应当在生物安全二级实验室进行,并应在生物安全风险评估的基础上,采取适当的个体防护措施,包括手套、口罩和隔离衣等。
开展新冠病毒核酸检测的实验室应当制定实验室生物安全相关程序文件及实验室生物安全操作失误或意外的处理操作程序,并有记录。
(2)实验室前安全要求应使用2000mg∕L含氯消毒剂或75%酒精进行桌面、台面及地面消毒。
消毒液需每天新鲜配制,不超过24小时。
转运至实验室的标本转运桶应在生物安全柜内开启。
转运桶开启后,使用2000mg∕L含氯消毒剂或75%酒精对转运桶内壁和标本采集密封袋进行喷洒消毒。
实验室存在问题及整改措施有哪些实验室是进行科学研究、技术开发和教学实验的重要场所,是推动科学技术进步的重要力量。
然而,近年来,我国实验室存在一些问题,影响了实验室的正常运行和科研成果的产出。
本文将对实验室存在的问题进行分析,并提出相应的整改措施。
一、实验室存在的问题1. 安全问题实验室安全是实验室管理的重中之重,但目前我国实验室安全问题仍然较为突出。
部分实验室安全设施不完善,如消防器材不足、紧急疏散通道不畅等;实验室安全教育不到位,部分实验人员安全意识不强,违规操作现象时有发生;实验室废弃物处理不当,容易造成环境污染。
2. 管理问题实验室管理是保障实验室正常运行的关键,但目前我国实验室管理存在一定的不足。
实验室规章制度不健全,导致实验室管理混乱;实验室人员配备不合理,部分实验室缺少专业管理人员;实验室设备维护不及时,影响实验设备的正常使用。
3. 科研问题实验室是科研工作的重要场所,但目前我国实验室在科研方面也存在一些问题。
实验室研究方向不明确,导致科研资源浪费;实验室科研团队建设不足,缺乏高效的协作机制;实验室与产业界的联系不紧密,科研成果转化率较低。
4. 人才问题实验室是培养人才的重要基地,但目前我国实验室在人才建设方面也存在一定的问题。
实验室师资力量不足,部分实验教师待遇较低,影响其工作积极性;实验室人才培养体系不完善,实验技术人才短缺;实验室人才流动性强,难以形成稳定的科研团队。
二、整改措施1. 加强实验室安全管理(1)完善实验室安全设施,确保实验室安全防护措施到位;(2)加强实验室安全教育,提高实验人员的安全意识;(3)建立健全实验室废弃物处理制度,加强环保意识。
2. 优化实验室管理(1)建立健全实验室规章制度,加强实验室管理;(2)合理配置实验室人员,提高实验室管理水平;(3)加强实验室设备维护,确保实验设备正常运行。
3. 提升实验室科研能力(1)明确实验室研究方向,优化科研资源配置;(2)加强实验室团队建设,提高协作效率;(3)加强实验室与产业界的联系,提高科研成果转化率。
PCR常见问题及解决方案问题可能原因解决方法无产物或产量低模板浓度偏低或偏高电泳检测模板浓度,调整模板用量模板降解重新制备;基因组DNA、cDNA应小量分装后低温保存模板中含有抑制反应的杂质纯化模板引物浓度不足调整引物浓度,特别是针对长片段PCR引物存在二级结构重新设计引物,避免二级结构;优化退火温度引物降解引物应高浓度小量分装,-20℃保存,避免反复冻融Mg2+浓度偏低适当提高Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP降解-20℃保存,小量分装,避免反复冻融酶纯度低,扩增效率差选用高质量DNA聚合酶酶量不足适当增加酶量用酶不当针对模板、目标片段的特选择适当的酶(详见PCR产品选择指南)缓冲液失效更换缓冲液或使用预混PCR反应体系模板变性不充分适当延长变性时间;对高GC或复杂结构模板,提高起始变性温度至98℃退火温度偏高降低退火温度,应比引物Tm低至少5℃ 延伸时间不足增加延伸时间,特别是针对长片段PCR 循环数目不够增加循环数PCR管污染质量可靠的PCR管通常不需灭菌,否则应先高温高压灭菌处理;用过的PCR管不可清洗后重复使用PCR仪故障检查程序和模块温度其他使用PCR增强剂非特异产物过多,引物二聚体拖尾严重体系污染设计对照实验寻找污染源,操作时应注意避免交叉污染引物浓度过高适当减少引物浓度引物序列特异性差重新设计引物Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度dNTP浓度过高降低dNTP浓度酶量过多减少酶量,以0.5 U间隔递减退火温度过低提高退火温度延伸时间过短增加延伸时间,以1 min间隔递增循环次数过多减少循环次数模板结构过于复杂或目标片段过长特选择适当的酶(详见PCR产品选择指南);使用PCR增强剂其他HotStart PCRTouchDown PCR巢式PCR引物3’末端存在互补序列重新设计引物引物浓度过高降低引物浓度模板浓度过低提高模板浓度退火温度不合适优化退火温度循环次数过多减少循环次数其他HotStart PCR引物浓度过高调整引物浓度引物序列特异性差或模板上存在同源序列重新设计引物模板降解重新制备模板模板浓度过高降低模板浓度dNTP浓度过高减少dNTP用量Mg2+浓度过高降低Mg2+浓度,从1 mM到3 mM以0.5 mM间隔递增,针对不同模板和引物摸索最佳Mg2+浓度酶量过多或质量差减少酶量,以0.5 U间隔递减;更换质量可靠的酶变性温度过低提高变性温度,以0.5℃递增退火温度过低提高退火温度延伸时间过长缩短延伸时间循环次数过多减少循环次数,以2个循环间隔递减体系污染设计对照实验,消除污染源其他HotStart PCR TouchDown PCR 巢式PCR假阳性目标片段与非特异扩增片段间存在同源性设计阴性对照,确认为引物问题后重新设计引物体系污染设计阴性对照判断是否有污染,去除污染源。
实验室存在问题及改进措施实验室是进行科学研究、教学实验、技术开发和产品质量检测的重要场所,对于提高人才培养质量、促进科技进步和经济发展具有重要作用。
然而,在实际运行过程中,实验室存在一些问题,需要我们认真分析并采取相应的改进措施。
一、实验室存在问题1. 安全意识不强实验室安全管理是实验室工作的重中之重,但由于部分实验室人员安全意识不强,对实验室安全管理工作重视不够,导致实验室安全事故时有发生。
例如,实验室废弃物处理不当、实验仪器设备维护不及时、实验操作不规范等,都可能引发安全事故。
2. 实验设备不足且老化实验室设备是开展实验工作的重要物质基础,但目前许多实验室设备数量不足,难以满足实验教学和科研需求。
此外,部分设备老化严重,性能不稳定,影响实验结果的准确性。
3. 实验教学资源整合不足实验室教学资源包括实验教材、实验项目、实验师资等,目前存在整合不足的问题。
实验教材内容陈旧,实验项目设置单一,实验师资队伍不稳定,这些问题影响了实验教学的质量。
4. 科研与实验教学脱节在一些高校和研究机构,科研与实验教学存在脱节现象。
科研成果未能有效转化为实验教学内容,实验教学内容与实际科研需求不符,导致学生实践能力不足。
5. 实验室管理水平不高实验室管理水平直接关系到实验室运行效率和实验教学质量。
目前,部分实验室管理水平不高,表现在实验室管理制度不健全、实验室队伍建设不足、实验室经费投入不足等方面。
二、实验室改进措施1. 加强实验室安全管理(1)建立健全实验室安全管理制度,明确实验室安全责任人。
(2)加强实验室安全培训,提高实验室人员安全意识。
(3)定期检查实验室设备,确保设备安全性能良好。
(4)规范实验室废弃物处理,防止环境污染。
2. 增加实验设备投入(1)加大财政支持力度,购买新型实验设备。
(2)优化实验设备配置,满足不同实验室需求。
(3)定期更新实验设备,提高设备性能。
3. 优化实验教学资源(1)修订实验教材,更新实验项目,提高实验教学内容的时代性。