备战高考化学化学反应速率与化学平衡(大题培优 易错 难题)及答案
- 格式:doc
- 大小:590.50 KB
- 文档页数:16
备战高考化学化学反应速率与化学平衡( 大题培优易错难题)及答案一、化学反应速率与化学平衡1.根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。
完成下列填空:(1)将 0.050mol SO2(g) 和 0.030mol O 2(g) 充入一个 2L 的密闭容器中,在一定条件下发生反应: 2SO2(g)+O2 (g)? 2SO3(g)+Q。
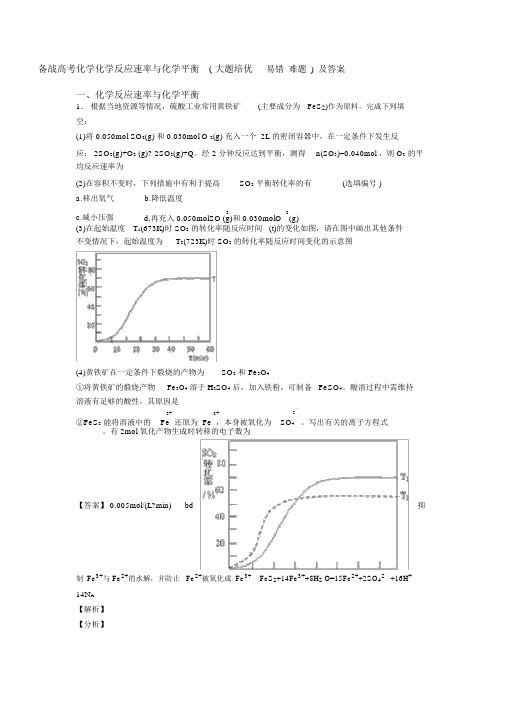
经 2 分钟反应达到平衡,测得n(SO3)=0.040mol ,则 O2的平均反应速率为 ______(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有 ______(选填编号 )a.移出氧气b.降低温度c.减小压强2 2(g) d.再充入 0.050molSO (g)和 0.030molO(3)在起始温度T1(673K)时 SO2的转化率随反应时间 (t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时 SO2的转化率随反应时间变化的示意图___(4)黄铁矿在一定条件下煅烧的产物为SO2和 Fe3O4①将黄铁矿的煅烧产物Fe3O4 溶于 H2SO4后,加入铁粉,可制备 FeSO4。
酸溶过程中需维持溶液有足够的酸性,其原因是______②FeS2能将溶液中的3+ 2+ 2﹣。
写出有关的离子方程式Fe 还原为 Fe ,本身被氧化为SO4______。
有 2mol 氧化产物生成时转移的电子数为______【答案】 0.005mol/(L?min) bd抑制Fe3+与 Fe2+的水解,并防止 Fe2+被氧化成 Fe3+ FeS2+14Fe3++8H2 O=15Fe2++2SO42﹣ +16H+14N A【解析】【分析】(1)根据 v =c求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计t算;(2)反应放热,为提高 SO 2 平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高 SO 2 平衡转化率,由此分析解答;(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;(4)① Fe 3+与 Fe 2+易水解, Fe 2+易被氧化成 Fe 3+;②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数。

备战高考化学 化学反应速率与化学平衡 培优 易错 难题练习(含答案)及答案一、化学反应速率与化学平衡1.某化学兴趣小组欲测定KClO 3,溶液与3NaHSO 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO 3,溶液和310mL0.3mol /LNaHSO 溶液,所得数据如图所示。
已知:2334ClO 3HSO Cl 3SO 3H ----++=++。
(1)根据实验数据可知,该反应在0~4min 内的平均反应速率()Cl v -=________()mol /L min ⋅。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 假设实验操作 Ⅰ 该反应放热使溶液温度升高,反应速率加快 向烧杯中加入10mL0.1mo//L 的3KClO 溶液和10mL0.3mol/L 的3NaHSO 溶液,Ⅱ 取10mL0.1mo/L 的3KClO 溶液加入烧杯中,向其中加入少量NaCl 固体,再加入10mL0.3mol/L 的3NaHSO 溶液Ⅲ 溶液酸性增强加快了化学反应速率分别向a 、b 两只烧杯中加入10mL0.1mol/L 的3KClO 溶液;向烧杯a中加入1mL 水,向烧杯b 中加入1mL0.2mol/L 的盐酸;再分别向两只烧杯中加入10mL0.3mol/L 的3NaHSO 溶液①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
【答案】0.0025 插入温度计 生成的Cl -加快了化学反应速率 生成的24SO -加快了化学反应速率 将1mL 水改为1mL0.2mol/L 的NaCl 溶液 反应物浓度降低【解析】【分析】【详解】(1)根据实验数据可知,该反应在0~4min 内生成氯离子的浓度是0.010mol/L ,所以平均反应速率()()Cl 0.010mol /L 4min 0.0025mol /L min c -=÷=⋅; (2)①由于是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化;②方案I 、Ⅱ相比较,Ⅱ中加入了少量氯化钠,所以方案Ⅱ中的假设为生成的Cl -加快了化学反应速率;③由于反应中还有硫酸根离子生成,则除I 、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率;④为防止氯离子对实验的干扰,则改进措施是将1mL 水改为1mL0.2mol/L 的NaCl 溶液; ⑤反应后期反应物浓度减小,因此化学反应速率变慢。

备战高考化学培优易错难题(含解析)之化学反应速率与化学平衡含答案一、化学反应速率与化学平衡1.用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。
下列判断正确的是___________(填字母)。
a. 加入KI后改变了反应的路径b. 加入KI后改变了总反应的能量变化c. H2O2+I-=H2O+IO-是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。
再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。
以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。
A试管加入CCl4,B试管不加CCl4,分别振荡、静置。
观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)ƒI3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:微粒I-I2I3-浓度/(mol·L-1) 2.5×10-3a 4.0×10-3①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
【答案】2H2O2KI2H2O+O2↑ a 下层溶液呈紫红色在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B 试管中产生气泡速率没有明显减小 32.510-⨯ 2c (I 2)+c (I -)+3c (I 3-)<0.033mol ·L -1【解析】【分析】(1)H 2O 2+I -=H 2O +IO -,H 2O 2+IO -=H 2O +O 2↑+I -,把两式加和,即可得到总反应的化学方程式。

2020-2021备战高考化学培优易错难题(含解析)之化学反应速率与化学平衡附答案一、化学反应速率与化学平衡1.研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。
甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。
你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大2-272-4c(Cr O)c(CrO)_____(选填“增大”,“减小”,“不变”);(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验ⅰⅱⅲⅳ是否加入Fe2(SO4)3否否加入5g否是否加入H2SO4否加入1mL加入1mL加入1mL电极材料阴、阳极均为石墨阴、阳极均为石墨阴、阳极均为石墨阴极为石墨,阳极为铁Cr2O72-的去除率/%0.92212.720.857.3①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。

2020-2021备战高考化学化学反应速率与化学平衡(大题培优易错难题)及答案解析一、化学反应速率与化学平衡1.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)示意图序号温度试剂A现象①0°C0.5mol∙L−1稀硫酸4min左右出现蓝色②20°C1min左右出现蓝色③20°C0.1mol∙L−1稀硫酸15min左右出现蓝色④20°C蒸馏水30min左右出现蓝色(1)为探究温度对反应速率的影响,实验②中试剂A应为______________。
(2)写出实验③中I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液pH对反应速率的影响查阅资料:i.pH<11.7时,I-能被O2氧化为I2。
ii.pH= 9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用4支试管在装有O2的储气瓶中进行实验,装置如图所示。
序号⑤⑥⑦⑧试管中溶液的pH891011放置10小时后的现象出现蓝色颜色无明显变化分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实pH=10的条件下确实可以发生I-被O2氧化为I2的反应,如图所示,请你填写试剂和实验现象。
试剂1______________。
试剂2______________。
实验现象:___________________________。
(深入探究)较高温度对反应速率的影响小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:_______________。
假设2:45°C以上I2易升华,70°C水浴时,c(I2)太小难以显现黄色。

2020-2021备战高考化学化学反应速率与化学平衡(大题培优易错难题)附详细答案一、化学反应速率与化学平衡1.某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I−发生可逆反应,实验Ⅰ在用量上的用意是__________(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I−可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I−氧化为I2,使实验Ⅰ中溶液棕黄色变深。
甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
噲?2Fe2++I2使KI过量,再检验是否有Fe3+,以证明该反【答案】铁氰化钾 2Fe3++2I−垐?应为可逆反应下层呈紫色,上层呈浅绿色用CCl4萃取碘以后,使平衡右移,Fe3+浓度更小,与SCN-的反应不明显向试管中加入5ml 0.1mol/L的KI溶液和1-2滴淀粉溶液,加酸调pH=5,钟后观察现象碘离子浓度过小,氢离子浓度过小(合理即可)【解析】【分析】(1) 在含有Fe2+ 的溶液中滴加铁氰化钾溶液有蓝色沉淀生成;(2) Fe3+与I-发生氧化还原反应生成碘单质;(3) 取2mL实验Ⅰ反应后的溶液,滴加2滴0.1mol•L-1KSCN溶液溶液呈红色,实验Ⅰ滴入几滴反应后仍含铁离子;(4)I2易溶于CCl4;减小生成物的浓度,平衡会向正反应方向移动。
备战高考化学二轮 化学反应速率与化学平衡 专项培优 易错 难题及答案解析一、化学反应速率与化学平衡1.为了证明化学反应有一定的限度,进行了如下探究活动:步骤1:取8mL0.11mol L -⋅的KI 溶液于试管,滴加0.11mol L -⋅的FeCl 3溶液5~6滴,振荡; 请写出步骤1中发生的离子反应方程式:_________________ 步骤2:在上述试管中加入2mLCCl 4,充分振荡、静置;步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.11mol L -⋅的KSCN 溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe 3+,来验证是否有Fe 3+残留,从而证明化学反应有一定的限度。
针对实验现象,同学们提出了下列两种猜想: 猜想一:KI 溶液过量,Fe 3+完全转化为Fe 2+,溶液无Fe 3+猜想二:Fe 3+大部分转化为Fe 2+,使生成Fe (SCN )3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:信息一:乙醚比水轻且微溶于水,Fe (SCN )3在乙醚中的溶解度比在水中大。
信息二:Fe 3+可与46[()]Fe CN -反应生成蓝色沉淀,用K 4[Fe (CN )6]溶液检验Fe 3+的灵敏度比用KSCN 更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A 、B 中,请将相关的实验操作、预期现象和结论填入下表空白处:【答案】322222Fe I Fe I +-++=+ 若液体分层,上层液体呈血红色。
则“猜想一”不成立 在试管B 中滴加5-6滴K 4[Fe (CN )6]溶液,振荡【解析】 【分析】 【详解】(1) KI 溶液与FeCl 3溶液离子反应方程式322222FeI Fe I +-++=+;(2)①由信息信息一可得:取萃取后的上层清液滴加2-3滴K 4[Fe (CN )6]溶液,产生蓝色沉淀,由信息二可得:往探究活动III 溶液中加入乙醚,充分振荡,乙醚层呈血红色,实验操作预期现象结论若液体分层,上层液体呈血红色。
【化学】化学化学反应速率与化学平衡的专项培优易错难题练习题及答案一、化学反应速率与化学平衡1.某研究性学习小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),甲同学设计实验如下表:实验编号盐酸浓度(mol·L-1)铁的状态温度/°C1 2.00块状202 2.00粉末203 1.00块状204 2.00块状40请回答:(1)若四组实验均以收集到500mL(已转化为标准状况下)氢气为标准,则上述实验中还需要测定的数据是________。
(2)实验________和______是研究铁的状态对该反应速率的影响(填实验编号,下同);实验______和______是研究温度对该反应速率的影响。
(3)测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线c、d分别对应的实验组别可能是_______、______。
(4)乙同学设计了下列一组实验:所用铁块的形状、质量均相同,所用酸的体积相同,其浓度如下,你认为产生氢气速率最快的是______。
A 18.4mol·L-1硫酸B 5.0mol·L-1硝酸C 3.0mol·L-1盐酸D 2.0mol·L-1硫酸【答案】收集500 mL氢气所需的时间121413D【解析】【分析】该实验的目的是通过铁与盐酸反应的实验,研究影响反应速率的因素,由表格数据可知,实验1和2铁的状态不同,目的是研究铁的状态对该反应速率的影响;实验1和3盐酸的浓度不同,目的是研究盐酸的浓度对该反应速率的影响;实验1和4反应温度不同,目的是研究反应温度对该反应速率的影响。
【详解】(1)该实验的目的是通过铁与盐酸反应的实验,研究影响反应速率的因素,要比较反应速率的快慢,还需要测定收集到标准状况下500mL氢气所需的时间,故答案为:收集500 mL 氢气所需的时间;(2)由表格数据可知,实验1和2铁的状态不同,目的是研究铁的状态对该反应速率的影响;实验1和4反应温度不同,目的是研究反应温度对该反应速率的影响,故答案为:1;2;1;4;(3)由图可知,曲线c、d的反应速率较慢,固体表面积越大,反应速率越快,则1和2相比,1的反应速率较慢;酸的浓度越大,反应速率越快,则1和3相比,3的反应速率较慢;温度越高,反应速率越快,则1和4相比,1的反应速率较慢,所以曲线c、d分别对应的实验组别可能是1和3,故答案为:1;3;(4)铁在18.4mol·L-1硫酸中钝化,无氢气生成;铁与5.0mol·L-1硝酸反应生成一氧化氮,无氢气生成;铁与3.0mol·L-1盐酸和2.0mol·L-1硫酸反应生成氢气,3.0mol·L-1盐酸中氢离子浓度为3.0mol·L-1,2.0mol·L-1硫酸中氢离子浓度为4.0mol·L-1,氢离子浓度越大,反应速率越快,则产生氢气速率最快的是2.0mol·L-1硫酸,故答案为:D。
2020-2021备战高考化学化学反应速率与化学平衡培优易错难题练习(含答案)附详细答案一、化学反应速率与化学平衡1.SO2是常见的大气污染物,燃煤是产生SO2的主要原因。
工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。
该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3): V(NaOH)=_________________。
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是_________________。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。
为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。
甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
②________________________________________________。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是__________________溶液;滴加浓硫酸之前的操作是____________________。
高考化学化学反应速率与化学平衡(大题培优易错难题)及详细答案一、化学反应速率与化学平衡1.研究不同pH时CuSO4溶液对H2O2分解的催化作用。
资料:a.Cu2O为红色固体,难溶于水,能溶于硫酸,生成Cu和Cu2+。
b.CuO2为棕褐色固体,难溶于水,能溶于硫酸,生成Cu2+和H2O2。
c.H2O2有弱酸性:H2O2H+ +HO2-,HO2-H+ +O22-。
编号实验现象Ⅰ向1mL pH=2的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液出现少量气泡Ⅱ向1mL pH=3的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液立即产生少量棕黄色沉淀,出现较明显气泡Ⅲ向1mL pH=5的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液立即产生大量棕褐色沉淀,产生大量气泡(1)经检验生成的气体均为O2,Ⅰ中CuSO4催化分解H2O2的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出2种假设:ⅰ.CuO2,ⅱ.Cu2O和CuO2的混合物。
为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在Cu2O,设计如下实验:将Ⅲ中沉淀洗涤、干燥后,取a g固体溶于过量稀硫酸,充分加热。
冷却后调节溶液pH,以PAN为指示剂,向溶液中滴加c mol·L−1EDTA溶液至滴定终点,消耗EDTA溶液V mL。
V=__,可知沉淀中不含Cu2O,假设ⅰ成立。
(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96g·mol−1,M(Cu2O)=144g·mol−1)(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__。
备战高考化学化学反应速率与化学平衡(大题培优易错难题)及答案一、化学反应速率与化学平衡1.根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。
完成下列填空:(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)⇌2SO3(g)+Q。
经2分钟反应达到平衡,测得n(SO3)=0.040mol,则O2的平均反应速率为______(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有______(选填编号)a.移出氧气b.降低温度c.减小压强d.再充入0.050molSO2(g)和0.030molO2(g)(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图___(4)黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4①将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。
酸溶过程中需维持溶液有足够的酸性,其原因是______②FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42﹣。
写出有关的离子方程式______。
有2mol氧化产物生成时转移的电子数为______【答案】0.005mol/(L•min) bd 抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+ FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+14N A【解析】【分析】(1)根据v=ct∆∆求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计算;(2)反应放热,为提高SO2平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2平衡转化率,由此分析解答;(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;(4)①Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+;②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数。
【详解】(1)v(SO3)=ct∆∆=0.040mol2L2min=0.01mol/(L•min),所以v(O2)=12v(SO3)=0.005mol/(L•min),故答案为:0.005mol/(L•min);(2)a.移出氧气,平衡逆向移动,二氧化硫的转化率减少,故不选;b.降低温度,平衡正向移动,二氧化硫的转化率增大,故选;c.减小压强,平衡逆向移动,二氧化硫的转化率减少,故不选;d.再充入0.050molSO2(g)和0.030molO2(g),相当于增大压强,平衡正向移动,二氧化硫的转化率增大,故选;故答案为:bd;(3)反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图如图所示;故答案为:;(4)①Fe2O3(或Fe3O4等)溶于H2SO4后,生成的Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+,所以要加入Fe粉和酸,抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+,故答案为:抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+;②−2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为硫酸根离子,有关的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+,氧化产物是硫酸根离子,有2mol硫酸根生成时转移的电子数为14N A,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+;14N A。
【点睛】注意(3)温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,此为解题的关键。
2.某兴趣小组在实验室进行如下实验探究活动。
(1)设计如下实验研究2Fe3++2I-ƒ2Fe2++I2的反应。
①振荡静置后C中观察到的现象是_______________________;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________(写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________(答“可以”或“不可以”)步骤III达到滴定终点的现象是___________________________。
巳知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________;仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。
______________【答案】溶液分层,上层水层为黄绿色,下层四氯化碳层为紫色滴加KSCN溶液,溶液变红不能;;当滴入最后一滴Na2S2O3标准溶液时,蓝色褪去且半分钟内不复原用c mol/L Na2S2O3标准溶液滴定至溶液呈浅黄色时,滴加淀粉指示剂,再继续滴加标准溶液2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;加入试剂0.01mol/LKMnO4酸性溶液和0.1mol/L的H2C2O4溶液0.01mol/LKMnO4酸性溶液、0.1mol/L的H2C2O4溶液和硫酸锰固体褪色时间实验结论【解析】【分析】(1)①由题意可知,过量的碘化钾溶液与氯化铁溶液反应生成氯化亚铁和碘,向溶液中加入四氯化碳,振荡静置,溶液分层,为证明该反应存在一定限度,应检验上层溶液中是否存在Fe3+;②由步骤I可知,双氧水的氧化性强于单质碘,若步骤II省略,溶液中过氧化氢会与Na2S2O3溶液反应;当Na2S2O3标准溶液过量时,溶液中碘单质完全反应,溶液由蓝色变为无色;为避免引起实验误差,滴定开始时不能加入淀粉指示剂,应当在I2浓度较小时再滴入淀粉;(2)KMnO4酸性溶液与H2C2O4溶液反应生成硫酸钾、硫酸锰、二氧化碳和水。
【详解】(1)①由题意可知,过量的碘化钾溶液与氯化铁溶液反应生成氯化亚铁和碘,向溶液中加入四氯化碳,振荡静置,溶液分层,上层为氯化铁和氯化亚铁得混合溶液,溶液的颜色为黄绿色,下层为碘的四氯化碳溶液,溶液的颜色为紫色;为证明该反应存在一定限度,应检验上层溶液中是否存在Fe3+,还应补做实验为:取C中分液后的上层溶液,然后滴加KSCN溶液,溶液变红色,故答案为:溶液分层,上层水层为黄绿色,下层四氯化碳层为紫色;滴加KSCN溶液,溶液变红;②由步骤I可知,双氧水的氧化性强于单质碘,若步骤II省略,溶液中过氧化氢会与Na2S2O3溶液反应,导致Na2S2O3标准溶液体积偏大,所测结果偏高,故不能省略;当Na2S2O3标准溶液过量时,溶液中碘单质完全反应,溶液由蓝色变为无色,且半分钟内不复原;由I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,滴定开始时不能加入淀粉指示剂,应当在I2浓度较小时再滴入淀粉,故答案为:不能;当滴入最后一滴Na2S2O3标准溶液时,蓝色褪去且半分钟内不复原;用c mol/L Na2S2O3标准溶液滴定至溶液呈浅黄色时,滴加淀粉指示剂,再继续滴加标准溶液;(2)KMnO4酸性溶液与H2C2O4溶液反应生成硫酸钾、硫酸锰、二氧化碳和水,反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;据题给条件,设计探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响的实验,应用取两份等体积的0.01mol/LKMnO4酸性溶液,一份加入0.1mol/L的H2C2O4溶液,另一份加入等体积的0.1mol/L的H2C2O4溶液和硫酸锰固体,测定溶液由紫色退为无色所需要的时间,实验用表格如下:故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;当Na2S2O3标准溶液过量时,溶液中碘单质完全反应,溶液由蓝色变为无色,为避免引起实验误差,滴定开始时不能加入淀粉指示剂,应当在I2浓度较小时再滴入淀粉是解答关键,也是难点和易错点。
3.CuSO4溶液对过氧化氢的分解反应具有催化作用。
有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下探究。
(1)请你帮助他们完成实验报告:(2)已知FeCl3在水中可电离出Fe3+和Cl-,同学们提出以下猜想。
甲同学的猜想:真正催化H2O2分解的是FeCl3溶液中的H2O;乙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Fe3+;丙同学的猜想:真正催化H2O2分解的是FeCl3溶液中的Cl-。
你认为最不可能的是_______同学的猜想,理由是________。
(3)同学们对余下的两个猜想用实验进行了探究。
请你仔细分析后完成下表:【答案】试管中有大量气泡产生,带火星的木条复燃甲过氧化氢溶液中有水,可见水不是催化剂起催化作用的不是Cl- Fe2(SO4)3溶液试管中有大量气泡产生,带火星的木条复燃起催化作用的是Fe3+【解析】【分析】此题通过提出猜想、实验探究、得出结论等步骤,以实验形式探究FeCl2溶液对过氧化氢分解反应的催化作用。
(1)FeCl3溶液对双氧水的分解有催化作用,所以现象是试管中有大量气泡产生,带火星的木条复燃;(2)对于真正催化分解H2O2的到底是H2O、Fe3+还是Cl-,同学共有三个猜想,根据推理,可知最不可能的是甲;(3)通过加入加入少量的HCl引入Cl-,而无明显现象,起催化作用的不是Cl-;从而可知起催化作用的一定是铁离子,通过加入Fe(NO3)3溶液(或Fe2(SO4)3溶液引入Fe3+,H2O2的分解被促进,故试管中有大量气泡产生,带火星的木条复燃,说明起催化作用的是Fe3+。