2013北京高考有机二轮复习徐京汉
- 格式:ppt
- 大小:3.27 MB
- 文档页数:97
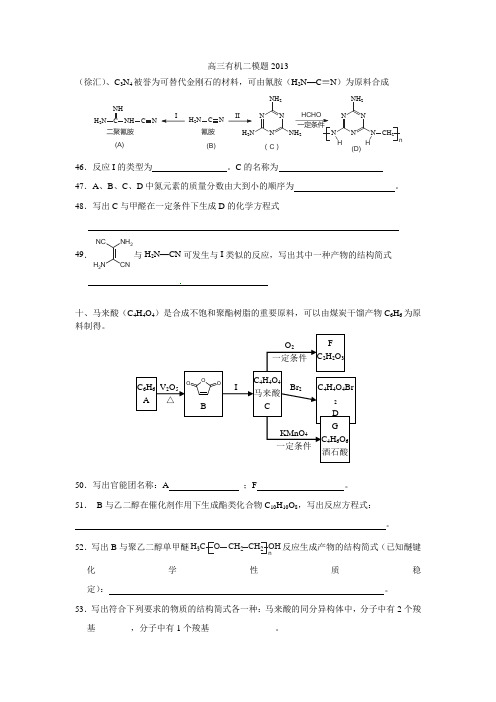
高三有机二模题2013(徐汇)、C 3N 4被誉为可替代金刚石的材料,可由氰胺(H 2N —C ≡N )为原料合成H 2NC NH NH C NH 2NC N N H 2NN NH 2NNH 2氰胺二聚氰胺(C )III HCHO 一定条件N N N N NNH 2H HCH 2n(A)(B)(D)46.反应I 的类型为 。
C 的名称为 47.A 、B 、C 、D 中氮元素的质量分数由大到小的顺序为 。
48.写出C 与甲醛在一定条件下生成D 的化学方程式49.NH 2NH 2NCCN与H 2N —CN 可发生与I 类似的反应,写出其中一种产物的结构简式十、马来酸(C 4H 4O 4)是合成不饱和聚酯树脂的重要原料,可以由煤炭干馏产物C 6H 6为原料制得。
50.写出官能团名称:A ;F 。
51. B 与乙二醇在催化剂作用下生成酯类化合物C 10H 10O 8,写出反应方程式: 。
52.写出B 与聚乙二醇单甲醚H 3C O CH 2CH 2OH n反应生成产物的结构简式(已知醚键化学性质稳定): 。
53.写出符合下列要求的物质的结构简式各一种:马来酸的同分异构体中,分子中有2个羧基________,分子中有1个羧基_______________。
C 6H 6 A OOOBC 4H 4O 4马来酸 CC 4H 4O 4Br2D IV 2O 5 △Br 2F C 2H 2O 3GC 4H 6O 6酒石酸O 2一定条件 一定条件KMnO 454.写出D 转化为G 的化学方程式。
(普陀)PHBV ( )是一种可降解的高分子材料。
此类产品可用于食品包装、化妆品、医药、卫生及农业等行业。
它可由互为同系物的M 、N (均为不饱和烃)等原料经下列路线合成:完成下列填空:43、写出N 的结构简式 ,C 中官能团的名称 。
44、写出反应类型:M→A 。
B 的同分异构体中能被新制氢氧化铜悬浊液氧化的有 种。
45、由E 和D 合成PHBV 的化学方程式是 。
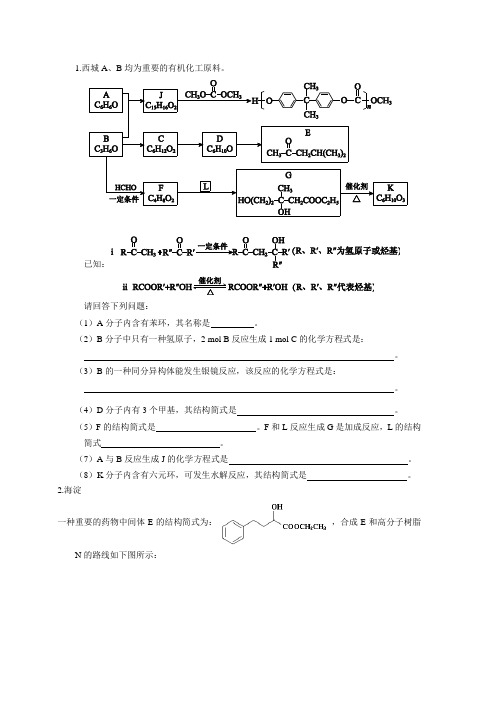
1.西城A、B均为重要的有机化工原料。
已知:请回答下列问题:(1)A分子内含有苯环,其名称是。
(2)B分子中只有一种氢原子,2 mol B反应生成1 mol C的化学方程式是:。
(3)B的一种同分异构体能发生银镜反应,该反应的化学方程式是:。
(4)D分子内有3个甲基,其结构简式是。
(5)F的结构简式是。
F和L反应生成G是加成反应,L的结构简式。
(7)A与B反应生成J的化学方程式是。
(8)K分子内含有六元环,可发生水解反应,其结构简式是。
2.海淀一种重要的药物中间体E的结构简式为:,合成E和高分子树脂N的路线如下图所示:已知:①C O R HCl 3CCOOH DMFCH R CCl 3OH (i) NaOH/H 2O ,(ii) H +CH R COOHOH②C OR H + R`CH 2C HO R CH C C H + H 2OOR`稀 NaOH 溶液(注:R 和 R`表示烃基或氢原子)请回答下列问题: (1)合成高分子树脂N① A 中含氧官能团的名称为_____________。
② 由A 可制得F ,F 的结构简式为___________________;F→G 的反应类型为__________。
③ G 有多种同分异构体,其中一种异构体X 的结构简式为:CH CH CH 2CHOBrBr,下列有关X 的说法正确的是___________(填标号)。
a .能与银氨溶液发生反应b .能与氢气在一定条件下发生加成反应c .在碱性条件下发生水解反应,1 mol X 消耗2 mol NaOHd .加热条件下,与NaOH 醇溶液反应,只生成一种有机物 ④ 写出M→N 反应的化学方程式_______。
⑤ 已知碳碳双键能被O 2氧化,则上述流程中“F→G”和 “H→M”两步 的作用是__________。
(2)合成有机物E① 写出C→E 反应的化学方程式______________________。
② 实验室由C 合成E 的过程中,可使用如右图所示的装置提高反应物的转化率。
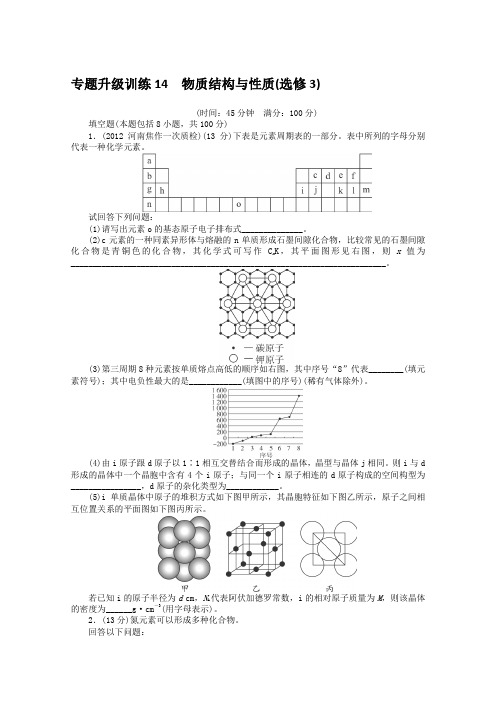
专题升级训练14物质结构与性质(选修3)(时间:45分钟满分:100分)填空题(本题包括8小题,共100分)1.(2012河南焦作一次质检)(13分)下表是元素周期表的一部分。
表中所列的字母分别代表一种化学元素。
试回答下列问题:(1)请写出元素o的基态原子电子排布式______________。
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作C x K,其平面图形见右图,则x值为________________________________________________________________________。
(3)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表________(填元素符号);其中电负性最大的是____________(填图中的序号)(稀有气体除外)。
(4)由i原子跟d原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。
则i与d 形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为________________,d原子的杂化类型为____________。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知i的原子半径为d cm,N A代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
2.(13分)氮元素可以形成多种化合物。
回答以下问题:(1)基态氮原子的价电子排布式是____________________________________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是________________________________________________________________________。

注意事项:1.本试卷分试题卷和答题卷两部分,试题卷共8页,答题卷共4页。
共六大题150分,测试时间150分钟。
2.所有试题均应按题号把答案涂、写在答题卷相应的位置上,超出答题框或答在试卷上的答案无效。
3.答题前将密封线内要求填写的内容填写清楚,将座号写在答题卷上。
考生交卷时只交答题卷。
第I卷阅读题甲必考题一、现代文阅读(9分,每小题3分)阅读下面文字,完成后面题目。
2010年11月29日,北京市小学生张皓经调查和实验发现“鲜食用菌不同程度地用荧光增白剂浸泡过”。
消息一出,北京市工商部门旋即澄清,张皓的实验结果“不具有科学性”,并在后续的实验检测中宣称食用菌的合格率为97.73%。
但在某网站调查中,99%的网友选择“相信小学生”而不信工商局。
究竟哪一方代表了“科学”的立场?先让我们回到17世纪六七十年代的英国。
那时,在是否存在真正的真空的问题上还存在着很大争议。
争论的一方是科学家罗伯特·波义耳,另一方则是被标定为机械论哲学家、政治学家的托马斯·霍布斯。
基于政治立场君权至上的信仰,霍布斯推定:知识也应该服从权力。
然而波义耳等人发起的英国皇家学会却将霍布斯的信念归于无形,因为皇家学会的宗旨是不必经过政府批准,不对政府任何部门负责,以及国家无法凌驾于他们可以独立表达意见的实验室之上。
这个新的小圈子将关注点聚焦在了空气泵的实验之上。
为了弥补人类感官上的局限,波义耳设计出空气泵装置,并把它塑造成帮助人们“发现新的可见世界”的有力武器。
这个装置的精妙之处便在于它能够使观察者看到玻璃试管内部的情况,并允许人们引导甚至控制实验的发展。
于是每当某个贵族大公光临科学聚会时,空气泵的神奇便不可避免地被展示一番。
当技术人员屏住呼吸,小心翼翼地操作那透明却又封闭的空气泵,泵中倒置的试管的水银面又有明确的下降时,实验室变成了一个生产知识的“公共空间”。
没错,这里体现着波义耳借鉴自司法领域,又不断倡导并期望形成科学新传统的观念——事实的构成,就是见证者增衍的过程。

北京西城区2013年5月抽样高三理科综合能力测试(化学部分)2013.5 6.对下列物质用途的解释不正确...的是()A B C D用途抗坏血酸(Vc)可作抗氧化剂明矾可用于净水纯碱可去油污“84”消毒液可用于漂白解释Vc具有酸性明矾在水中生成的氢氧化铝胶体有吸附性纯碱水解呈碱性置于空气中生成的次氯酸有氧化性7.下列说法不正确...的是()A.NH4+中质子数和电子数相等B.乙醇比乙二醇的沸点低C.乙炔与苯的实验式均为CH D.过氧化钠与过氧化氢中均含有非极性键8.下列离子方程式正确的是()A.Fe与盐酸反应制H2:2Fe+6H+=2Fe3++3H2↑B.用石墨电极电解饱和食盐水:2H++2Cl—电解Cl2↑+H2↑C.用AlCl3和氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓D.向Mg(OH)2浊液中滴入FeCl3溶液:3Mg(OH)2(s)+2Fe3+2Fe(OH)3(s)+3Mg2+9.合成某吸水性树脂的单体是丙烯酸钠(CH2=CHCOONa),下列关于丙烯酸钠的说法不正确...的是()A.水溶液呈碱性B.经加聚反应得树脂C.存在顺反异构D.使酸性KMnO4溶液褪色10.下列实验操作不能..达到预期实验目的的是()实验目的实验操作A 鉴别乙酸乙酯和乙酸分别加入饱和Na2CO3溶液B 比较Fe和Cu的金属活动性分别加入浓硝酸C 比较H2O和乙醇中羟基氢的活泼性分别加入少量NaD 比较I2在H2O和CCl4中的溶解度向I2水中加入CCl4,振荡11.一定条件下,碳钢腐蚀与溶液pH的关系如下:pH 2 4 6 6.5 8 13.5 14腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3FeO2-下列说法不正确...的是()A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓12.工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol在温度T1和T2时,分别将0.50 molCH4和1.2 molNO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:温度时间/minn/mol0 10 20 40 50T1n(CH4) 0.50 0.35 0.25 0.10 0.10T2n(CH4) 0.50 0.30 0.18 ……0.15下列说法不正确...的是()A.10 min内,T1时υ(CH4)比T2时小B.温度:T1<T2C.ΔH:a<0 D.平衡常数:K(T1)<K(T2)25.(14分)铝及其化合物在生产生活中具有重要的作用。
适考素能特训(对应学生用书P093)一、选择题1.(2012·平顶山第三次调研)设N A表示阿伏加德罗常数,下列说法正确的是()A.在0℃,101 kPa时,22.4L氢气中含有N A个氢原子B.1mol HCl气体中的粒子数与0.5mol·L-1盐酸中溶质粒子数相等C.N A个一氧化碳分子和0.5mol甲烷的质量比为7∶4D.2.4g金属镁变为镁离子时失去的电子数为0.2N A[解析]A中1mol H2应该有2N A个氢原子,A项错误;B盐酸只是给出浓度而未给出体积,所以错误;C中1mol CO和0.5mol甲烷的质量比应该是28∶8,即7∶2,C项错误;D正确。
[答案] D2.(2010·新课标全国理综)把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。
则该混合溶液中钾离子浓度为()A.0.1(b-2a)mol·L-1B.10(2a-b)mol·L-1C.10(b-a)mol·L-1D.10(b-2a)mol·L-1[解析]根据离子反应方程式:Ba2++SO2-4===BaSO4↓,Cl-+Ag+===AgCl↓,从而求出500mL混合液中Ba2+、Cl-的物质的量分别为5a mol、5b mol,再结合电荷守恒求出K+的物质的量为(5b-10a)mol,因此K+的浓度为c(K+)=(5b-10a)mol0.5L=10(b-2a)mol·L-1。
[答案] D3. (2012·北京海淀模拟)下列叙述正确的是()A. 常温下,78g Na2O2中含有的阴离子数是2×6.02×1023B. 常温下,1L 0.1mol·L-1NH4NO3溶液中含有的NH+4数是0.1×6.02×1023C. 常温常压下,22.4L SO2和O2混合气体中含有的氧原子数是2×6.02×1023D. 铁、铝混合物与一定量稀盐酸反应生成1mol H2时,转移电子数是2×6.02×1023[解析]A项,78g Na2O2的物质的量为1mol,含有的阴离子O2-2数为6.02×1023,不正确;B项,NH4NO3溶液中NH+4会部分水解,故1L 0.1mol·L-1 NH4NO3溶液中含有的NH+4数小于0.1×6.02×1023,不正确;C项,常温常压下,22.4L SO2和O2混合气体的物质的量小于1mol,即氧原子数小于2×6.02×1023,不正确。
2013年北京高考化学试题---工艺流程汇编3.(朝阳区14分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。
工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:回答下列问题:(1)氢氧化钠的电子式是________。
(2)经过步骤①后,加入NaOH固体的原因是。
(3)步骤②反应的离子方程式是。
(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为。
(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH________(填“高”或“低”)。
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是(答两点)。
4. (东城区14分)某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1)燃料电池中通入氧气的电极是(填“正”或“负”)极,电极反应式是;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是;由TiCl4得到金属Ti的化学方程式是。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:①P1 4MPa②实验Ⅰ条件下合成甲醇的热化学方程式是。
5.(房山区)金属钛被称为“21世纪金属”。
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:其中,步骤Ⅱ发生的反应为:2H2SO4 + FeTiO3 = TiOSO4 + FeSO4 + 2H2O①步骤Ⅰ中发生反应的化学方程式:、。
②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为。
第七讲 有机合成题的解题策略一、有机合成思想:逆向思维 重在切断 二、基本知识:1、碳架构建:信息2、官能团的消除⑴通过加成消除不饱和键;⑵通过消去、氧化、酯化等消除醇羟基; ⑶通过加成或氧化消除醛基。
⑷通过消去、取代等消除卤素原子.3.官能团的转换、引入CH 3—CH 3CH 2 = CH 2CH 2 = CHCl CH 3—CH 2Cl CH 3—CH 2OH CH 3—CHO CH 3—COOH CH 3—COOC 2H 5252H 5CH 3—COON aCHCH—CH —CH —Cl[]n—CH 2—CH 2—[]n CH 2CH 2OH OHCH 2CH 2Cl Cl COOH COOH O=C CH 2O=CCH 2O O C 6H 12O 6C 12H 22O 11C 12H 22O 11(C 6H 10O 5)n纤维素乙酸酯硝化纤维淀粉麦芽糖蔗糖葡萄糖(C 6H 7O 2)OHOHOH n4.官能团的保护a .只有被保护基团发生反应(保护),而其它基团不反应;b .被保护的基团易复原,复原的反应过程中不影响其它官能团. 例如:防止醇羟基被氧化或羧基碱性条件下反应,可利用酯化反应生 成酯,从而达到保护羟基或羧基的目的。
例1.高分子材料M 在光聚合物和金属涂料方面有重要用途.已知:M 可以用丙烯为原料,通过如下图所示的路线合成:(1)A 中两种官能团的名称是 和 .(2)注明反应类型。
C→甲基丙烯酸: ,E →M: . (3)写出下列反应的化学方程式:① D→C 3H 8O 2: . ② 生成E: 。
(4)A →B 的反应中还可能生成一种有机副产物,该副产物的结构简 式为 。
(5)写出与甲基丙烯酸具有相同官能团的所有同分异构体(包括顺反 异构)的结构简式 。
(6)请用合成路线流程图表示A→丙烯酸(CH 2=CHCOOH )的合 成线路,并注明反应条件。
提示:① 氧化羟基的条件足以氧化有机分子中的碳碳双键; ② 合成过程中无机试剂任选; ③ 合成路线流程图示例如下:例2.某吸水材料与聚酯纤维都是重要化工原料.合成路线如下:(1)A 的结构简式是 。