仪器分析实验5-紫外可见光谱分析
- 格式:pdf
- 大小:385.46 KB
- 文档页数:8

主讲教师:苏萍 第五章 5.2 影响紫外可见吸收 光谱的因素01共轭体系的影响 目 录 CONTENTS 02 空间异构效应的影响03异构现象的影响 04取代基的影响 05溶剂极性的影响 06 pH 值的影响1. 共轭体系的影响CH2=CH2的π-π*跃迁:λmax = 171 nm(无色)1,3-丁二烯:λmax = 217 nm(无色)1,3,5-己三烯:λmax = 258 nm(无色)⋯番茄红素(C=C)11 λmax = 470 nm(红色)2. 空间异构效应的影响如CH3I (λmax = 258nm)CH2I2 (λmax = 289nm)CHI3 (λmax = 349nm)3. 异构现象的影响如乙酰乙酸乙酯在溶液中存在酮式与烯醇式的平衡,烯醇式中的共轭双键使π-π*跃迁能量降低,λmax向长波方向移动。
CH3―C ― CH2 ― C ― OC2H5 CH3―CH = CH― C ― OC2H5 ‖ ‖ ‖O O O乙酰乙酸乙酯酮式烯醇式204nm处仅有弱吸收245nm处有强的K吸收带4. 取代基的影响取代基为含孤对电子基团时,如-NH2、-OH、-Cl,可使分子向长波方向移动;取代基为斥电子基时,如-R,-OCOR则使分子向短波方向移动;苯环或烯烃上的H被各种取代基取代,多向长波方向移动。
4. 取代基的影响例如:OH基团本身无色,但能增强生色团颜色,因为含有n 电子,且能与π电子作用,产生n →π共轭。
184204254270苯(π→π*)苯酚(—OH为助色团)λ/nm5. 溶剂极性的影响◆溶剂极性越强,由π→π*跃迁产生的谱带向长波方向移动越显著,即红移越大。
这是因为发生π→π*跃迁的分子激发态的极性大于基态,在极性溶剂的作用下,激发态能量降低的程度大于基态,从而使基态到激发态跃迁所需的能量变小,使吸收带发生红移。
◆溶剂极性越强,由n→π*跃迁产生的谱带向短波方向移动越明显,即蓝移越大。




紫外可见分光光度计实验报告实验目的:1.学习操作紫外可见分光光度计,并了解其原理和使用方法。
2.通过测量不同溶液的吸光度,了解溶液的浓度与吸光度之间的关系。
3.掌握分光光度计的标定方法。
实验原理:紫外可见分光光度计是一种常用的光谱仪器,可用于测定溶液吸光度。
其原理是通过将入射光分光为不同波长的光束,经过被测溶液后,测量出透射光强度与入射光强度的比值,即吸光度。
吸光度与溶液浓度之间通常存在一定的线性关系。
实验步骤:1.打开紫外可见分光光度计的电源,待仪器启动后进行预热。
2.调节光电倍增管的位置,使得入射光线居中。
3.根据实验要求选择合适的波长范围和检测波长。
4.调节样品舱盖,将待测样品放入样品舱内。
5.按下“调零”按钮,将吸光度调零。
6.按下“测量”按钮,记录下测量的吸光度数值。
7.将待测样品取出,用试剂喷洒清洗样品舱。
8.重复步骤4-7,测量其他样品的吸光度。
实验结果与讨论:1.测量了一系列浓度不同的对苯二酚溶液的吸光度,并绘制了吸光度与浓度之间的曲线。
通过拟合可以得到该溶液的吸光度与浓度的线性关系,这为后续测量其他溶液的浓度提供了基础。
2.在测量过程中,注意避免样品舱残留上一次测量的溶液,以免影响测量结果。
3.在选择波长时,应根据被测样品的特性和需要,选择合适的波长范围和检测波长,以提高测量精度。
实验体会:通过这次实验,我初步掌握了紫外可见分光光度计的使用方法和原理,了解了溶液浓度与吸光度之间的关系。
实验中需要注意操作的细节,如样品舱的清洗、选择合适的波长等。
在实验过程中,我也遇到了一些问题,但在指导老师的帮助下,逐渐解决了这些问题。
总的来说,这次实验对我深化了对光谱仪器的理解,并提高了我的实验操作能力。

一、实验目的1. 熟悉紫外分光光度计的仪器结构和工作原理。
2. 掌握紫外-可见吸收光谱法的基本原理和应用。
3. 通过实验掌握紫外-可见分光光度计的操作方法。
4. 学习利用紫外-可见吸收光谱法进行定量分析。
二、实验原理紫外-可见分光光度法是一种基于物质分子对紫外-可见光的选择性吸收而建立的分析方法。
该方法广泛应用于有机化合物的定性、定量分析以及物质的纯度检验。
紫外-可见光波长范围一般为200-800nm,其中200-400nm为紫外区,400-800nm为可见光区。
当物质分子吸收紫外-可见光时,分子中的电子从基态跃迁到激发态。
不同物质的分子结构不同,吸收光的波长和强度也不同。
因此,通过测定物质的吸收光谱,可以实现对物质的定性和定量分析。
朗伯-比尔定律(Lambert-Beer Law)是紫外-可见分光光度法的基础。
该定律表明,在一定波长下,溶液的吸光度(A)与溶液的浓度(c)和光程(l)成正比,即A= εcl,其中ε为摩尔吸光系数。
三、实验仪器与试剂1. 仪器:紫外-可见分光光度计、移液管、容量瓶、比色皿、洗耳球等。
2. 试剂:待测样品、标准溶液、溶剂等。
四、实验步骤1. 标准溶液的配制:根据待测样品的浓度,配制一系列标准溶液。
2. 吸收光谱的绘制:将标准溶液和待测样品分别置于比色皿中,在紫外-可见分光光度计上测定其在不同波长下的吸光度值。
3. 标准曲线的制作:以吸光度值为纵坐标,浓度为横坐标,绘制标准曲线。
4. 待测样品的定量分析:将待测样品的吸光度值代入标准曲线,计算其浓度。
五、实验结果与分析1. 标准曲线的制作:以吸光度值为纵坐标,浓度为横坐标,绘制标准曲线。
根据实验数据,标准曲线的线性关系良好,相关系数R²大于0.99。
2. 待测样品的定量分析:将待测样品的吸光度值代入标准曲线,计算其浓度。
实验结果表明,待测样品的浓度为X mg/L。
六、实验总结1. 通过本次实验,我们掌握了紫外-可见分光光度计的基本原理和操作方法。
01. 溶液有颜色是因为它吸收了可见光中特定波长范围的光。
若某溶液呈蓝色,它吸收的是什么颜色的光?若溶液无色透明,是否表示它不吸收光?答:溶液呈蓝色,表明其吸收了蓝光的互补光,即黄光(若答是吸收了黄光外的所有可见光,不能说错,但是这样的情况过于巧合,少见!)。
若溶液无色透明,仅能说明其不吸收可见波段的光。
2. 分别在己烷和水中测定某化合物UV-Vis 光谱,发现该化合物的某个吸收峰由285 nm (己烷)蓝移至275 nm (水),(1)判断产生该吸收峰的跃迁类型;(2)试估算该化合物与水生成氢键的强度。
答:(1)溶剂极性增大,λmax 蓝移,表明该吸收峰是由n →π*跃迁产生的。
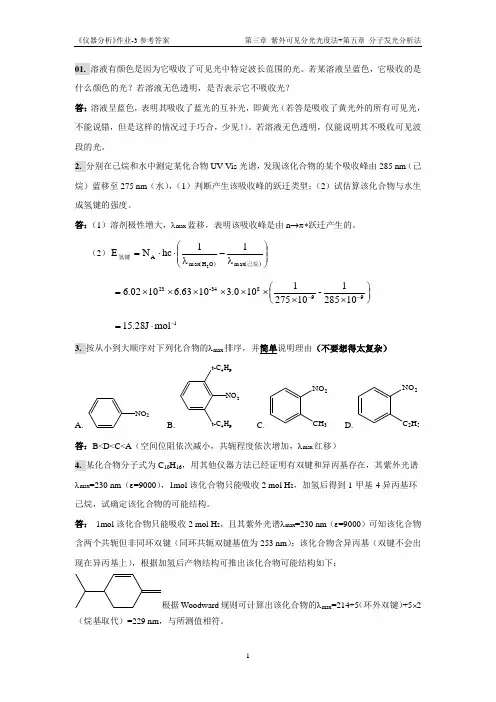
(2)()()⎪⎪⎭⎫⎝⎛λ-λ⋅⋅=己烷氢键max O H max A 11hc N E 2 ⎪⎭⎫ ⎝⎛⨯⨯⨯⨯⨯⨯⨯⨯=--99834-23102851-102751100.31063.61002.61mol J 28.15-⋅=3. 按从小到大顺序对下列化合物的λmax 排序,并简单说明理由(不要想得太复杂)A. NO 2B. NO 2t-C 4H 9t-C 4H 9 C.NO 2CH 3 D. NO 2C 2H 5答:B<D<C<A (空间位阻依次减小,共轭程度依次增加,λmax 红移)4. 某化合物分子式为C 10H 16,用其他仪器方法已经证明有双键和异丙基存在,其紫外光谱λmax =230 nm (ε=9000),1mol 该化合物只能吸收2 mol H 2,加氢后得到1-甲基-4异丙基环己烷,试确定该化合物的可能结构。
答: 1mol 该化合物只能吸收2 mol H 2,且其紫外光谱λmax =230 nm (ε=9000)可知该化合物含两个共轭但非同环双键(同环共轭双键基值为253 nm );该化合物含异丙基(双键不会出现在异丙基上),根据加氢后产物结构可推出该化合物可能结构如下:根据Woodward 规则可计算出该化合物的λmax =214+5(环外双键)+5⨯2(烷基取代)=229 nm ,与所测值相符。


第一部分:Vc 、苯甲酸、水杨酸三种有机物紫外吸收曲线制作一、技能目标1、熟练使用T6型紫外-可见光分光光度计;2、掌握有机物紫外吸收曲线的制作方法;3、掌握应用紫外吸收曲线进行有机物定性分析的方法; 二、实验原理紫外吸收光谱法是根据有机化合物对特定波长光的吸收作用来进行定量分析的,当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;若以波长为横坐标,吸光度为纵坐标作图,就可获得该化合物的紫外吸收光谱图; 三、实验仪器和试剂试剂:1.0mg/LVc ,1mg/Ll 苯甲酸,1mg/L 水杨酸,蒸馏水 仪器:T6型紫外-可见光分光光度计,石英比色皿(一套),100ml 容量瓶1个,1ml 移液管1支,洗耳球1个,100ml 烧杯1个,500ml 烧杯1个,吸水纸、擦镜纸若干 四、实验内容与步骤(1)、仪器开机预热15~20min ;(2)、按照测定方法设定测量参数; (3)、将三种标准储备液和未知液均配成浓度为10μg/ml 的待测溶液(配制方法自定); (4)、以蒸馏水位参比,于波长200~350nm 范围内测定三种溶液的吸光度,记录吸光度值于表格中(表格自己设计); (5)、根据数据在坐标纸上分别绘出三种物质的吸收曲线,并确定出最大吸收波长,在图上注明;Vc 的紫外吸收曲线λ/nm A λ/nm A 苯甲酸的紫外吸收曲线λ/nm A λ/nm A 水杨酸的紫外吸收曲线λ/nm A λ/nm A第二部分:紫外分光光度法测定未知物含量一、技能目标1、熟练使用T6型紫外-可见分光光度计;2、掌握应用紫外吸收曲线进行有机物定性分析的方法;3、掌握标准曲线法测定步骤。
二、实验原理当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;三、仪器和试剂1、试剂:1.0mg/LVc 、1.0mg/L 苯甲酸、1.0mg/L 水杨酸、未知样浓度4~6μg/ml (Vc 、苯甲酸、水杨酸中的一种)、蒸馏水2、仪器:T6紫外分光光度计、石英比色皿一套、100ml 容量瓶1个、10ml 比色管6只,比色管架一个,1ml 吸量管1支、10ml 吸量管1支、洗耳球1个、100ml 烧杯1个,500ml 烧杯1个,洗瓶1个、吸水纸、擦镜纸、标签纸若干。


紫外可见习题一、填空题1.朗伯定律是说明光的吸收与液层厚度正比,比耳定律是说明光的吸收与溶液浓度成正比,二者合为一体称为朗伯一比尔定律,其定义为A=KCL。
2.摩尔吸光系数的单位是L.mol-1,它表示物质的浓度为1mol.L-1液层厚度为1cm时溶液的吸光度。
常用符号ε表示,故光的吸收定律的表达式可写为A=εcL。
3.吸光度和透射比〔τ%〕关系式是A=2-logT。
4.一般分光光度分析,使用波长在35Onm以上时可用玻璃比色皿,在350nm以下时应选用石英比色皿。
5.紫外吸收光谱法大多应用于鉴定含有双键尤其是共轭体系的化合物,如含羰基、羧基、硝基等的脂肪族化合物,以及含有苯环的芳香族化合物。
6.752型分光光度计,采用自准式光路,其波长围为200—1000nm,在波长320—1000nm围200-320nm围用氢弧灯作光源。
1.当有色溶液浓度为C时,其投射比τ,当其浓度增大1倍时,仍符合比耳定律,那么此时溶液投射比为2τ。
〔×〕2.可见、紫外光吸收光谱的产生,是由于分子中原子的振动和分子的转动。
〔×〕3.比色分析中显色时间越长越好。
〔×〕4.摩尔吸光系数与溶液的浓度,液层厚度没有关系。
〔√〕5.摩尔吸光系数ε越大,说明该物质对某波长光透过的能力越强。
〔×〕6.摩尔吸光系数越大,表示某物质对某波长的光吸收能力越强。
〔√〕7.722型分光光度计和752型分光光度计都是以钨灯作为光源的。
〔×〕8.拿比色皿时只能拿毛玻璃面,不能拿透光面,擦拭时必须用擦镜纸擦透光面,不能用滤纸擦。
〔√〕9.饱和碳氢化合物在紫外光区不产生光谱吸收,所以常以饱和碳氢化合物作为紫外吸收光谱分析的溶剂。
〔√〕三、选择题1.人眼能感觉到的光称为可见光,其波长围是〔 D 〕。
A.400~70Onm;B.2O0~40Onm;C.20O~6O0nm;D.4O0~76Onm;2.物质与电磁辐射相互作用后,产生紫外一可见吸收光谱,这是由于〔 C 〕。
现代仪器分析习题解答20xx年春第12章电位分析及离子选择性电极分析法P2161.什么是电位分析法?什么是离子选择性电极分析法?答:利用电极电位和溶液中某种离子的活度或浓度之间的关系来测定待测物质活度或浓度的电化学分析法称为电位分析法。
以离子选择性电极做指示电极的电位分析,称为离子选择性电极分析法。
2.何谓电位分析中的指示电极和参比电极?金属基电极和膜电极有何区别?答:电化学中把电位随溶液中待测离子活度或浓度变化而变化,并能反映出待测离子活度或浓度的电极称为指示电极。
电极电位恒定,不受溶液组成或电流流动方向变化影响的电极称为参比电极。
金属基电极的敏感膜是由离子交换型的刚性基质玻璃熔融烧制而成的。
膜电极的敏感膜一般是由在水中溶解度很小,且能导电的金属难溶盐经加压或拉制而成的单晶、多晶或混晶活性膜。
4. 何谓TISAB溶液?它有哪些作用?答:在测定溶液中加入大量的、对测定离子不干扰的惰性电解质及适量的pH缓冲剂和一定的掩蔽剂,构成总离子强度调节缓冲液(TISAB)。
其作用有:恒定离子强度、控制溶液pH、消除干扰离子影响、稳定液接电位。
5. 25℃时,用pH=4.00的标准缓冲溶液测得电池:“玻璃电极|H+(a=X mol?L-1)║饱和甘汞电极”的电动势为0.814V,那么在c(HAc)=1.00×10-3 mol?L-1的醋酸溶液中,此电池的电动势为多少?(KHAc=1.8×10-5,设aH+=[H+])解:∵E1=φ(+)--φ(-)=φ(+)-(K-0.0592pH1)E2=φ(+)--φ(-)=φ(+)-(K-0.0592pH2)∴E2- E1= E2-0.814=0.0592(pH2- pH1)∴E2=0.814+0.0592(-lg√Kc-4.00)=0.806(V)6.25℃时,用pH=5.21的标准缓冲溶液测得电池:“玻璃电极|H+(a=X mol?L-1)║饱和甘汞电极”的电动势为0.209V,若用四种试液分别代替标准缓冲溶液,测得电动势分别为①0.064V;②0.329V;③0.510V;④0.677V,试求各试液的pH和H+活度解:(1)ΔE1=0.064-0.209=0.0592(pH1-pHs)∵pHs=5.21∴pH1=2.76 aH+=1.74×10-3 mol?L-1(2)ΔE2=0.329-0.209=0.0592(pH2-pHs)∵pHs=5.21∴pH2=7.24 aH+=5.75×10-8 mol?L-1(3)ΔE3=0.510-0.209=0.0592(pH3-pHs)∵pHs=5.21∴pH3=10.29 aH+=5.10×10-11 mol?L-1(4)ΔE4=0.677-0.209=0.0592(pH4-pHs)∵pHs=5.21∴pH4=13.12 aH+=7.60×10-14 mol?L-17.25℃时,电池:“镁离子电极|Mg2+(a=1.8×10-3mol?L-1)║饱和甘汞电极”的电动势为0.411V,用含Mg2+试液代替已知溶液,测得电动势为0.439V,试求试液中的pMg值。
实验五色氨酸、苯丙氨酸和酪氨酸的紫外吸收光谱分析一、实验目的1. 掌握紫外-可见分光光度计的工作原理和基本操作。
2. 掌握紫外-可见吸收光谱的绘制(包括导数光谱)以及定量测定方法。
3. 掌握。
4. 了解氨基酸类物质的紫外吸收光谱特点。
二、实验原理1. 紫外-可见吸收光谱法测定蛋白质含量的基本原理紫外-可见吸收光谱法是根据溶液中物质的分子或离子对紫外和可见光谱区辐射能的吸收来研究物质的组成和结构的方法,也称作紫外和可见吸收广度法,它包括比色分析法和紫外-可见分光光度法。
紫外-可见分光光度法属于吸收光谱法,分子中的电子总是处在某一种运动状态中,每一种状态都具有一定的能量,属于一定的能级。
电子由于受到光、热、电等的激发,从一个能级转移到另一个能级,称为跃迁。
当这些电子吸收了外来辐射的能量,就从一个能量较低的能级跃迁到另一个能量较高的能级。
图1 电子跃迁示意图物质对不同波长的光线具有不同的吸收能力,如果改变通过某一吸收物质的入射光的波长,并纪录该物质在每一波长处的吸光度(A),然后以波长为横坐标,以吸光度为纵坐标作图,这样得到的谱图为该物质的吸收光谱或吸收曲线。
当一定波长的光通过某物质的溶液时,入射光强度I。
与透过光强度I之比的对数与该物质的浓度c及样品池厚度b成正比。
其数学表达式为:此式为Lambert-Beer定律,是分光光度法定量分析的基础,其中A为吸光度。
由于不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,具有不同的吸收光谱,因而,我们可以利用紫外-可见吸收光谱法对物质结构进行鉴定和进行定量分析、根据被测量物质分子对紫外-可见波段范围(150~800nm)单色辐射的吸收或反射强度来进行物质的定性、定量或结构分析的一种方法。
氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称,是蛋白质的基本组成单位。
氨基酸类物质的一个重要光学性质是对光有吸收作用。
20种氨基酸在可见光区域均无光吸收,在远紫外区均有光吸收,而在近紫外区(220nm-300nm)只有三种AA有光吸收能力,这三种氨基酸分别是色氨酸(Try)、酪氨酸(Tyr)和苯丙氨酸(Phe)因为它们的结构均含有芳香共轭π键系统。
实验五色氨酸、苯丙氨酸和酪氨酸的紫外吸收光谱分析一、实验目的1. 掌握紫外-可见分光光度计的工作原理和基本操作。
2. 掌握紫外-可见吸收光谱的绘制(包括导数光谱)以及定量测定方法。
3. 掌握。
4. 了解氨基酸类物质的紫外吸收光谱特点。
二、实验原理1. 紫外-可见吸收光谱法测定蛋白质含量的基本原理紫外-可见吸收光谱法是根据溶液中物质的分子或离子对紫外和可见光谱区辐射能的吸收来研究物质的组成和结构的方法,也称作紫外和可见吸收广度法,它包括比色分析法和紫外-可见分光光度法。
紫外-可见分光光度法属于吸收光谱法,分子中的电子总是处在某一种运动状态中,每一种状态都具有一定的能量,属于一定的能级。
电子由于受到光、热、电等的激发,从一个能级转移到另一个能级,称为跃迁。
当这些电子吸收了外来辐射的能量,就从一个能量较低的能级跃迁到另一个能量较高的能级。
图1 电子跃迁示意图物质对不同波长的光线具有不同的吸收能力,如果改变通过某一吸收物质的入射光的波长,并纪录该物质在每一波长处的吸光度(A),然后以波长为横坐标,以吸光度为纵坐标作图,这样得到的谱图为该物质的吸收光谱或吸收曲线。
当一定波长的光通过某物质的溶液时,入射光强度I。
与透过光强度I之比的对数与该物质的浓度c及样品池厚度b成正比。
其数学表达式为:此式为Lambert-Beer定律,是分光光度法定量分析的基础,其中A为吸光度。
由于不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,具有不同的吸收光谱,因而,我们可以利用紫外-可见吸收光谱法对物质结构进行鉴定和进行定量分析、根据被测量物质分子对紫外-可见波段范围(150~800nm)单色辐射的吸收或反射强度来进行物质的定性、定量或结构分析的一种方法。
氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称,是蛋白质的基本组成单位。
氨基酸类物质的一个重要光学性质是对光有吸收作用。
20种氨基酸在可见光区域均无光吸收,在远紫外区均有光吸收,而在近紫外区(220nm-300nm)只有三种AA有光吸收能力,这三种氨基酸分别是色氨酸(Try)、酪氨酸(Tyr)和苯丙氨酸(Phe)因为它们的结构均含有芳香共轭π键系统。
苯丙氨酸最大吸收波长在259 nm、酪氨酸在278 nm、色氨酸在279 nm,蛋白质一般都含有这三种氨基酸残基,所以其最大光吸收在大约280 nm波长处,故我们能够利用紫外-可见分光光度法很方便的测定蛋白质的含量。
图2 色氨酸、酪氨酸、苯丙氨酸结构式2. 紫外-可见分光光度计基本构造荧光分光光度计主要有五部分组成:光源、单色器、样品室、检测器、信号处理和读出装置。
(1) 光源在整个紫外光区或可见光谱区可以发射连续光谱,具有足够的辐射强度、较好的稳定性、较长的使用寿命。
可见光区: 钨灯作为光源,其辐射波长范围在320-2500nm。
紫外区:氢、氘灯,发射185~400 nm的连续光谱。
(2) 单色器从连续光谱中获得所需单色光的装置。
①入射狭缝: 光源的光由此进入单色器;②准光装置: 透镜或返射镜使入射光成为平行光束;③色散元件: 将复合光分解成单色光; 棱镜或光棚;④聚焦装置: 透镜或凹面反射镜,将分光后所得单色光聚焦至出射狭缝;⑤出射狭缝。
的单色光,作为激发光源,激发待测物质。
(3) 样品室样品室放置各种类型的吸收池(比色皿)和相应的池架附件。
吸收池主要有石英池和玻璃池两种。
在紫外区须采用石英池,可见区一一般用玻璃池。
(4) 检测器利用光电效应将透过吸收池的光信号变成可测的电信号,常用的有光电池、光电管或光电倍增管。
(5) 信号处理和读出装置与计算机连接,自动处理数据。
三、仪器试剂1. 仪器:UV-2501PC Plus型荧光分光光度计,10 mL带玻璃塞的比色管,0.5mL、1.0mL、2.0mL移液管。
2. 试剂:标准溶液(a):100 mg/L酪氨酸标准溶液;标准溶液(b):100mg/L色氨酸标准溶液;标准溶液(c):1000mg/L苯丙氨酸标准溶液(所有溶液均用去离子水配制);待测样品:混合溶液。
四、实验步骤1. 紫外-可见光谱溶液的配制(1) 移取标准溶液(a) 2.0ml于10ml比色管中,稀释到刻度;移取标准溶液(b) 1.0ml于10ml比色管中,稀释到刻度;移取标准溶液(c) 1.0ml于10ml比色管中,稀释到刻度;(2) 分别移取0.2,0.4,0.6,0.8,1.0ml 标准溶液(b)于5个10ml比色管中,稀释到刻度。
2.仪器操作(1) 双击分光光度计图标“UVProbe”,出现软件界面,点左下角“连接”,系统开始自检,等系统自检结束。
预热15-30分钟。
待仪器稳定后方可使用。
(2) 在光谱测量模式下,以去离子水为参比溶液,分别绘制步骤(1)中各溶液在200~ 350nm波长范围内的吸收光谱。
并记录各标准溶液的λmax。
·(3) 在定量测定模式下,以去离子水为参比溶液,测定步骤1.(2)中的各标准溶液在λmax处的吸光度。
(4) 在步骤(3)同样条件下,测定未知样品溶液在λmax处的吸光度。
(5) 对色氨酸、酪氨酸定性分析结果做1至4阶导数。
(6) 观察各阶导数光谱,选取酪氨酸导数光谱为0,且色氨酸导数光谱可取到接近极大值的点。
(7) 在此波长上对各浓度色氨酸标准溶液进行求导测定,绘制标准曲线,计算未知样品中色氨酸浓度。
五、数据处理1. Phe、Tyr、Trp紫外-可见光谱定性分析图3 氨基酸定性分析2. 导数光谱的绘制及分析图4 酪氨酸(红)与色氨酸一阶导数光谱图5 酪氨酸(黄)与色氨酸二阶导数光谱A b s .A b s .图6 酪氨酸(黄绿)与色氨酸三阶导数光谱图7 酪氨酸(黄)与色氨酸四阶导数光谱本实验欲测得样品色氨酸的浓度,因此可选取酪氨酸导数光谱为0,且色氨酸导数光谱可取到接近极大值的点。
观察图像可见各阶导数光谱均有满足上述条件的波长位A b s .A b s .置,考虑到求导次数越多,引入误差越大、精确度越低(峰高越低),我们选择一阶导数光谱进行数据处理。
λmax =221.6nm ①标准曲线的绘制 取之前的一系列浓度的标准样品的光谱,做一阶导数,得到其在221.6nm 出的dA/d λ数值:Y = A + B * XParameter Value Error------------------------------------------------------------ A -2.38095E-4 0.00368 B -0.07479 6.08332E-4------------------------------------------------------------ R SD N P------------------------------------------------------------ -0.99987 0.00509 6 <0.0001A b s .图8 色氨酸标准曲线标准曲线方程:dA/dλ=-2.38095×10-4 -0.07479×([Trp]/(mg·L-1))②样品吸光值A x=-0.737,代入计算得样品色氨酸浓度为9.851mg·mL-1六、思考题1. 本实验是采用紫外吸收光谱中最大吸收波长进行测定的,是否可以在波长较短的吸收峰下进行定量测定,为什么?理论上,吸光度在任意波长处都与浓度呈正比,只要满足待测物不被干扰,可以选择任意波长处测定。
但一般选择吸收峰处,因为此处吸光度最大,测量误差小。
2. 被测物浓度过大或过小对测量有何影响? 应如何调整? 调整的依据是什么?浓度过大会超过工作曲线线性范围,浓度过小测量误差会增大。
如果浓度不在线性范围内,要调整待测物浓度,比如稀释或浓缩使其落在线性范围内。
或者也可以选择其他合适波长处测量(浓度高时)。
3. 思考紫外-可见分光光度法应用于蛋白质测量的依据,并设计相应的实验方案,测定奶粉中蛋白质的含量。
双缩脲试剂与蛋白质形成紫色络合物,在540nm处有吸收峰,吸收强度与蛋白质浓度呈正比,而与蛋白质分子量和氨基酸组成无关。
实验方案: 通过样品3描找出最大吸收峰波长,然后配制奶粉蛋白质标样并作出工作曲线,依据工作曲线和测出的奶粉样本吸光度可以求出奶粉蛋白质含量。
七、实验总结1. 定性分析:由图3可知: 苯丙氨酸,酪氨酸,色氨酸吸收峰波长依次增大,摩尔吸光系数依次增大。
解释如下:在紫外-可见光区域内能发生跃迁的原子团叫生色团,如各种不饱和键,而且吸收峰波长和摩尔吸光系数随共轭程度增加而增大。
不能发生跃迁但和生色团相连可以增大吸收峰波长,增强吸收强度的原子团叫助色团,如羟基,氨基,烷氧基,巯基,卤素等。
图9 三种氨基酸共轭体系三种氨基酸均具有苯环、吲哚环等大的不饱和基团,其中具有吲哚基团的色氨酸的不饱和键数量及其面积最大,故发生红移,具有最大的吸收波长,大于苯丙氨酸和酪氨酸的波长(苯丙氨酸有4 个共轭双键,而色氨酸有5 个共轭双键); 而酪氨酸中的羟基存在给电子共轭效应,其相对苯丙氨酸发生了红移,最大吸收波长也大于苯丙氨酸。
从共轭角度看,体系的共轭度增强,波长红移。
对于吸收强度,因为共轭体系J一t*跃迁所产生的吸收带的吸收强度大,摩尔吸收系数emax-10000L.moll.cm:1,.三种氨基酸均有I- n*跃迁,而酪氨酸还有n- J*跃迁(不过这种跃迁的吸收强度小),所以最大吸收峰处的吸收强度苯丙氨酸较小,但总体差别不大,2. 实验总结紫外吸收光谱法是化学与材料学科制备表征物相的基本表征手段之一。
实验原理较简单,操作也较轻松通过紫外吸收光谱法定性测出了氨基酸的最大吸收波长,定量分析了氨基酸的浓度。
下面是本实验的一些经验教训与体会:(1) 标准溶液一定要配制准确,保证工作曲线上的点在一条直线上;(2) 测量时比色皿要用蒸馏水和待测溶液润洗,否侧会出现较大偏差;(3) 在测量前应将机器预热半小时,用蒸馏水校零后再开始测量;(4) 紫外吸收法有许多优点: 方法操作简便、迅速、不需要复杂和昂贵的设备,不消耗样品,测定后仍能回收使用,低浓度的盐和大多数缓冲溶液不干扰测定; 但缺点是紫外区干扰物质多: 且对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定的误差;。