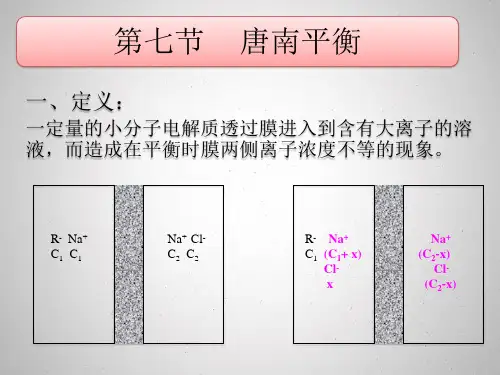
相平衡和化学平衡
- 格式:doc
- 大小:155.00 KB
- 文档页数:4


热力学中的相平衡与相变的条件热力学是一门研究物质宏观状态及其变化规律的学科。
在热力学中,相平衡和相变是两个重要的概念。
相平衡是指在一定条件下,系统内各个不同相的物质所处的状态达到了平衡。
在相平衡状态下,系统内各相的温度、压力等物理性质是相等的。
相平衡是热力学中最基本的概念之一,对于理解物质的相变过程和物质的宏观性质变化具有重要意义。
那么,什么是相变呢?相变是指物质由一种相转变为另一种相的过程。
常见的相变包括固-液相变(熔化)、液-气相变(汽化)、固-气相变(升华)以及反向相变等。
相变过程中,物质的物理性质会发生明显的变化,如体积、密度、热容等。
相平衡和相变之间有着密切的联系。
相平衡是指在物质不发生相变的条件下,系统内各相之间的平衡状态。
换句话说,当系统达到相平衡时,各相之间的物质变化已经结束,不再发生相变。
而当系统处于相平衡的边缘时,只需微小的变化便能引发相变。
那么,相平衡和相变的条件是什么呢?首先,相平衡的条件之一是热平衡。
即系统内各相之间的温度必须相等。
这是因为温度是物质内能的一种度量,不同相之间的温度差异会导致能量的传递和转化,从而引发相变。
只有温度相等,才能使各相之间的能量变化趋于平衡,从而达到相平衡状态。
同时,相平衡的另一个条件是力学平衡。
即系统内各相之间的压力必须相等。
压力是物质分子的碰撞和相互作用产生的结果,不同相之间的压力差异会导致物质分子的运动和排列发生变化,从而引发相变。
只有压力相等,才能使各相之间的物质运动和排列达到平衡,从而形成相平衡状态。
此外,相平衡还要求系统处于化学平衡。
化学平衡是指物质内部各组分之间的浓度或活性系数达到了稳定的状态。
不同相之间的化学成分差异会导致物质的化学反应和转化,从而引发相变。
只有化学成分相等,才能使各相之间的化学反应和转化趋于平衡,从而实现相平衡。
相变的条件与相平衡存在一定的区别。
相变的条件主要与温度和压力的变化相关。
以固体与液体相变为例,当温度达到固液平衡点(熔点)时,固体会开始熔化为液体;而当温度降低到液固平衡点时,液体会开始凝固为固体。



热力学平衡判据热力学平衡是研究物质在热力学条件下是否达到平衡状态的一个重要概念。
在热力学中,物体处于平衡状态时,各种宏观性质不随时间变化,各个部分之间的各种宏观性质也相等。
因此,热力学平衡判据是用来判断系统是否达到平衡状态的依据。
热力学平衡判据有以下几个方面:1. 热平衡判据:在热力学平衡状态下,物体的温度是均匀分布的。
如果物体内部存在温度差异,则说明系统没有达到热平衡。
热平衡是热力学平衡的基本要求之一。
2. 力学平衡判据:在热力学平衡状态下,物体内部的所有力相互平衡,即受力和合力为零。
如果物体存在未平衡的力,则系统没有达到力学平衡。
3. 相平衡判据:在热力学平衡状态下,物体的各个相之间处于平衡。
相平衡是指物质的各个相之间的物质交换和能量交换达到平衡。
如果物体的不同相之间存在物质或能量的不平衡,系统就没有达到相平衡。
4. 化学平衡判据:在热力学平衡状态下,化学反应达到平衡。
化学平衡是指化学反应的反应物和生成物之间的浓度或活性之间达到动态平衡。
如果化学反应没有达到平衡,系统就没有达到化学平衡。
5. 熵增准则:在热力学平衡状态下,系统的总熵是最大的。
熵增准则是热力学第二定律的表述之一。
如果系统的总熵减小或保持不变,说明系统没有达到平衡状态。
以上是热力学平衡判据的几个方面,通过判断热平衡、力学平衡、相平衡、化学平衡和熵增准则的达成与否,可以判断一个系统是否达到平衡状态。
热力学平衡是研究物质在热力学条件下的状态变化的基础,也是研究其他热力学性质和过程的前提。
热力学平衡判据的应用十分广泛。
在化工、材料科学、环境科学等领域中,研究物质的平衡状态对于设计和优化过程具有重要意义。
例如,在化工生产中,通过研究反应体系的化学平衡和相平衡,可以确定最佳反应条件和产物纯度。
在材料科学中,研究材料的热平衡和力学平衡,可以揭示材料的稳定性和性能。
在环境科学中,研究大气和水体的热平衡和化学平衡,可以评估环境污染和气候变化的影响。


第4章相平衡一、填空题1.碳酸钠和水可形成三种化合物:Na2CO3.H2O(s), Na2CO3.7H2O(s), Na2CO3.10H2O(s)。
在100kPa下,能与碳酸钠水溶液、冰平衡共存的含水盐有种,这种(或这些)含水盐是。
(1, Na2CO3.10H2O(s))2.碳在高温下还原氧化锌达到平衡后,体系中有ZnO(s),C(s),Zn(g),CO(g)和CO2(g)五种物质存在,已知存在如下两个独立的化学反应:ZnO(s)+C(s)=Zn(g)+CO(g)2CO(g)=CO2(g)+C(s)则Zn(g),CO(g)和CO2(g)的平衡压力P Zn(g),P CO(g)和P CO2(g)之间的关系为,组分数,相数,自由度数,举出独立变量如下。
(P Zn(g)=P CO(g)+2P CO2(g),C=2, P=3, f=1)3.将固体NH4Cl(s)放入真空容器中,在某温度下达到分解平衡时NH4Cl(s)=NH3(g)+HCl(g)体系的组分数为,相数为,自由度数为。
(1,2,0)4.盐AB(s)与H2O可以形成以下几种稳定水合物: AB.H2O(s),2AB.5H2O(s),2AB.7H2O(s)和AB.6H2O(s),这个盐水体系的组分数为( ),有( )个低共熔点,最多可有( )相同时共存。
(2, 5,3)5.有完全互溶的双液系统A-B的沸点-组成图如下:(1) 当深度为X1的溶液在封闭系统中恒压加热是,溶液的泡点(开始沸腾)的温度为,露点(液相完全消失)的温度为。
(2)指出:当系统分别处于Q点和Q’点所示的状态时,系统的状态的相同之处是,不同之处是。
(3) M点的自由度数f= 。
((1) T M, T N; (2) 所处的T,P相同;气液两相的组成y B,x B不相同;达两相平衡时,汽液相的相对量不同;(3) f=1)6.有理想气体反应:A(g) +2B(g) → C(g)在等温和总压不变的条件下进行,若原料气体中A与B的物质的量之比为1:2,达平衡时系统的组分数C=,自由度数f=。


化学平衡与相平衡的差异
化学平衡状态是指在一定条件下,当一个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态。
化学平衡状态具有逆,等,动,定,变、同六大特征。
1、逆:化学平衡研究的对象就是可逆反应。
2、等:平衡时,正、逆反应速率相等,即v正=v逆。
3、颤抖:均衡时,反应仍在展开,就是动态平衡,反应展开至了最大限度。
4、定:达到平衡状态时,反应混合物中各组分的浓度保持不变,反应速率保持不变,反应物的转化率保持不变,各组分的含量保持不变。
5、变小:化学平衡跟所有的动态平衡一样,就是有条件的,暂时的,相对的.,当条
件发生变化时,平衡状态就可以被毁坏,由均衡变成不均衡,再在代莱条件下创建崭新均衡,即为化学平衡出现了移动。
6、同:一定条件下化学平衡状态的建立与反应的途径无关。

第4章相平衡一、填空题1.碳酸钠和水可形成三种化合物:(s), (s), (s)。
在100kPa下,能与碳酸钠水溶液、冰平衡共存的含水盐有种,这种(或这些)含水盐是。
(1, (s))2.碳在高温下还原氧化锌达到平衡后,体系中有ZnO(s),C(s),Zn(g),CO(g)和CO2(g)五种物质存在,已知存在如下两个独立的化学反应:ZnO(s)+C(s)=Zn(g)+CO(g)2CO(g)=CO2(g)+C(s)则Zn(g),CO(g)和CO2(g)的平衡压力P Zn(g),P CO(g)和P CO2(g)之间的关系为,组分数,相数,自由度数,举出独立变量如下。
(P Zn(g)=P CO(g)+2P CO2(g),C=2, P=3, f=1)3.将固体NH4Cl(s)放入真空容器中,在某温度下达到分解平衡时NH4Cl(s)=NH3(g)+HCl(g)体系的组分数为,相数为,自由度数为。
(1,2,0)4.盐AB(s)与H2O可以形成以下几种稳定水合物: (s),(s),(s)和(s),这个盐水体系的组分数为( ),有( )个低共熔点,最多可有( )相同时共存。
(2, 5,3)5.有完全互溶的双液系统A-B的沸点-组成图如下:(1) 当深度为X1的溶液在封闭系统中恒压加热是,溶液的泡点(开始沸腾)的温度为,露点(液相完全消失)的温度为。
(2)指出:当系统分别处于Q点和Q’点所示的状态时,系统的状态的相同之处是,不同之处是。
(3) M点的自由度数f= 。
((1) T M, T N; (2) 所处的T,P相同;气液两相的组成y B,x B不相同;达两相平衡时,汽液相的相对量不同;(3) f=1)6.有理想气体反应:A(g) +2B(g) →C(g)在等温和总压不变的条件下进行,若原料气体中A与B的物质的量之比为1:2,达平衡时系统的组分数C=,自由度数f=。
当温度一定时,增大压力则k0(填增大、减小或不变),平衡将移动(填向左、向右或不)。
物理化学习题三《相平衡、化学势与化学平衡》部分一 判断题1、二组分完全互溶双液系理想溶液,若P A *> P B *则Y A <X A ( ) 2、等温等压条件下,0>=∆∑BB B mr u v G 的化学反应一定不能进行。
( ) 3、一个含有K +、Na +、NO 3-及SO 42-离子的不饱和水溶液,其组分数K 为4。
( ) 4、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
( )5、在水的三相点,物种数S 和组分数C 相等,都等于1,自由度数等于F=0。
( )6、定温、定压及W /=0时,化学反应达平衡,反应物的化学势之和等于产物的化学势之和。
( ) 7、由CaCO 3(s)、CaO(s)、BaCO 3(s)、及CO 2(g )构成的平衡物系的自由度为0。
( ) 8、I 2(s )= I 2(g )平衡共存,因S = 2, R = 1, R /= 0所以C = 1。
( ) 9、对于放热反应C B A +=2,提高转化率的方法只能降低温度或减小压力。
( )10、下列反应的平衡常数0K 为22CO O C =+为01k ;222CO O CO =+为02K ;CO O C =+221为03K ,则三个平衡常数间的关系为:020103/k k k =。
( )11、某化学反应00<∆m r H ,00<∆m r S ,则反应的标准平衡常数10>K ,且随温度升高而减小。
( )12、反应)()()()(222323g CO g O H s CO Na s NaHCO ++=的平衡常数p K 与分解压力P 的关系为P/2。
( )13、反应)()(2)(42g CH g H C →+石墨,在873K 时的0m r H ∆=-8805.23J·mol -1,减小H 2的压力,可获得更大的平衡产率。
( )14、二元溶液中A 组分若在某浓度区间内服从拉乌尔定律,B 组分也必在该浓度区间内服从拉乌尔定律。
物理化学习题二《相平衡、化学势与化学平衡》部分一 判断题1、二组分完全互溶双液系理想溶液,若P A *> P B *则Y A <X A ( ) 2、等温等压条件下,0>=∆∑BB B mru v G的化学反应一定不能进行。
( )3、一个含有K +、Na +、NO 3-及SO 42-离子的不饱和水溶液,其组分数K 为4。
( ) 4、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
( )5、在水的三相点,物种数S 和组分数C 相等,都等于1,自由度数等于F=0。
( )6、定温、定压及W /=0时,化学反应达平衡,反应物的化学势之和等于产物的化学势之和。
( ) 7、由CaCO 3(s)、CaO(s)、BaCO 3(s)、及CO 2(g )构成的平衡物系的自由度为0。
( ) 8、I 2(s )= I 2(g )平衡共存,因S = 2, R = 1, R /= 0所以C = 1。
( ) 9、对于放热反应C B A +=2,提高转化率的方法只能降低温度或减小压力。
( )10、下列反应的平衡常数0K 为:22CO O C =+为01k ;222CO O CO =+为02K ;CO O C =+221为03K ,则三个平衡常数间的关系为:020103/k k k =。
( ) 11、某化学反应00<∆m r H ,00<∆m r S ,则反应的标准平衡常数10>K ,且随温度升高而减小。
( )12、反应)()()()(222323g CO g O H s CO Na s NaHCO ++=的平衡常数p K 与分解压力P 的关系为P/2。
( )13、反应)()(2)(42g CH g H C →+石墨,在873K 时的0m r H ∆=-8805.23J·mol -1,减小H 2的压力,可获得更大的平衡产率。
( )14、二元溶液中A 组分若在某浓度区间内服从拉乌尔定律,B 组分也必在该浓度区间内服从拉乌尔定律。
( )15、理想溶液中,溶剂服从亨利定律,溶质服从拉乌尔定律。
( ) 二、选择题1.下列化学势是偏摩尔量的是 。
A . ⎪⎪⎭⎫⎝⎛∂∂n F B n CV T ,, B. ⎪⎪⎭⎫⎝⎛∂∂n G B n CP T ,,C .⎪⎪⎭⎫⎝⎛∂∂n U B n CV S ,, D .⎪⎪⎭⎫⎝⎛∂∂n H B n CP S ,,2、如右图所示,当水处在三相点平衡时,若系统发生绝热膨胀,水的相态将如何变化? A.气相、固相消失,全部变成液态; B.气相、液相消失,全部变成固态; C.液相消失,固相、气相共存; D.固相消失,液相、气相共存3.已知718K 时, )(2s O Ag 的分解压力20974.3KPa ,则此时分解反应 )(21)(2)(22g O s Ag s O Ag +=的 m r G ∆为kJ/mol.A. –217.2B. –15.92C. –19.73D. –31.834.冬季建筑施工中,为了保证施工质量,常在浇注混凝土时加入盐类,其主要作用是 。
A .增加混凝土的强度; B .防止建筑物被腐蚀; C .降低混凝土的固化温度; D .吸收混凝土中的水分。
5、已知纯A 和纯B 的饱和蒸气压P A *<P B *,且A 和B 所组成的体系具有最高恒沸点。
向A 中 不断加入B ,则溶液的蒸气压 A.不断增大 B.不断减小 C.先增大后减小 D.先减小后增大6、下图为气液平衡相图,图中M 点 A.代表压力为p 1时气相的组成 B.代表压力为p 1时液相的组成C.是压力为p 1时气相中物质B 的物质的量D.是压力为p 1时液相中物质B 的量7.温度为T 时,纯液体A 的饱和蒸汽压为P A *,化学势为μA *,在1 p ⊕时,凝固点为0f T ,向A 中加入少量溶质形成稀溶液,该溶质是不挥发的,则p A 、μA 、T f 的关系是 。
A .p A *<p A ,μA *<μ A , 0f T <T f ; B .p A *>p A ,μA *<μ A , 0f T <T f ; C .p A *>p A ,μA *<μ A , 0f T >T f ; D .p A *>p A ,μA *>μ A , 0f T >T f 。
8.已知某温度下反应 H 2O(g)=H 2(g)+21O 2(g)的Θ1K 和反应 CO 2(g)=CO(g)+21O 2(g)的 Θ2K ,则反应的CO(g)+ H 2O(g)= CO 2(g) +H 2(g)的Θ3K 为 .A. Θ3K = Θ1K + Θ2KB. Θ3K = Θ1K Θ2K C. Θ3K = Θ2K / Θ1K D. Θ3K = Θ1K / Θ2K9.在α、β两相中含A 、B 两种物质,当达平衡时,正确的是 。
A . aB a A u u = B .B A a A u u =C . BB a A u u =10.水煤气发生炉中共有C (s ),H 2O (g ),CO(g), CO 2(g)及H 2(g)五种物质,它们之能发生下述反应:CO 2(g )+ C(s) = 2CO(g) CO 2(g) + H 2(g) = CO(g) + H 2O(g),H 2O(g) + C(s) = H 2(g) + CO(g) 则此体系的组分数、自由度数为 。
A .5;3 B .4;3 C .3;3 D .2;211.物质A 与B 可形成低共沸混合物E ,已知纯A 的沸点小于纯B 的沸点,若将任意比例的A+B 混合物在一个精馏塔中精馏,在塔顶的馏出物是 。
A .纯A B .纯B C .低共沸混合物 D .都有可能12.在某一温度下,以真空容器中,引入(NH 4)2CO 3固体,将发生反应: (NH 4)2CO 3(s)=2NH 3(g)+CO 2(g)+H 2O(g),其标准平衡常数为K。
设各种气体都是理想气体,总压力为p,欲使固体停止分解,K必须 .A. >1/8B. >1/64C. < 1/8D. <1/6413.已知水的三相点温度为273.16K,压力为611Pa,若将已经冻结的蔬菜放入不断抽气的真空容器中,使蔬菜中的冰升华来生产干燥蔬菜,则容器的T,P 范围是 。
A .T>273.16K,P>611Pa B .T>273.16K,P<611Pa C .T<273.16K,P<611Pa D .T<273.16K,P>611Pa 14、克拉佩龙方程表明A.两相平衡时的平衡压力随温度而变化的变化率B.任意状态下压力随温度的变化率C.它适用于任何物质的两相平衡D.以上说法都不对15.在298K 条件下,)(21)(2)(22g O s Ag s O Ag +=,a K =Θ,则)(2s O Ag 的分解压力为A.ΘP a / B. Θ⋅P a C. Θ⋅P a 2D. Θ⋅P a三、填空题1.理想溶液混合时,∆mix V , ∆mix S , ∆mix G , ∆mix H (填 >0、<0 或 =0)。
2. NH 4Cl(s)分解反应NH 4Cl(s) =NH 3(g)+HCl(g),在700K 时分解压力为600kPa ,那么该反应的标准平衡常数K θ为____________。
(体系中气体视为理想气体)3.在一定的温度及压力下,某物质液汽两相达平衡,则两相的化学势μB (l)与μB (g)___;若维持压力不变,升高温度,则μB (l)和μB (g)都____;但μB (l)比μB (g)___ (填 >、< 或 =)。
4.理想溶液中任意组分B 的化学势:μB =_______________。
5. 298K 、101.325kPa ,有两瓶萘的苯溶液,第一瓶为2升,溶有0.5mol 萘,第二瓶为1升,溶有0.25mol 萘,若以μ1和μ2表示两瓶中萘的化学势,则它们的关系为___。
6. 在25℃时,A ,B ,C 三种物质(不发生化学反应)所形成的溶液与固相A 和B 、C 组成的气相呈平衡,则体系的自由度 f = 。
A ,B ,C 三物质组成的体系能平衡共存的最大相数是 。
7.在石灰窑中,分解反应CaCO 3(s)=CaO(s)+CO 2 (g)已平衡,则该体系的组分数C= ,相数P = ,自由度数f = 。
8.CaCO 3(s),CaO(s),BaCO 3(s),BaO(s)和CO 2(g)达到平衡时,此体系的相数是 ,组分数是 ,自由度数是 。
9.纯液体在其正常沸点下沸腾变为气体,下述各量中增加的量是 ,减少的量是 ,不变的量是 。
A .蒸气压B .摩尔气化热C .摩尔熵D .摩尔焓E .吉布斯自由能F .温度G .外压H .摩尔体积I .亥姆霍兹自由能10.已知在1120℃下,反应:FeO(s)+H 2(g)=H 2O(g)+Fe(s), Θ1K =0.852 2H 2O(g)=2H 2(g)+O 2(g), Θ2K =3.4×10-13则在相同温度下,反应FeO(s) 4= Fe(s) +1/2 O 2(g)的标准平衡常数 Θ3K =__________11. 由反应0=∑BB Bu v,知化学反应的平衡条件是______________。
12.一个含有K +,Na +,NO 3-,SO 42-,四种离子的不饱和水溶液,其组分数为 。
13.已知温度T 时,液体A 的蒸气压为13330Pa ,液体B 的蒸气压为6665Pa ,设A 与B 构成理想液体混合物,则当A 在溶液中的摩尔分数0.5时,其在气相中的摩尔分数为 。
14. 某反应 0=∆Θm r G ,则该反应的标准平衡常数KΘ为____________。
15. Cu(s)+1/2 O 2(g)=CuO(s),已知 1130),,298(-Θ⋅-=∆mol KJ s CuO K G m f ,则在298K ,该反应的K Θ= __________。
四、简答题1、标准状态下的化学反应:aA(g)+bB (g )=dD(g)+eE(g)的u B ☉应指什么?若本题中反应物和产物都是气体,则反应体系的总压力为多少?2、在一个真空容器中,分别使NH4HS(s)和CaCO3(s)加热分解,两种情况的独立组分数是否都等于1?3、指出下列体系的自由度,并说明变量是什么?(1)在101325Pa的压力下,水与水蒸气达平衡;(2)液态水和水蒸气达平衡;(3)在101325Pa的压力下,I2在液态水和CCl4中的分配已达平衡(无固体碘存在);(4)NH3(g)、H2(g)、N2(g)已达平衡。