【清华】3蛋白质的三维结构习题昶公版
- 格式:doc
- 大小:119.00 KB
- 文档页数:6




3蛋白质的三维结构习题1. 含有685个氨基酸残基的单一一条多肽链的蛋白质的近似相对分子质量是多少?2. 氨基酸的定量分析表明牛血清白蛋白含有0.58%的色氨酸(色氨酸的相对分子质量为204)。
(a)试计算牛血清白蛋白的最小分子量(假设每个蛋白分子只含有一个色氨酸残基);(b)凝胶过滤测得的牛血清白蛋白的相对分子质量为70 000,试问血清白蛋白分子含有几个色氨酸残基?3. 胃液(pH=1.5)的胃蛋白酶的等电点约为1,远比其他蛋白质低。
试问等电点如此低的胃蛋白酶必须存在大量的什么样的官能团?什么样的氨基酸才能提供这样的基团?4. 组蛋白是真核细胞的核蛋白,它们与具有很多磷酸基团的脱氧核苷酸紧密结合在一起,组蛋白的等电点非常高,约为10.8,试问组蛋白含有大量的什么样的氨基酸?这些氨基酸残基靠什么方法使得组蛋白与DNA紧密结合?5 画出三肽谷胱甘肽的化学结构式,其肽健形成中有什么特点?谷胱甘肽的还原型与氧化型之间有什么区别?6. 已知某蛋白是由一定数量的链内二硫键连接的两个多肽链组成的。
1.00g该蛋白样品可以与25.0mg还原型谷胱甘肽(GSH,相对分子质量MW=307)反应。
(a)该蛋白的最小相对分子质量是多少?(b)如果该蛋白的真实相对分子质量为98 240,那么每个分子中含有几个二硫键?(c)多少毫克的巯基乙醇(MW=78.0)可以与起始的1.00g该蛋白完全反应?7. 理论上讲一个蛋白的结构几乎是无穷的,解释是什么原因使得极大地限制了这种可能性。
8. 下面是一个三肽的立体结构示意图,(a)标出三肽中的Cα、肽健和用方框将每个肽单位所涉及到的原子都包括在内。
(b)为什么C=O不能绕着肽健旋转?(c)肽健可以是顺式或是反式构型,图中的肽健构型属于哪种构型?(d)肽平面可以绕着图中什么健旋转?9. Pro很少出现在α-螺旋结构中,但常出现在β-转角中,这是什么道理?10. 羊毛衫等羊毛制品在热水中洗变长,然后在电干燥器内干燥,又收缩,丝制品进行同样处理,却不收缩。


第四章蛋白质的三维结构一、选择题⒈维持蛋白质二级结构的主要化学键是:()A、盐键;B、疏水键;C、二硫键;D、氢键;E、范德华力⒉蛋白质的构象特征主要取决于:()A、氨基酸的组成、顺序和数目;B、氢键、盐键、范德华力和疏水作用;C、温度、离子强度和pH等环境条件;D、肽链间及肽链内的二硫键;E、各氨基酸之间的肽链⒊在一个肽平面中含有的原子数为:()A、4;B、5;C、6;D、7;E、8⒋具有四级结构的蛋白质的特征是:()A、分子中必定含有辅基;B、含有两条或两条以上的多肽链;C、每条多肽链都具有独立的生物学活性;D、依靠肽链维持结构的稳定性;E、以上都不是⒌下列有关α-螺旋的叙述哪个是错误的?A、分子内的氢键使α-螺旋稳定;B、减弱R基团间不利的相互作用使α螺旋稳定;C、疏水作用使α螺旋中断;D、在某些蛋白质中,α螺旋是二级结构中的一种类型;E、脯氨酸和甘氨酸残基使α螺旋中断⒍下列有关β折叠的叙述哪个是错误的?()A、球状蛋白质中无β折叠的结构;B、β折叠靠链间氢键而稳定;C、它的氢键是肽链的C=O和N-H间形成的;D、α-角蛋白可以通过加热处理而转变成β折叠的结构;E、β-折叠有平行的β折叠和反平行的β折叠⒎具有四级结构的蛋白质特征是:()A、分子中必定含有辅基;B、含有两条或两条以上的肽链;C、每条多肽链都具有独立的生物学活性;D、依靠肽链维持结构的稳定性;E、以上都不是⒏具有四级结构的蛋白质是:()A、胰岛素;B、核糖核酸酶;C、血红蛋白;D、肌红蛋白;E、胰凝乳蛋白⒐在四级结构的蛋白质分子中,每个具有三级结构的多肽链是:()A、辅基;B、辅酶;C、亚基;D、寡聚体;E、肽单位⒑关于蛋白质亚基的描述,其中正确的是:()A、一条多肽链卷曲成螺旋结构;B、两条以上多肽链卷曲成二级结构;C、两条以上多肽链与辅基与辅基结合成蛋白质;D、每个亚基都有各自的三级结构;E、以上都是正确⒒胶原蛋白组成中出现的不寻常氨基酸是()A、乙酰氨基酸;B、羟基氨基酸;C、甲基氨基酸;D、D赖氨酸⒓一种非常稳定的小分子量蛋白质的化学结构中,经常是()A、含有大量的二硫键;B、含有丰富的甘氨酸;C、有较多络合金属离子;D、含有疏水氨基酸⒔形成稳定的肽链空间结构,一个重要原因是肽键中的四个原子以及和它相临的两个α碳原子处于()A、不断绕动状态;B、可以相对自由旋转;C、同一平面;D、随不同外界环境而变化的状态⒕在寡聚蛋白质中,亚基间的立体排布、相互作用以及接触部位间的空间结构称之为()A、三级结构;B、缔合现象;C、四级结构;D、变构现象⒖下列哪种方法是目前研究蛋白质分子空间结构最常用的()A、圆二色性;B、荧光光谱;C、X光衍射;D、核磁共振二、判断是非⒈从热力学上讲最稳定的蛋白质构象自由能最低。


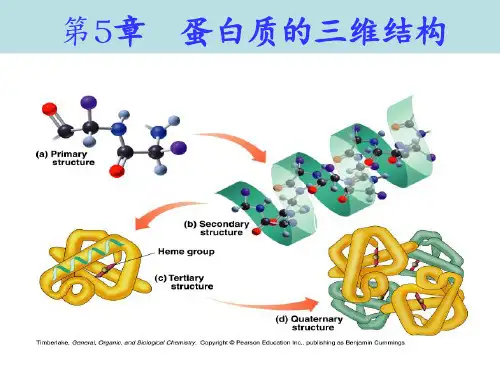
蛋白质的三维结构考点整理●蛋白质的四级结构●蛋白质的一级结构:蛋白质一级结构是指氨基酸如何连接成肽链及氨基酸在肽链中的序列。
在一级结构中,致公认肽键是主要连接键, 而多肽链无疑是一级结构的主体。
●蛋白质的二级结构:蛋白质的二级结构是指蛋白质分子中多肽链本身的折叠方式。
多肽链的二级结构主要有 a 螺旋结构,其次是β 折叠结构,还有β 转角,Ω环和无规卷曲。
在二级结构中有氢键参加以维持其稳定性。
●蛋白质的三级结构:蛋白质的三级结构是指多肽链在二级结构的基础上进一步盘绕、折叠成复杂的空间结构,包括肽链中一切原子的空间排列方式,即原子在分子中的空间排列和组合的方式。
维系三级结构的力有疏水作用、氢键、范德华力、离子键。
另外,二硫键在某些蛋白质中也起非常重要的作用。
●蛋白质的四级结构:蛋白质的四级结构是指蛋白质的亚基聚合成大分子蛋白质的方式。
维系四级结构的力有疏水作用、氢键、范德华力、离子键。
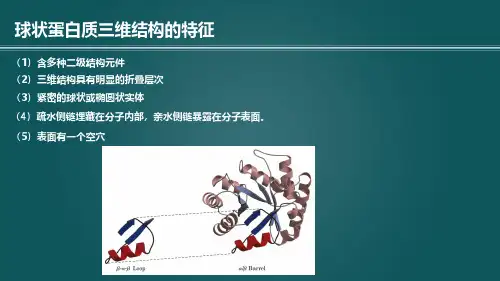
●二级结构●肽平面:由于肽键不能自由旋转,形成肽键的四个原子(C、O、N、H)和与之相连的两个α-碳原子共处在一个平面上,形成酰胺平面,也称肽键平面或肽平面。
●α螺旋:●是蛋白质中最常见的一种二级结构,肽链主链骨架围绕中心轴盘绕成螺旋状,称为a 螺旋。
在 a 螺旋结构中,每 3.6 个氨基酸残基螺旋上升一圈,每圈的高度为0.54nm。
每个氨基酸残基沿轴上升 0.15nm,沿轴旋转 100°。
在同一肽链内相邻的螺圈之间形成氢键,氢键的取向几乎与中心轴平行,氢键是由第 n 个氨基酸残基的α羰基氧与第 n+4 个氨基酸残基的α氨基氢之间形成的。
α螺旋的稳定性靠氢键来维持。
●β折叠●是蛋白质中常见的一种二级结构, β 折叠结构的肽链几乎是完全伸展的,邻近两链以相同或相反方向平行排列成片状结构。
两个氨基酸残基之间的轴心距为0.35nm。
β 折叠结构的氢键是由邻近两条肽链中一条的 CO-基与另一条的-NH基之间所形成。
●β-转角:●在蛋白质的多肽链中经常出现 180°的回折,在肽链回折处的结构称为β 转角,也称β 弯曲,或称发夹结构。
蛋白质的三维结构习题2004010310 丁昶环415 8 22? 24 281. 含有685个氨基酸残基的单一一条多肽链的蛋白质的近似相对分子质量是多少?答:128*685-684*18=753682. 氨基酸的定量分析表明牛血清白蛋白含有0.58%的色氨酸(色氨酸的相对分子质量为204)。
(a)试计算牛血清白蛋白的最小分子量(假设每个蛋白分子只含有一个色氨酸残基);(b)凝胶过滤测得的牛血清白蛋白的相对分子质量为70 000,试问血清白蛋白分子含有几个色氨酸残基?答:(a)最小分子量为204/0.0058=35172。
(b)70000/35172=2,所以有两个色氨酸残基。
3. 胃液(pH=1.5)的胃蛋白酶的等电点约为1,远比其他蛋白质低。
试问等电点如此低的胃蛋白酶必须存在大量的什么样的官能团?什么样的氨基酸才能提供这样的基团?答:存在大量的羧基。
谷氨酸和天冬氨酸能提供这样的基团。
4. 组蛋白是真核细胞的核蛋白,它们与具有很多磷酸基团的脱氧核苷酸紧密结合在一起,组蛋白的等电点非常高,约为10.8,试问组蛋白含有大量的什么样的氨基酸?这些氨基酸残基靠什么方法使得组蛋白与DNA紧密结合?答:含有大量的含碱性基团的氨基酸。
可能有以下原因:1、这些氨基酸的碱性基团与脱氧核苷酸的磷酸基团形成酯键,使得二者紧密结合。
2、碱性基团和磷酸基团带不同电荷,之间的离子相互作用时二者紧密结合。
5画出三肽谷胱甘肽的化学结构式,其肽健形成中有什么特点?谷胱甘肽的还原型与氧化型之间有什么区别?答:甘氨酸的γ羧基与半胱氨酸的α氨基形成肽键,而不是用α羧基。
两个还原型谷胱甘肽的巯基脱氢缩合成二硫键形成一个氧化型的谷胱甘肽。
6. 已知某蛋白是由一定数量的链内二硫键连接的两个多肽链组成的。
1.00g该蛋白样品可以与25.0mg还原型谷胱甘肽(GSH,相对分子质量MW=307)反应。
(a)该蛋白的最小相对分子质量是多少?(b)如果该蛋白的真实相对分子质量为98 240,那么每个分子中含有几个二硫键?(c)多少毫克的巯基乙醇(MW=78.0)可以与起始的1.00g该蛋白完全反应?答(a)n (GSH)=0.025/307=8.14e-5 n(二硫键)=2*n(GSH)=1.63e-4 n(蛋白)<= n(二硫键)所以M(蛋白)=1.0/ n(蛋白)>= 1.0/ n(二硫键)=1.0/( 1.63e-4)=6140 最小相对分子质量为6140。
(b)98240/6140=16 含有16个二硫键。
(c)m=8.14e-5*78*1000=6.35(mg)需要6.35mg巯基乙醇7. 理论上讲一个蛋白的结构几乎是无穷的,解释是什么原因使得极大地限制了这种可能性。
答:1、氨基酸只能是L构型2、肽健的双键特性使其不能旋转,所以参与肽键形成的2个原子以及另外4个取代成员:羰基氧原子、酰胺氢原子、以及2个相邻的α-碳原子一共6个原子处于同一平面3、N-Cα键和每一个 Cα-C 键虽然可以自由旋转形成顺式和反式构型,但由于侧链基团之间的立体干扰有利于生成伸展的反式构型,所以蛋白质中几乎所有的肽单位都是反式构型。
4、又由于氢键、疏水相互作用、范德华力、共价交联和离子相互作用等的影响,常见的多肽结构只有α-螺旋(α-helix)和β-折叠(β-sheet)结构两种,再加上空间阻碍使得φ,ψ角受到很大限制以上几种原因(应该还有更多)使得蛋白质的结构受到极大限制。
8.下面是一个三肽的立体结构示意图,(a)标出三肽中的Cα、肽健和用方框将每个肽单位所涉及到的原子都包括在内。
(b)为什么C=O不能绕着肽健旋转?(c)肽健可以是顺式或是反式构型,图中的肽健构型属于哪种构型?(d)肽平面可以绕着图中什么健旋转?答:(a)如上图(b)肽键有40%的双键特性,所以该键不能旋转,导致C=O也无法绕肽键旋转。
(c)反式构型。
(d)N-Cα和Cα-C9. Pro很少出现在α-螺旋结构中,但常出现在β-转角中,这是什么道理?答:Pro为亚氨基酸,形成肽键后将没有酰胺H,无法在α-螺旋中形成氢键10. 羊毛衫等羊毛制品在热水中洗变长,然后在电干燥器内干燥,又收缩,丝制品进行同样处理,却不收缩。
如何解释这两种现象?答:羊毛的主要成分为α角蛋白,多肽链的结构为α螺旋,在热水中肽链充分伸长,多条肽链形成β-折叠结构,所以拉长,干燥后由于某种原因(?)变成卷曲的结构,从而收缩。
丝织品的主要成份为丝心蛋白,多肽链的结构为β-折叠,已经是充分伸长的结构了,所以无法伸长后再弯曲。
11. 人的头发每年以15~20cm的速度生长,头发主要是α角蛋白纤维在表皮细胞里面合成和组装成的“绳子”。
α角蛋白的基本结构单元是α-螺旋。
如果α-螺旋的生物合成是头发生长的限速因素,计算α-螺旋链的肽键以多大的速度(每秒钟)合成才能满足头发每年的生长长度?答:每秒应该生长的长度:0.15/365/86400=4.76e-9m一个氨基酸在螺旋中上升的高度为0.15nm,即1.5e-10mN=4.76e-9/1.5e-10=31.712. 通过烫发使头发成形,从生物化学角度解释烫发的原理。
答:是一个生物化学过程,分三步:1、纤维之间的二硫键被还原2、相邻两条纤维发生错位3、原来不相邻的巯基发生氧化生成新的二硫键13. 跨生物膜的蛋白质通常含有跨膜α-螺旋,膜内部是个高疏水区,你推测哪些氨基酸残基会出现在螺旋中?为什么α-螺旋特别适合存在于膜内的疏水环境?答:脂肪族和芳香族氨基酸,氨基酸的疏水基由于疏水相互作用有聚集在一起的趋势,螺旋结构所占体积较小,有利于氨基酸的聚集,所以说螺旋适合疏水环境。
14. 嗜盐菌可合成膜蛋白视紫红质(相对分子质量为26 000),呈紫色是由于它含有视黄醛。
该蛋白分子凝聚在细胞膜上形成一个“紫色通道”。
X射线分析表明它由7段平行的α-螺旋片段组成,每段都横跨4.5nm厚的细胞膜。
计算能完全跨越细胞膜的每段α-螺旋最少需由多少氨基酸组成?估计视紫红质中,参与跨膜螺旋的蛋白部分占总蛋白的百分比。
答:4.5/0.15*7=210 至少需要210个氨基酸210*128-209*18=23118百分比为23118/26000=88.9%15. 列出维持蛋白三维结构稳定的5种力,并指出每种相互作用涉及的蛋白中的基团。
答:氢键(多肽链骨架和水之间,多肽链骨架和极性侧链之间,两个极性侧链之间以及极性侧链和水之间)、疏水相互作用(疏水基团之间)、范德华力(非极性残基之间)、共价交联(巯基之间)和离子相互作用(任何带有电荷的侧链)16. 分析蛋白质中的Glu、Leu、Tyr和His残基的侧链基团对稳定该蛋白的三维结构的各种力有什么贡献?答:Glu(谷氨酸),含有羧基,属于极性带电基团:氢键,离子相互作用Leu(亮氨酸),侧链为烃基,非极性基团:范德华力,疏水相互作用Tyr(酪氨酸),侧链为对羟基苯基:氢键His(组氨酸),侧链为碱性咪唑环,为极性带电基团:氢键,离子相互作用17. 分析血红蛋白中天冬氨酸94和组氨酸146侧链官能团的离子相互作用力。
假定其他所有条件都保持恒定,下列条件变化时怎样影响此作用力:(a) pH值由7变化到11;(b) pH 值由7变化到3;(c) 两个官能团之间的距离增加了。
答:天冬氨酸的侧链羧基的PKa为3.65,组氨酸的咪唑基的PKa为6.00,PH=7时,羧基基本上全部离子化,咪唑基约有1/11离子化PH=3时,羧基约有84%离子化,咪唑基全部离子化PH=11时,羧基全部离子化,咪唑基基本没有离子化(a)由7到11,作用力减弱(b)由7到3,作用力增强(c)距离增加,由库仑定律知作用力减弱18. 当没有2,3-二磷酸甘油酸(BPG)存在下,血红蛋白的氧饱和曲线与与肌红蛋白相似,这是什么道理?答:2,3-二磷酸-D-甘油酸(2,3BPG)有助于去氧血红蛋白构象形成,促进氧在周围组织的释放。
所以去除BPG后,只需要较低的氧浓度即可使血红蛋白达到饱和,所以曲线左移,与肌红蛋白相似。
19. 相对分子质量为132 000的寡聚蛋白样品660mg在弱碱性条件下用2,4-二硝基氟苯(Sanger试剂)处理,直至化学反应完成,然后用浓硫酸通过加热彻底水解该蛋白的所有肽键。
水解物中发现含有5.5mg的DNP-V al,除此之外,没有其他的2,4-二硝基氟苯衍生物。
(a)解释为什么能用该方法确定寡聚蛋白中多肽链的数目?(b)计算该蛋白质中的多肽链数目。
(c)有什么其他技术可确定该蛋白质中的多肽链是否相同?答:(a)DNFB与氨基以一比一的摩尔比生成DNP氨基酸,所以测出DNP氨基酸的数目即可知道游离氨基的数目,等于肽链的数目。
(b)n(DNP-Val)=0.0055/299=1.84e-5(mol)n(Protein)=0.660/132000=5e-6(mol)N= n(DNP-Val)/ n(Protein)=5有五个肽链(c)丹磺酰氯检测生成的磺胺衍生物苯异硫氰酸酯(PITC)检测生成的PTH-氨基酸20. 已知血红蛋白含0.34%的铁,血红蛋白的最小相对分子质量是多少?实验表明,血红蛋白的相对分子质量是64 500,实际上血红蛋白含有几个铁原子?答:56/0.0034=16470——最小相对分子质量64500/16470=3.91,所以实际上含有4个铁原子21. 从某植物中分离得到一种脯氨酸羟化酶的抑制剂,(a)试解释为什么将该抑制剂喂食给大鼠,会导致其血管变脆,皮肤受损,牙龈出血?(b)人类患维生素C缺乏症时也出现与(a)中类似的症状,试解释之。
答:(a)4-羟脯氨酸是胶原的组成成分之一。
若抑制其合成,将会使胶原合成减少,从而导致上述症状。
(b)原因:维生素C参与胶原蛋白的合成(具体原理不清楚)22. 对蛋白质中自然发生的氨基酸替换的研究有以下结果,试解释每种现象。
(a)丝氨酸的替换可能最不易改变蛋白质的功能;(b)色氨酸的替换可能最易改变蛋白质的功能;(c)Lys→Arg和Ile→Leu这样的替换一般来说对蛋白质的功能基本无影响;答:23. 疯牛病是由正常朊病毒变性产生的异常朊病毒引起的,解释朊病毒,正常和异常朊病毒有什么区别?答:朊病毒:产生疯牛病以及其它相关疾病的一种名叫Prion的小蛋白质正常Prion蛋白含有大量的α螺旋,而病变Prion蛋白含有更多的β折叠24.写出由二氧化碳和水形成碳酸氢根的方程式,并解释H+和CO2在血红蛋白氧合中的作用(Bohr效应)。
答:二氧化碳增加使得氢离子浓度增加,从而使血红蛋白中的几个基团质子化,有利于脱氧血红蛋白的构想形成,,结果p50 增加,氧饱和曲线右移,有利于O2 的释放。