LuminalB型乳腺癌内分泌治疗方案
- 格式:docx
- 大小:19.55 KB
- 文档页数:4


2024乳腺癌常用内分泌治疗药物乳腺癌的内分泌治疗又叫做抗激素治疗,主要是调控患者体内的激素分泌水平,阻止癌细胞接触和利用那些它们生长所需的天然激素(主要是雌激素和孕激素),以达到抑制肿瘤细胞生长的目的。
01内分泌治疗适应症内分泌治疗适用于激素受体(HR)阳性的乳腺癌,具体包括HR阳性HER-2阳性、HR阳性HER-2阴性,后者在乳腺癌亚型占比为60%-70%β其中HR 可分为雌激素受体(ER)和孕激素受体(PR)两种,有一种激素受体免疫组织化学检测的阳性阈值≥1%即为HR阳性,其中ER阳性比例1%-10%判读为弱阳性,但有争议的一点是阳性比例在这个区间时,内分泌治疗获益较小。
表1:2023年CSCO乳腺癌诊疗指南ER结果判读02分子分型根据HR和HER-2的不同,将乳腺癌分为四个亚型,其中内分泌型乳腺癌LuminalA型和LuminalB型,A型比B型对内分泌治疗更敏感,应用内分泌药物疗效更好,但化疗药物获益低。
二者主要有两点不同:一是PR的表达,因为PR是重要的乳腺癌预后指标,CSCO乳腺癌指南将PR20%阳性作为LuminalA型和LuminalB型的临界值;二是Ki-67的表达,它是一种细胞增殖指数,数值越大,就代表细胞增殖快,恶性程度高,预后越差。
它作为一个持续变化的生物标志物,可根据其数值判断是否辅助化疗。
一般认为LuminalB的高表达为Ki-67≥30%,LuminalA的低表达为≤14%o表2:2023年CSCO乳腺癌诊疗指南分子分型HER-2阳性(HR阳性)++任何任何03内分泌治疗常用药物01雌激素受体拮抗剂表3:雌激素受体拮抗剂女性绝经前的雌激素主要由卵巢分泌,绝经后妇女的雌激素70%以上来自肾上腺产生的雄激素前体经芳香化酶作用而生成。
绝经后乳腺癌的癌组织中雌激素主要有癌组织和癌周组织分泌,芳香化酶抑制剂(AI)通过抑制癌组织中的芳香化酶活性,降低雌激素水平达到抑制癌细胞增殖的作用。

luminal b型(her2+)的定义
"Luminal B型(HER2+)" 是乳腺癌的一个分子亚型,通常与癌细胞的特定分子标记相关。
在这个术语中,"Luminal B型" 表示该癌症属于乳腺癌的"Luminal" 亚型之一,而"HER2+" 表示该癌症表达HER2(人类表皮生长因子受体2)蛋白。
这里有一些关键术语的解释:
1.Luminal亚型:乳腺癌的Luminal亚型分为Luminal A型和
Luminal B型,这两者主要根据癌细胞中雌激素受体(ER)和/或孕激素受体(PR)的表达水平以及其他因素来区分。
Luminal B型通常与较高的细胞增殖指数和更侵袭性的特征相关。
2.HER2+:HER2 是一种受体蛋白,它在一些乳腺癌细胞上过
度表达。
HER2过度表达通常与更侵袭性的癌症相关,并且对HER2阳
性(HER2+)的乳腺癌患者而言,可能会选择使用针对HER2的特定治疗方法,例如抗HER2药物。
因此,Luminal B型(HER2+)乳腺癌表示这种癌症属于Luminal B亚型,并且其癌细胞表达HER2蛋白。
这对于确定患者的治疗计划和预后非常重要,因为HER2阳性的乳腺癌通常会得益于针对HER2的靶向治疗。

luminal B型晚期乳腺癌临床病理特征及预后分析郑雅方;贾勇圣;郎荣刚;佟仲生【摘要】目的:探讨luminal B型晚期乳腺癌患者的临床病理特征及预后因素.方法:收集2008年6月至2013年6月天津医科大学肿瘤医院收治的206例luminal B 型晚期乳腺癌患者的临床资料,回顾性分析其临床病理特征及影响预后的因素.结果:206例患者中HER-2阳性型54例(26.2%),HER-2阴性型152例(73.8%).其中HER-2阳性型患者中Ki-67>30%为57.4%(31/54),较HER-2阴性型的55.9%(85/152)高,差异具有统计学意义(P<0.01);HER-2阳性型患者中无病生存期(disease free survival,DFS)<36个月为79.6%(43/54),较HER-2阴性型的65.1%(99/152)高,差异具有统计学意义(P<0.05).206例患者的中位生存期为25(2.1~85.0)个月,是否合并内脏转移、一线解救化疗疗效、是否行解救内分泌治疗是luminal B型晚期乳腺癌患者的独立预后因素(P<0.05).结论:luminal B型晚期乳腺癌患者中,HER-2阳性型中的Ki-67指数比HER-2阴性型更高,且更易在3年内发生复发、转移.合并内脏转移、一线解救化疗时病情进展、未行解救内分泌治疗是影响luminal B型晚期乳腺癌患者不良预后的独立因素.%Objective:To analyze the clinicopathological features and prognostic factors of advanced luminal B-like breast cancer. Meth-ods:The clinicopathological features and prognostic factors of 206 patients with advanced luminal B-like breast cancer treated in our hospital between June 2008 and June 2013 were retrospectively analyzed. Results:Among 206 cases, human epidermal growth factor receptor 2 (HER2) positive subtype was found in 54 cases (26.2%), whereas the negative subtype was found in 152 cases (73.8%). The proportion of Ki-67 >30% in HER-2 positive subtype wassignificantly higher (57.4%; 31/54) than that in HER-2 negative subtype (55.9%; 85/152; P<0.01). The percentage of disease-free survival <36 months in HER-2 positive subtype was dramatically higher (79.6%;43/54) than that in HER-2 negative subtype (65.1%;99/152;P<0.05). The median overall survival of metastasis was 25 (2.1-85.0) months. Multivariate analysis revealed that visceral metastases, first-line salvage chemotherapeutic effect, and palliative endo-crine therapy were the independent predictors of survival in advanced luminal B-like breast cancer (P<0.05). Conclusion:Among pa-tients with advanced luminal B-like breast cancer, HER-2 positive subtype was more commonly diagnosed with higher Ki-67 index, quicker and easier recurrence, and metastasis within three years than HER-2 negative subtype. Visceral metastases, poor effect of first-line salvage chemotherapy, and not receiving palliative endocrine therapy were independent factors of poor prognosis for the survival of advanced luminal B-like breast cancer.【期刊名称】《中国肿瘤临床》【年(卷),期】2017(044)004【总页数】6页(P163-168)【关键词】乳腺癌;分子分型;复发;转移;治疗;预后【作者】郑雅方;贾勇圣;郎荣刚;佟仲生【作者单位】天津医科大学肿瘤医院乳腺肿瘤内科,国家肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心天津市300060;天津医科大学肿瘤医院乳腺肿瘤内科,国家肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心天津市300060;天津医科大学肿瘤医院乳腺肿瘤内科,国家肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心天津市300060;天津医科大学肿瘤医院乳腺肿瘤内科,国家肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心天津市300060【正文语种】中文2011年St.Gallen共识提出,根据雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(HER-2)和细胞增殖标志Ki-67的表达情况,将乳腺癌分为luminal A型、luminal B型、HER-2过表达型和三阴性乳腺癌[1],luminal A 和luminal B型统称为lu⁃minal型。

乳腺癌分子分型及医治选择传统的解剖病理分期(如TNM分期,包括大小、淋巴结转移数量、远处转移情形)关于预测的复发转移价值不可低估,是临床上较成熟的风险评估指标。
但由于是一种异质性,其在组织形态、免疫表型、生物学行为及医治反映上存在着极大的不同,传统病理TNM分期相同的患者对临床医治的反映及预后可能会有专门大不同。
最近几年来,基于DNA微阵列技术和多基因RT-PCR定量检测的方式对进行的分子分型来预测的复发转移风险及其对医治的反映,目前常将基因芯片技术的分子亚型和免疫组织化学结合起来,临床上通常应用ER、PR、HER-2 及Ki-67可将划分为4类分子亚型(见附表)。
由于不同分子亚型的临床医治反映和生存截然不同,研究分子标志及分子分型关于指导临床医治与判定预后有重要意义。
比如临床上比较棘手处置的“三阴”(指ER、PR及HER-2均阴性;Triple-negative breast cancer)的,相当于分子分型的Basal-like型分子表达(特点为基底上皮分子标志物高表达(CK5/6或17,EGFR)和ER或ER相关基因及HER-2或HER-2相关基因低表达),约占全数的10%~15%。
三阴5年生存率不到15%,临床上往往作为一种预后差的类型代表。
三阴多见于绝经前年轻患者,内脏转移、脑转移概率较高,病理组织学分级较差,多为3级,细胞增殖比例较高,且多伴p53突变,p53、EGFR表达多为阳性,基内幕胞标志物CK5/6、CK17也多为阳性。
三阴预后与大小和淋巴结状况关系不大,复发迅速,1-3年是复发顶峰,5年内是死亡顶峰,脑转移发生率高,迅速显现远处转移而致使死亡。
“三阴”内分泌医治和曲妥珠单抗(Herceptin)靶向医治无效,医治上依托为主,灵敏性差并容易产生耐药。
表:分子亚型的概念和医治推荐(2020年共识)分子亚型定义治疗类型注释ER和(或)PR阳性单纯内分泌治疗Luminal (管腔或激素受体阳性)A型HER-2阴性Ki-67低表达(小于14%)Ki-67染色的质量控制非常重要。

氟维司群联合曲妥珠单抗治疗芳香化酶抑制剂耐药的晚期Luminal B型乳腺癌的疗效观察【摘要】目的:观察氟维司群与曲妥珠单抗共治晚期Luminal B型乳腺癌的疗效。
方法:选取本院62例晚期Luminal B型乳腺癌病患,根据不同疗法纳入单药组与联合组,均31例,单药组给予氟维司群治疗,联合组给予氟维司群与曲妥珠单抗治疗,对比其疗效。
结果:联合组的有效率(61.3%)高于单药组(35.5%),联合组的不良反应出现率(9.7%)低于单药组(16.1%),联合组生命质量得分高于单药组,差异均显著(P<0.05)。
结论:氟维司群与曲妥珠单抗共治晚期Luminal B型乳腺癌的疗效理想,不良反应出现率低,且可改善病患的生命质量,建议推行。
【关键词】氟维司群;曲妥珠单抗;芳香化酶抑制剂;晚期Luminal B型乳腺癌Luminal B型乳腺癌的症状表现具有典型性,康复效果欠佳,且其对内分泌治疗耐药,常见如芳香化酶抑制剂耐药[1]。
针对芳香化酶抑制剂耐药的晚期Luminal B型乳腺癌,目前认为,首选细胞毒药物治疗[2]。
基于此,本研究为了进一步探讨芳香化酶抑制剂耐药的晚期Luminal B型乳腺癌的有效疗法,选取62例病患的治疗情况展开对比分析,汇报如下。
1 资料与方法1.1 基本资料选出本院2017年9月到2018年9月的62例晚期Luminal B型乳腺癌病患,纳入标准:①通过体检、影像学检查以及病理组织学确诊,符合临床标准;②均为女性;③远处脏器转移;④曾给予芳香化酶抑制剂治疗,且治疗后出现耐药;⑤对本研究知情且同意;排除标准:①合并其他严重器官病症;②合并精神疾病;③哺乳期、妊娠期女性。
根据不同疗法把62例病患纳入单药组、联合组,均31例。
单药组:年龄36~81岁,平均(52.6±5.2)岁;进行放疗17例,未行放疗14例;转移部位中,多处转移6例,单一脏器转移7例,仅骨转移18例。


mcf7分子分型
MCF7是一种乳腺癌细胞系,属于ER阳性乳腺癌。
MCF7细胞系是乳腺癌
细胞系中较为常见的一个,它是雌激素受体阳性(ER+)的细胞系,这意味着它对雌激素具有较高的亲和力和依赖性。
MCF7细胞系的分子分型有多种,常见的包括:
1. Luminal A型:这种类型的乳腺癌细胞通常表达高水平的ER和PR(孕
激素受体),但HER2基因扩增和蛋白表达较低。
这种类型的乳腺癌对激素治疗和内分泌治疗敏感,预后相对较好。
2. Luminal B型:这种类型的乳腺癌细胞也表达高水平的ER和PR,但HER2基因扩增和蛋白表达较高。
这种类型的乳腺癌对激素治疗和内分泌治疗有一定敏感性,但可能对化疗和靶向治疗更敏感。
3. HER2过表达型:这种类型的乳腺癌细胞HER2基因扩增和蛋白表达较高,ER和PR表达较低。
这种类型的乳腺癌对化疗、靶向治疗和曲妥珠单抗治疗敏感,但可能对激素治疗不敏感。
4. 三阴性乳腺癌:这种类型的乳腺癌细胞ER、PR和HER2基因表达均为阴性。
这种类型的乳腺癌对激素治疗、内分泌治疗和靶向治疗不敏感,通常需要采用化疗等治疗方案。
需要注意的是,MCF7细胞系的分子分型并不是绝对的,不同的实验条件和研究结果可能会有所不同。
因此,在实际的实验设计和研究中,需要根据具体情况进行分子分型分析和验证。

中国乳腺癌内分泌治疗专家共识乳腺癌是中国女性常见的恶性肿瘤之一,内分泌治疗作为其重要的治疗手段之一,在临床上得到了广泛应用。
为了明确内分泌治疗的适应症、选择合适的药物及剂量、规范治疗过程,中国乳腺癌内分泌治疗专家经过充分的讨论和研究,制定了本专家共识,以供临床医生参考。
一、内分泌治疗的适应症乳腺癌内分泌治疗适用于以下类型的患者:1. 雌激素受体阳性的乳腺癌患者:该类型的患者约占乳腺癌患者的70-80%,对内分泌治疗较为敏感,预后相对较好;2. 经前绝经期女性:由于经前绝经期女性雌激素水平较低,内分泌治疗常常成为常规的治疗方法;3. 术后辅助治疗:内分泌治疗可以用于术后辅助治疗,以减少肿瘤的复发风险;4. 合并其他疾病或禁忌手术的患者:基于其个体情况,内分泌治疗可以成为替代手术的有效选择。
二、内分泌治疗药物内分泌治疗主要通过干扰雌激素对肿瘤生长的刺激作用,来达到抑制肿瘤生长的目的。
以下是常用的内分泌治疗药物:1. 雌激素受体调节剂:如选择性雌激素受体调节剂,可通过调整雌激素受体的表达和功能来抑制雌激素依赖性肿瘤的生长;2. 雌激素合成抑制剂:通过抑制雌激素的合成过程,降低血液中雌激素的水平,从而达到抑制肿瘤生长的效果;3. 孕激素受体拮抗剂:用于经前绝经期女性乳腺癌的治疗,通过抑制孕激素对肿瘤生长的促进作用。
三、内分泌治疗的剂量和疗程内分泌治疗的剂量和疗程应根据患者的具体情况进行个体化调整,一般原则如下:1. 药物剂量:应根据患者的年龄、肿瘤分期、雌激素受体表达情况等因素进行评估,并由专业医生根据具体情况选择合适的剂量;2. 疗程:内分泌治疗通常需要持续一段时间,期间需对患者进行定期随访,评估治疗效果,并根据具体情况决定是否需要延长或调整治疗疗程。
四、内分泌治疗的预防和处理副作用内分泌治疗常常伴随着一些不良反应或副作用的出现,预防和处理这些副作用对于患者的疗效和生活质量至关重要。
以下是一些建议:1. 预防骨质疏松和乳腺癌相关关节炎:通过补充钙、维生素D和规范的运动等方法来预防骨质疏松和关节炎的发生;2. 管理更年期综合征:尽可能通过非药物干预控制更年期症状,如规律生活作息、科学饮食等;3. 预防心血管疾病:应定期监测血脂、血压等指标,遵循健康生活方式,预防心血管疾病;4. 注意皮肤护理:内分泌治疗常伴有皮肤干燥和瘙痒等症状,定期对皮肤进行保湿和护理;5. 定期随访:对于出现药物不良反应或其他情况的患者,应及时与医生沟通,调整治疗方案。
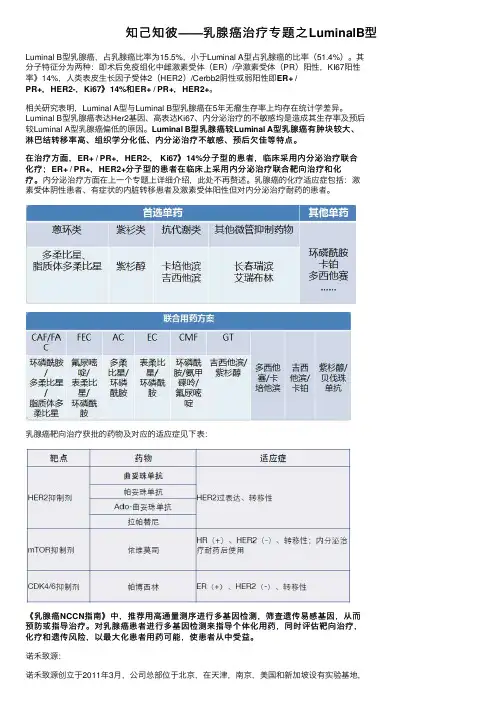
知⼰知彼——乳腺癌治疗专题之LuminalB型Luminal B型乳腺癌,占乳腺癌⽐率为15.5%,⼩于Luminal A型占乳腺癌的⽐率(51.4%)。
其分⼦特征分为两种:即术后免疫组化中雌激素受体(ER)/孕激素受体(PR)阳性,KI67阳性率》14%,⼈类表⽪⽣长因⼦受体2(HER2)/Cerbb2阴性或弱阳性即ER+ /PR+,HER2-,Ki67》14%和ER+ / PR+,HER2+。
相关研究表明,Luminal A型与Luminal B型乳腺癌在5年⽆瘤⽣存率上均存在统计学差异。
Luminal B型乳腺癌表达Her2基因、⾼表达Ki67、内分泌治疗的不敏感均是造成其⽣存率及预后较Luminal A型乳腺癌偏低的原因。
Luminal B型乳腺癌较Luminal A型乳腺癌有肿块较⼤、淋巴结转移率⾼、组织学分化低、内分泌治疗不敏感、预后⽋佳等特点。
在治疗⽅⾯,ER+ / PR+,HER2-, Ki67》14%分⼦型的患者,临床采⽤内分泌治疗联合化疗;ER+ / PR+,HER2+分⼦型的患者在临床上采⽤内分泌治疗联合靶向治疗和化疗。
内分泌治疗⽅⾯在上⼀个专题上详细介绍,此处不再赘述。
乳腺癌的化疗适应症包括:激疗。
素受体阴性患者、有症状的内脏转移患者及激素受体阳性但对内分泌治疗耐药的患者。
乳腺癌靶向治疗获批的药物及对应的适应症见下表:《乳腺癌NCCN指南》中,推荐⽤⾼通量测序进⾏多基因检测,筛查遗传易感基因,从⽽预防或指导治疗。
对乳腺癌患者进⾏多基因检测来指导个体化⽤药,同时评估靶向治疗,化疗和遗传风险,以最⼤化患者⽤药可能,使患者从中受益。
诺⽲致源:诺⽲致源创⽴于2011年3⽉,公司总部位于北京,在天津,南京,美国和新加坡设有实验基地,并在⾹港、美国、英国和新加坡设有分公司。
⽬前已建成亚太地区通量规模最⼤的基因测序中⼼,每年可完成 40000 ⼈全基因组测序的超⾼通量。
诺⽲以深度基因测序和⼤数据分析为核⼼技术,持续研发国际领先的肿瘤管理产品,提供贯穿肿瘤预测、预防、诊断、治疗、复发监测等全过程的肿瘤精准诊疗解决⽅案。

乳腺癌的内分泌治疗指南乳腺癌是一种常见的恶性肿瘤,常发生在女性乳房组织中。
内分泌治疗作为乳腺癌治疗的重要手段之一,在不同的疾病阶段和临床情况下都具有重要的应用价值。
本文将为您详细介绍乳腺癌内分泌治疗的指南和相关信息。
一、内分泌治疗的原理及适应症内分泌治疗是通过干扰或阻断肿瘤组织中的雌激素信号传导,以达到抑制肿瘤生长和扩散的目的。
乳腺癌内分泌治疗的主要适应症包括:1. 雌激素受体阳性乳腺癌:约70%的乳腺癌患者为雌激素受体阳性乳腺癌,在内分泌治疗中溢于言表。
这些肿瘤对雌激素依赖明显,通过给予内分泌治疗可以有效地抑制肿瘤细胞增殖。
2. 更年期前后女性乳腺癌:更年期前后女性雌激素与卵巢功能相关的巨大变化,容易导致雌激素水平的波动,从而增加了乳腺癌的风险。
内分泌治疗在这一群体中具有重要的应用价值。
二、内分泌治疗的方法和药物选择内分泌治疗的方法包括手术切除卵巢、放射治疗和药物治疗等。
药物治疗是内分泌治疗中最常用的方法。
常用的药物包括:1. 雌激素受体调节剂:如丽珠维 (Tamoxifen)、托烷司琼(Toremifene) 等。
这些药物可以与雌激素受体结合,在竞争性抑制雌激素结合,从而达到抑制乳腺癌细胞生长的效果。
2. 第三代芳香化酶抑制剂:如阿那曲唑 (Anastrozole)、依那西普(Exemestane) 等。
这些药物可以通过抑制体内产生的雌激素的合成酶,从而进一步降低体内的雌激素水平,达到治疗乳腺癌的目的。
三、内分泌治疗的疗效评估与副作用管理内分泌治疗后,应通过一系列的疗效评估指标来监测治疗的效果。
常用的评估方法包括实验室检查、影像学检查、体格检查等。
通过及时准确地评估治疗效果,可以进一步调整治疗方案,以获得最佳效果。
同时,内分泌治疗也伴随着一些副作用,如更年期综合征、骨质疏松、心血管疾病等。
在内分泌治疗中,我们应该注意对患者的副作用管理和年龄、病情以及患者自身状况的综合考量,有效地降低并缓解患者的副作用,以提高治疗的依从性和生活质量。
乳腺癌协助化疗方案1、 TAC方案多西他赛75mg /M2d1阿霉素50 /M2d1环磷酰胺500 /M2d1共6个周期, 21天为 1周期多西他赛预办理:地塞米松8mg Bid 连续 3 天( -1,1,2 )合用于高度复发危险的病例该方案中多柔比星的不良反响主要为心脏毒性,心肌毒性与剂量累计亲密有关,辅酶Q10,维生素 C,维生素 E 可消除自由基,可能会降低心脏毒性。
该方案的剂量限制性毒性是造血系统毒性,白细胞,特别是粒细胞降落,易惹起发热性粒细胞降落和感染。
并且粒细胞下降发生早,最早发生在用药后3~4 天,降至最低点的时间是第8 天,往常再降至最低点 1周左右能完整恢复。
,预防使用 G-CSF 可有效地预防严重的骨髓克制的发生。
如出现发热性粒细胞降落应注意以下几点:拍摄胸片,查血惯例;尽量防止有创操作,认真检查并尽可能发现感得病灶及感染;惯例进行血、尿培育、中心静脉置管或可疑感染部位的培育;经验性应用广谱抗生素,依据药敏试验结果改换抗生素等。
本方案致吐性为中等程度,应用 5-HT3 拮抗剂。
2、 AC-P 方案阿霉素60mg /M2d1第 1-4 周期环磷酰胺600mg /M2d1第 1-4 周期生理盐水500ml+ 紫杉醇175mg /M2 d1第5-8周期21天为 1周期紫杉醇预办理:地塞米松 20mg 口服(用药前 12h、前 6h)苯海拉明 40mg 肌注、西咪替丁400mg 静脉注射(用药前 30min )合用于高度复发危险的病例注意事项:紫杉醇用药需丈量血压(化疗前 30min 、0min 、后 15min 、后 30min 、后 60min 、后 2h、后 3h),静滴时间: 3h;紫杉醇在滴注的最先几分钟内,有可能发生过敏反响。
如发生过敏反响症状较稍微,如脸红或局部皮肤反响,则不需停止治疗。
假如发生严重过敏反响,如血压降落超出20mmHg 、支气管痉挛或浑身皮疹或红斑,则需立刻停止滴注,并进行对症治疗。
・846・现代生物医学进展 Progress in Modern Biomedicine VoL21NO.5MAR.2021doi:10.13241/ki.pmb.2021.05.009-临床研究-Luminal A型和Luminal B型乳腺癌患者的腋窝淋巴结转移发生率及预后的比较研究*辛肇晨吴茜方昭然耿盛凯张宏伟△(复旦大学附属中山医院普外科上海200032)摘要目的:对比Luminal A型和Luminal B型乳腺癌患者的腋窝淋巴结转移发生率及预后情况方法:回顾性分析我院从2011年5月〜2014年12月收治的乳腺癌患者180例作为研究对象将其按照临床病理类型的差异分成Luminal A型组84例与Luminal B 型组96例,比较两组临床病理特征、腋窝淋巴结转移发生率、5年复发率与生存率,比较两组患者超声学特征「结果:Luminal A型组年龄>50岁、肿瘤大小M2cm、组织分级I级人数占比均高于Luminal B型组(片0.05)Luminal A型组腋窝淋巴结转移发生率为13.10%(11/84),显著低于Luminal B型组的39.58%(38/96)(/M).O5)Luminal A型组和Luminal B型组患者的5年复发转移率对比差异无统计学意义(P>0.05),Luminal A型组5年生存率为86.90%(73/84),高于Luminal B型组的73.96%(71/96)(F<0.05)Luminal A型组边界清晰、无钙化人数占比均高于Luminal B型组,而Alder为III级人数占比低于Luminal B型组(P<0.05)结论:Luminal A型乳腺癌患者的腋窝淋巴结转移发生率低于Luminal B型乳腺癌患者,且两者的临床病理和超声学特征存在一定的差异,Luminal A型乳腺癌患者的预后优于Luminal B型关键词:乳腺癌;Luminal A型;Luminal B型;腋窝淋巴结;转移;预后中图分类号:R737.9文献标识码:A文章编号:1673-6273(2021)05-846-04A Comparative Study on the Incidence and Prognosis ofAxillary Lymph Node Metastasis in Luminal Type A and Luminal Type BBreast Cancer Patients*XINZhao-chen,WU Qian,FANG Zhao-ran,GENG Sheng-kai,ZHANG Hong・weA(Department of G eneral Surgery,Zhongshan Hospital Affiliated to Fudan University,Shanghai,200032,China) ABSTRACT Objective:To compare the incidence and prognosis of axillary lymph node metastasis in Luminal type A and Luminal type B breast cancer patients.Methods:A retrospective analysis was performed on180cases of breast cancer who were admitted to our hospital from May2011to December2014as an object of study.According to the differences of clinicopathological types,they were divided into two groups:84patients in Luminal type A group and96patients in Luminal type B group.The clinicopathological features, incidence of axillary lymph node metastasis,5-year recurrence rate and survival rate of the two groups were compared.In addition,the ultrasonic characteristics of the two groups of patients were compared.Results:Luminal type A group age>50years old,and tumor size<2cm,organize class I number proportion were significantly higher than that of Luminal type B group(P<0.05).The incidence of axillary lymph node metastasis in Luminal type A group was13.10%(11/84),which was significantly lower than39.58%(38/96)in Luminal type B group(P<0.05).There were no significant differences in5-year recurrence and metastasis rate between Luminal type A group and Luminal type B group(j P>0.05).The5-year survival rate in Luminal type A group was86.90%(73/84),which was significantly higher than73.96%(71/96)in Luminal type B group(P<0.05).The boundary clear,no calcification in Luminal type A group were higher than those in Luminal type B group,and Alder111grade number proportion was lower than that in Luminal type B group (P<0.05).Conclusion:The incidence of axillary lymph node metastasis in Luminal A type breast cancer patients is lower than that in Luminal type B breast cancer patients,and there are some differences in clinicopathological and ultrasonic characteristics,and The prognosis of luminal type A breast cancer is better than that of luminal type B breast cancer.Key words:Breast cancer;Luminal type A;Luminal type B;Axillary lymph node;Metastasis;PrognosisChinese Library Classification(CLC):R737.9Document code:AArticle ID:1673-6273(2021)05-846-04*基金项目:上海市科委科研项目(17104930411)作者简介:辛肇晨(1996-),男,硕士研究生,研究方向:乳腺癌诊疗,E-mail:xinzhaochenchen@△通讯作者:张宏伟(1961-),男,博士,教授、主任医师.研究方向:乳腺癌诊疗,E-mail:****************************.cn(收稿日期:2020-06-31接受日期:2020-07-25)现代生物医学鳩j o Progress in Modern Biomedicine VoL21NO.5MAR.2021・847・»-刖g近年来.随着人们生活方式的不断改变,乳腺癌的发病率逐年增长“叫乳腺癌是我国女性所有恶性肿瘤中发病率最高的一种恶性肿瘤疾病,且病死率较高,严重威胁我国女性生命健康安全叫相关研究报道表明叫组织学分类相同的乳腺癌患者预后亦可能存在一定的差异。
乳腺癌的激素治疗方法乳腺癌作为女性最常见的恶性肿瘤之一,给患者和家属带来了巨大的心理和生理负担。
然而,随着医学的不断进步,乳腺癌的治疗手段也在不断完善与发展。
其中,激素治疗作为一种重要的治疗手段,日益受到广大医生和患者的重视。
本文将介绍乳腺癌的激素治疗方法,包括雌激素受体阳性乳腺癌的内分泌治疗、具体的药物选择以及治疗效果评估等方面。
1. 雌激素受体阳性乳腺癌的内分泌治疗雌激素受体阳性乳腺癌,是指乳腺癌细胞上表达雌激素受体(ER)的一种类型。
此类型乳腺癌对雌激素的依赖性较高,患者接受内分泌治疗可以极大地延缓疾病进展,提高患者的生存率和生活质量。
内分泌治疗主要通过抑制雌激素的生物活性来达到抑制肿瘤细胞生长的目的。
目前,常用的内分泌治疗药物主要包括:(1)选择性雌激素受体调节剂,如地非那醇、托瑞米费;(2)雌激素合成抑制剂,如芳香化酶抑制剂;(3)选择性雌激素降解剂,如贝那普利。
2. 具体的药物选择2.1 选择性雌激素受体调节剂地非那醇和托瑞米费是常用的选择性雌激素受体调节剂。
它们通过与雌激素受体结合,阻止雌激素受体与雌激素的结合,从而抑制雌激素对乳腺癌细胞生长的刺激作用。
这些药物具有较好的疗效和良好的耐受性,可以用于术后辅助治疗、晚期和转移性乳腺癌的治疗。
2.2 芳香化酶抑制剂芳香化酶抑制剂主要包括阿那曲唑和依那司他。
它们通过抑制芳香化酶的活性,降低体内雌激素水平,从而达到治疗乳腺癌的效果。
这些药物适用于更年期后的乳腺癌患者,尤其是绝经后乳腺癌患者。
需要注意的是,芳香化酶抑制剂在使用过程中可能引起骨质疏松和关节痛等不良反应,应定期进行相关检测。
2.3 选择性雌激素降解剂贝那普利是目前唯一一种被批准用于乳腺癌激素治疗的选择性雌激素降解剂。
它可以通过抑制雌激素的合成和降解来减少体内雌激素的合成和降解,从而达到治疗乳腺癌的效果。
贝那普利在早期和晚期乳腺癌的治疗中,显示出良好的疗效和耐受性。
3. 治疗效果评估对于接受激素治疗的乳腺癌患者,需要定期进行治疗效果的评估。
2020乳腺癌luminal分型标准乳腺癌是乳腺组织中最常见的一种恶性肿瘤,根据乳腺癌的分子分型,可分为Luminal A、Luminal B、HER2阳性和三阴性乳腺癌等不同类型。
其中,Luminal A型乳腺癌和Luminal B型乳腺癌是乳腺癌中最为常见的两种类型。
在临床上,准确地识别乳腺癌的分子分型对于指导治疗方案的选择和预后判断具有重要意义。
Luminal A型乳腺癌是一种激素受体阳性(ER+和/或PR+)且HER2阴性的乳腺癌。
该类型的乳腺癌通常具有较低的增殖指数和较好的预后,患者的生存率相对较高。
Luminal A型乳腺癌主要发生在更年期后的女性,并且多数为年龄较大的患者。
此外,Luminal A型乳腺癌在组织学表现上常呈现低核分裂率和低组织学分级,具有较小的肿瘤大小和较好的分化程度。
Luminal B型乳腺癌是另一种激素受体阳性(ER+和/或PR+)的乳腺癌类型,但与Luminal A型乳腺癌相比,Luminal B型乳腺癌通常具有较高的细胞增殖指数。
Luminal B型乳腺癌的患者相对而言预后较差,生存率较低。
Luminal B型乳腺癌的病理特点是细胞增殖活性高,肿瘤的组织学分级较高,核分裂活跃,肿瘤体积较大。
判断乳腺癌的Luminal A和Luminal B分型主要依靠对激素受体和HER2的免疫组织化学检测结果和分子生物学分析。
免疫组织化学检测主要是通过检测细胞的激素受体(如ER和PR)和HER2的表达情况来确定乳腺癌的分子分型。
分子生物学分析则是通过检测肿瘤细胞中相关基因的表达水平,包括ER、PR、HER2、Ki-67等指标,来更准确地识别乳腺癌的分子分型。
根据国际乳腺癌研究组织(International Breast Cancer Study Group,IBCSG)和美国乳腺病理学家学会(American Society of Breast Pathology,ASBP)等权威机构的建议,通常将表达ER和/或PR的乳腺癌定义为激素受体阳性(HR+),HER2阴性(HER2-)的乳腺癌作为Luminal A型,而表达ER和/或PR,且HER2阳性(HER2+)的乳腺癌定义为Luminal B型。
乳腺癌的内分泌治疗晚期乳癌患者,激素受体(ER和/或PR)阳性,即使有内脏转移,如果没有症状,可以首选内分泌治疗。
ER和PR阴性的患者在某些特殊情况下也可以选内分泌治疗,尤其是对软组织转移和/或以骨转移的患者。
此外,临床中ER和PR状态也可能为假阴性,且有些患者原发灶与转移灶的激素受体情况也可能不同。
因此对于ER和PR阴性,仅有骨转移或软组织转移的复发转移患者,也可以考虑严格疗效评价和病情监控下试用一次内分泌治疗。
接受过抗雌激素治疗的绝经后患者,芳香化酶抑制剂是复发乳腺癌的首选一线治疗。
对未接受抗雌激素治疗的绝经前患者,初始治疗可以是抗雌激素单药治疗,或有效的卵巢功能抑制后加用芳香化酶抑制剂,卵巢功能抑制可以采取外科切除,或应用促黄体生成激素释放激素(LHRH)拮抗剂。
绝经前抗雌激素治疗失败的患者,首选二线治疗方案是卵巢功能抑制联合芳香化酶抑制剂。
复发转移乳腺癌内分泌治疗可以选择的药物包括:芳香化酶抑制剂(阿那曲唑、来曲唑和依西美坦)、抗雌激素药物(他莫昔芬、托瑞米芬和氟维司群)和孕激素类药物(醋酸甲地孕酮和甲羟孕酮)。
内分泌药物的选择原则主要遵循:1、不重复使用辅助治疗阶段治疗失败的药物;2、他莫昔芬治疗失败的绝经后患者首选芳香化酶抑制剂AI治疗;3、绝经前乳癌患者,可采用手术切除或卵巢功能有效抑制治疗基础上,遵循绝经后患者内分泌治疗原则;4、芳香化酶抑制剂失败的可选择孕激素治疗或氟维司群;5、非甾体类芳香化酶抑制剂(阿那曲唑或来曲唑)治疗失败可选甾体类芳香化酶抑制剂(依西美坦)、孕激素或氟维司群;甾体类芳香化酶抑制剂治疗失败可选非甾体类芳香化酶抑制剂、孕激素或氟维司群。
6、既往未曾接受过抗雌激素治疗者仍可选择他莫昔芬或托瑞米芬。
抗雌激素药物氟维司群是激素受体阳性、抗雌激素或芳香化酶抑制剂经治再次进展的转移性乳腺癌患者的选择用药之一。
对于在既往的他莫昔芬治疗中疾病进展的患者,氟维司群与阿那曲唑有效率相似,但缓解持续时间更长。
患者:检查及化验:长春中日联谊医院-病理诊断:(左乳)乳腺浸润性导管癌Ⅱ级(大小20*20*10mm)MBNG: Ⅱ级。
其内大部分为导管原位癌成分,未见脉管及神经累及。
分送“改良根治标本”缺损旁及其余乳腺均呈腺病改变,基底及胸肌未见癌,腋窝淋巴结转移癌(1/18),转移灶5mm。
PTNM:T1N1Mx 免疫组化:ER(20%1+)PR(-) C-erbB-2(3+) EGFR(-) P53(-) Ki67(50%+) CK5/6(-) P63(-) (右乳2点位)乳腺腺病伴纤维腺瘤样增生(右乳12点位)乳腺腺病伴那纤维腺瘤,局部导管扩张,大汗腺化生。
天津肿瘤医院-病理报告左乳腺侵润性导管癌,组织学II-III级,其中导管内癌成分分级为III级。
淋巴阳性1/18,ER阳性细胞约30%,平均着色强度弱--中;PR阳性细胞<1%;C-ERBB-2 3+,可见导管内癌细胞膜着色。
因浸润性癌成分着色稍弱于导管癌成分,故建议复检C-erbB-2(3+) EGFR(-) P53(-) Ki67(50%+) CK5/6(-) P63(-)。
治疗情况:CA15-3变化情况:(该医院正常值1-25U/ml),每三周化疗一次1、术后并进行1期AT化疗后:23.55 2、AC化疗一期后:27.46 3、AC化疗二期后:无肿瘤标志物验血记录4、AC化疗三期后:26.94 5、TH化疗一期后:26.40 6、TH化疗二期后:30.36 7、TH化疗三期后:27.25 8、TH化疗四期后:还未检查。
病史求Luminal B 型【ER(+)PR(-)HER2(+)Ki67(50%+)腋窝淋巴结转移癌(1/18),转移灶5mm,(49周岁,ac-th化疗后闭经)】型乳腺癌患者绝经前内分泌治疗方案?(第一年考虑与曲妥珠单抗联合治疗效果)广东省中医院乳腺科陈前军:它莫昔芬5年+曲妥珠单抗1年;5年后若达绝经状态,5年芳香化酶抑制剂(AI)年强化治疗。
患者:Luminal A 型:是乳腺癌最常见的分子亚型,发病率为44.5%- 69.0%。
ER 和/或PR +,Her-2 –,预后最好。
内分泌治疗效果最佳。
常采用内分泌治疗(±化疗)。
绝经前常选择三苯氧胺,药物性去势药物诺雷德,绝经后常选择芳香化酶抑制剂如阿那曲唑、来曲唑等。
Luminal B 型:luminal B 型为7. 8%,ER 和/或PR +,Her-2 +,内分泌治疗仍有效,预后较好。
Luminal B 型乳腺癌由于HER2 表达阳性, 对他莫昔芬的反应性低于luminal A 型, 但改用其他作用机制的内分泌治疗仍有效。
治疗常采用化疗+内分泌治疗+靶向治疗。
对于ER(+)PR(-)的乳腺癌患者,阿娜曲唑的疗效显著优于他莫西芬(TAM),其原因可能是由于表皮生长因子受体如Her-2不同所致。
目前多数医生对数据进行讨论后认为可以考虑用阿那曲唑替代他莫西芬(TAM)作为辅助治疗。
与内分泌治疗联用:赫赛汀能逆转TAM的耐药性,这为赫赛汀联合内分泌药物治疗转移性乳腺癌提供了临床依据,目前已有阿那曲唑联合赫赛汀治疗转移性和TAM耐药乳腺癌的大宗临床研究。
结论:戈舍瑞林(诺雷德)联合阿那曲唑对绝经前晚期乳腺癌的疗效肯定,是乳腺癌内分泌治疗的一种有效方案;对于激素依赖型绝经前乳腺癌患者,可以推荐作为一线治疗方案。
经过讨论,专家一致认为,LHRHa是最适宜的卵巢功能抑制治疗手段,尤其对于年轻的、淋巴结阳性的高危乳腺癌患者更加适用,使用后月经也能恢复正常。
绝经前高危患者,如经济情况允许,可首先选择“双德”疗法(即诺雷德和瑞宁得联合应用),效果较三苯氧胺为佳。
另一项研究更表明,ER阳性、Her-2过度表达的患者用TAM治疗的预后比不接受治疗者还差、无病生存期更短。
Her-2过度表达的乳腺癌对芳香化酶的内分泌治疗却高度敏感。
Ellis组织的一项多中心Ⅲ期新辅助内分泌治疗的随机分组研究,300例均为绝经后未接受任何治疗而不适合保乳手术的术前病例分别采用来曲唑和TAM新辅助治疗,有效率分别为88%和21%,进一步分析来曲唑治疗组,Her-2过度表达、ER(+)组有效率为88%明显高于Her-2阴性、ER(+)的54%,而TAM组中的结果却相反,Her-2过度表达、ER(+)组21%明显低于Her-2 阴性、ER(+)组的42%,由此说明Her-2过度表达并不总是内分泌治疗的耐药标志,对芳香化酶抑制剂治疗可能是更为有效的标志。
其可能机制是来曲唑能显著降低雌激素水平绕过Her-2-TAM耐药途径。
对于绝经后受体阳性的乳腺癌患者如何选择内分泌治疗药物,研究表明Ki67阳性和高表达的患者可能对芳香化酶抑制剂敏感。
因而建议Ki-67指数高的患者应选用来曲唑治疗。
多数临床资料表明,ER+/PR+/HER-2+乳腺癌对他莫西芬的反应率下降,但并非完全耐药,改用阿那曲唑可提高疗效。
综上不用“他莫昔芬”还有其他方案吗?如:诺雷德+瑞宁德+赫赛汀(双德疗法)是否可行?广东省中医院乳腺科陈前军:看来你是查阅了很多文献啊,这样很好!月经状态是讨论内分泌治疗方案的前提,未绝经,TAM是标准治疗。
该患者是在化疗期间出现停经,不应属于绝经,所以使用TAM是HR+乳腺癌患者标准治疗。
你提到的问题:1)至于HER2表达是否影响TAM疗效,这些数据均来自RCT的亚组分析,而且数据是矛盾的(负面影响数据如 SBCCG试验、GUN试验;无影响数据如:DBCG 77c试验;正面影响数据如: J Clin Oncol.2003;21(3):453)。
所以目前临床并不能根据HER2状态来决定是否选择TAM。
2)在使用TAM的情况下是否需要加卵巢功能抑制(如戈舍瑞林):尽管国际多数指南在绝经前使用TAM的情况下加减卵巢功能抑制(你应该查阅过,不必赘述),但目前证据并不支持在TAM情况下使用卵巢功能抑制(见ZIPP试验、ABC(OAS)试验,以及2007年的关于卵巢功能抑制的荟萃分析。
还有SOFT试验结果还未出)。
因此在使用TAM的前提下我不主张使用卵巢功能抑制,尤其是40岁以后的患者。
3)至于你说的双德方案请参考奥地利的ABCSG12研究结果你就明白了。
患者:HER-2过表达和激素受体阳性转移性乳腺癌患者靶向药物与内分泌治疗的联合疗效TAnDEM试验表明,治疗HER-2过表达和激素受体阳性转移性乳腺癌,曲妥珠单抗联合阿那曲唑的疗效优于阿那曲唑。
基础研究已经证实,激素敏感性乳腺癌在经去雌激素治疗(AI或TAM)后,乳腺癌细胞可通过上调生长因子信号传导通路,转变为雌激素超敏感细胞,极低浓度雌激素就可刺激这些细胞增殖生长。
此时如果阻断上调的生长因子信号传导通路(如曲妥珠单抗阻断HER-2信号通路),就可显著增加内分泌药物的疗效。
第29届圣安东尼奥乳腺癌会议上,加拿大Mackey报告了曲妥珠单抗联合阿那曲唑治疗HER-2过表达和激素受体阳性转移性乳腺癌的Ⅲ期临床试验――TAnDEM试验的结果。
该试验将207例患者随机分为两组,一组仅接受阿那曲唑(1 mg/d)治疗,另一组接受曲妥珠单抗(4 mg/kg,d1,继之以2 mg/kg,qw)和阿那曲唑联合治疗。
结果显示,联合治疗组的无进展生存期、临床获益率和至疾病进展时间均显著优于阿那曲唑单药组(P值分别为0.0016、0.026和0.0007),总反应率和总生存期也优于后者(P值分别为0.018和0.325)。
亚组分析显示,对于无肝转移患者,联合治疗组的无进展生存期和总生存期均显著优于单药组(P值分别为0.0006和0.04)。
上述结果表明,通过阻断生长因子的信号传导途径,可进一步提高内分泌治疗的效果。
综上是否可以这样理解?绝经前:“TAM+赫赛汀”或“(卵巢去势)+AI+赫赛汀”效果更好,只有单纯的(无赫赛汀)“TAM或AI”治疗才会耐药甚至病情发展?患者:或者说“(AI或TAM)后降低了ER上调了HER2,曲妥珠单抗降低了HER2上调了ER”的共同作用,规避了(AI或TAM)和曲妥珠单抗的耐药,广东省中医院乳腺科陈前军:1)你由TAnDEM试验得出“TAM+赫赛汀”或“(卵巢去势)+AI+赫赛汀”效果更好,只有单纯的(无赫赛汀)“TAM或AI”治疗才会耐药甚至病情发展“这样的结论并不靠谱,理由是:(1)TAnDEM试验是解救治疗试验,不能用来解决辅助治疗的问题(如”解救治疗的“双德”方案并不在辅助治疗中有优势--ABCSG12试验;解救治疗的希罗达在辅助治疗中也没有优势--CALGB/CTSU 49907试验)。
(2)肿瘤是分子网络病,不能单靠2个或几个信号传导通路就能解答其某一靶点药物的耐药问题。
(3)我同意你的“TAM+赫赛汀”要要好于单用TAM的意见,但不同意“(卵巢去势)+AI+赫赛汀”效果更好的意见。
因为前者已经在B31、N9831、BCIRG006、HERA试验中得到证实(上述试验HR+患者运用的均是TAM),而后者却无相关辅助治疗试验。
2)你的观点“(AI或TAM)后降低了ER上调了HER2,曲妥珠单抗降低了HER2上调了ER”的共同作用,规避了(AI或TAM)和曲妥珠单抗的耐药,”在理论上有其一定道理,除了你所说的ER与HER2表达调控关系之外,其间还存在“cross-talk”现象。
是的,目前临床上确实存在一个问题,就是绝经后(不是绝经前的患者,绝经前已无需讨论,譬如你提供的这个病例使用TAM+H方案)患者,在使用H的情况下是否需要使用AI,即使用TAM 已经足够,因为目前唯一在辅助治疗中使用H的前提下允许使用AI的试验是PACS04,其结果是阴性的,所以确实给我们带来一定的思考。
但这些并不能改变我们的目前临床实践。
就是说绝经后HER2+患者还是选择AI+H,尤其是中高复发风险患者;绝经前选择TAM+H,(40岁以前可以考虑使用卵巢功能抑制,40岁数据来源于2007的那篇荟萃分析,卵巢功能抑制的获益人群主要是40岁以前的患者),而不考虑使用双德+H方案,因为这一方案目前并未被证实更有优势。